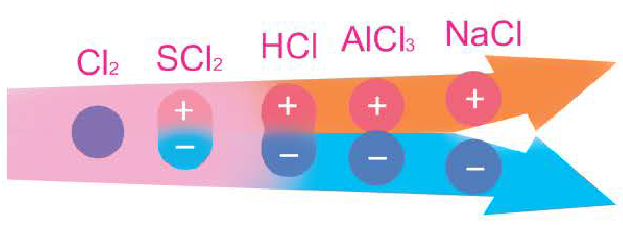
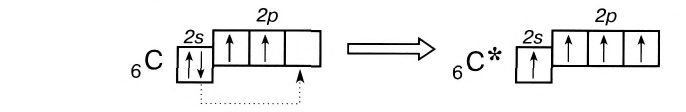
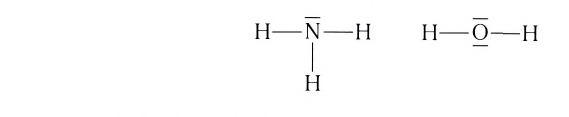
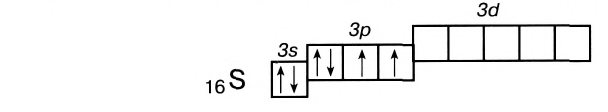
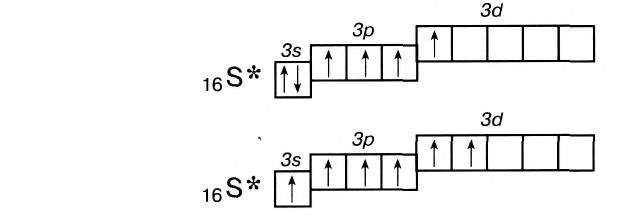
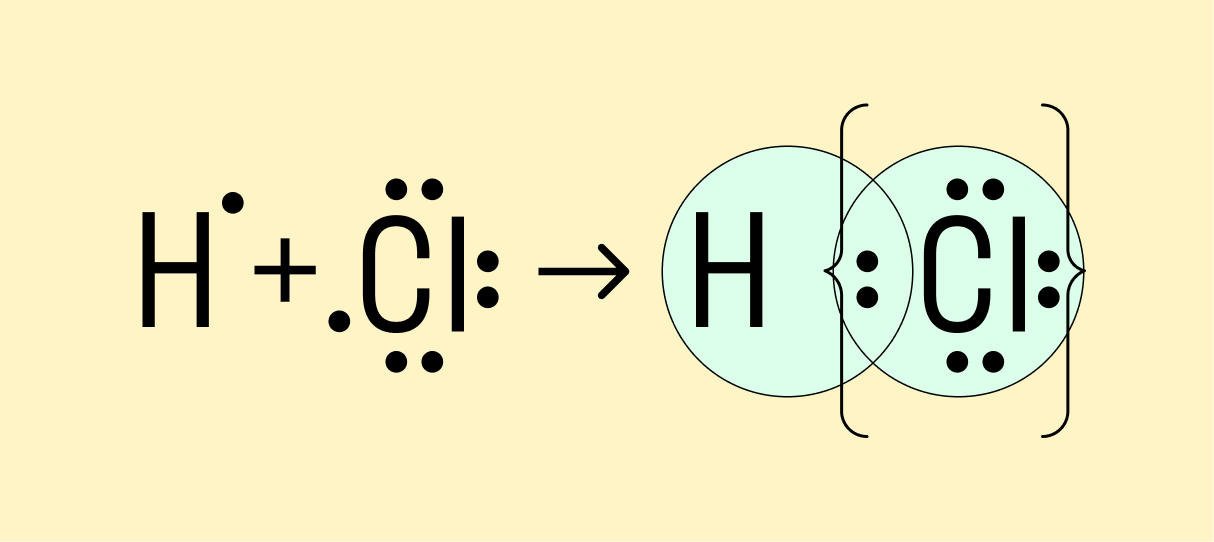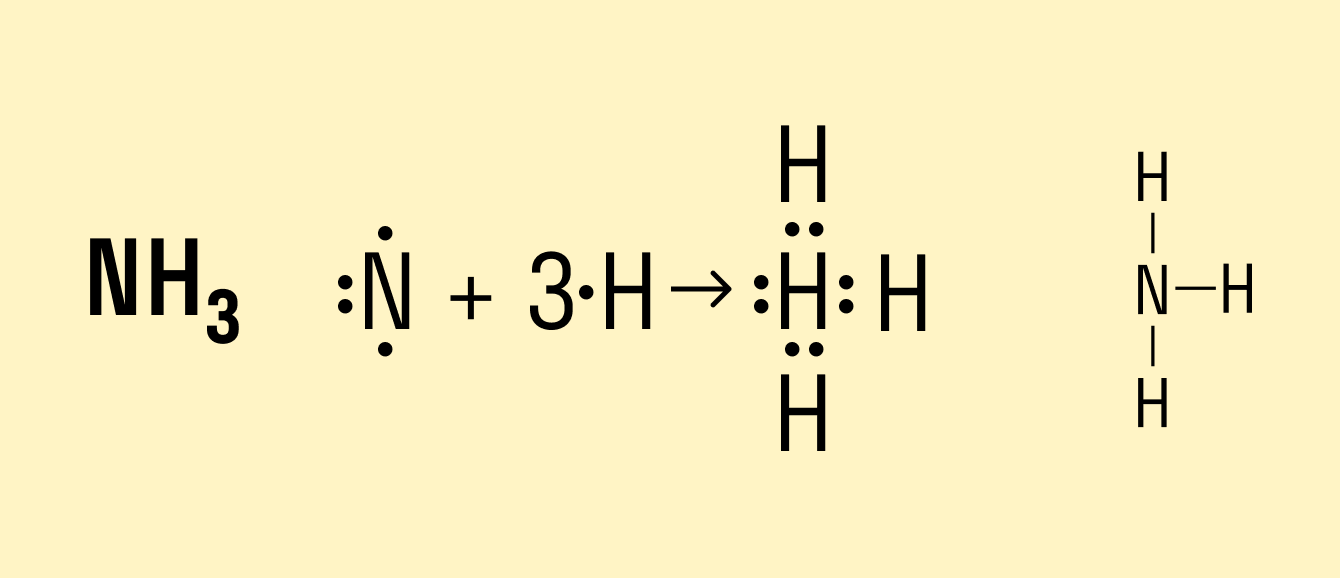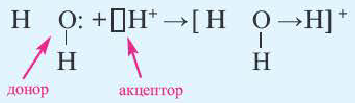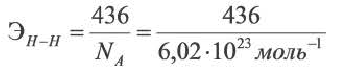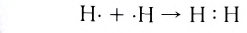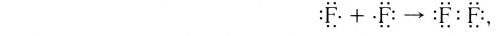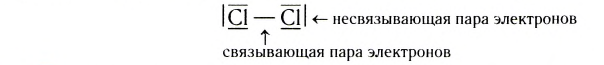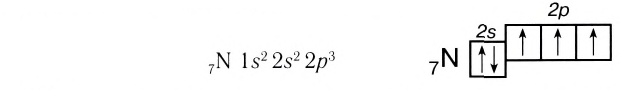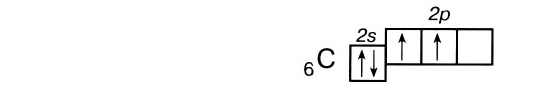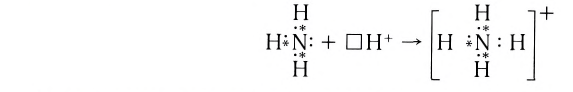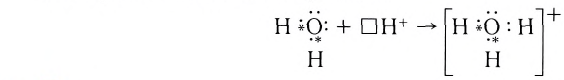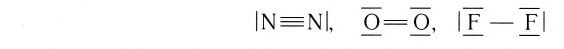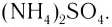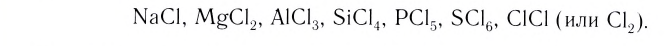Как понять что связь ковалентная
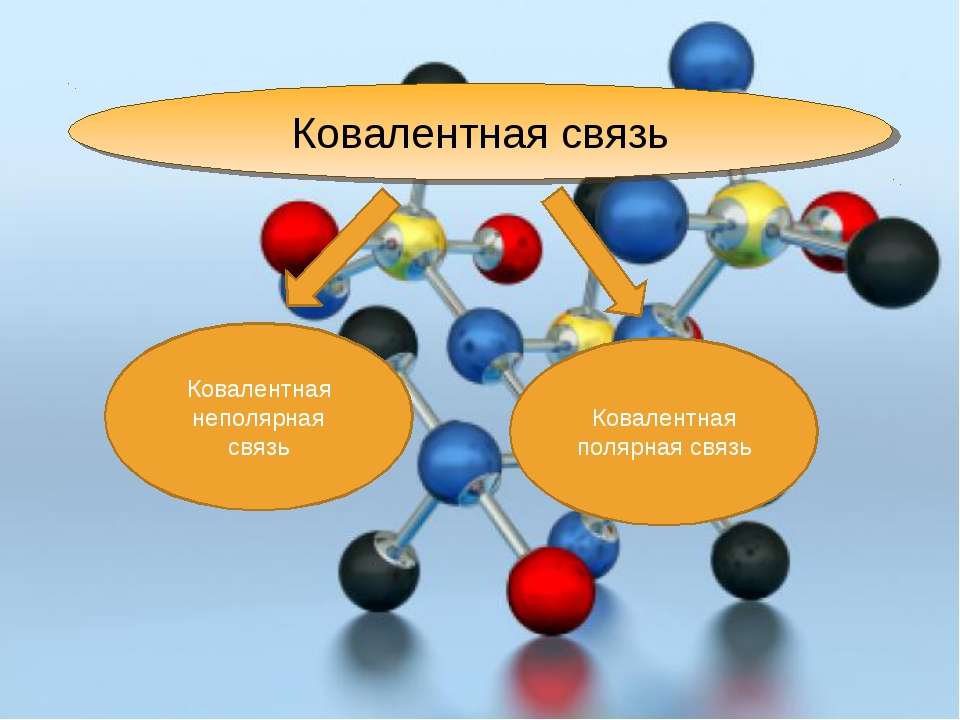
Ковалентная химическая связь. Типы химической связи: ковалентная связь
Ковалентная химическая связь является одним из видов связи, благодаря которой образуются молекулы неорганических и органических веществ. Химическая связь появляется при взаимодействии электрических полей, которые создаются ядрами и электронами атомов. Следовательно, образование ковалентной химической связи связано с электрической природой.
Что такое связь
Под этим термином подразумевают результат действия двух либо более атомов, которые приводят к формированию прочной многоатомной системы. Основные виды химической связи образуются при уменьшении энергии реагирующих атомов. В процессе формирования связи атомы стараются завершить свою электронную оболочку.
Виды связи

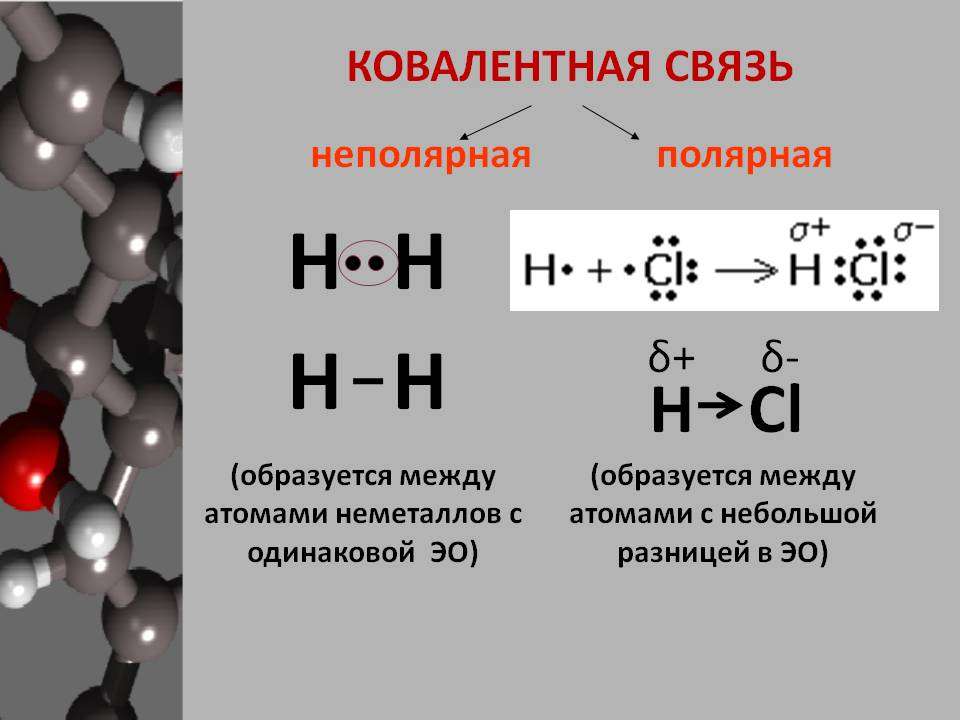
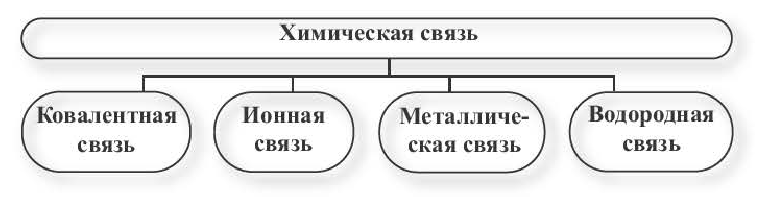
В химии выделяют несколько видов связи: ионной, ковалентной, металлической. Ковалентная химическая связь имеет две разновидности: полярная, неполярная.
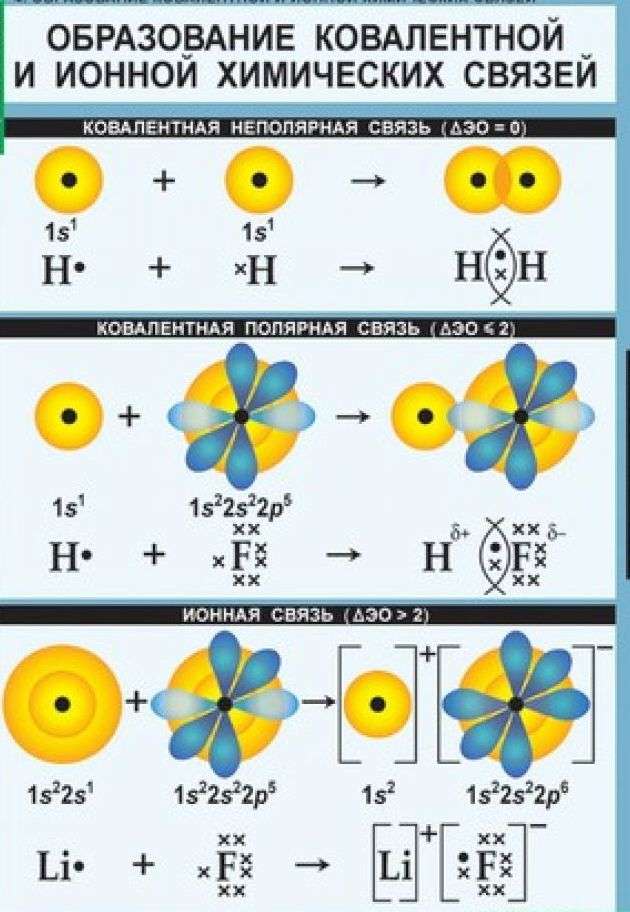
Каков механизм ее создания? Ковалентная неполярная химическая связь образуется между атомами одинаковых неметаллов, имеющих одну электроотрицательность. При этом образуются общие электронные пары.
Неполярная связь

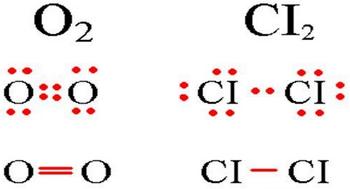
Среди примеров молекул, у которых ковалентная химическая связь неполярного вида, можно назвать галогены, водород, азот, кислород.
Впервые эта связь была обнаружена в 1916 году американским химиком Льюисом. Сначала им была выдвинута гипотеза, а подтверждена она была только после экспериментального подтверждения.
Ковалентная химическая связь связана с электроотрицательностью. У неметаллов она имеет высокое значение. В ходе химического взаимодействия атомов не всегда возможен перенос электронов от одного атома к другому, в результате осуществляется их объединение. Между атомами появляется подлинная ковалентная химическая связь. 8 класс обычной школьной программы предполагает детальное рассмотрение нескольких видов связи.
Типы ковалентной связи
Подробнее остановимся на данном вопросе. Какие выделяют типы химической связи? Ковалентная связь существует в обменном, донорно-акцепторном вариантах.
Первый тип характеризуется отдачей каждым атомом одного неспаренного электрона на образование общей электронной связи.
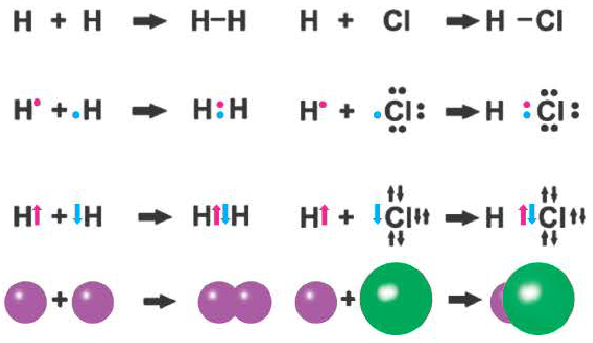
Электроны, объединяемые в общую связь, должны обладать противоположными спинами. В качестве примера подобного вида ковалентной связи можно рассмотреть водород. При сближении его атомов наблюдается проникновение их электронных облаков друг в друга, именуемое в науке перекрыванием электронных облаков. В результате увеличивается электронная плотность между ядрами, а энергия системы понижается.
При минимальном расстоянии ядра водорода отталкиваются, в итоге образуется некое оптимальное расстояние.
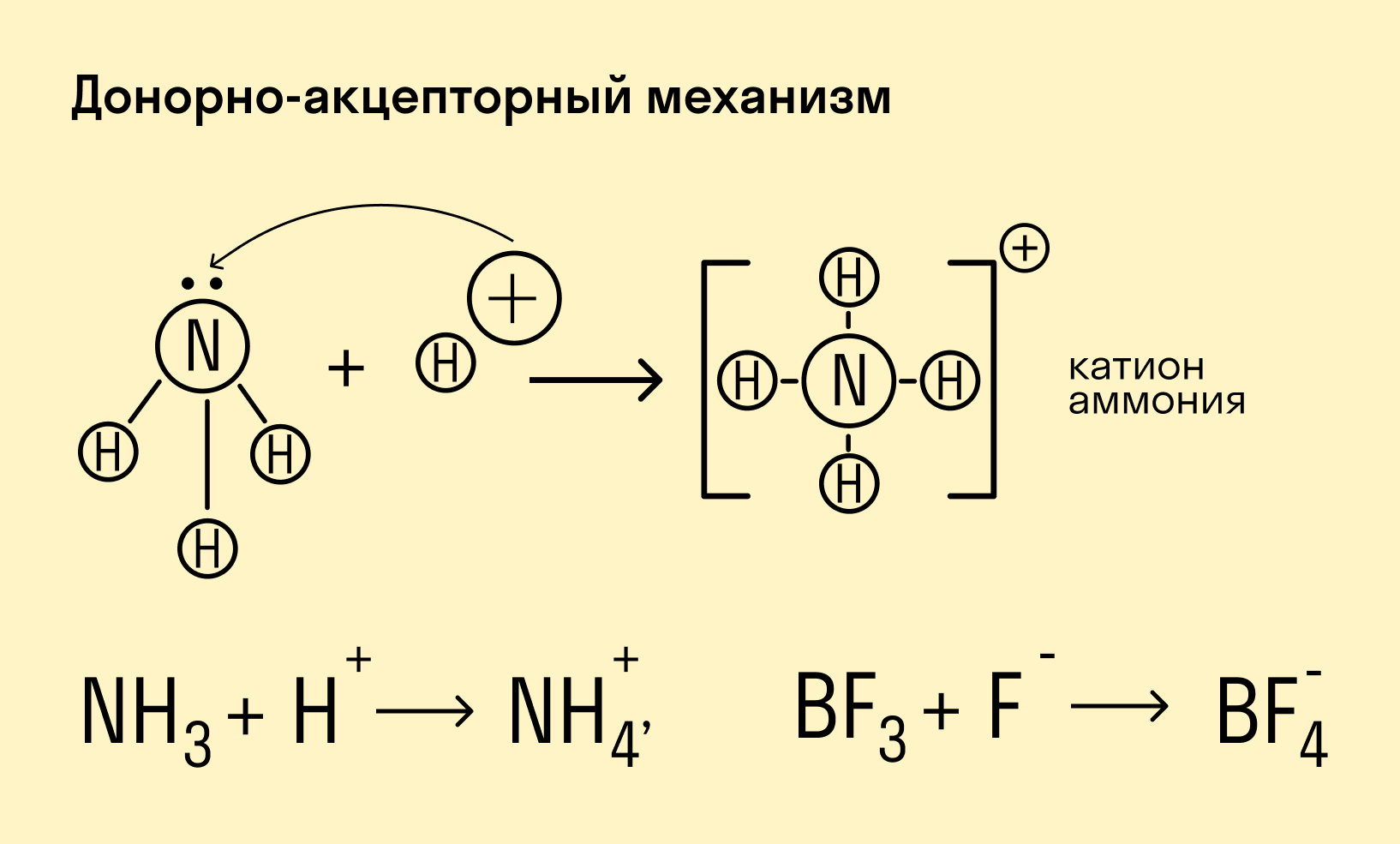
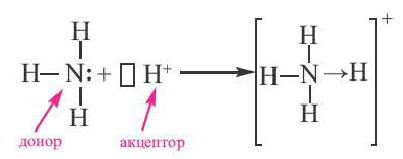
В случае донорно-акцепторного типа ковалентной связи у одной частицы есть электроны, ее называют донором. Вторая частица имеет свободную ячейку, в которой будет размещаться пара электронов.
Полярные молекулы
Как образуются ковалентные полярные химические связи? Они возникают в тех ситуациях, когда у связываемых атомов неметаллов различная электроотрицательность. В подобных случаях обобществленные электроны размещаются ближе к тому атому, у которого значение электроотрицательности выше. В качестве примера ковалентной полярной связи могут рассматриваться связи, которые возникают в молекуле бромоводорода. Здесь общественные электроны, которые отвечают за формирование ковалентной связи, ближе находятся к брому, чем к водороду. Причина подобного явления в том, что у брома электроотрицательность выше, чем у водорода.
Способы определения ковалентной связи
Как определить ковалентные полярные химические связи? Для этого необходимо знать состав молекул. Если в ней присутствуют атомы разных элементов, в молекуле существует ковалентная полярная связь. В неполярных молекулах присутствуют атомы одного химического элемента. Среди тех заданий, которые предлагаются в рамках школьного курса химии, есть и такие, которые предполагают выявление вида связи. Задания подобного типа включены в задания итоговой аттестации по химии в 9 классе, а также в тесты единого государственного экзамена по химии в 11 классе.
Ионная связь
Чем отличается ковалентная и ионная химическая связь? Если ковалентная связь характерна для неметаллов, то ионная связь образуется между атомами, имеющими существенные отличия по электроотрицательности. К примеру, это характерно для соединений элементов первой и второй групп главных подгрупп ПС (щелочных и щелочноземельных металлов) и элементов 6 и 7 групп главных подгрупп таблицы Менделеева (халькогенов и галогенов).
Она формируется в результате электростатического притяжения ионов, обладающих противоположными зарядами.
Особенности ионной связи
Так как силовые поля противоположно заряженных ионов распределяются равномерно во всех направлениях, каждый из них способен притягивать к себе противоположные по знаку частицы. Это и характеризует ненаправленность ионной связи.
Взаимодействие двух ионов, обладающих противоположными знаками, не предполагает полной взаимной компенсации индивидуальных силовых полей. Это способствует сохранению способности притягивать по остальным направлениям ионы, следовательно, наблюдается ненасыщенность ионной связи.
В ионном соединении у каждого иона есть возможность притягивать к себе некое число других, обладающих противоположных знаком, чтобы сформировать кристаллическую решетку ионного характера. В таком кристалле не существует молекул. Каждый ион окружается в веществе неким конкретным числом ионов иного знака.
Металлическая связь
Данный вид химической связи обладает определенными индивидуальными особенностями. Металлы имеют избыточное количество валентных орбиталей при недостатке электронов.
При сближении отдельных атомов происходит перекрывание их валентных орбиталей, что способствует свободному перемещению электронов из одной орбитали в другую, осуществляя между всеми атомами металла связь. Эти свободные электроны и являются основным признаком металлической связи. Она не обладает насыщенностью и направленностью, поскольку валентные электроны распределяются по кристаллу равномерно. Присутствие в металлах свободных электронов объясняет их некоторые физические свойства: металлический блеск, пластичность, ковкость, теплопроводность, непрозрачность.
Разновидность ковалентной связи
Она образуется между атомом водорода и элементом, который имеет высокую электроотрицательность. Существуют внутри- и межмолекулярные водородные связи. Эта разновидность ковалентной связи является самой непрочной, она появляется благодаря действию электростатических сил. У атома водорода небольшой радиус, и при смещении либо отдаче этого одного электрона водород становится положительным ионом, действующим на атом с большой электроотрицательностью.
Среди характерных свойств ковалентной связи выделяют: насыщаемость, направленность, поляризуемость, полярность. Каждый из этих показателей имеет определенное значение для образуемого соединения. К примеру, направленность обуславливается геометрической формой молекулы.
Ковалентная связь: полярная, неполярная, механизмы ее появления
Содержание:
Определение и характеристика
Сам термин «ковалентная связь» происходит от двух латинских слов: «со» – совместно и «vales» – имеющий силу, так как это связь происходящая за счет пары электронов, принадлежащей одновременно обоим атомам (или говоря более простым языком, связь между атомами за счет пары электронов, являющихся общими для них). Образование ковалентной связи происходит исключительно среди атомов неметаллов, причем появляться она может как в атомах молекул, так и кристаллов.
Впервые ковалентная химическая связь была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, идеи, лишь затем была подтверждена экспериментально. Что же выяснили химики по ее поводу? А то, что электроотрицательность неметаллов бывает довольно большой и при химическом взаимодействии двух атомов перенос электронов от одного к другому может быть невозможным, именно в этот момент и происходит объединение электронов обоих атомов, между ними возникает самая настоящая ковалентная связь атомов.
Типы связи
В целом есть два типа ковалентной связи:
При обменном типе ковалентной связи между атомами каждый из соединяющихся атомов представляет на образование электронной связи по одному неспареному электрону. При этом электроны эти должны иметь противоположные заряды (спины).
Примером подобной ковалентной связи могут быть связи происходящие молекуле водорода. Когда атомы водорода сближаются, в их электронные облака проникают друг в друга, в науке это называется перекрыванием электронных облаков. Как следствие, электронная плотность между ядрами увеличивается, сами они притягиваются друг к другу, а энергия системы уменьшается. Тем не менее, при слишком близком приближении ядра начинают отталкиваться, и таким образом возникает некое оптимально расстояние между ними.
Более наглядно это показано на картинке.
Что же касается донорно-акцепторного типа ковалентной связи, то он происходит когда одна частица, в данном случае донор, представляет для связи свою электронную пару, а вторая, акцептор – свободную орбиталь.
Также говоря о типах ковалентной связи можно выделить неполярную и полярную ковалентные связи, более подробно о них мы напишем ниже.
Неполярная связь
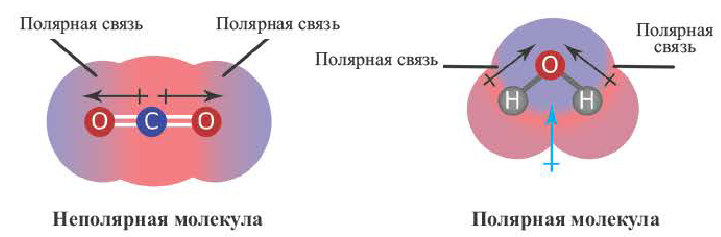
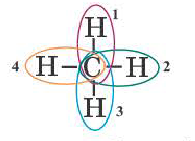
Определение ковалентной неполярной связи просто, это связь, которая образуется между двумя одинаковыми атомами. Пример образование неполярной ковалентной связи смотрите ниже на схеме.
Схема ковалентной неполярной связи.
В молекулах при ковалентной неполярной связи общие электронные пары располагаются на равных расстояниях от ядер атомов. Например, в молекуле кислорода (на схеме выше), атомы приобретают восьми электронную конфигурацию, при этом они имеют четыре общие пары электронов.
Веществами с ковалентной неполярной связью обычно являются газы, жидкости или сравнительно низкоплавные тверды вещества.
Полярная связь
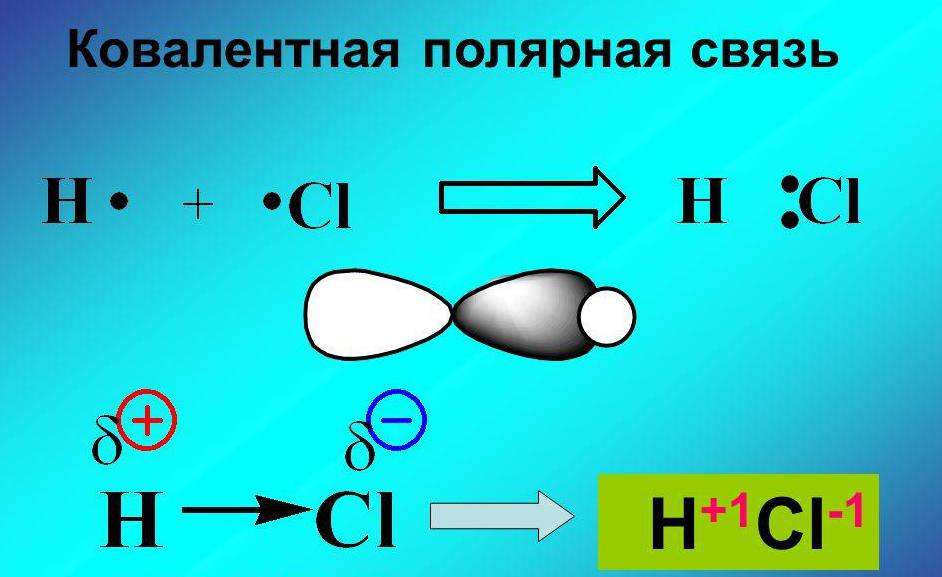
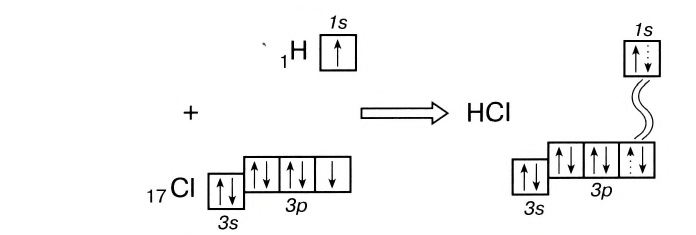
Теперь же ответим на вопрос какая связь ковалентная полярная. Итак, ковалентная полярная связь образуется, когда ковалентно связанные атомы имеют разную электроотрицательность, и обобществленые электроны не принадлежат в равной степени двум атомам. Большую часть времени обобществленые электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там обобществленые электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.
Так выглядит схема ковалентной полярной связи.
Ярким примером вещества с полярной ковалентной связью является вода.
Как определить связь
Что же, теперь вы знаете ответ на вопрос как определить ковалентную полярную связь, и как неполярную, для этого достаточно знать свойства и химическую формулу молекул, если эта молекула состоит из атомов разных элементов, то связь будет полярной, если из одного элемента, то неполярной. Также важно помнить, что ковалентные связи в целом могут возникать только среди неметаллов, это обусловлено самим механизмом ковалентных связей, описанным выше.
Видео
И в завершение видео лекция о теме нашей статьи, ковалентной связи.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Covalent Bond.
Ковалентные неполярные и полярные связи
Что такое ковалентная связь
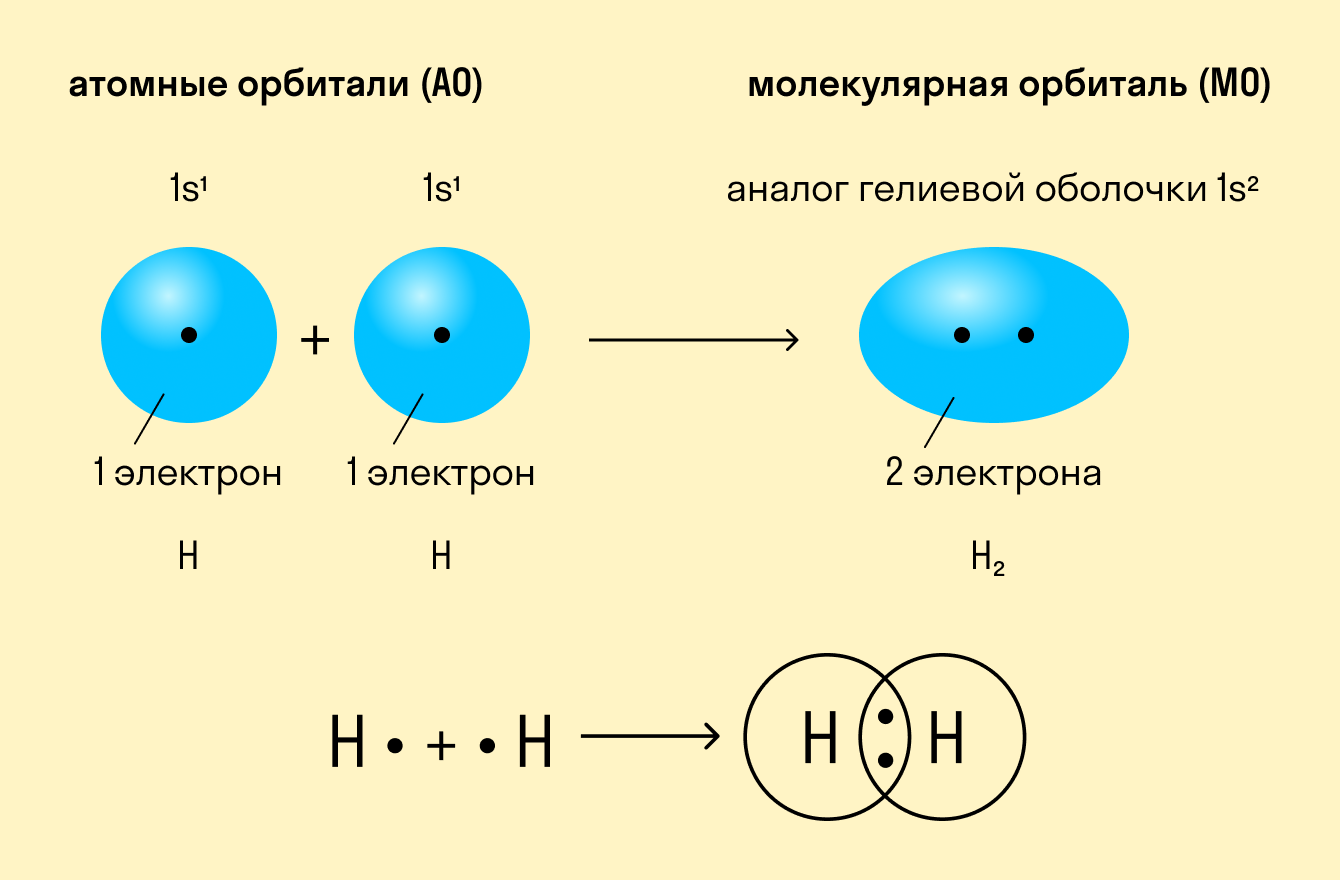
На примере ковалентных связей удобно описывать механизм химической связи в целом. Впервые это сделал американский ученый Гилберт Льюис, анализируя взаимодействие между частицами в молекулах водорода, азота, кислорода и других простых неметаллов.
Как происходит такое взаимодействие? Атом водорода отличается очень простым строением — его электронное облако или орбиталь содержит лишь один свободный (валентный) электрон. При сближении двух атомов водорода их орбитали пересекаются и начинают частично перекрывать друг друга.
Свободные электроны на этих орбиталях объединяются в пару, которая принадлежит обоим участникам взаимодействия. Это и есть процесс образования ковалентной связи. По ее итогам каждый атом имеет уже два электрона и приобретает устойчивую внешнюю оболочку.
Ковалентная связь — это образование общей электронной пары у двух атомов вещества при сближении ядер этих атомов.
В зависимости от того, будет ли пара принадлежать обоим атомам в равной мере или сместится к одному из них, ковалентная связь бывает полярной или неполярной.
Ковалентная неполярная связь
Приведенный выше пример с атомами водорода иллюстрирует ковалентную неполярную связь. Образованная пара электронов находится на общей молекулярной орбитали и принадлежит обоим атомам. Это происходит потому, что в простых веществах взаимодействуют атомы с одинаковой электроотрицательностью (ЭО), т. е. они имеют равную способность притягивать электроны.
Ковалентная неполярная связь — это такое взаимодействие двух атомов, при котором их общая пара электронов равноудалена от атомных ядер и одинаково принадлежит обоим атомам. Другими словами, электронная плотность (область, в которой наиболее вероятно нахождение электронов) распределена равномерно.
Ковалентная неполярная связь образуется между атомами элементарных веществ с одинаковой ЭО.
Интересный пример ковалентной связи этого типа — молекула ромбической серы S8. У атома серы есть 2 свободных электрона, поэтому он может образовать 2 связи. Это простое вещество, а значит, все атомы будут притягивать электроны с одинаковой силой.
Формула данного вещества с ковалентной неполярной связью:
Ковалентная полярная связь
Мы рассмотрели, как проходит ковалентная химическая связь в молекулах, где все частицы одинаковы. Но если сблизить два атома с разной ЭО — например, водорода и хлора, получится другая картина. Поскольку у хлора ЭО выше и он притягивает электроны немного сильнее, чем водород, общая пара смещается в его сторону. Другими словами, у такой химической связи есть полярность.
Атом, принимающий электроны (в данном случае хлор), приобретает условно отрицательный заряд. Второй же атом, отдающий валентные электроны, заряжается положительно.
Ковалентная полярная связь — это электронный обмен между двумя атомами в молекуле вещества, при котором общая пара электронов смещается к одному атому (более электроотрицательному). Электронная плотность распределена неравномерно.
Ковалентная полярная связь образуется между атомами неметаллов с разной ЭО в составе сложных веществ.
Проиллюстрируем все, о чем сказано в определении ковалентной полярной связи, на примерах.
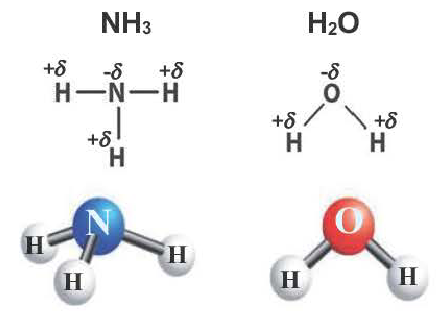
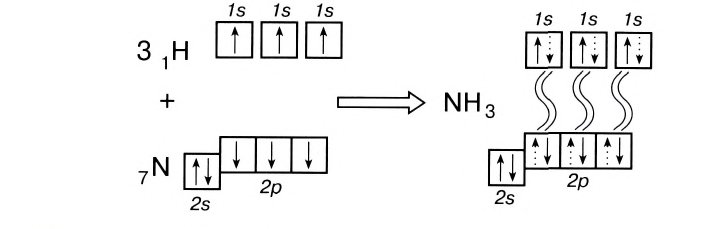
В молекуле аммиака NH3 атом азота имеет 3 свободных электрона, т. е. может образовать 3 химические связи. Поскольку это сложное вещество, состоящее из атомов неметаллов, можно говорить о полярности. Атом азота имеет общие электронные пары с тремя атомами водорода. При этом азот обладает более высокой ЭО, чем водород, поэтому электронная плотность смещена в его сторону.
Формула данного вещества с ковалентной полярной связью:
Механизмы образования ковалентной связи
Не всегда взаимодействие атомов происходит так, как в молекуле водорода. Иногда один атом отдает оба электрона, а второй забирает их на свою свободную орбиталь. В зависимости от этого выделяют два механизма ковалентной связи:
Обменный механизм — объединение в пару свободных электронов от взаимодействующих атомов (по одному электрону от каждого).
Донорно-акцепторный механизм — процесс, при котором атом-донор отдает два электрона, а атом-акцептор предоставляет для них орбиталь.
Химическую связь, образованную по донорно-акцепторному принципу, можно рассмотреть на примере молекулы катиона аммония. В данном случае атом азота, который содержится в аммиаке NH3, имеет неподеленную пару электронов и является донором. Он передает эти электроны на орбиталь атома водорода — акцептора. В результате такой связи образуется молекула NH4 + в форме тетраэдра, где углы представлены четырьмя атомами водорода.
Вещества, в молекулах которых есть хотя бы одна ковалентная химическая связь, осуществляемая по донорно-акцепторному принципу:
Урок №64. Ковалентная связь. Полярная и неполярная ковалентные связи
Сущность и виды химической связи
Атомы стремятся завершить свой внешний уровень (до 8 электронов, исключение водород, гелий до 2 электронов)
В образовании химической связи участвуют валентные электроны. Число валентных электронов определяется по номеру группы, в которой находится атом, образующий химическую связь. Число неспаренных валентных электронов Nе — =8-N группы
Классификация химических связей
1. По способу достижения завершенной электронной оболочки
2. По механизму образования химической связи
3. По способу перекрывания электронных орбиталей
I. По способу достижения завершенной электронной оболочки
КОВАЛЕНТНАЯ СВЯЗЬ
КОВАЛЕНТНАЯ СВЯЗЬ — это связь, возникающая между атомами за счет образования общих электронных пар: H 2 , HCl, H 2 O, O 2
ИОННАЯ СВЯЗЬ
ИОННАЯ СВЯЗЬ – образуется между атомами металлов и неметаллов, т.е. между атомами, резко отличающимися друг от друга по значениям электроотрицательности: NaCl, K 2 O, LiF.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке.
II. По механизму образования химической связи (только для ковалентной связи)
III. По способу перекрывания электронных орбиталей (только для ковалентной связи)
По степени смещения общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Образующиеся общие электронные пары смещены в сторону более электроотрицательного элемента согласно ряду электроотрицательности элементов, предложенному американским химиком Л. Полингом.
В результате на более электроотрицательном элементе образуется избыток электронной плотности ( частичный отрицательный заряд δ- ), а на менее электроотрицательном элементе образуется недостаток электронной плотности ( частичный положительный заряд δ+ ).
Самый электроотрицательный элемент – фтор F.
Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла!
AlCl 3 , разница в электроотрицательности ∆ Э.О.
Содержание:
Ковалентная связь:
Свойство вещества определяется его химическим составом, последовательностью соединения атомов в его молекуле и их взаимодействием. Совокупность сил, связывающих друг с другом атомы в молекуле, называется химической связью. Теория строения атома раскрывает природу химической связи и механизм образования молекулы.
Электроны, участвующие в образовании связи, называются валентными электронами. В различных химических соединениях химические связи по механизму образования и типу отличаются друг от друга. Электроотрицательность элементов влияет на распределение электронов между взаимодействующими друг с другом атомами. По характеру распределения электронов в веществах различают четыре основных типа химической связи.
Химическая связь, возникающая в результате образования общих (связывающих) электронных пар, называется ковалентной связью. Ковалентная связь образуется между атомами неметаллов с одинаковыми или мало отличающимися друг от друга электроотрицательностями. Образование большинства молекул связано с созданием ковалентной связи.
Ковалентная связь это локализованная двухэлектронная связь с двумя центрами. Локализованная связь подразумевает такую связь, которая действует лишь между двумя атомами на ограниченном участке. Одна ковалентная связь образуется одной электронной парой. Т.е. ковалентную связь показывают парными точками или линиями. Эти электроны расположены в наружных электронных слоях обоих атомов.
Ковалентная связь в основном возникает по двум различным механизмам:
1. Механизм обмена. Каждый атом, образующий ковалентную связь, отдаёт одинаковое количество электронов для образования общей электронной пары. Общую электронную пару образуют неспаренные (одиночные |) электроны атомов, образующих связь. При этом спаренные электроны должны обладать антипараллельными спинами
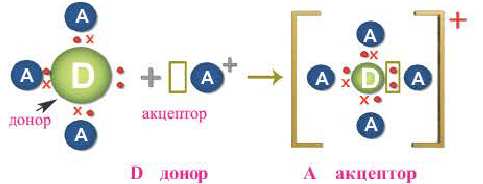
2. Донорно-акцепторный механизм. Ковалентная связь образуется за счет неподеленной электронной пары одного атома и незаполненных (пустых) орбиталей другого атома. Схематически это выглядит так:
Здесь атом D, предоставляющий свою неподеленную электронную пару для общего пользования, называется донором, а атом А, имеющий свободную орбиталь, акцептором. Образованная таким путем ковалентная связь называется донорно-акцепторной или координативной связью.
 | Этот механизм химической связи был открыт в 1893 ем году Альфредом Вернером, создавшим координационную теорию комплексных соединений. В связи с этим, донорно акцепторная связь раньше называлась координативной связью. |
Ион аммония (NH
Установлено, что все связи N H ионе аммония (NH
Механизм образования иона аммония
| Все кислоты, кроме кремниевой кислоты (H2SiO3), при растворении а воде образуют ион гидроксония (H3O + ). Образование иона гидроксония также происходит по донорно акцепторному механизму. |
Механизм образования угарного газа 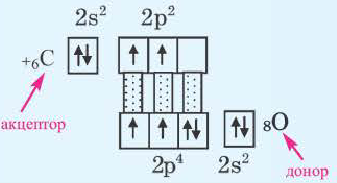 |
| Вещество или ион | Донор | Акцептор | Число электронов, участвующих в образовании связей | |
| у донора | у акцептора | |||
NH | N | H | 5 | 3 |
| СО | O | C | 4 | 2 |
| H3O + | O | H | 4 | 2 |
Виды ковалентной связи
Начертите схему связи и электронов, образующих эту связь.
1. H2S→ 




Какие виды ковалентной связи существуют? Чем они отличаются друг от друга?
Существует два вида ковалентной связи, образованной по механизму обмена:
Неполярная ковалентная связь
Ковалентная связь, образованная между атомами неметаллов одного вида (или между атомами с одинаковой электроотрицательностью), называется неполярной ковалентной связью:
H2, N2, O2, F2, Cl2, Br2,I2, P4, S8

Неполярная ковалентная связь
При образовании ковалентной связи между атомами с одинаковой электроотрицательностью электронные пары между ядрами атомов размещаются симметрично. В образовавшейся в результате
этого молекуле центры положительных и отрицательных зарядов совпадают.
Полярная ковалентная связь
Ковалентная связь, образованная между атомами различных видов неметаллов (или между атомами неметаллов с различными электроотрицательностями), называется полярной ковалентной связью.
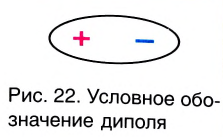
В большинстве полярных молекул центры положительных и отрицательных зарядов не совпадают. Одна сторона молекулы частично заряжается положительно, а другая сторона частично отрицательно. В результате создается диполь (поляризация в молекуле). Электронная пара перемещается в сторону атома с большей электроотрицательностью. Молекулы, образующие диполь, бывают полярными.

Полярная ковалентная связь
| Слово «диполь» на греческом «polos» означает «полярный». +δ и δ (дельта) относительные заряды. Их абсолютное значение бывает меньше 1. |
Несмотря на то, что в молекулах некоторых веществ все связи полярноковалентные, однако из-за неспособности молекулы к поляризации (т.е. к созданию диполя), они являются неполярными (СО2, СН4).
При наличии между атамами одной ковалентной связи ее называют одинарной связью. Все одинарные связи σ— связи.
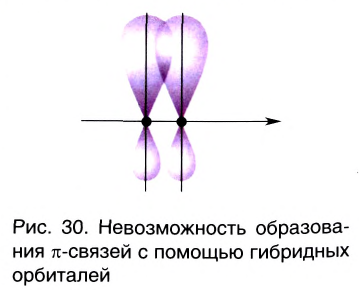
π— связь:
При образовании второй и третьей ковалентных связей между двумя атомами перекрывание электронных облаков происходит не по линии, соединяющей центры атомов. Электронные облака в атоме расположены в отношении друг к другу под определенным углом. И поэтому перекрывание электронных облаков происходит по обе стороны от линии, пересекающей центры атомов.
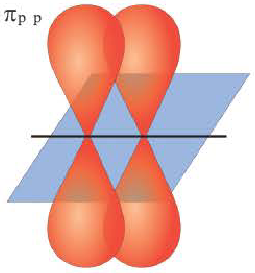
π- связь.
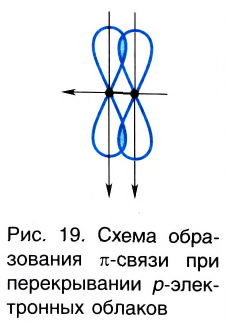
Ковалентная связь, созданная за счет перекрывания орбиталей по обе стороны от оси, соединяющей центры атомов, называется π- связью, π— связь образуется перекрыванием двух р- орбиталей по обе стороны от оси, соединяющей центры атомов, π— связь могут образовать негибридизированные р- орбитали (р- электроны).
В результате образования π— и σ- связей, находящихся на перпендикулярно расположенных друг к другу плоскостях в пространстве в составе одной молекулы, создаются двойные и тройные связи.
Все одинарные связи являются σ- связью, из двойных же связей одна σ- связь, а другая σ- связь, из тройных связей одна σ- связь, а две π— связи.
| Вещество | 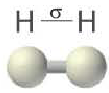 | 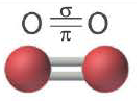 | 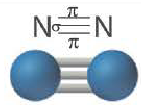 |
| Количество σ- связей | 1 | 1 | 1 |
| Количество π- связей | 0 | 1 | 2 |
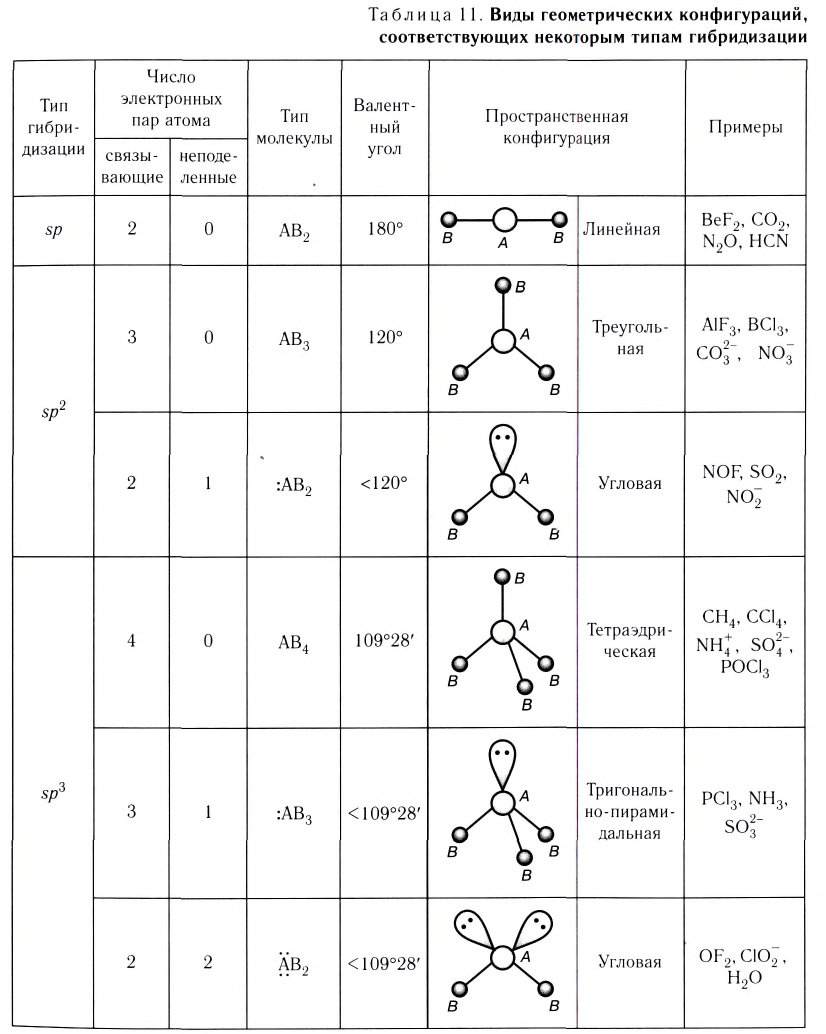
Пространственное строение молекул и гибридизация
Определите соответствие. 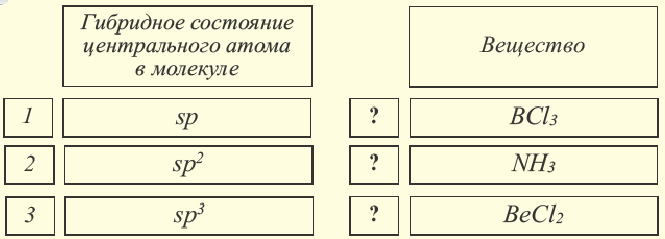
Какое значение имеют гибридные орбитали в процессе гибридизации? Какие формы гибридизации вы знаете?
Пространственное строение молекулы зависит от формы и направления электронных орбиталей её атомов. Процесс образования новых орбиталей с одинаковыми энергией и формой из комбинации различных орбиталей (s- и р-) называется гибридизацией. Образовавшиеся новые орбитали называются гибридными орбиталями.
Для s- и р-орбиталей возможны три типа гибридизации.
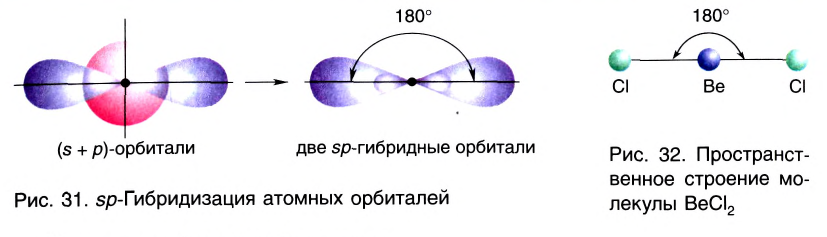
sp- гибридизация:
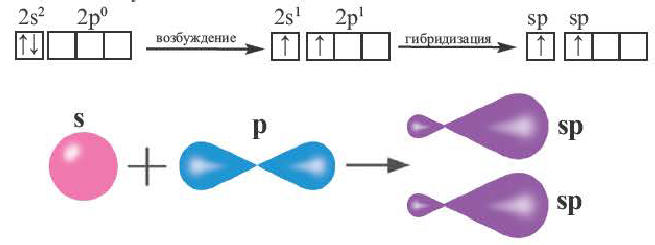
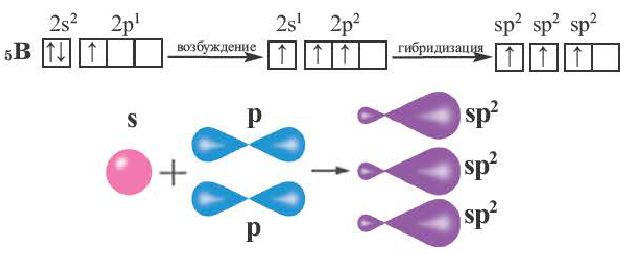
При участии одной s- и одной р-орбитали образуются 2 sp- гибридные орбитали, расположенные под углом 180°. Подобная гибридизация характерна для некоторых элементов II группы: ZnCl2, BeCl2, Mgl2 и др. Электронное строение внешнего электронного слоя бериллия имеет вид 2s 2 2p°. При возбуждении атома бериллия один из s- электронов переходит на р- подуровень, а затем, в результате гибридизации одной s- и одной р- орбиталей, образуются две sp-гибридные орбитали с одинаковой энергией,
расположенные под углом 180°.
Образовавшиеся две sp-гибридные орбитали, оттолкнувшись друг от друга, располагаются под углом 180°, т.е. вдоль прямой линии, двигаясь в противоположных направлениях. В результате перекрывания двух sp- гибридных электронных облаков атома Be р-электроными облаками атомов Cl образуется BeCl2 линейного строения.
BeF2, BeCl2, BeBr2, Bel2, СО2 это вещества линейного строения, образованные за счет перекрывания sp- гибридных орбиталей.
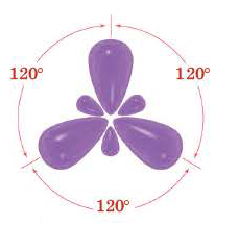
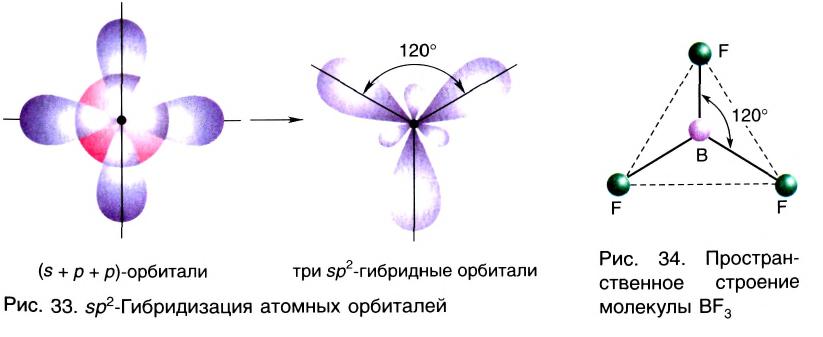
Эти три возбужденных гибридных электронных облака атома бора перекрываются р- электронными облаками атомов фтора и в результате образуется молекула BF3 треугольной формы. Все три образовавшиеся связи находятся на одной плоскости. BCl3, ВВr3, Bl3 также обладают подобным плоским строением.
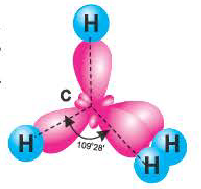
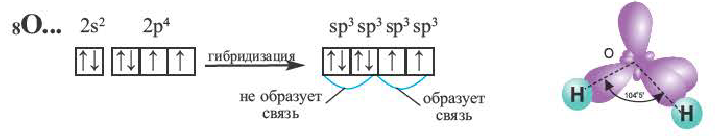
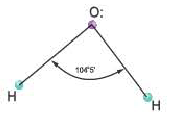
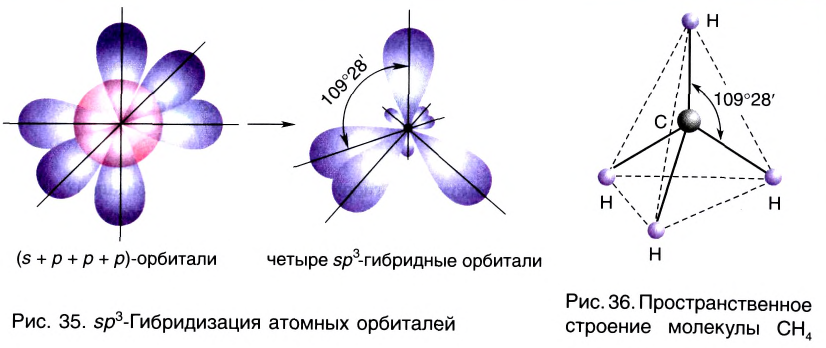
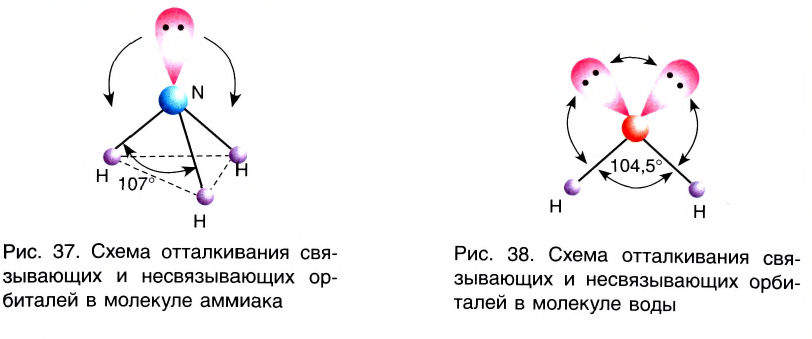
Гибридные орбитали, содержащие электронные пары атома кислорода в молекуле воды, отталкивают другие гибридные орбитали и в результате молекула приобретает неправильную (несимметрическую) форму тетраэдра, образуя угол связи 104 o 5′.
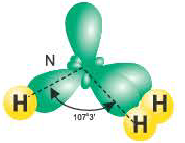
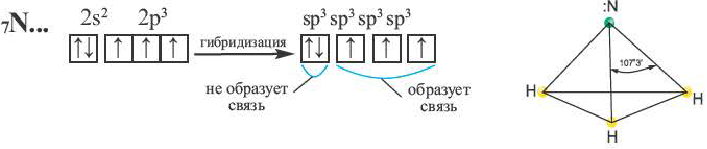
Гибридные орбитали, содержащие электронные пары атома азота в молекуле аммиака, отталкивают другие гибридные орбитали и в результате молекула приобретает неправильную (несимметрическую) форму тетраэдра, а угол связи составляет 107 o 3′.
Свойства ковалентной связи
Основными характерными свойствами ковалентной связи являются ее прочность, энергия, насыщенность, направленность, полярность, длина и кратность.
Прочность ковалентной связи
Чем больше электронная плотность между ядрами атомов, тем прочнее будет связь. Прочность химической связи зависит от:
1) насыщенности связи; 2) длины связи; 3) полярности связи.
Энергия связи
Энергия связи для 1 молекулы равна соотношению между минимальной энергией, необходимой для разрыва связи, и постоянной Авогадро.
Для вычисления энергии, необходимой для разрыва одной связи в многоатомных молекулах, следует поделить общую энергию связи на количество связей. Энергия связи в молекуле метана(СН4)
ΔH=+1647 кДж/моль Эсвязи= 1647 : 4 ≈ 412 кДж/моль
Однако действительное значение каждой отдельно взятой энергии связи несколько отличается от ее среднего значения.
Пользуясь понятием энергии связи, можно определить, являются ли химические реакции экзотермическими или эндотермическими.
Разница между суммой энергий связи между атомами продуктов реакции и суммой энергий связи между атомами веществ, вступивших в реакцию, определяет тепловой эффект химической реакции. Если эта разница положительная, то реакция экзотермическая, а при отрицательной разнице эндотермическая. При вычислении же по изменению энтальпии (ΔH) бывает наоборот.
В общем виде вычисляется следующим образом:
Δ H равен тепловому эффекту реакции с противоположным значением, называется изменением энтальпии. Оно находится только посредством вычислений.
| В экзотермических реакциях, пропротекающих с выделением теплоты: Q  0 ; ΔH 0 ; ΔH 0 ; ΔH=+Q 0 ; ΔH=+Q | В эндотермических реакциях, пропротекающих с поглощением теплоты: Q  0 ; ΔH 0 ; ΔH 0 ; ΔH= Q 0 ; ΔH= Q |
Насыщенность связи
Насыщенность ковалентной связи определяется валентными возможностями атомов. Возможность образования ковалентной связи определяется числом валентных электронов (или образующих ковалентную связь орбиталей). Например, в атоме углерода, имеющем в наружном электронном слое всего 4 орбитали, в возбужденном состоянии содержится 4 одиночных электрона и поэтому атом углерода способен образовать не более 4-х ковалентных связей. Валентные возможности атомов определяются числом неподеленных электронных пар, которые могут быть отданы другим атомам с незаполненными орбиталями на наружном энергетическом уровне.
Направленность связи
Это свойство ковалентной связи обуславливает пространственное строение молекул. Направленность химических связей объясняется различным расположением электронных облаков в пространстве. Во время взаимного перекрывания электронных облаков в пространстве могут образоваться соединения, молекулы которых будут иметь линейную форму или форму угла. Н2, N2, F2, НСl, СО, NO имеют линейное строение, а H2O, SO2, NO2 форму угла.
Кратность связи определяется числом электронных пар (числом ковалентных связей), соединяющих два атома. В молекуле кислорода кратность связи равна 2. На внешнем энергетическом уровне каждого атома кислорода содержатся два неспаренных одиночных электрона: O=O
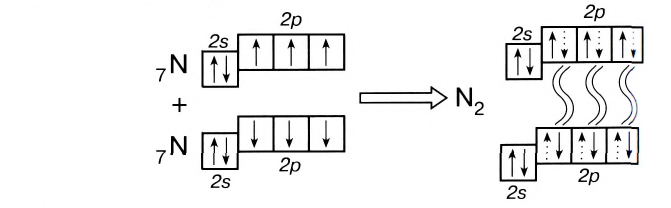
В молекуле азота кратность связи равна 3. На внешнем энергетическом уровне каждого атома азота содержатся три неспаренных одиночных электрона. N 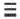
Длина связи это расстояние между ядрами атомов, образующих связь; измеряется в нанометрах (нм). Чем короче длина химической связи, тем прочнее будет связь.
Полярность связи зависит от смещения электронной пары, образующей ковалентную связь, в сторону одного из атомов.
В галогенидах водорода (HF, HC1, HBr, HI) в связи с увеличением радиуса по мере возрастания порядкового номера галогена, увеличивается и длина связи. Так как F (фтор) самый сильный неметалл, HF отличает большей полярностью и прочностью. В связи с увеличением длины связи в HF, HC1, HBr, HI, по мере увеличения радиуса, их полярность, прочность связи уменьшаются, а кислотность, восстановительные свойства усиливаются.
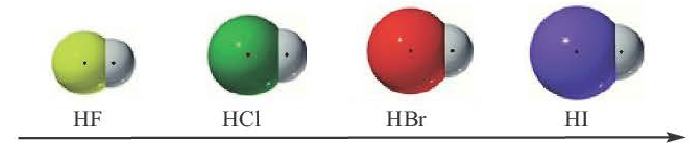
полярность, прочность связи уменьшаются, кислотность, восстановительные свойства усиливаются.
Природа и типы химической связи
При обычных условиях химические элементы существуют в форме различных атомных частиц в составе простых и сложных веществ. Из них только простые вещества благородных газов (элементов VIIIA-группы) являются одноатомными молекулами, а остальные представляют собой самые разнообразные соединения. Число атомов в таких соединениях колеблется от двух до сотен и тысяч. Силы, которые обеспечивают существование таких агрегатов (молекул, радикалов, кристаллов и др.), получили название химическая связь.
Химическая связь — это взаимодействие, которое связывает отдельные атомы в более сложные системы (молекулы, радикалы, кристаллы и т. д.).
Причиной образования химической связи является стремление атомов путем взаимодействия с другими атомами достичь более устойчивого состояния, т. е. состояния с минимально возможным запасом энергии. Следовательно, основным условием образования химической связи является понижение полной энергии Е многоатомной системы по сравнению с суммарной энергией изолированных атомов, т. е.
в случае образования вещества АВ из атомов А и В.
Таким образом, образование химической связи всегда сопровождается выделением энергии.
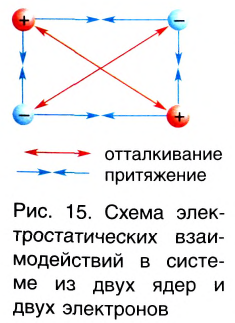
Природа сил химической связи — электростатическая, т. е. обусловлена различными видами взаимодействий положительно заряженных ядер и отрицательно заряженных электронов (рис. 15).
У атомов остальных элементов внешние энергетические уровни являются незавершенными, и поэтому в процессе химического взаимодействия атомы стремятся их завершить, т. е. приобрести электронное строение атома ближайшего благородного газа. Это соответствует нахождению двух электронов на внешнем уровне у атомов водорода, который расположен в одном периоде с гелием, и восьми электронов (октет) — у всех остальных атомов. Достичь такого электронного состояния атомы могут только за счет обобществления электронов, т. е. их совместного использования атомами, соединяющимися между собой. При этом образуются общие электронные пары, которые связывают атомы друг с другом — между ними возникает химическая связь.
В зависимости от способа обобществления электронов различают три основных типа химической связи: ковалентную, ионную и металлическую.
Ковалентная связь:
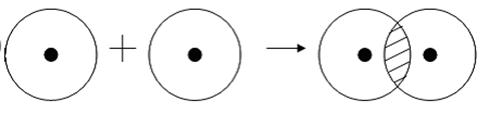
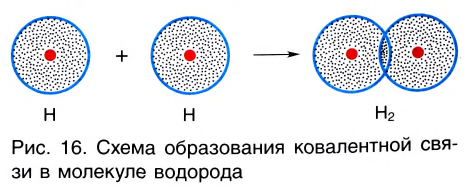
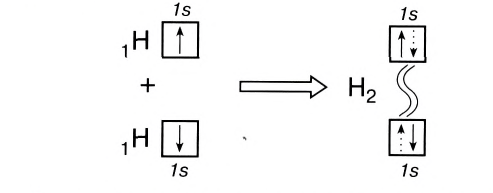
Ковалентная связь возникает обычно между двумя атомами неметаллов с одинаковыми или близкими значениями электроотрицательности. Рассмотрим образование ковалентной связи на примере простейшей молекулы — молекулы водорода Н2. У атома водорода всего один электрон, находящийся на внешнем (первом) энергетическом уровне, до завершения которого не хватает одного электрона.
При сближении двух атомов водорода за счет сил притяжения, действующих между их ядрами и электронами, происходит частичное перекрывание электронных облаков неспаренных электронов с антипараллельным спином (это одно из условий образования общей электронной пары!). В зоне их перекрывания плотность двухэлектронного облака увеличивается. Ядра атомов стягиваются к этой области повышенного отрицательного заряда до тех пор, пока не наступит равновесие между силами межъядерного отталкивания и силами притяжения. Расстояние между ядрами атомов уменьшается, энергия системы, состоящей из двух атомов водорода, также понижается. Область повышенной электронной плотности связывает два атома водорода в молекулу Н2 (рис. 16).
Образование химической связи между атомами водорода в молекуле можно показать различными способами. Например, с помощью электронных формул, в которых Указывают символы элементов и валентные электроны в виде точек:
В графических (или структурных) формулах пару электронов обозначают с помощью черточки:
В случае молекулы водорода эта единственная черточка символизирует ковалентную связь.
Химическая связь, возникающая в результате обобществления электронов с образованием общих электронных пар между атомами, называется ковалентной связью.
Образование ковалентной связи можно показать и с помощью электронно-графических схем, на которых обычно указываются только орбитали внешнего энергетического уровня:
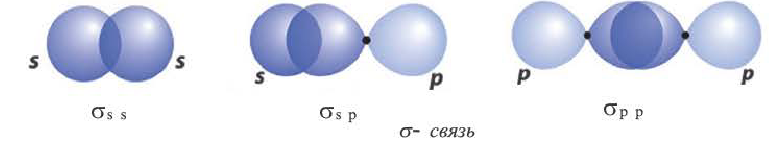
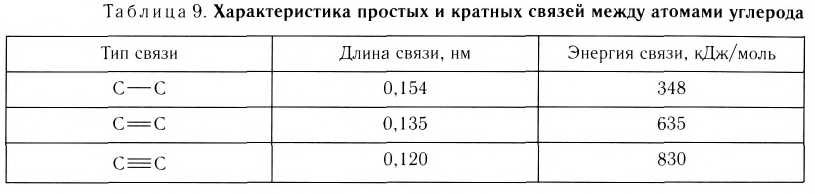
Волнистая линия между двумя орбиталями 1s указывает на то, что каждый электрон как бы одновременно находится как на одной, так и на другой орбитали. В данном случае ковалентная связь образована в результате перекрывания двух s-opбиталей (или s-облаков) (рис. 17).
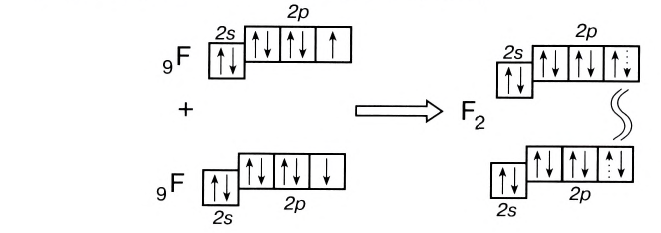
Подобным образом образуется ковалентная связь и между двумя атомами фтора в молекуле F2. Атом фтора имеет 7 электронов на внешнем электронном слое, один из них — неспаренный электрон. При сближении двух атомов фтора происходит перекрывание электронных облаков их неспаренных электронов, образуется общая электронная пара и внешний энергетический уровень каждого атома фтора завершается до октета (8 электронов):
Схема образования молекулы фтора с помощью электронных формул:
а графическая формула молекулы:
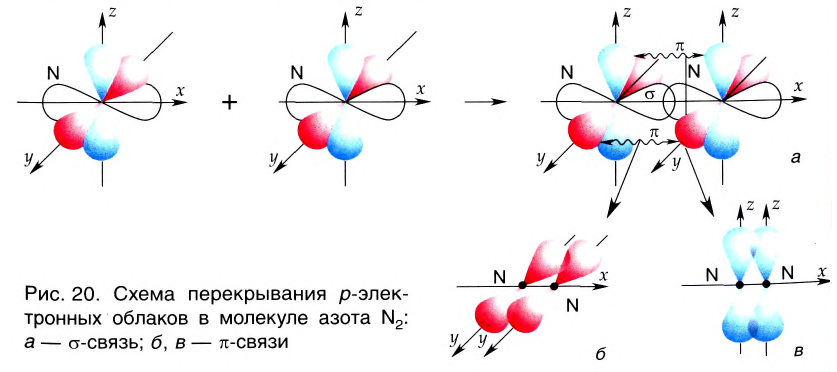
В данном случае образование ковалентной связи произошло за счет перекрывания р-электронных облаков (рис. 18).
Одинарная связь:
И в молекуле водорода, и в молекуле фтора атомы связаны электронной парой, образующей одну химическую связь, называемую одинарной. В обоих случаях перекрывание электронных облаков (как s-, так и р-) происходит вдоль линии, соединяющей центры взаимодействующих атомов. Эту условную прямую называют линией (или осью) связи.
Ковалентная связь, образованная за счет перекрывания атомных орбиталей вдоль линии связи, называется 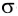
Пару электронов, образующих ковалентную связь, называют связывающей в отличие от электронных пар, которые не участвуют в образовании связей и, следовательно, являются несвязывающими. Такие пары часто также называют неподеленными, поскольку они принадлежат только одному атому.
У атомов водорода в молекуле Н2 нет несвязывающих пар, а в молекулах F2, С12, Вr2 или I2 у каждого из атомов галогенов их по три:
Кратные связи. Полярная и неполярная ковалентная связь
Два атома могут быть связаны между собой не только одной, но и несколькими ковалентными связями. В таком случае говорят о кратности связи, понимая под этим термином число электронных пар, участвующих в образовании ковалентной связи.
Кратные связи
У атомов азота (элемента VA-группы) до завершения внешнего энергетического уровня не хватает трех электронов:
Поэтому при образовании молекулы N2 атомы азота обобщают уже не одну, а три пары электронов:
Схема образования молекулы азота:
а графическая формула молекулы:
Одна из ковалентных связей, образовавшаяся в результате перекрывания р-электронных облаков вдоль линии связи, представляет собой 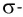
Такая ковалентная связь получила название 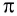
► 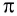
Облака s-электронов не могут образовывать 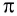
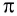
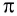
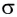
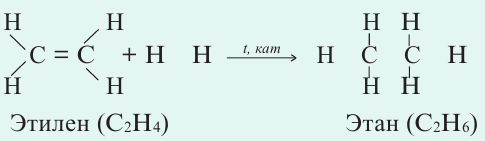
Если ковалентная связь между двумя атомами образуется двумя общими электронными парами, то такая ковалентная связь называется двойной связью, и она обозначается двумя черточками. Например, в молекуле этена С2Н4 атомы углерода соединены между собой двойной связью:
одна из которых — 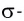
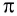
Если в молекуле имеется тройная связь, как, например, в молекуле азота N2, то одна из них — 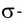
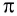
Полярная и неполярная ковалентная связь
До сих пор мы рассматривали ковалентную связь, образованную атомами одного и того же элемента. В этом случае общая пара электронов располагается симметрично между двумя атомами с одинаковой электроотрицательностью. Такая ковалентная связь называется неполярной.
Если же взаимодействуют атомы с различными электроотрицательностями, т. е. атомы разных элементов, то общая электронная пара смещается к атому с большей электроотрицательностью. В таких случаях возникает полярная ковалентная связь.
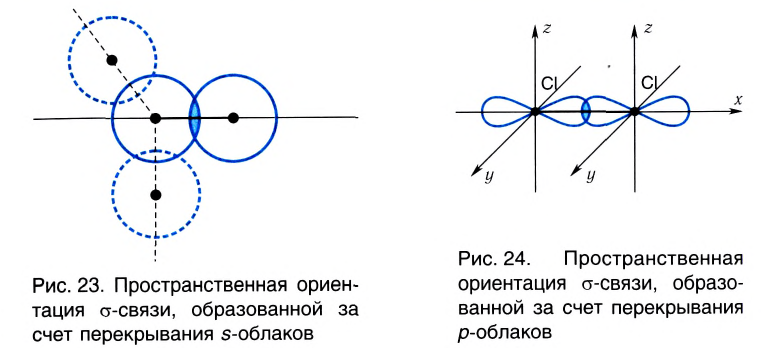
Например, в молекуле хлороводорода HCI общая электронная пара смещена в сторону более электроотрицательного элемента, каким является хлор:
В данном случае перекрываются сферическое s-электронное облако атома водорода и гантелеобразное р-облако атома хлора (рис. 21).
Схема такого перекрывания:
В результате смещения общей электронной пары в молекуле HCl на атоме хлора возникает частичный отрицательный заряд, а на атоме водорода — такой же по величине, по положительный заряд:
(греческая буква 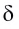
Значение заряда 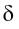
Чем больше разность электроотрицательностей связанных атомов, тем более полярна химическая связь межту ними.
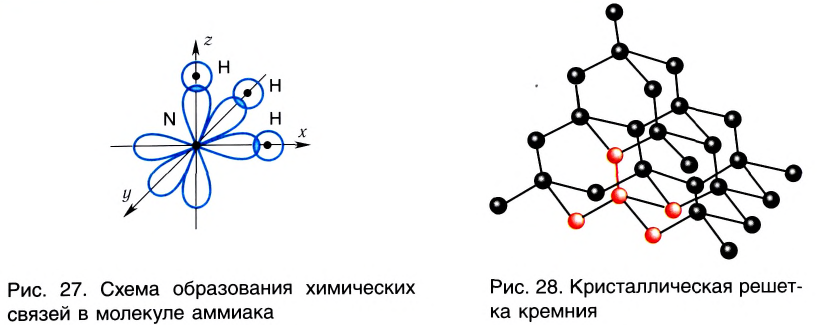
С помощью ковалентной связи образуются молекулы и более сложных веществ, состоящих из трех, четырех и более атомов. В качестве примера рассмотрим образование молекулы аммиака NH3. Электронно-графическая схема взаимодействия трех атомов водорода и одного атома азота следующая:
Общая схема образования аммиака:
а графическая формула молекулы:
Таким образом, три неспаренных электрона атома азота принимают участие в образовании трех ковалентных связей с атомами водорода, а на внешнем энергетическом уровне у атома азота остается еще неподеленная пара электронов. Каждая связь N — Н является полярной. В целом вся молекула NH;i представляет собой диполь, так как она имеет форму пирамиды с атомом азота в ее вершине. Однако существует много молекул, которые содержат полярные связи, но сами являются неполярными. Это объясняется особенностями их пространственного строения. Об этом мы поговорим в следующих параграфах.
Механизмы образования ковалентной связи
Различают два основных механизма образования ковалентной связи — обменный и донорно-акцепторный.
Обменный механизм образования связи
Ковалентная связь образуется двумя атомами с помощью двух электронов с антипараллельным спином, т. е. химическая связь находится (локализована) между двумя атомами. Так как нахождение двух электронов в поле действия двух ядер энергетически выгоднее, чем пребывание каждого электрона в поле своего ядра, то в образовании ковалентной связи принимают участие все одноэлектронные орбитали внешнего энергетического уровня. Например, атом азота имеет три не-спаренных электрона на внешнем уровне:
атом кислорода — два:
а атом фтора — один:
Поэтому эти атомы могут образовывать за счет таких электронов соответственно три, две и одну ковалентные связи.
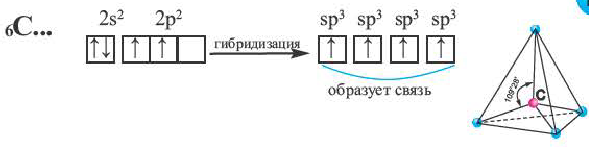
Число неспаренных электронов может увеличиваться при переходе атома в возбужденное состояние. Например, на внешнем энергетическом уровне атома углерода находится только два неспаренных электрона.
Однако в большинстве своих соединений углерод проявляет валентность, равную 4, образуя четыре ковалентные связи, например: С02, СН4, ССl4 и т.д. Такая валентность атома углерода становится возможной благодаря тому, что его атом при образовании химических связей с другими атомами переходит в возбужденное состояние (т. е. в состояние с большей энергией) за счет распаривания пары электронов 2s 2 и перехода одного из них па подуровень 2р:
В возбужденном состоянии атом углерода имеет четыре неспаренных электрона, за счет которых он может образовывать четыре ковалентные связи с атомами других элементов. Распаривание электронов требует затраты энергии, но эта затрата с избытком компенсируется энергией, выделяющейся при образовании дополнительных связей. Распаривание, как правило, происходит лишь в пределах данного энергетического уровня, поскольку переход электронов на свободные орбитали другого уровня энергетически не выгоден. Поэтому в возбужденное состояние могут перейти атомы только тех элементов второго периода, у которых имеются свободные орбитали (бериллий, бор, углерод). У атомов азота, кислорода и фтора нет свободных орбиталей на втором энергетическом уровне, а переход электронов на третий уровень потребует слишком больших затрат энергии, которые не компенсируются выделением энергии при образовании дополнительных связей.
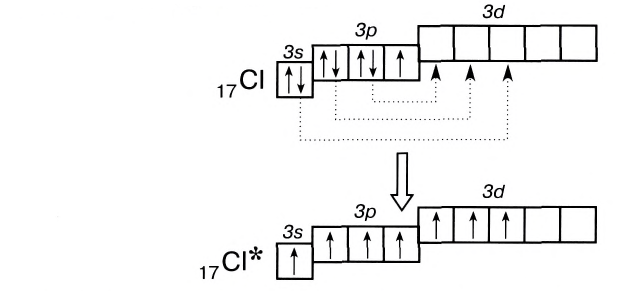
В то же время атомы элементов третьего и следующих периодов имеют на внешнем энергетическом уровне d-подуровень, на который при возбуждении могут переходить s- и р-электроны:
Благодаря этому атом хлора способен образовывать не одну, а несколько ко-валентных связей, вплоть до семи, как, например, в оксиде Сl207.
Таким образом, атомы при образовании ковалентных связей используют все свои неспаренные электроны, как находящиеся в основном состоянии, так и образовавшиеся при распаривании.
Донорно-акцепторный механизм образования ковалентной связи
Образование ковалентной связи возможно и при взаимодействии атомов, один из которых имеет пару неподеленных электронов (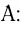

Атом, предоставляющий электронную пару для образования связи, называется донором, а участвующий в обобществлении пары за счет свободной орбитали, — акцептором. Такой механизм образования ковалентной связи получил название донорно-акцепторного.
Механизм образования ковалентной связи за счет неподеленной пары электронов одного атома и свободной орбитали другого называется донорно-акцепторным.
Примером такого механизма может служить образование иона аммония 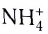
Сокращенно ионное уравнение этой реакции:
Составим электронную схему такого взаимодействия, обозначив точками электроны, принадлежащие атому азота, а звездочками — атомам водорода:
В ионе аммония каждый атом водорода связан с атомом азота общей электронной парой. И хотя одна из этих связей образована по донорно-акцепторному механизму, она не отличается по своим характеристикам от остальных ковалентных связей, образованных по обменному механизму.
Электронная схема этого процесса:
Свойства ковалентной связи
Вы уже познакомились с одной из характеристик ковалентной связи — полярностью. Полярность связи и всей молекулы в целом во многом определяет физические и химические свойства вещества, такие, как температуры кипения и плавления, растворимость и даже способность вступать в химические реакции с другими веществами.
Рассмотрим еще некоторые характеристики ковалентной связи.
Энергия и длина связи
Одной из важнейших характеристик химической связи является ее прочность. Прочность связей определяет реакционную способность вещества.
Мерой прочности связи является та энергия, которую необходимо затратить на ее разрыв. Эту характеристику называют энергией связи. В случае веществ с двухатомными молекулами ее величину рассчитывают на 1 моль вещества. Так. у молекулы водорода Н2 энергия связи Н — Н равна 435 кДж/моль, у молекулы фтора F2 — 159 кДж/моль, а у молекулы азота эта характеристика равна 943 кДж/моль. Чем меньше энергия связи, тем менее прочной является ковалентная связь, тем больше реакционная способность вещества.
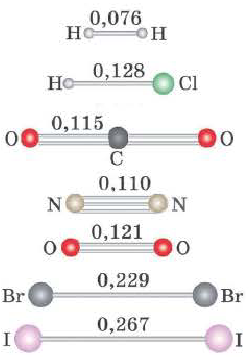
Еще одной характеристикой прочности связи является длина связи — расстояние между ядрами химически связанных атомов. С увеличением радиусов атомов длина связи между ними увеличивается, а прочность — уменьшается. Ковалентная связь Н—Н более прочная, чем связь F—F, так как ее длина равна 0,074 нм, а связи F—F — 0,142 нм.
Увеличение кратности связи приводит к уменьшению межъядерного расстояния и упрочнению связи между атомами (табл. 9).
Из таблицы 9 видно, что энергия двойной связи 


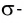
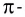
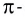
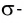
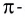
Насыщаемость
Ковалентная связь характеризуется насыщаемостью. Это свойство состоит в том, что образование связывающей два атома электронной пары исключает ее участие в других химических взаимодействиях. Благодаря этому общее число ковалентных связей, которые способен образовывать тот или иной атом, ограничено. Оно определяется числом орбиталей атома, использование которых для образования химических связей энергетически выгодно. Так, элементы второго периода, у атомов которых внешний энергетический уровень состоит только из четырех орбиталей (одна s- и три р-типа), могут образовать не более четырех ковалентных связей. У атомов следующих периодов в образовании ковалентных связей могут принимать участие и d-орбитали как внешнего, так и предвнешнего энергетических уровней.
Поэтому ковалентные соединения имеют строго определенный состав.
Направленность ковалентной связи
Ковалентная связь между двумя атомами располагается таким образом, чтобы обеспечить максимальное перекрывание электронных облаков. Поскольку в образовании связей принимают участие электронные облака различной формы и ориентации в пространстве, то и ковалентные связи, образованные этими облаками, также характеризуются определенной направленностью.
Если ковалентная связь образуется путем перекрывания сферических s-электронных облаков, как, например, в молекуле Н2, то она может располагаться в любом направлении (рис. 23) относительно центра данного атома.
А вот в молекуле Сl2, где ковалентная связь образована за счет перекрывания р-облаков, область перекрывания располагается только вдоль линии связи, определенной пространственной ориентацией р-облака (рис. 24).
Следовательно, направленность ковалентных связей объясняется различным расположением электронных облаков в пространстве.
Понятие о стереохимии и атомные кристаллические решетки
Каждая молекула представляет собой систему взаимосвязанных атомов, расположенных определенным образом относительно друг друга. Следовательно, молекула характеризуется определенным пространственным строением, или, говоря иначе, геометрией (формой).
Вопросы строения молекул рассматривает один из разделов химии, который называется стереохимией (в буквальном переводе с греческого языка — пространственная химия).
Согласно стереохимическим представлениям, когда один атом образует несколько связей, они будут направлены под определенными углами друг к другу. Угол между связями (или валентный угол) — это угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов. Такие прямые, как вы уже знаете, называются линиями связи (рис. 25).
Например, в молекуле Н20 атом кислорода образует две 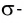
Аналогично в молекуле NH3 углы между связями N—Н, образованные тремя р-орбиталями атома азота, также должны быть близки к 90° (рис. 27), а вся молекула в целом должна иметь форму треугольной пирамиды с атомом азота в вершине.
Действительные значения углов между связями (104,5° в молекуле Н20 и 107° в молекуле NH3) отличаются от ожидаемых. Увеличение валентных углов можно объяснить взаимным отталкиванием положительно заряженных атомов водорода. Например, уже в молекуле H2S такое отталкивание слабее, чем в молекуле Н20 (так как радиус атома серы больше радиуса атома кислорода), и угол Н—S—Н ближе к 90°, чем угол Н—О—Н.
За счет ковалентной связи образуются не только молекулы. Некоторые простые и сложные вещества построены из атомов, связанных друг с другом ковалентными связями, и образуют протяженные кристаллические структуры — атомные кристаллические решетки.
Примерами таких веществ являются простые вещества — бор, алмаз, кремний. В кремнии (как и в кристалле алмаза)(рис. 28) каждый атом связан четырьмя ковалентными связями с другими атомами.
Подобное строение имеют и сложные вещества: карбид кремния SiC и оксид кремния Si02 (кварц).
Атомных кристаллов сравнительно немного. Благодаря высокой прочности ковалентных связей они имеют очень высокие температуры плавления, большую твердость. Так, самым твердым природным веществом является алмаз — его температура плавления более 3500 °С. Карбид кремния SiC также является одним из самых твердых веществ с очень высокой температурой плавления — более 2700 °С.
Гибридизация атомных орбиталей
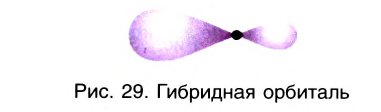
Вы уже знаете, что в образовании ковалентных связей принимают участие как s-, так и р-электроны, орбитали которых имеют разную форму и направленность в пространстве. Вместе с тем связи, которые образуются при их участии, оказываются равноценными и расположенными симметрично.
В рамках электронной теории химической связи эти факты объясняются на основе концепции гибридизации атомных валентных орбиталей. Согласно данной концепции в образовании ковалентных связей участвуют не «чистые», а так называемые гибридные, усредненные по форме и размерам (а следовательно, и по энергии) орбитали. Число таких орбиталей равно числу исходных орбиталей. Гибридные орбитали более вытянуты в пространстве (рис. 29), что обеспечивает их более полное перекрывание с орбиталями соседних атомов при образовании связей. Гибридные орбитали, вследствие особой симметрии, в образовании 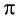
Условия устойчивой гибридизации:
Ориентация гибридных орбиталей определяет геометрическую структуру молекулы и молекулярных ионов. Так, при комбинации одной s- и одной р-орбитали возникают две sp-гибридные орбитали, расположенные симметрично под углом 180° (рис. 31). Соответственно связи, образованные с участием электронов этих орбиталей, также располагаются под углом 180°. Например, у атома бериллия sp-гибридизация орбиталей проявляется в молекуле ВеСl2, которая вследствие этого имеет линейную форму (рис. 32).
Основные характеристики указанных типов гибридизации приведены в таблице 10.
Существуют и другие типы гибридизации атомных орбиталей. Они достаточно доступны для понимания, но их рассмотрение выходит за рамки школьного курса.
Пространственное строение молекул
Пространственное строение молекул или молекулярных ионов зависит от типа гибридизации и взаимного расположения в пространстве гибридизованных орбиталей центральных атомов.
В реальных молекулярных структурах углы между связями часто отличаются от углов, соответствующих типу гибридизации.
В чем причина таких отклонений?
Прежде чем ответить на этот вопрос, выделим несколько положений, на которых основываются подходы к рассмотрению геометрии молекул.
Линия связи (или ось связи) — это прежде всего область перекрывания электронных облаков при образовании 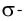
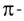
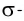
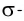
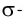
Основными причинами отклонений углов связей от углов, соответствующих типу гибридизации, являются следующие.
1. Не все гибридные орбитали участвуют в образовании связей, часть из них — несвязывающие. Электронные пары, находящиеся на этих орбиталях, также называются несвязывающими (или неподеленными). Например, у атома азота в молекуле NH3 одна пара электронов — несвязывающая, а в молекуле Н20 у атома кислорода две пары электронов являются несвязывающими:
Число атомов В (в общем случае и число групп атомов), непосредственно связанных с центральным атомом А, называется его координационным числом. В соединениях с ковалентным типом связей координационное число атома равно числу 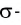
2. Наличие 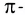
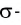
В молекуле углекислого газа С02, графическая формула которого
две ковалентные связи одинарные, т. е. являются 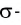
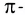
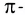
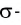
Многоцентровые связи
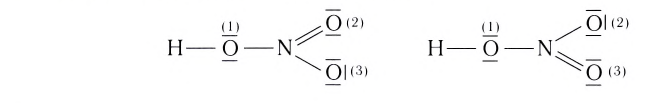
Строение многих молекул нельзя изобразить только одной графической формулой с точной локализацией кратной связи, поскольку истинные свойства молекулы оказываются промежуточными между теми, которые отражаются в каждой отдельной схеме. Например, строение молекулы HNO3 можно изобразить двумя равнозначными графическими формулами:
Поскольку в этой молекуле оба атома кислорода 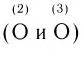
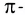
В этой формуле пунктирные линии означают, что одна из общих электронных пар в равной степени распределена между одной и другой связями N—О. Другими словами, эта электронная пара принадлежит не двум, а трем атомам и, следовательно, образованная ею связь является трехцентровой.
Примерами структур с многоцентровыми (делокализованными) 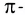
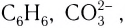
Валентность и степень окисления
Валентность и валентные возможности атомов
Мы установили, что атомы способны образовывать ковалентные связи различным образом. Количественно эта способность атомов оценивается с помощью характеристики, называемой валентностью.
Валентность — мера способности атомов данного элемента соединяться с другими атомами.
Такое толкование валентности является общим, или стехиометрическим. Оно обосновывает количественные соотношения атомов элементов в любых химических соединениях.
С развитием электронных представлений о строении веществ понятие валентности приобрело определенное физическое обоснование. В современной химии валентность химического элемента определяется числом ковалентных связей, которыми данный атом связан с другими атомами.
Ковалентные связи могут быть образованы как с помощью одноэлектронной орбитали атома, так и с помощью неподеленной пары электронов (если атом — донор) или свободной орбитали (если атом — акцептор). Следовательно, можно сказать, что валентность химического элемента также равна числу электронных орбиталей, которые данный атом использует для образования ковалентных связей.
Таким образом, валентность химического элемента определяется как числом ковалентных связей, которыми его атом связан с другими атомами, так и числом орбиталей, используемых этим атомом для образования связей.
Зная электронное строение атома того или иного элемента, можно определить его валентные возможности. Так, атом водорода всегда проявляет валентность, равную единице, поскольку у него всего одна орбиталь.
Анализируя строение простых и сложных веществ, образованных атомами элементов второго периода, нетрудно убедиться, что большинство этих элементов могут проявлять переменную валентность. Например, в молекулах простых веществ N2, 02, F2 атом азота имеет валентность, равную трем, кислорода — двум, а фтора — единице согласно графическим формулам этих молекул:
Простые вещества бора и углерода являются немолекулярными соединениями, однако атомы этих элементов связаны в кристаллах ковалентными связями: бор — тремя, а углерод — четырьмя. Поэтому их валентности равны соответственно III и IV.
В то же время в соединениях с атомами других элементов кислород, азот и фтор способны проявлять и другие валентности. Например, в молекулярном ионе 
В любом случае у элементов второго периода максимальная валентность не может быть больше четырех, так как на внешнем электронном слое у атомов этих элементов всего четыре орбитали, и, следовательно, атомы максимально могут образовать только четыре ковалентные связи.
У атомов элементов третьего периода в связи с появлением d-подуровня валентные возможности увеличиваются, так как в результате распаривания Зр- и 3s-электронов может образоваться от четырех до семи (у хлора) неспаренных электронов. Например, сера, помимо валентности II в основном состоянии:
может проявлять также валентности IV и VI:
Такое распаривание электронов проявляется обычно поддействием атома более электроотрицательного элемента, например фтора, кислорода, поэтому свои высшие валентности атомы проявляют обычно в соединениях с кислородом и фтором.
Таким образом, валентность является численной характеристикой способности атомов данного элемента образовывать ковалентные связи и поэтому может относиться только к соединениям с таким типом связи.
Степень окисления
Более универсальной характеристикой состояния атома в химическом соединении является степень окисления.
Степень окисления — это условный заряд атома в химическом соединении, если предположить, что оно состоит из ионов.
При определении степени окисления атомов предполагают, что все связывающие электронные пары перешли к более электроотрицательному атому. На самом деле такого полного смещения не происходит даже при взаимодействии элементов с большой разницей в электроотрицателыюстях.
Однако условно считают такое смещение электронных нар полным независимо от реальной степени смещения.
Численное значение этой характеристики выражается в единицах заряда электрона и может иметь положительное, отрицательное и нулевое значения.
Количественно степень окисления определяется числом валентных электронов, смещенных от атома данного элемента в химическом соединении (положительная степень окисления) или к нему (отрицательная степень окисления).
В основу расчета степени окисления атомов в соединениях положен принцип, согласно которому алгебраическая сумма степеней окисления атомов в соединении равна нулю, а в сложном ионе (типа 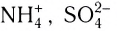
При расчетах надо знать несколько основных положений.
1. Металлы во всех сложных соединениях имеют только положительные степени окисления.
2. Неметаллы могут проявлять как положительные, так и отрицательные степени окисления.
3. Элементы, проявляющие постоянную степень окисления:
Кислород практически во всех своих соединениях проявляет степень окисления —2, исключая его фторид OF2 и пероксид Н202.
4. Высшая положительная степень окисления, как правило, равна номеру группы периодической системы.
5. Низшая отрицательная степень окисления обычно равна разности:
Для большинства элементов характерно проявление переменных степеней окисления в зависимости от атомов, с которыми они связаны, и типа соединения, в котором они находятся. Например, атом азота может проявлять самые разнообразные степени окисления от —3 в молекуле аммиака NH3 до +5 в молекуле азотной кислоты HN03.
Степень окисления не следует отождествлять с валентностью элемента, хотя их численные значения часто совпадают:
В пероксиде Н — О — О — Н валентность кислорода равна двум, а степень окисления —1, в ионе Н30 + его валентность III, а степень окисления —2.
Очень часто степень окисления элемента определяется как алгебраическая сумма степеней окисления по всем связям с другими элементами. Например, в молекуле гидроксиламина NH2OH общая степень окисления азота равна —1. так как по двум связям с водородом азот проявляет суммарную степень окисления —2, а по связи с атомом кислорода +1:
Степень окисления характеризует состояние атомов элемента в сложном веществе независимо от типов связей его атомов. Особенно важна эта характеристика при составлении уравнений окислительно-восстановительных реакций.
Ионная связь и металлическая связь
Ковалентная химическая связь обычно возникает между атомами неметаллов с одинаковой или не очень сильно различающейся электроотрицательностью. Если различие в электроотрицательности атомов, между которыми образуется химическая связь, велико ( 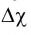
Ионная связь
Ионная связь, как правило, возникает между атомами типичных металлов и типичных неметаллов. Характерным свойством атомов металлов является то, что они легко отдают свои валентные электроны, тогда как атомы неметаллов способны легко их присоединять.
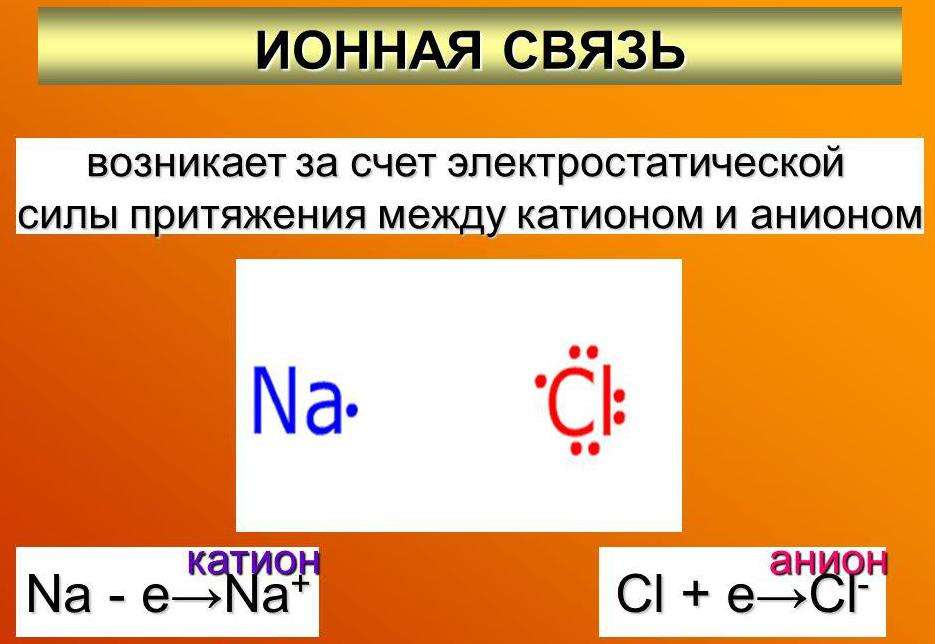
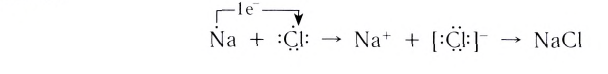
Рассмотрим возникновение ионной химической связи, например, между атомами натрия и атомами хлора в хлориде натрия NaCl.
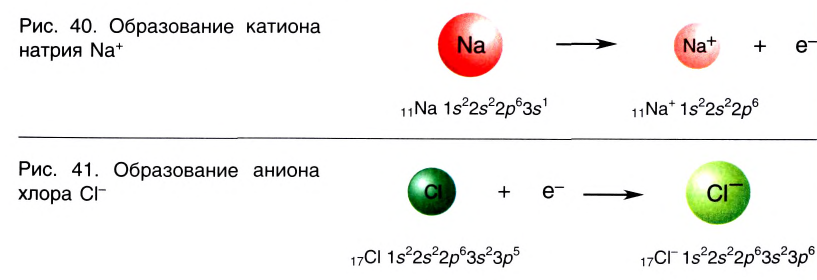
Отрыв электрона от атома натрия приводит к образованию положительно заряженного иона — катиона натрия Na + (рис. 40).
Присоединение электрона к атому хлора приводит к образованию отрицательно заряженного иона — аниона хлора CI — (рис. 41).
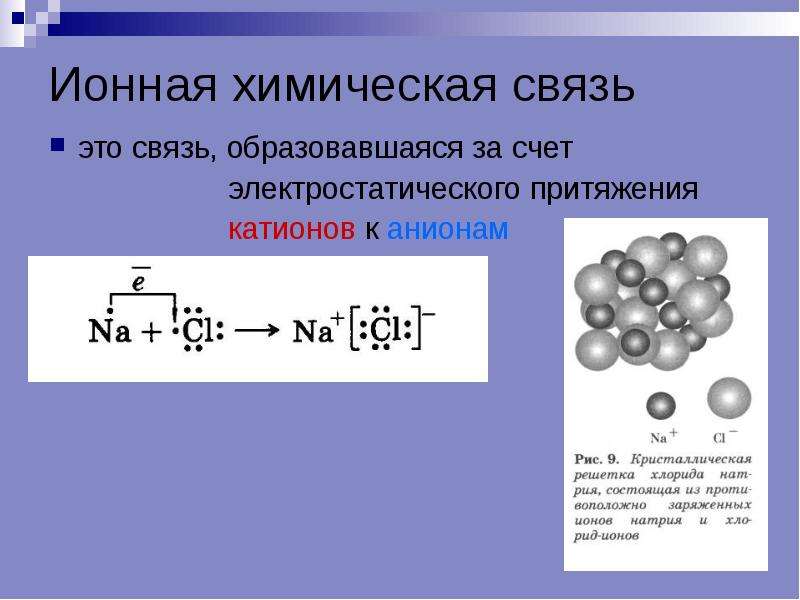
Химическая связь, которая осуществляется за счет электростатического взаимодействия противоположно заряженных ионов, называется ионной связью.
Таким образом, процесс образования ионной связи сводится к переходу электронов от атомов натрия к атомам хлора с образованием противоположно заряженных ионов, имеющих завершенные электронные конфигурации внешних слоев:
Соединения, в которых вклад ионной связи значителен, принято называть ионными. Большинство бинарных соединений, содержащих атомы металлов, являются ионными, т. е. в них химическая связь в значительной степени ионная. К числу таких соединений относятся галогениды, оксиды, сульфиды, нитриды и др.
Ионная связь возникает не только между простыми катионами и простыми анионами типа 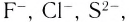
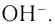
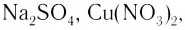
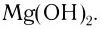
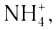
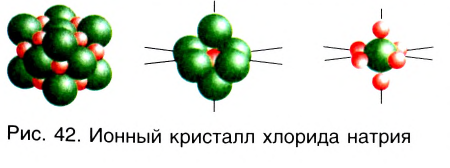
Ионные кристаллы
Наименьшей структурной единицей кристалла (т. е. наименьшей частью), отражающей все особенности структуры его кристаллической решетки, является элементарная ячейка. Строение элементарной ячейки зависит от соотношения размеров катиона и аниона. На рисунке 43 приведено строение элементарных ячеек хлорида натрия NaCl и хлорида цезия CsCl. Существуют и другие типы элементарных ячеек.
Если частицы в веществе связаны ионной связью, то оно относится к веществам с немолекулярным строением. В твердом агрегатном состоянии такие вещества представляют собой ионные кристаллы. Так как ионная связь является прочной, то ионные кристаллы имеют обычно высокие температуры плавления и кипения, не имеют запаха. Сильное притяжение ионов друг к другу обусловливает хрупкость таких веществ при разрушении, а отсутствие свободных заряженных частиц объясняет тот факт, что при комнатной температуре они плохо проводят электрический ток.
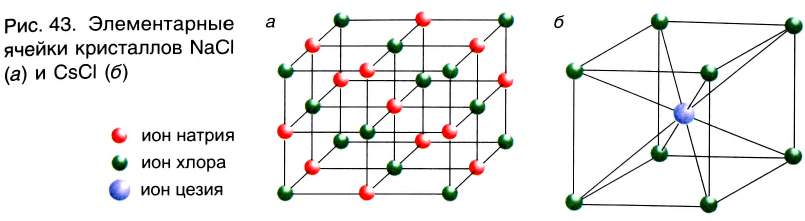
Металлическая связь. Металлические кристаллы
Атомы большинства металлов достаточно легко отдают свои валентные электроны, в результате чего превращаются в положительно заряженные ионы. Это происходит не только при взаимодействии металлов с другими атомами, но и при образовании металлических кристаллов из одних и тех же атомов.
В кристалле металла непрерывно протекают два противоположных процесса — образование ионов металла из нейтральных атомов в результате отрыва от них валентных электронов:
и присоединение валентных электронов к ионам металла с образованием нейтральных атомов:
В узлах кристаллической решетки металлов попеременно находятся как нейтральные атомы, так и положительно заряженные катионы металла (рис. 44). Образующиеся при этом электроны свободно перемещаются внутри кристалла и компенсируют взаимное отталкивание между положительно заряженными катионами металла, а также удерживают атомы в составе кристалла. Они становятся общими для всех атомов и ионов металла, связывая их между собой.
► Химическая связь между атомами в металлическом кристалле посредством обобществления валентных электронов называется металлической связью.
Металлическая связь не имеет направленности в пространстве. Эта химическая связь является коллективной, как и ионная, в ней принимают участие все атомы кристалла металла.
Металлическая связь сходна с ковалентной связью тем, что при ее образовании так же, как и при образовании ковалентной связи, электроны обобществляются. Однако в случае металлической связи эти электроны связывают все атомы металлического кристалла, тогда как в ковалентном соединении связываются лишь находящиеся рядом атомы.
Взаимосвязь различных типов химической связи
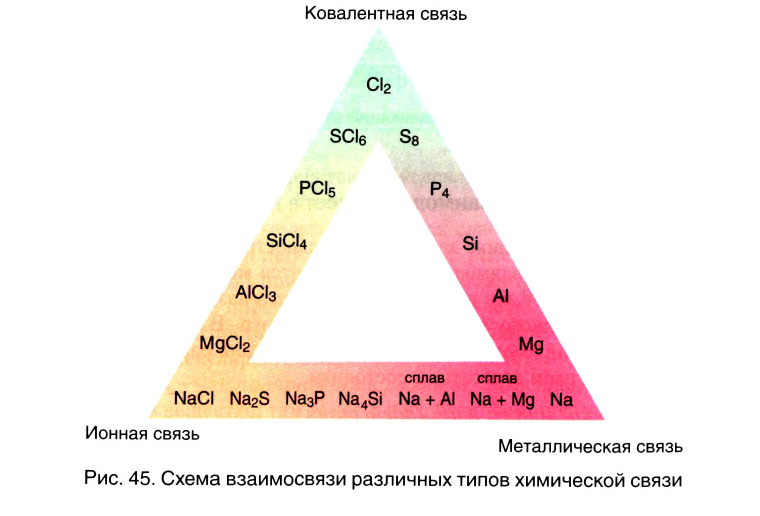
Вы познакомились с тремя типами химической связи и соответствующими веществами, которые мы характеризовали как вещества с ковалентным (02, N2, Cl2), ионным (LiF, NaCl) и металлическим типом связи (металлы). В реальности в большинстве неорганических веществ взаимодействие между различными атомами носит более сложный характер, являясь как бы комбинацией различных типов связи. Это особенно характерно проявляется в ряду простых и сложных бинарных веществ элементов III периода, который Д. И. Менделеев назвал «типическим».
В углах представленного треугольника химических связей (рис. 45) расположены вещества, являющиеся наиболее характерными представителями каждого типа связи: NaCl — соединений ионного типа, Cl2 — ковалентного, а Na — металлического. В ряду от NaCl до Cl2 находятся бинарные вещества общей формулы ЭСl, где Э — элемент третьего периода:
Как вам уже известно, в периодах от щелочного металла до галогена электроотрицательность последовательно растет и, соответственно, уменьшается величина 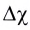
где 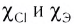
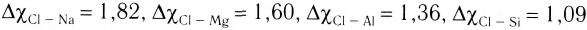
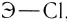
Подобные закономерности наблюдаются и в двух других рядах веществ. В ряду от Na до NaCl располагаются соединения условной формулы NaЭ, где Э — элемент третьего периода. Характер химической связи в этих веществах последовательно изменяется от металлического до ионного.
В ряду от Na до Cl2 располагаются простые вещества третьего периода. Свойства этих веществ последовательно изменяются от металлических к неметаллическим, что соответствует изменению характера химической связи от металлического к ковалентному.
Таким образом, мы можем заключить, что однозначное определение типа химической связи в большинстве неорганических соединений невозможно. В реальности химическая связь между разнородными атомами носит смешанный характер с той или иной долей ковалентной, ионной или металлической составляющей.
Межмолекулярное взаимодействие
Молекулы, несмотря на свою электронейтральность, способны взаимодействовать между собой. Такое взаимодействие называется межмолекулярным. Силы, за счет которых возникает это взаимодействие, часто называют ван-дер-ваальсовыми в честь голландского ученого И. Д. Ван-дер-Ваальса. Эти силы обусловливают притяжение молекул данного вещества (или разных веществ) друг к другу в жидком и твердом агрегатном состоянии.
Природа межмолекулярного взаимодействия
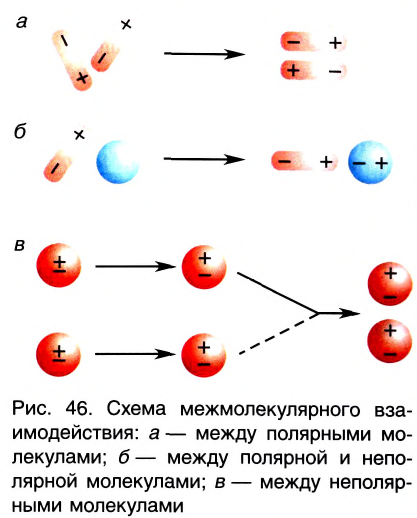
Межмолекулярное взаимодействие, как и химическая связь между атомами, имеет электростатическую природу. Несимметричность распределения электронов и ядер атомов в молекуле приводит к появлению у нее электрических полюсов — положительного с той стороны, где электронная плотность понижена, и отрицательного, где она повышена. Образовавшиеся полярные молекулы притягиваются друг к другу разноименными полюсами (рис. 46, а).
Взаимодействие может осуществляться также между полярной и неполярной молекулами. При этом в неполярной молекуле под действием электрического поля полярной молекулы возникает (индуцируется) диполь. Постоянный диполь и индуцированный диполь притягиваются друг к другу (рис. 46, б).
В неполярных молекулах вследствие непрерывного движения частиц с различными электрическими зарядами (ядер и электронов) также непрерывно возникают, перемещаются и исчезают электрические полюсы. Поэтому в разные моменты времени возникают мгновенные диполи, между которыми также действуют силы притяжения (рис. 46, в).
В этом и состоит объяснение существования притяжения между любыми молекулами, как полярными, так и неполярными.
Прочность межмолекулярного взаимодействия и агрегатное состояние вещества
Межмолекулярное взаимодействие обусловливает переход вещества из газообразного в жидкое, а затем и в твердое состояние. Но по сравнению с ковалентной связью межмолекулярные взаимодействия слабые, связи между молекулами относительно непрочные и легко разрываются. Именно поэтому молекулярные вещества плавятся и кипят при относительно низких температурах. Межмолекулярное взаимодействие определяет также механические свойства подобных веществ, их теплопроводность, электрическую проводимость и др.
Энергия межмолекулярного взаимодействия зависит в основном от двух характеристик молекулы — ее полярности и размера. Чем сильнее межмолекулярное взаимодействие в веществе, тем выше у него будут температуры плавления и кипения. Например, кислород из-за более прочного межмолекулярного взаимодействия кипит при более высокой температуре, чем азот, что и используется при получении этих газов из воздуха. Углеводороды с большой молекулярной массой кипят при более высокой температуре, чем низкомолекулярные углеводороды. Это свойство углеводородов лежит в основе процесса перегонки нефти.
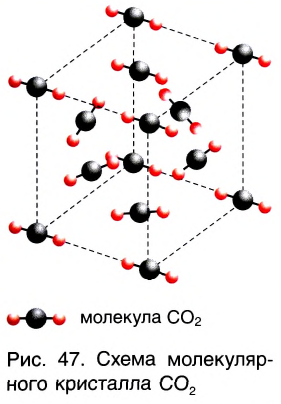
Молекулярные кристаллы
В узлах молекулярной кристаллической решетки расположены молекулы, связанные между собой слабыми межмолекулярными связями (рис. 47). Молекулярные кристаллические решетки образуют водород, азот, кислород, сера, йод, вода, углекислый газ, многие органические вещества. Кристаллы благородных газов также молекулярные, они построены из одноатомных молекул.
Для веществ, образующих молекулярные кристаллы, характерны низкие температуры плавления и кипения, значительная сжимаемость, небольшая твердость. Нагревание некоторых молекулярных кристаллов, например иода, углекислого газа, приводит к переходу вещества из твердого состояния сразу в газообразное, минуя жидкую фазу. Этот процесс называется возгонкой или сублимацией.
В то же время многие органические вещества с большими молекулами, содержащими десятки тысяч и более атомов, вообще не плавятся, так как прочность связей между молекулами в сумме оказывается выше прочности связей внутри молекулы. Попробуйте расплавить, например, крахмал, целлюлозу, вату. Вы убедитесь в том, что вещество начнет разрушаться раньше, чем плавиться.
Однако надо иметь в виду, что реакционная способность молекулярных веществ зависит от прочности не межмолекулярных, а внутримолекулярных связей. Ведь при химическом взаимодействии разрываются именно внутримолекулярные связи. Например, парафин — механически непрочное вещество, связи между молекулами в нем слабые. Но это вещество химически достаточно устойчиво.
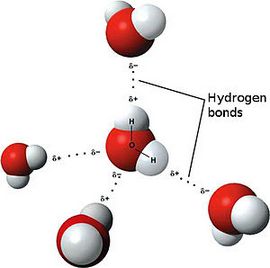
Водородная связь
Одной из разновидностей межмолекулярного взаимодействия является водородная связь. Она осуществляется между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом другой молекулы:
где X — атом одного из наиболее электроотрицательных элементов — F, О, N, реже CI и S.
Возникновение водородной связи (на схеме она показывается тремя точками) обусловлено прежде всего тем, что у атома водорода имеется только один электрон, который при образовании полярной ковалентной связи с атомом сильно электроотрицательного элемента смещается в сторону атома этого элемента. На атоме водорода возникает высокий эффективный положительный заряд, что в сочетании с отсутствием внутренних электронных слоев позволяет другому атому сближаться до расстояний, близких к длинам атомных связей.
В первом приближении образование водородной связи можно объяснить электростатическим взаимодействием между молекулами. Определенный вклад в образование водородной связи вносит донорно-акцепторное взаимодействие «свободной» 1s-орбитали атома водорода и орбитали с неподеленной парой электронов электроотрицательного атома. Поэтому водородная связь обладает свойством направленности, во многом определяя структуру вещества в конденсированном состоянии.
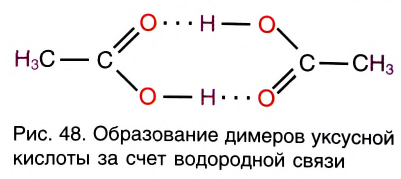
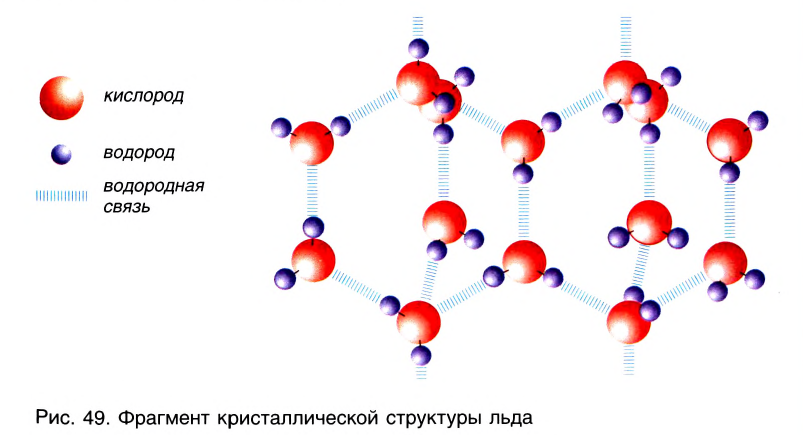
Благодаря водородным связям молекулы объединяются в ассоциаты, например молекулы уксусной кислоты образуют димеры (рис. 48). Водородные связи определяют кристаллическую структуру льда, где каждый атом кислорода в молекулах Н20 связан с четырьмя атомами водорода — двумя ковалентными и двумя водородными связями (рис. 49).
Водородная связь в несколько раз сильнее, чем обычное межмолекулярное взаимодействие, но слабее ковалентной связи. С повышением температуры прочность водородной связи уменьшается. Поэтому водородная связь более характерна для веществ в твердом и жидком состояниях.
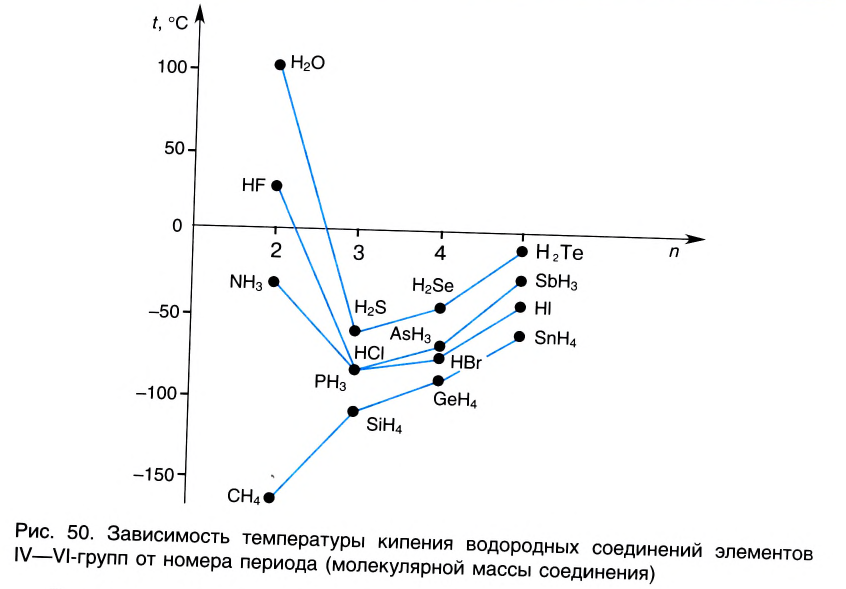
Наличие водородной связи существенно влияет на физические свойства веществ. Так, аномально высокие температуры кипения H2O, HF, HN3 по сравнению с аналогичными веществами, образованными элементами этих же групп других периодов (рис.50), объясняются образованием ассоциатов за счет водородных связей.
Во дородная связь О. Н наиболее распространена в природе. Именно ее наличием обусловлены аномальные свойства воды, в том числе высокие температуры кипения и плавления, необычайно высокие теплоемкость и диэлектрическая проницаемость. Благодаря своей ажурной структуре (см.рис.49) лед имеет меньшую плотность, чем жидкая вода. Поэтому зимой лед находится на поверхности воды, и глубокие водоемы не промерзают до дна.
Светло-голубой цвет чистой воды и толстого слоя льда обусловлен водородными связями. Когда одна молекула воды колеблется, то она заставляет колебаться и другие, связанные с ней молекулы. В результате этого молекулы H2O частично поглощают красный цвет, а вода приобретает голубоватый оттенок.
Водородная связь может возникать и между атомами одной молекулы. Чаще всего внутримолекулярная водородная связь возникает в молекулах органических веществ, содержащих в своем составе такие группы атомов как — 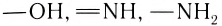
Особенно велика роль водородных связей в биохимических процессах с участием высокомолекулярных соединений (белки, ДНК и др.), пространственная структура которых определяется наличием водородных связей.
Межмолекулярное взаимодействие возникает между любыми молекулами, как полярными, так и неполярными, и имеет электростатическую природу.
Межмолекулярное взаимодействие обусловливает переход вещества из газообразного в жидкое, а затем и в твердое состояние.
Водородная связь осуществляется между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом фтора, кислорода, азота (реже хлора и серы), принадлежащим другой молекуле.
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.