Как запомнить что с чем реагирует в химии
Как запомнить что с чем реагирует в химии
Химия-это достаточно сложный предмет, запоминание которого не всем дается достаточно просто. Как же помочь студентам в такой ситуации? Все мы знаем, что стихи и рифмованные песни быстро запоминаются, так и с химией. Некоторые правила можно превратить в стихи и быстро все выучить.
Вот несколько примеров, которые помогут вам подготовиться к занятию и ответить на вопросы преподавателя.
Химик правила обмена
Не забудет никогда:
В результате — непременно
Будет газ или вода,
Выпадет осадок —
Вот тогда — порядок!
Про органическую химию
Запомним, друг, и я, и ты,
Чем отличаются спирты —
В них углерод и гидроксид,
И каждый спирт легко горит.
R — это значит радикал,
Он может быть велик и мал,
Предельный или непредельный.
Но это разговор отдельный.
Среди карбоновых кислот
Известных «лиц» невпроворот.
В кислотах — группы карбоксильные,
Но все кислоты здесь — несильные.
В кетонах группа есть CO,
Но это тоже ничего…
Горит прекрасно ацетон,
И растворитель — тоже он.
Если ты, придя с мороза,
Наливаешь крепкий чай,
Хорошенько сахарозу
в чашке ложкой размешай.
Виноградную глюкозу
И медовую фруктозу
и молочную лактозу
любит взрослый и малыш.
Но крахмалом и клетчаткой,
Что совсем-совсем несладки
Тоже нас не удивишь.
Так устроена природа —
Это тоже углеводы.
Мы говорим спокойно: жир. А, между прочим, он — эфир, он из кислот и глицерина. Такая вот у нас картина…
Автор – преподаватель кафедры «Товароведение и технология общественного питания» Айгуль Латипова
Как быстро выучить химию с нуля, подтянуть знания и оценки
В статье мы подготовили советы, которые помогут быстро выучить химию на «отлично». Разберемся, сколько времени нужно, чтобы освоить предмет с нуля, хватит ли для этого нескольких дней и как легко выучить все формулы.
С чего начать учить химию
Химия – одна из наиболее сложных школьных дисциплин. Физические и химические свойства элементов, особенности протекания реакций между различными веществами, валентность, электролитическая диссоциация и многое другое – все это школьники должны знать и понимать.
3 рекомендации, с чего лучше начать учить химию:
Получится ли освоить предмет самостоятельно
Химию можно выучить и самому, но следует иметь в виду, что процесс не будет быстрым или легким. С какими трудностями сталкиваются школьники, которые занимаются самостоятельно:
Как учиться в домашних условиях
Если хотите подтянуть химию в домашних условиях, то проще и правильнее будет заниматься вместе с преподавателем онлайн.
Уроки с репетитором.
Он оценивает уровень знаний ребенка и составляет индивидуальный план. Занятия проводятся через Скайп: школьник и учитель общаются в режиме реального времени, работают на интерактивной доске. Педагог сразу же отвечает на все вопросы, при необходимости еще раз объясняет сложную тему, указывает на ошибки.
Стоимость онлайн-уроков ниже, чем встречи с преподавателем офлайн, но не уступают им по качеству.
На нашем сайте есть разные сервисы для обучения с репетиторами. В детском разделе можно выбрать программу по цене, срокам подготовки и другим параметрам.
Онлайн-курсы.
Самый эффективный способ выучить химию, подойдет для тех, кто хочет заниматься по индивидуальному графику. Уроки проводят в режиме реального времени и записывают. Если вы не сможете подключиться к онлайн-занятию, то посмотрите видеоурок в личном кабинете в любое время.
Все видеозаписи, конспекты лекций, презентации и другие учебные материалы будут доступны ученику и после курса. Вопросы можно задавать на онлайн-уроке или писать в чат куратору.
Подобрать курс по химии также можно на нашем сайте в детском разделе.
Для вашего удобства, приведем ссылки для разных классов:
Преимущества учебы в онлайн-школах:
Хватит ли года, чтобы понять все темы с 7 по 11 класс
Год – это достаточный срок, чтобы разобраться по всех разделах химии. 5 рекомендаций школьникам, как изучать химию:
Выучить школьный предмет за год легче всего на онлайн-курсах – многие из них длятся с сентября до мая-июня. На занятиях помогут понять химию, подготовят к ОГЭ 9 класса или к ЕГЭ. Например, в онлайн-школе «Фоксфорд» есть углубленные программы, подготовительные и просто развивающие кругозор, например, «Эксперименты и химия вокруг нас».
Как быстро и легко выучить химию с нуля
Как можно ускорить и облегчить процесс, если вы изучаете химию с нуля:
Далее расскажем подробнее, как выучить или повторить химию за месяц, неделю или день.
На нашем сервисе собран список школ с курсами подготовки к ОГЭ и ЕГЭ по химии.
За 1-2 месяца
Если вам нужно вспомнить пройденный материал, чтобы написать годовую контрольную на отлично, то подготовку можно начать за месяц. Но если предстоит сдавать ОГЭ или ЕГЭ, то 2-3 месяцев не хватит, чтобы полноценно выучить всю программу по химии с нуля.
Что делать, если до сдачи экзамена остается не больше 8-10 недель:
Еще один эффективный способ, как можно выучить химию за короткий срок, – это экспресс-курсы. В онлайн-школах есть специальные программы, состоящие из видеоуроков в записи, вы сможете смотреть их 2 и даже 3 раза в неделю. Доступ к новому занятию открывается после сдачи домашней работы по предыдущей теме. Например, видеокурс «Неорганическая химия: практикум для 8-11 классов» от школы «Фоксфорд» включает 8 занятий – его можно пройти за пару недель.
За неделю
Что можно сделать за неделю:
Реально ли подтянуть знания в более короткие сроки
За 1, 2 или 3 дня можно подтянуть знания по химии, если сдаете итоговую работу в четверти. Но если вам предстоит написать годовую контрольную, ОГЭ или ЕГЭ, то подготовку надо начинать заранее – хотя бы за несколько недель/месяцев.
Накануне экзамена можно позаниматься 2-3 часа, почитать лекции, посмотреть решение задач. Но не стоит сидеть над учебниками весь день и тем более ночь – вы только сильнее запутаетесь.
А также не нужно открывать конспекты или зубрить формулы за 5-15 минут до экзамена. Лучше подготовьтесь морально. Чем больше волнения – тем выше риск ошибок из-за невнимательности.
Как запомнить термины к экзамену ЕГЭ по химии. Советы!
Проверенные советы, которые действительно помогут вам лучше запомнить термины по химии и сдать экзамен ЕГЭ.
Как запомнить термины по химии
Изучая такую науку, как химия, нужно потратить достаточно времени перед экзаменом ЕГЭ, чтобы убедиться, что вы можете правильно пользоваться терминологией, которую учили в течении всего курса. Главная проблема в том, что большинство терминов достаточно трудно запомнить.
Однако, применив немного изобретательности, можно быстрее понять язык химии, биологии или физики. Всегда можно найти связь, если её искать.
Создать запоминающиеся образы для любых технических терминов очень легко. Потратьте немного времени во всем повторении материала, чтобы создать собственный список запоминающихся образов для главных терминов, которые необходимы на экзамене.
Несколько примеров:
Элементы
Элементы содержат только один вид атомов. Их нельзя расщепить на более простые вещества.
Сложные соединения
Это сложные вещества, состоящие из атомов двух или более различных химических элементов, объединенных хим. связью. Могут расщепляться на более простые. Подумайте о загоне для животных, в котором живут несколько видов.
Кислоты
Кислоты – это вещества, которые:
1) Превращают синюю лакмусовую бумажку в красную. Представьте себе милиционера в синей форме, краснеющего от злости.
2) Кислые на вкус: представьте себе вкус уксуса.
3) При взаимодействии с металлами образуют соли: представьте себе членов тяжелой металл-группы, играющих на «кислой» домашней вечеринке и превращающиеся в столбы из соли.
4) Нейтрализуют основания (базы): бас-гитара нейтрализована.
Сплавы
Сплавами называют любые однородные системы, образованные сплавлением металлов, неметаллов, оксидов, органические в-тв и т.д., и закрепления полученной смеси. Латунь, например, это сплав из меди и цинка. Подумайте о том, как несколько человек сплавляются на плотах.
Растворение
Это происходит, когда вещество впитывает влагу или воду и растворяется, образуя раствор. Чтобы запомнить это, представьте, как ваш любимый шербет, который слишком долго простоял в шкафу на кухне, превратился в жидкую массу.
Эфлоресценция
Это происходит, когда кристаллическое вещество превращается в порошок под воздействием воздуха или когда соль выходит на поверхность вещества и кристаллизируется. Представьте себе флуоресцентный поток, в котором содержаться растворенные кристаллы, высыхающие на воздухе и превращающиеся в порошок.
Алкоголь
Алкоголь состоит из углерода, водорода и кислорода. Это можно запомнить, если подумать об алкоголе следующее: «Купил, выпил, упал», или алкоголь, содержащийся в напитках, произведён путём брожения сахара и дрожжей.
Ионы
Ионы – это частицы, которые переносят электрический заряд. Они могут (+) заряженные и (-) заряженные. Подумайте о положительных и отрицательных шпионах.
Анионы
Это (-) заряженные ионы. Подумайте о девушке Ане, сражающейся с вражеским шпионом.
Катионы
Это (+) заряженные ионы. Подумайте о катящейся шаровой молнии.
Экзотермические реакции
Это хим. реакции, при которых будет выделение теплоты. Подумайте о жарких экзотических странах.
Эндотермические реакции
Это хим. реакции, происходящие с поглощением теплоты из окружающей среды. Подумайте о том, как теплота внедряется.
Аллотропия
Аллотропия — это существование химических элементов в виде двух или более простых веществ или форм. Например, у углерода есть несколько абсолютно разных аллотропных форм, включая графит и алмаз. Подумайте о том, как в лесу по тропинкам бродят разные животные. Это хороший пример того, как можно создать индивидуальные ассоциации, столкнувшись с термином или фразой, которые не имеют ничего общего со своим значением или определением.
Аммиак
Видите как легко создать нелепые образы, которые останутся в памяти до экзамена. Вам не придется прерываться во время ответа, лихорадочно вспоминая определение: информацию легко будете пересказывать и быстро отвечать на вопросы.
Классификация неорганических веществ
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Кислоты
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Блиц-опрос по теме Классификация неорганических веществ
7 важных советов, как готовиться к ЕГЭ по химии. Все нужные таблицы, формулы и пособия
До ЕГЭ по химии осталось совсем немного — меньше полугода (вот тут календарь ЕГЭ-2018). Но наверстать упущенное и разобраться наконец в таблице растворимости и формулах — не поздно. И не только в них, если составить чёткий план и выбрать правильные материалы. О подготовке к ЕГЭ по химии — преподаватель химии и автор телеграм-канала «ФарСмацевтика» Анна Тихонова.
В этом году форма экзамена почти не изменилась: вместо 34 заданий их будет 35. Но из-за этого немного изменится система пересчёта первичных баллов в тестовые. Экзамен состоит из двух частей: первая предполагает выбор цифр или последовательности цифр (29 заданий), вторая — ответы с развёрнутым ответом (6 заданий). Максимальное количество первичных баллов, которое можно набрать за первую часть, — 40, за вторую — 20. Обычно мои ученики начинают паниковать уже на этой стадии — когда узнают о заданиях. Но на самом деле всё не так страшно, как кажется.
1. Найдите человека, которому вы сможете задавать вопросы
Необязательно нанимать репетитора. Этим человеком может быть учитель в школе или знакомый студент, который учится на химфаке. Главное — не стесняться задавать даже самые глупые, на ваш взгляд, вопросы и стараться закрывать пробелы, которые возникают во время подготовки. Поверьте, то, что у вас появляются хоть какие-то мысли насчёт химии, уже говорит о том, что процесс запущен. Смело поднимайте руку прямо во время урока, расспрашивайте репетитора, участвуйте в обсуждениях в тематических сообществах и не бойтесь выглядеть глупо в глазах других.
2. На экзамене у вас будет три официальные шпаргалки. И в них нужно разбираться
Это таблица Менделеева, таблица растворимости и ряд напряжения металлов. В них содержится около 70% информации, которая поможет вам успешно сдать экзамен. На остальные 30% от вашего успеха приходится ваше умение пользоваться ими.
Чтобы разобраться с таблицей Менделеева, нужно сначала изучить периодические свойства элементов: строение атомов элементов, электроотрицательность, металлические, неметаллические, окислительные и восстановительные свойства, валентности, степени окисления. Если запомните их — не придётся запоминать свойства каждого отдельного элемента или каждого отдельного вещества в природе. Достаточно взглянуть в таблицу и вспомнить о периодическом законе.
Подсказка для тех, кто вечно всё забывает: F (Фтор) самый сильный неметалл и самый электроотрицательный элемент, а Fr (Франций) — наоборот (самый сильный металл и наименее электроотрицательный элемент). Это поможет с чего-то начать.
3. Повторяйте математику. Химию без неё не сдать
Конечно, никто не просит вас интегрировать или дифференцировать и вообще на экзамене можно пользоваться непрограммируемым калькулятором. Но повторить темы процентов и пропорций — обязательно. Формул, которые необходимы для решения задач, не так уж и много. Запомнить нужно только основные: формула для расчёта массовой доли, массы вещества, объёма, количества вещества, плотности и выхода продукта. Зная их, вы сможете без проблем выводить другие.
Попробуйте вывести из формулы массовой доли массу раствора или, зная массу и молярную массу вещества, определить его количество. Через несколько недель тренировок вы заметите, что все эти формулы связаны между собой и, если вы что-то забыли, всегда можно вывести нужную вам формулу из другой.
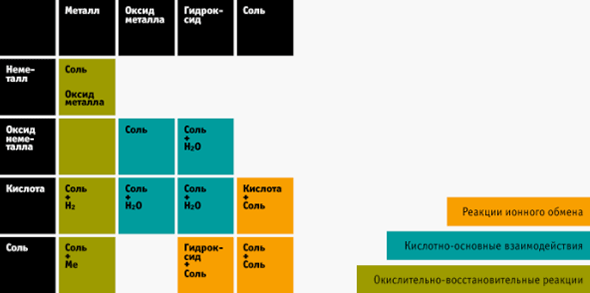
4. Таблица химических реакций — ваш помощник
Веществ в химии действительно очень много, их можно систематизировать и выявить закономерности. Вам поможет таблица взаимодействия веществ между собой. Распечатайте её и держите перед глазами, когда только начнёте решать цепочки или реакции.
Как ей пользоваться?
На экзамене такой шпаргалкой пользоваться нельзя. Но во время подготовки вы легко запомните, что получается, если, например, реагируют кислота и щелочь, и другие вещества. А это около 80% заданий на ЕГЭ.
5. Берите книжки ФИПИ и идите от простого к сложному
На самом деле не важно, какой учебник вы выберете для подготовки к ЕГЭ. Берите тот, где вам будет понятен материал и в котором есть все темы, которые встретятся на экзамене. Что касается тестов, здесь тоже не нужно изобретать велосипед: я рекомендую пользоваться книжками ФИПИ. Тот материал, который они дают, максимально приближен к тому, что будет на экзамене. И можно решать тексты по изученным темам прямо на их сайте.
Начать стоит с блоков, которые встречаются чаще всего:
Остальные блоки сложнее. После того, как прорешаете задания по основным блокам, вы поймёте, в каких темах у вас пробелы, а какие вы знаете хорошо. Закрепите темы, которые вы знаете лучше остальных, и вернитесь к изучению теоретической базы тех тем, которые даются хуже. Учите тему и выполняйте по 20 упражнений в день. Если времени для подготовки мало, сосредоточьтесь на заданиях, темы которых вам ясны. Лучше целиком решить задание с ОВР (окислительно-восстановительными реакциями), чем не сделать ничего.
6. Теория хорошо, но без тестов всё равно никуда
Если кажется, что вы всё знаете из теории и вам не нужно тратить время на решение тестов — это не так. Большинство ошибок на экзамене случается из-за того, что ученик неправильно прочитал задание или не понял, что от него хотят. Чем чаще вы будете решать тесты, тем быстрее поймёте структуру экзамена и сложные и загадочные формулировки задания.
Например, в задании № 30 сказано: «Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. В ответе запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций». Очень часто ученики пропускают стадию написания полного ионного уравнения и пишут сразу сокращённое, потому что так быстрее. Это не ошибка, но за это могу снять один первичный балл.
7. А вот читать лишние статьи и литературу точно не нужно
Иногда во время подготовки к экзамену ученик настолько увлекается, что начинает читать узкоспециализированную литературу. И при ответе на простой вопрос путает самого себя: вроде бы гидроксид цинка проявляет амфотерные свойства и реагирует и с кислотами, и с основаниями, а вот в такой-то статье говорилось, что новые исследования говорят абсолютно о другом. И это ставит под сомнения все фундаментальные знания о химии! Я, конечно, утрирую, но смысл в том, что цель экзамена — проверить ваши знания школьной программы. И стратегия «чем проще, тем вернее» работает в тестах как нельзя лучше.