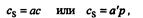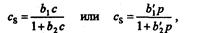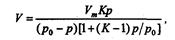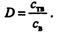Коэффициент сорбции в чем измеряется
Механизм сорбции



Сорбция
Сорбцию широко используют для разделения и концентрирования веществ. Сорбционные методы обычно обеспечивают хорошую селективность разделения, высокие значения коэффициентов концентрирования.
Наиболее высокие значения коэффициентов концентрирования достигаются при определении микрокомпонентов непосредственно в фазе сорбента с использованием атомно-эмиссионного, атомно-абсорбционного, атомно-флуоресцентаого и рентгенофлуоресцентного методов.
Сорбция — процесс поглощения газов, паров и растворенных веществ,твердыми или жидкими поглотителями на твердом носителе (сорбентами). Классификация сорбционных методов основана на различии механизма взаимодействия веществ с сорбентами. Различают адсорбцию (физическая адсорбция и хемосорбция), распределение веществ между двумя несмешивающимися фазами (растворитель и жидкая фаза на сорбенте) и капиллярную конденсацию — образование жидкой фазы в порах и капиллярах твердого сорбента при поглощении паров вещества. В чистом виде каждый из перечисленных механизмов, как правило, не реализуется, и обычно наблюдаются смешанные механизмы.
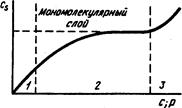
Изотерма сорбции. Область применимости:
/ — уравнения Генри; 2 — уравнения Фрейндлиха и Лэнгмюра; 3 — уравнения Брунауэра—Эмметта—Геллера
Сорбционный процесс в статических условиях описывается уравнениями, связывающими количество сорбированного вещества с, и концентрацию вещества с в жидкой (газообразной) фазе или давление р i газообразной фазе и учитывающими химическую и геометрическую неоднородность сорбента и свойства сорбируемого вещества. Графическая зависимость с; = /(с) называется изотермой сорбции.
В области малых концентраций и при однородной поверхности сорбента справедливо уравнен» Генри:
где а и а’ — характерные для веществ постоянные; р — парциальное давление. В этой области концентрации сохраняется постоянство коэффициента распределения. После выхода из области Генри эмпирический коэффициент распределения становится зависимым от равновесной концентрации сорбируемого вещества, и тогда изотерма сорбции может быть описана уравнением Лэнгмюра:
Для описания адсорбционных процессов на неоднородных поверхностях при образовании мономолекулярного слоя применяют уравнение Фрейндлиха:
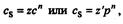
Для полимолекулярных слоев действительно уравнение Брунауэра—Эмметта— Теллера:
где V — объем газа, сорбированного при давлении р; Vm — объем газа, соответствующий мономолекулярному слою; К — постоянная, характерная для данного вещества; р0 — давление пара сорбируемого вещества.
При физической адсорбции взаимодействие молекул сорбирующихся веществ с поверхностью сорбента определяется главным образом дисперсионными силами, вызываемыми согласованным движением электронов в сближающихся молекулах. Такой механизм характерен для сорбции на активных углях. Для некоторых сорбентов, например, кремнеземов, оксида алюминия, цеолитов, имеют значение электростатические силы: ориентационные силы, проявляющиеся при адсорбции полярных молекул на поверхности, несущей постоянный электростатический заряд, и индукционные силы, обусловленные появлением в сорбирующихся молекулах дипольных моментов, наведенных зарядами поверхности или появлением дипольных моментов в сорбенте, наведенных диполями сорбирующихся молекул. Физическая адсорбция легко обратима.
При сорбции воды, спиртов, кетонов, аминов и других соединений на сорбентах, поверхность которых покрыта гидрокси- и оксигруппами (например, кремнезем, оксид алюминия), в дополнение ‘к неспецифическим (дисперсионным и электростатическим) взаимодействиям происходит образование комплексов с межмолекулярной водородной связью. В этом случае может осуществляться смешанный механизм.
Наконец, сорбция может сопровождаться возникновением между сорбирующимся соединением и поверхностью прочной химической связи и, следовательно, образованием нового химического соединения на поверхности (хемосорбция). Такой механизм осуществляется на природных и синтетических сорбентах с ионогенными и хелатообразующими группами. В отличие от физической адсорбции хемосорбция обратима не полностью. Использование синтетических сорбентов с ионогенными и хелатообразующими группами наиболее эффективно, и их широко применяют для селективного разделения макро- и микрокомпонентов и для группового и селективного концентрирования микрокомпонентов.
При сорбции органических соединений более применимы сорбенты с химически привитой «жидкой» фазой (сорбенты с привитыми, длинными алкильными. или алкилсилильными группами). Разделение в этом случае похоже на равновесие, которое устанавливается при распределении растворенных веществ между двумя жидкими фазами (раствор — поверхностный монослой сорбента).
Основные количественные характеристики сорбции, как и экстракции, — коэффициент распределения и степень извлечения. Так, коэффициент распределения представляет собой отношение концентрации вещества ств в фазе сорбента к концентрации св, его в водной фазе:
Если известны коэффициенты распределения, то можно решить вопрос о разделении веществ на данном сорбенте.
Процесс сорбции осуществляют двумя методами: статическим и динамическим. Последний положен в основу хроматографических методов разделения. В анализе используют разнообразные сорбенты: активные угли, ионообменные и хелатообразую-щие синтетические смолы, обычные и химически модифицированные кремнеземы и целлюлозу, сорбенты на неорганической основе.
Характеристика сорбционных процессов
Адсорбция растворенных веществ с использованием зернистых материалов является результатом перехода частиц растворенного вещества из раствора на поверхность твердого сорбента.
Баланс энергетических взаимодействий, приводящих к избирательной сорбции извлекаемого вещества из водного раствора, можно представить в виде равенств:
где Е – энергия сорбции молекул извлекаемого вещества; Еа – энергия сорбционного взаимодействия молекул этого вещества в отсутствие молекул воды и других компонентов раствора; Ер – энергия взаимодействия молекул воды с сорбентом; Е r – энергия взаимодействия молекул растворенного вещества с молекулами воды в растворе.
Поверхность сорбента, погруженного в жидкость, всегда полностью покрыта молекулами компонента раствора, то есть относительная степень заполнения поверхности раздела фаз молекулами всех видов qS всегда равна единице и не зависит от концентрации раствора. В сорбционном слое происходит лишь перераспределение молекул раствора в соответствии с энергией их взаимодействия с сорбентом. Поэтому каждый компонент раствора заполняет определенную долю общей поверхности раздела фаз qi, то есть является функцией равновесной концентрации раствора.
Отношение концентраций молекул сорбируемого вещества в сорбционном слое и в равновесном растворе характеризует избирательность сорбции этого вещества из водного раствора. При отсутствии избирательности это отношение равно единице, то есть концентрация раствора не изменяется, поскольку все компоненты его сорбированы в таких же соотношениях, в каких они находятся в жидкости. С увеличением избирательности сорбции растворенного вещества отношение его концентрации в сорбционном слое и в водном растворе увеличивается, что приводит к уменьшению содержания этого вещества в растворе.
Избирательность сорбции извлекаемых веществ из водного раствора определяет принципиальную целесообразность применения сорбционной технологии для очистки сточных вод от примесей. Однако для решения вопроса о технической эффективности применения того или иного сорбента важна величина его удельной сорбционной емкости, то есть максимальной массы или объема веществ, которые могут быть сорбированы единицей массы или объема сорбента. Такой удельный объем сорбированного вещества (Va) определяется только площадью поверхности стенок пор сорбента, то есть является его характеристикой, в общем случае не зависящей от свойств молекул компонентов раствора, так как из-за своих размеров они могут свободно проникать в эти поры. Учитывая эти ограничения, удельный адсорбционный объем можно считать для каждого сорбента постоянной величиной.
Уменьшение размеров пор сорбента при сохранении их общего объема приводит к быстрому увеличению удельной поверхности. При доступности микропор сорбента для молекул воды и всех растворенных в ней веществ сорбционный объем его всегда заполнен компонентами раствора. Зависимость концентрации растворенного вещества в сорбционном объеме от концентрации его в равновесном водном растворе при постоянной температуре является изотермой адсорбции растворенного вещества. Вместо концентрации вещества в сорбционном объеме можно использовать массу сорбированного вещества, приходящуюся на единицу массы или объема сорбента, называемую удельной сорбцией вещества. Таким образом, чтобы оценить равновесные условия сорбционной очистки от растворенных веществ, необходимо знать удельный сорбционный объем пористого сорбента как основную характеристику сорбента; изотерму сорбции вещества из раствора, являющуюся функцией энергии взаимодействия молекул компонента раствора с сорбентом Еа и энергии гидратации молекул вещества в водном растворе Е r.
Чем больше энергия гидратации частиц растворенного вещества, тем больше противодействие испытывают данные частицы при переходе на поверхность сорбента и тем слабее адсорбируется вещество из раствора. Поэтому сорбционная очистка природных и сточных вод целесообразна, если в них содержатся компоненты, энергия взаимодействия с твердой поверхностью превосходит энергию гидратации.
Сорбцию растворенных веществ твердофазными материалами осуществляют в статических и динамических условиях
Характеристику межфазного распределения выражают через коэффициент распределения, который устанавливает соотношение между равновесными концентрациями частиц в сорбенте и в растворе:
Лекция 9 Особенности сорбции как метода концентрирования. Сорбенты, общие требования к ним. Параметры сорбции: коэффициент распределения, емкость сорбента, изотермы сорбции
Сорбцию широко используют для разделения и концентрирования веществ. Сорбционные методы обычно обеспечивают хорошую селективность разделения, высокие значения коэффициентов концентрирования. Наиболее высокие значения коэффициентов концентрирования достигаются при определении микрокомпонентов непосредственно в фазе сорбента с использованием атомно-эмиссионного, атомно-абсорбционного и рентгено-флуоресцентного методов.
Сорбция – процесс поглощения газов, паров и растворённых веществ твёрдыми или жидкими поглотителями на твёрдом носителе (сорбентами). Классификация сорбционных методов основана на различии механизма взаимодействия веществ с сорбентами. Различают адсорбцию (физическая адсорбция и хемосорбция), распределение веществ между двумя несмешивающимися фазами (растворитель и жидкая фаза на сорбенте), капиллярную конденсацию – образование жидкой фазы в порах и капиллярах твёрдого сорбента при поглощении паров вещества, и ионный обмен. В чистом виде каждый из перечисленных механизмов, как правило, не реализуется, и обычно наблюдаются смешанные механизмы. Процессом сорбции относительно легко управлять, поскольку, варьируя условия эксперимента, можно осуществить количественную сорбцию десорбцию и контролировать этот процесс. Для осуществления сорбционных методов не требуется сложного приборного оформления, экстремальных условий, их легко сочетать с методами последующего определения компонентов. Сорбционные методы отличаются высокой технологичностью и легкостью автоматизации. Можно анализировать не только операцию концентрирования, но и само определение, например в хроматографических и проточно-инжекционных методах.
При ионообменном концентрировании происходит обменная адсорбция: взамен адсорбированных ионов в раствор переходит эквивалентное количество других ионов, входящих первоначально в состав применённого адсорбента.
Схематично механизм ионного обмена заключается в том, что сначала происходит диффузия иона к частице, затем диффузия вглубь ионообменника к его активным центрам, обмен с ионом, диффузия вытесненного иона к поверхности частицы ионообменника и, наконец, его диффузия в раствор. При перемешивании раствора перемещение ионов к поверхности и от поверхности частицы сорбента происходит быстро и эти стадии существенно не влияют на скорость установления равновесия (за исключением очень разбавленных растворов). Однако диффузия ионов в самой частице сорбента происходит медленно и практически не зависит от перемешивания раствора. Поэтому равновесие устанавливается не мгновенно, а в течение нескольких минут или даже часов, в зависимости от размеров обменивающихся ионов и плотности частицы ионообменника.
В качестве адсорбентов применяют активные угли, цеолиты, глинистые минералы, силикагель, оксид алюминия, модифицированные сорбенты на основе силикагеля и целлюлозы, синтетические неорганические и органические ионообменники и пр.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Коэффициент сорбции в чем измеряется
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Оценка коэффициента адсорбции почвой и осадками сточных вод методом высокоэффективной жидкостной хроматографии
Testing of chemicals that are hazardous to the environment. Estimation of the adsorption coefficient ( ) on soil and on sewage sludge using high performance liquid chromatography (HPLC)
Дата введения 2015-06-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием «Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ» (ФГУП «ВНИЦСМВ»); Техническим комитетом по стандартизации ТК N 339 «Безопасность сырья, материалов и веществ» Федерального агентства по техническому регулированию и метрологии на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 30 мая 2014 г. N 67-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97
Сокращенное наименование национального органа по стандартизации
Минэкономики Республики Армения
Госстандарт Республики Беларусь
4 Приказом Федерального агентства по техническому регулированию и метрологии от 24 сентября 2014 г. N 1211-ст межгосударственный стандарт ГОСТ 32630-2014 введен в действие в качестве национального стандарта Российской Федерации с 1 июня 2015 г.
5 Настоящий стандарт идентичен международному документу OECD, Test N 121:2001 «Оценка коэффициента адсорбции почвой и осадками сточных вод методом высокоэффективной жидкостной хроматографии» [«Estimation of the adsorption coefficient ( ) on soil and on sewage sludge using high performance liquid chromatography (HPLC)», IDT].
Наименование настоящего стандарта изменено относительно наименования указанного международного документа для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6)
7 ПЕРЕИЗДАНИЕ. Сентябрь 2019 г.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге «Межгосударственные стандарты»
Введение
Описанный в настоящем стандарте экспериментальный метод, применяемый для оценки коэффициента адсорбции химического вещества почвой и осадками сточных вод, основан на использовании высокоэффективной жидкостной хроматографии [9].
В качестве метода оценки он не может полностью заменить серию экспериментов по исследованию адсорбционного равновесия, используемых в Руководстве ОЭСР по испытаниям химических веществ N 106. Тем не менее, оценка может помочь выбору соответствующих параметров испытаний при исследовании процессов адсорбции/десорбции в соответствии с [1] путем расчета (коэффициент распределения) или (коэффициент адсорбции Фрейндлиха) по формуле 3 (см. пункт 2.3 настоящего стандарта).
1 Область применения
Настоящий стандарт устанавливает методы испытания химических веществ с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ) для оценки коэффициента их адсорбции ( ) почвой и осадками сточных вод.
Метод высокоэффективной жидкостной хроматографии с соответствующей системой детектирования (например с использованием спектрофотометрического детектора, детектора радиоактивности) применяется для химических веществ, имеющих или не имеющих в своем составе радиоактивную (изотопную) метку, и являющихся достаточно стабильными в течение проведения эксперимента. Этот метод может быть особенно полезен при тестировании химических веществ, которые трудно определить с использованием других экспериментальных методов, например: летучих веществ; веществ, нерастворимых в воде при концентрации, которая может быть измерена аналитическим методом; веществ с высоким сродством к поверхности инкубационных систем.
Метод ВЭЖХ может использоваться для смесей, которые дают неразрешенные полосы при элюировании. В таких случаях должны быть установлены нижний и верхний пределы значений 
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
Уточнение дано с учетом особенностей межгосударственной стандартизации.
вычисляют по формуле




— наклон прямой адсорбционной изотермы Фрейндлиха;

при 

2.3 коэффициент адсорбции, (adsorption coefficient, ): Коэффициент адсорбции, нормированный по содержанию органического углерода в сорбенте (почве или осадках сточных вод).
Коэффициент распределения ( ) и коэффициент адсорбции Фрейндлиха ( ) нормализуются по содержанию органического углерода ( ) в сорбенте. Коэффициент является приблизительным показателем степени адсорбции испытуемого вещества сорбентом, в особенности для неионизируемых химических веществ, и позволяет проводить сравнение между различными химическими веществами. В зависимости от размерности и коэффициент может быть безразмерным или иметь размерность мл·л или мкг·г по органическому углероду.
вычисляют по формуле


Сорбционная емкость, распределение и диффузия
Первый результат рассмотренного выше опыта зависит от отношения объемов фаз, называемого «фазовым отношением» (очевидно, что чем больше «пустой» фазы по отношению к «наполненной», тем большая доля веществ смеси перейдет в первую), и от особого свойства сорбционных систем – сорбционной емкости.
Сорбционная емкость ( 
Иногда сорбционную емкость конкретизируют по каждому веществу ( 
Ясно, что если сорбционная емкость равна нулю, то каким бы большим ни было фазовое отношение, концентрация веществ в свободной фазе (в которой они оказались первоначально) останется без изменений. Если фаза сорбента характеризуется большой сорбционной емкостью, то во многих практических случаях ее полное насыщение не достигается, и тогда говорят о концентрации данного вещества в этой фазе (верхним пределом которой является емкость).
Второй результат опыта по сорбции в статике определяется различным распределением веществ между фазами, т.е. различными значениями отношения равновесных концентраций одного и того же вещества в разных фазах. Это отношение называется коэффициентом распределения данного вещества в заданной сорбционной системе ( 
Третий результат определяется молекулярно-статистическим механизмом выравнивания химических потенциалов уравновешиваемых фаз. Он имеет диффузионную природу, т.е. скорость процесса тем больше, чем сильнее отличие текущего значения концентрации от равновесного значения. Мерой этой взаимосвязи служит коэффициент диффузии – разный для различных веществ и сред ( 
Три перечисленные величины важны не только для простейшего опыта сорбции в статике, их задание исчерпывает набор физико-химических характеристик для любой сорбционной задачи!
Первые две величины могут быть найдены из графика изотермы сорбции – зависимости равновесной концентрации в фазе сорбента 


Рис.2.3. Изотерма сорбции, построенная на основании опытов по сорбции в статике. Каждая экспериментальная точка соответствует результатам отдельного опыта при длительной экспозиции. Показано, как определяются емкость ( 


Емкость сорбента можно найти также при проведении фронтального процесса, рассчитав площадь над выходной кривой (см. рис. 2.1б: площадь под пунктирной линией; см. также главу 5, рис. 5.5).
Третья величина (кинетический коэффициент) может быть найдена из опыта сорбции в статике, поставленного специальным образом, называемого в этом случае «кинетика сорбции из ограниченного объема». Его суть заключается в получении зависимости 


Существуют и другие специальные методы определения коэффициентов диффузии, однако теория сорбционных процессов развита в достаточной мере, чтобы не ставить очень сложные эксперименты, а определять необходимые параметры из простых экспериментов по сорбции в статике или хроматографии.


Законы, управляющие процессами разделения
Перейдем теперь от интуитивных представлений о сорбционном процессе к количественным.