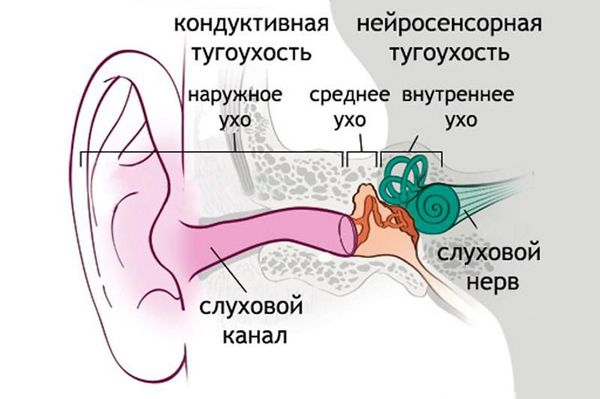
Кохлеарные симптомы что такое
Кохлеарный неврит (нейросенсорная тугоухость)
Заболевание органов слуха, в основе которого лежит неинфекционная природа, получило название кохлеарный неврит слухового нерва, или второе название — нейросенсорная тугоухость. Болезнь негативно воздействует на слуховой нерв человека, что ведет к нарушению звукового восприятия.
Врожденный кохлеарный неврит
Данная патологическое состояние бывает двух видов: врожденным и приобретенным. Малыш может появиться на свет с врожденной формой в том случае, если хотя бы у одного из родителей есть патология слуха. Также существуют и внешние факторы, которые провоцируют развитие данного заболевания. Рассмотрим некоторые из них.
Приобретенный кохлеарный неврит
Заболеванием приобретенного характера могут страдать люди разного возраста. Рассмотрим, что же может спровоцировать развитие данной патологии.
Вторичный кохлеарный неврит — результат хронического гнойного отита.
Симптомы кохлеарного неврита
К главным симптомам относятся два — наличие непроходящего шума в ушах и снижение слуха.
Также могут возникнуть признаки нарушения деятельности вестибулярного аппарата:
Диагностика
Существует достаточно много патологий, которые влияют на качество слуха больных. Именно поэтому во время диагностики кохлеарного неврита очень важно исключить наличие других патологических процессов, а именно:
Для этого ЛОР-врач выясняет степень и скорость снижения слуха, проводя следующие обследования:
Для точности диагностирования очень важно проинформировать доктора о всех симптомах болезни, рассказать о том, как и почему возникли первые признаки.
Лечение кохлеарного неврита
Если появились первые проявления заболевания, то с лечением нейросенсорной тугоухости нельзя медлить, ибо от этого зависит, восстановится ли слух у больного. Специалисты предупреждают: чем раньше начат процесс лечения, тем большая вероятность вернуть слух пациенту. В первую очередь это касается тех пациентов, у которых развилась внезапная и острая форма заболевания. Лечение осуществляется только в условиях стационарного ЛОР-отделения.
Какое же осуществляется лечение?
Лечение кохлеарного неврита является задачей повышенной сложности даже для лор-специалиста с большим опытом работы. Именно поэтому заниматься самолечением недопустимо. Когда больной начинает применять средства народной медицины при данном заболевании, он теряет время, а процесс становится необратимым.
В медицинском центре «Клиника К+31» работают высококвалифицированные ЛОР-специалисты, которые окажут профессиональную помощь пациентам с патологией «кохлеарный неврит».
Кохлеарный неврит (нейросенсорная тугоухость)
Заболевание органов слуха, в основе которого лежит неинфекционная природа, получило название кохлеарный неврит слухового нерва, или второе название — нейросенсорная тугоухость. Болезнь негативно воздействует на слуховой нерв человека, что ведет к нарушению звукового восприятия.
Врожденный кохлеарный неврит
Данная патологическое состояние бывает двух видов: врожденным и приобретенным. Малыш может появиться на свет с врожденной формой в том случае, если хотя бы у одного из родителей есть патология слуха. Также существуют и внешние факторы, которые провоцируют развитие данного заболевания. Рассмотрим некоторые из них.
Приобретенный кохлеарный неврит
Заболеванием приобретенного характера могут страдать люди разного возраста. Рассмотрим, что же может спровоцировать развитие данной патологии.
Вторичный кохлеарный неврит — результат хронического гнойного отита.
Симптомы кохлеарного неврита
К главным симптомам относятся два — наличие непроходящего шума в ушах и снижение слуха.
Также могут возникнуть признаки нарушения деятельности вестибулярного аппарата:
Диагностика
Существует достаточно много патологий, которые влияют на качество слуха больных. Именно поэтому во время диагностики кохлеарного неврита очень важно исключить наличие других патологических процессов, а именно:
Для этого ЛОР-врач выясняет степень и скорость снижения слуха, проводя следующие обследования:
Для точности диагностирования очень важно проинформировать доктора о всех симптомах болезни, рассказать о том, как и почему возникли первые признаки.
Лечение кохлеарного неврита
Если появились первые проявления заболевания, то с лечением нейросенсорной тугоухости нельзя медлить, ибо от этого зависит, восстановится ли слух у больного. Специалисты предупреждают: чем раньше начат процесс лечения, тем большая вероятность вернуть слух пациенту. В первую очередь это касается тех пациентов, у которых развилась внезапная и острая форма заболевания. Лечение осуществляется только в условиях стационарного ЛОР-отделения.
Какое же осуществляется лечение?
Лечение кохлеарного неврита является задачей повышенной сложности даже для лор-специалиста с большим опытом работы. Именно поэтому заниматься самолечением недопустимо. Когда больной начинает применять средства народной медицины при данном заболевании, он теряет время, а процесс становится необратимым.
В медицинском центре «Клиника К+31» работают высококвалифицированные ЛОР-специалисты, которые окажут профессиональную помощь пациентам с патологией «кохлеарный неврит».
Лечение неврита слухового нерва
Одна из частых причин, по которой человек приходит на прием к ЛОР-врачу – это снижение слуха. И нередко тугоухость является следствием повреждения нервных волокон во внутреннем ухе.
Слуховой нерв страдает под действием неблагоприятных факторов – воспалительных процессов в периферическом отделе слуховой системы, токсических веществ, травм и др. Это заболевание называется неврит слухового нерва ( кохлеарный неврит, нейросенсорная тугоухость).
Болезнь может протекать как в острой, так и в хронической форме. И в зависимости от степени поражения нерва приводит к нарушениям слухового восприятия от умеренного снижения слуха до полной глухоты. Поэтому так важно вовремя диагностировать заболевание и начать лечение.
Почему возникает кохлеарный неврит
Основными причинами заболевания врачи-отоларингологи часто называют:
Нейросенсорная тугоухость чаще всего диагностируется у мужчин старше 50 лет, а также у жителей крупных городов.
Симптомы неврита слухового нерва
Главный признак заболевания – это снижение слуха. Как полное, так и частичное: например, некоторые пациенты перестают слышать звуки определенной частоты, воспринимают речь собеседника неразборчиво, отмечают шум или звон в ушах.
К другим симптомам относятся:
Диагностика и лечение
Если врач подозревает неврит слухового нерва, пациенту могут быть назначены следующие обследования:
Тактика лечения для каждого пациента разрабатывается персонально, при этом главное значение имеет установление причин развития патологии.
Консервативное лечение включает прием лекарственных препаратов, дезинтоксикационную терапию (если причина поражения нерва – отравление токсинами), а также физиотерапевтические процедуры.
В некоторых случаях показано хирургическое лечение.
Кохлеарный неврит слухового нерва причины, симптомы, методы лечения и профилактики
Кохлеарный неврит (нейросенсорная тугоухость) — это воспалительный процесс в слуховом нерве, который характеризуется угнетением слуха, возникновением болевых ощущений, шумом в ушах, потерей равновесия. Причины патологии могут быть врождёнными или приобретёнными. Опасность болезни в том, что симптомы могут развиваться медленно, но возможно потерять слух внезапно, в течение нескольких часов. Для диагностики и лечения нужно обращаться к оториноларингологу и неврологу.
Причины кохлеарного неврита слухового нерва
Происхождение патологии может быть как на генетическом уровне, так и полученным вследствие различных факторов:
Статью проверил
Дата публикации: 24 Марта 2021 года
Дата проверки: 24 Марта 2021 года
Дата обновления: 03 Декабря 2021 года
Содержание статьи
Симптомы
Характерные признаки патологии проявляются внезапно, но бывают случаи, когда симптоматика не проявляется до возникновения серьёзных нарушений. На первом этапе у больного наблюдают незначительное снижение слуха, как правило, на одну сторону. Дальнейшее развитие неврита зависит от того, как быстро пациент обратился к врачу и какие причины спровоцировали недуг. Самые распространнёные симптомы кохлеарного неврита:
Разновидности
Кохлеарный неврит различают по форме, происхождению, этапам развития:
Острую стадию можно вылечить окончательно, если сразу предпринять меры и начать лечение. Подострая форма чаще переходит в хроническую. Прогрессирующий этап считается самым опасным — именно в этот период повышается риск получить глухоту.
Диагностика
Диагностические исследования назначают в комплексе — обычно это осмотр больного, неврологические и акустические тесты, а также инструментальные методики:
Кохлеовестибулярные нарушения: подходы к диагностике и лечению
Опубликовано в журнале:
Вестник оториноларингологии, 5, 2011
Cochleovestibular disorders: approaches to diagnostics and treatment
O.V. ZAITSEVA
ФГУ НКЦ оториноларингологии ФМБА России (дир. — проф. Н.А. Дайхес), МОНИКИ им. М.Ф. Владимирского (дир. — член-корр. РАМН проф. Г.А. Оноприенко), Москва
Проведена оценка эффективности включения Мильгаммы и Мильгаммы композитум в схему лечения пациентов с кохлеовестибулярными нарушениями. В результате проведенного лечения у пациентов, получавших Мильгамму и Мильгамму композитум, вестибулярная компенсация (в том числе по данным постурографических показателей) достигалась в более короткие сроки — через 3—4 нед от начала лечения, тогда как у пациентов, не получавших эти препараты, — через 5 нед. Таким образом, можно рекомендовать применение Мильгаммы и Мильгаммы композитум в качестве нейротропных средств, дополняющих базовую терапию у пациентов с кохлеовестибулярными нарушениями для сокращения сроков достижения вестибулярной компенсации.
Ключевые слова: кохлеовестибулярные нарушения, головокружение, нарушения равновесия, сенсоневральная тугоухость, Мильгамма, Мильгамма композитум.
The aim of this work was to evaluate the efficacy of introduction of milgamma and milgamma compositum in the treatment of 52 patients with cochleovestibular disorders of different etiology. Thirteen patients enrolled in the study received standard therapy and 39 others were given its combination with milgamma preparations. Combined therapy with milgamma and milgamma compositum ensured faster vestibular compensation including posturographic characteristics than the standard treatment (within 3—4 weeks compared with 5 weeks in controls). The results of the study give reason to recommend milgamma and milgamma compositum as neurotropic medicines in addition to standard therapy for the management of the patients presenting with cochleovestibular disorders for the acceleration of the vestibular compensation.
Key words: cochleovestibular disorders, dizziness, balance disorder, sensorineural loss of hearing, milgamma, milgamma compositum.
Актуальность проблемы кохлеовестибулярных нарушений определяется в первую очередь высоким уровнем заболеваемости с преобладанием лиц наиболее активного и трудоспособного возраста [1—4]. Так, при опросе более 20 тыс. человек в возрасте от 18 до 64 лет выяснилось, что за последний месяц более 20% испытали головокружение, из них свыше 30% страдают головокружением на протяжении более 5 лет [5]. Около трети пациентов, обращающихся к оториноларингологам, высказывают жалобы на различные типы головокружения. В Российской Федерации число больных с кохлеовестибулярными нарушениями составляет 13—14 человек на 10 тыс. населения [6]. Следует отметить, что детальное вестибулометрическое исследование больных острой сенсоневральной тугоухостью в ряде случаев позволяет выявить нарушения функции лабиринта [2]. Установленная по результатам калорической и вращательной проб экспериментальная вестибулярная гипо- или гиперрефлексия, а также выявленная в ходе стабилометрического исследования статическая атаксия даже при отсутствии спонтанной вестибулярной симптоматики дает основания расценивать такое состояние больного, как кохлеовестибулярное нарушение [7]. Считается, что при сенсоневральной тугоухости наиболее часто регистрируется симптоматика, характерная для периферического вестибулярного синдрома угнетения [2].
Периферические вестибулярные расстройства возникают при поражении сенсорных элементов ампулярного аппарата и преддверия, вестибулярного ганглия и нервных проводников ствола мозга [8].
Периферическое вестибулярное головокружение — это чаще головокружение приступообразного характера различной интенсивности (от слабых до бурных атак), сопровождающееся спонтанным нистагмом — клоническим горизонтальным или горизонтально-ротаторным, разной интенсивности, степени, ассоциированным с гармоничным отклонением туловища и рук в сторону медленного компонента. Отмечается положительное влияние поворота головы (в сторону медленного компонента нистагма). Как правило, периферическое вестибулярное головокружение бывает односторонним и нередко сопровождается нарушением слуховой функции на пораженной стороне. Экспериментальные пробы выявляют угнетение функции вестибулярных рецепторов (кроме начального периода заболевания) [9].
Установление причины кохлеовестибулярного расстройства весьма важно, поскольку это обеспечивает возможность проведения патогенетически обоснованного лечения и выбора адекватной профилактической тактики.
Обследование пациентов с кохлеовестибулярными нарушениями должно быть детальным и всесторонним и обязательно включать обследование у отоневролога, позволяющее оценить функциональное состояние вестибулярного анализатора и уровень его поражения.
Расстройство функции равновесия (атаксия), являясь неотъемлемой частью кохлеовестибулярных нарушений, существенно ухудшает качество жизни: пациенты нередко оказываются неспособными без посторонней помощи передвигаться даже в пределах собственного жилища. Поэтому при оценке состояния вестибулярной функции большое внимание уделяется исследованию способности человека поддерживать вертикальное положение тела — функции равновесия, осуществляющейся посредством установочных рефлексов, которые удерживают центр массы тела в пределах проекции площади его опоры.
Одним из способов выявления атаксии является цифровая постурография. Применявшиеся ранее методики проведения стабилографического исследования предполагали проведение проб, часто мучительных для пациента: обследование на аппарате, конструкция которого предусматривала качательные движения в горизонтальной и сагиттальной плоскостях, которые регистрировались на ЭВМ, контроль спонтанных и поствращательных отклонений при помощи «пишущего стержня» и шкалы, прикрепленных к креслу Барани [10]. Позднее для выявления нарушений статокинетической устойчивости были предложены пробы, не сопровождающиеся вегетосенсорными проявлениями: медленные наклоны головы в сагиттальной и фронтальной плоскости, повороты головы вправо и влево с последующей ходьбой по прямой линии, а также алгоритм «пятка—носок», шагательная проба [11].
Использование современной аппаратуры значительно расширило диагностические возможности проведения статокинетических исследований, позволило проводить информативную качественную и количественную оценку функции равновесия. Современным вариантом позы Ромберга является проведение исследования на стабилометрической платформе, являющейся центром прибора, оценивающего функцию равновесия в количественном отношении [12]. Для дифференциальной диагностики различных нарушений функции равновесия используются нагрузочные функциональные пробы с одновременной постурографией: пробы с оптокинетической стимуляцией, с максимальным поворотом головы вправо и влево, с дозированной пороговой вращательной стимуляцией, с фиксацией взора [13].
Лечение пациентов с кохлеовестибулярными нарушениями должно быть незамедлительным и этиотропным и включать наряду с вестибулярной реабилитацией использование вазоактивных, антихолинергических, нейротропных препаратов (высокие дозы витаминов группы В) [6, 14]. Витамины группы B, прежде всего В1, В6 и В12, многие годы применяются в комплексном лечении заболеваний периферической нервной системы с целью улучшения обменных и усиления регенеративных процессов в нейроэпителии и замедления развития нейропатии [15].
Витамин В1 (тиамин) участвует в энергетических процессах в нервных клетках, в частности в цикле Кребса [16], и регенерации поврежденных нервных волокон [6, 17—19].
Витамин В6 (пиридоксин) является кофактором более чем для 100 ферментов, а благодаря способности регулировать метаболизм аминокислот нормализует белковый обмен [20, 21]. Кроме того, в последние годы доказано, что витамин В6 имеет антиоксидантное действие [22], участвует в синтезе катехоламинов, гистамина и гаммааминомасляной кислоты, увеличивает внутриклеточные запасы магния, также играющего важную роль в обменных процессах нервной системы.
Витамин В12 (цианокобаламин) играет важную роль в делении клеток, кроветворении, регуляции обмена липидов и аминокислот. Он участвует в важнейших биохимических процессах миелинизации нервных волокон [23].
В настоящее время оториноларингологи редко используют водорастворимые препараты витаминов В1, В6 и В12 для монотерапии, так как наиболее эффективным считается их комплексное применение [24]. Одним из наиболее эффективных современных инъекционных В-комплексов считается препарат Мильгамма («WÖRWAG PHARMA GmbH & Co. KG», Германия). Мильгамма представляет собой комбинацию синергично действующих нейротропных витаминов В1, В6 и В12. Каждая ампула препарата содержит по 100 мг тиамина гидрохлорида и пиридоксина гидрохлорида, 1000 мг цианокобаламина. Входящий в состав Мильгаммы местный анестетик лидокаин (20 мг) позволяет сделать инъекции практически безболезненными. Следует отметить, что Мильгамма имеет небольшой объем ампулы — всего 2 мл. Это повышает приверженность пациента терапии. Последовательное назначение Мильгаммы и Мильгаммы композитум при различных заболеваниях нервной системы способствует восстановлению функции нервных тканей при невропатиях различного происхождения [25, 26]. В частности, эффективность применения Мильгаммы при сенсоневральной тугоухости подтверждена проведенными в последние годы исследованиями [15, 27].
В период с января 2008 г. по май 2011 г. проведено консервативное лечение 52 пациентов в возрасте от 18 до 43 лет (23 женщины и 29 мужчин) с кохлеовестибулярными нарушениями. Причиной кохлеовестибулярных нарушений у 21 пациента явилась перенесенная острая респираторная вирусная инфекция, у 19 — стрессовый фактор, у 12 — подъем артериального давления. Всем пациентам проводилось комплексное аудиологическое и вестибулологическое исследование, включавшее исследование спонтанной отоневрологической симптоматики, оптокинетического нистагма (скорость движения стимула 15°/с, 30°/с и 45°/с), тесты плавного зрительного слежения, зрительных саккад, позиционный тест Дикса—Холлпайка, битермальный бинауральный калорический тест, вращательный тест с записью движения глаз на видеоокулографическом комплексе VNG Stad Alone Unit VO 25 («Heinemann Medizintechnik GmbH», Германия), исследование статики, координации на постурографическом комплексе Smart EquiTest Balans Master («NeuroCom», США), электрокохлеография на установке Viking Ques («Nicolet», США) и/или дегидратационный тест с ксилитом.
Повторная аудиометрия и вестибулометрия проводились сразу по окончании лечения и спустя 2 мес, цифровая постурография выполнялась еженедельно на протяжении курса лечения и также спустя 2 мес. Выраженность головокружения оценивали по критериям выраженности функциональных нарушений Международной классификации функций ВОЗ: 0 — нет (никаких, ничтожные), 1 — легкие (незначительные, слабые), 2 — умеренные (средние, значимые), 3 — тяжелые (высокие, интенсивные), 4 — абсолютные (полные) [29].
Дополнительные исследования включали: рентгенографию височных костей по Стенверсу, при необходимости магнитно-резонансную томографию головного мозга/внутренних слуховых проходов и мостомозжечковых углов; рентгенографию шейного отдела позвоночника, экстра- и транскраниальную допплерографию. Всем больным выполняли общеклинические анализы крови и мочи, биохимический анализ крови, коагулограмму.
Спонтанная вестибулярная симптоматика в виде координаторных нарушений зарегистрирована у 34 (65%) человек. Спонтанный нистагм выявлен у 12 (23%) пациентов — нистагм был горизонтальный, мелкоразмашистый, клонический, I степени. Вестибулярная гипо- или гиперрефлексия (по результатам калорической и вращательной проб) зарегистрирована у всех пациентов. Гипорефлексия проявлялась отсутствием или продолжительностью калорического нистагма не более 40 с. Продолжительность нистагма в среднем составила 18±4 с. При гиперрефлексии продолжительность калорического нистагма увеличивалась до 80—100 с и составила в среднем 91±6 с (без диссоциации). Выраженность головокружения на момент начала лечения пациенты оценивали в среднем на 2,8±0,5 балла по критериям выраженности функциональных нарушений Международной классификации функций ВОЗ.
При аудиологическом исследовании нарушение звуковосприятия зарегистрировано у всех пациентов, в том числе двустороннее — у 38. Эндолимфатический гидропс при проведении электрокохлеографии и/или дегидратационного теста (с ксилитом) ни у одного из пациентов не выявлен.
При проведении цифровой постурографии (тест чувствительной организации — Sensory organization test (SOT)) у всех пациентов зарегистрирована статическая атаксия за счет вестибулярной составляющей. SOT — современный вариант теста Ромберга, выполняемый в 6 этапов: с открытыми и закрытыми глазами на неподвижной платформе при неподвижном окружении, с открытыми глазами на неподвижной платформе при подвижном окружении, с открытыми и закрытыми глазами на подвижной платформе при неподвижном окружении и с открытыми глазами на подвижной платформе при подвижном окружении. Базовое лечение пациентам проводилось в соответствии со сложившимися стандартами оказания медицинской помощи (с учетом противопоказаний) и включало применение пентоксифиллина, пирацетама, винпоцетина, бетагистина в течение 6 нед. В течение 4—6 нед всем пациентам проводилась вестибулярная реабилитация на постурографическом комплексе Smart EquiTest Balans Master («NeuroCom», США) 3—5 раз в неделю по индивидуальной программе. 12 человек продолжали прием гипотензивных препаратов центрального действия и диуретиков, назначенных ранее кардиологом или терапевтом. 19 пациентов с кохлеовестибулярными нарушениями постстрессовой этиологии по рекомендации невролога получали антидепрессант растительного происхождения. Пациенты, перенесшие острую респираторную вирусную инфекцию (21 человек), в течение первых 3 дней получали парентеральную дезинтоксикационную терапию (реополиглюкин или раствор глюкозы 5%, аскорбиновая кислота 5%).
39 человек (19 женщин и 20 мужчин в возрасте от 18 до 43 лет) получали помимо базовой терапии препараты Мильгамма и Мильгамма композитум по схеме: Мильгамма внутримышечно №10, затем по 1 драже Мильгаммы композитум 3 раза в день в течение 6 нед.
13 пациентам (6 женщинам и 7 мужчинам в возрасте от 20 до 43 лет) Мильгамма и Мильгамма композитум не назначались в связи с индивидуальной непереносимостью витаминов В-группы; они получали только препараты базовой терапии.
Данные отоневрологического и аудиологического исследований у пациентов, получавших и не получавших препараты Мильгамма и Мильгамма композитум, были сравнимы.
Данные компьютерной постурографии с автоматическим расчетом показателей, в частности индекса вестибулярной устойчивости, измеряемого в процентах, — отношение суммарной амплитуды смещения центра тяжести к абсолютному центру платформы — у пациентов обеих групп, получавших препараты Мильгамма и Мильгамма композитум, были также сравнимы и достоверно (р
В результате проведенного лечения у всех пациентов при проведении контрольной постурографии на момент окончания курса зафиксировано уменьшение статической атаксии, что выразилось в достоверном (рОднако у пациентов, принимавших Мильгамму и Мильгамму композитум, нормализация постурографических показателей наступала в среднем на 2 нед раньше и индекс вестибулярной устойчивости по окончании лечения был достоверно (р
| Сроки обследования в процессе лечения | Базовое лечение (n=13) | Базовое лечение+Мильгамма и Мильгамма композитум (n=39) |
| До начала лечения | 49±7 | 47±10 |
| От начала лечения | ||
| через 1 нед | 53±8 | 60±7 |
| через 2 нед | 59±4 | 67±6 |
| через 3 нед | 64±5 | 72±6 |
| через 4 нед | 70±6 | 79±4 |
| через 5 нед | 72±3 | 83±6 |
| через 6 нед | 78±6 | 85±7 |
| Спустя 2 мес после лечения | 81±5 | 86±6 |
Как видно из таблицы, у пациентов, получавших Мильгамму и Мильгамму композитум, стойкая нормализация основного постурографического показателя — индекса вестибулярной устойчивости (норма ≥70), достигалась в более короткие сроки — через 3—4 нед от начала лечения, тогда как у пациентов, получавших только базовую терапию, — через 5 нед.
Выраженность головокружения на момент окончания лечения пациенты в среднем оценивали на 0,3±0,2 балла по критериям выраженности функциональных нарушений Международной классификации функций ВОЗ (достоверной разницы в оценке выраженности головокружения среди пациентов обеих групп не было). У всех пациентов к окончанию курса лечения зафиксирована компенсация вестибулярной функции в покое, сочетавшаяся с положительной динамикой показателей повторной вестибулометрии. Повторное аудиологическое исследование показало, что у получавших Мильгамму и Мильгамму композитум пациентов слух улучшился в среднем на 24±0,8 дБ, что достоверно (р
Нежелательных явлений (т.е. любых неблагоприятных медицинских явлений, наблюдаемых у использующего медицинский продукт пациента, которое может и не иметь причинно-следственной связи с данным видом лечения) ни у кого из пациентов, в том числе получавших сопутствующую терапию, зафиксировано не было, лечение все переносили хорошо. Со слов пациентов, ни у одного из них за весь период наблюдений эпизодов вращательного головокружения не возникало. Таким образом, можно рекомендовать применение Мильгаммы и Мильгаммы композитум в качестве нейротропных средств, дополняющих базовую терапию у пациентов с кохлеовестибулярными нарушениями для сокращения сроков достижения вестибулярной компенсации и улучшения слуховой функции.