Контактная микроскопия что это
Биомикроскопия глаза
Диагностика, Лечение
Полное диагностическое обследование занимает около 2-2,5 часов. В него входит: точное определение.
Объективное измерение рефракции глаза с использованием современной специализированной аппаратуры.
Офтальмометрия или кератометрия – это диагностическая процедура, применяемая для определения радиуса.
Пневмотонометрия – диагностическое исследование в офтальмологии, предназначенное для измерения ВГД.
Доминирующим, ведущим глазом считается глаз, функционально преобладающий в процессе бинокулярного.
Данный метод обследования применяется в диагностике как глазных, так и соматических заболеваний.
Ультразвуковая диагностика — это высокоточный, безболезненный и доступный во всех отношениях метод.
ОКТ – высокоточный метод диагностики, позволяющий исследовать состояние структурных элементов глаза.
Наши преимущества
Соответствие международным стандартам ISO 9001:2015.
Сегодня это самая эффективная операция по коррекции зрения.
Пожизненная гарантия на качество проведенных операций.
Внедряются новые технологии и методики, приносящие стабильно успешный результат.
Акции и Скидки
* Предоставляемые скидки не суммируются
Суть метода биомикроскопии
В ходе процедуры исследуют внешние и внутренние структуры глаза: веки, конъюнктиву, склеру, хрусталик, радужку, роговицу, глазное дно.
Суть методики заключается в следующем:
Методика биомикроскопии глаза позволяет изучить анатомические структуры глаза, выявить патологические процессы, определить степень тяжести.
Роговица: при осмотре роговицы с помощью биомикроскопии изучается передняя и задняя поверхности роговицы. При выявлении патологических изменений определяется их локализация, глубина, размеры. Также при биомикроскопии роговицы выявляются инородные тела.
Хрусталик: при фокусировке на хрусталике врач получает его срез, определяется его форма и состояние, наличие участков помутнения (при катаракте);
Стекловидное тело: оценивается прозрачность, выявляются признаки воспаления, процессов дистрофии в виде формирования фибриллярных элементов;
Глазное дно: изучается состояние сетчатки глаза, зрительного нерва на предмет повреждений (разрывов сетчатки), наличие застойных явлений или воспалительного процесса (при неврите зрительного нерва)
Показания для проведения биомикроскопии глаза
Исследование оптических сред глаза может назначаться для диагностики различных патологий зрительного аппарата. Основными показаниями являются:
Противопоказания
Биомикроскопия не имеет противопоказаний. Не проводится в состоянии опьянения (алкогольного и наркотического), а также в период острых психозов.
Подготовительный этап
В большинстве случаев подготовка к обследованию не требуется.
Для улучшения визуализации хрусталика, стекловидного тела и сетчатки, перед началом процедуры пациенту закапывают глазные капли для расширения зрачков. Перед началом процедуры пациенту закапывают глазные капли для расширения зрачков. Данная манипуляция необходима для улучшения визуализации биологической линзы (хрусталика) и стекловидного тела.
Ход процедуры
Диагностика выполняется в темном помещении, без проникновения солнечных лучей или искусственного света. При повышенной чувствительности глаз к яркому освещению у исследуемого, применяются специальные фильтры, снижающие его интенсивность.
Исследуемого усаживают напротив устройства, подбородок фиксируется на специальной подставке, взгляд устремляется вперед. Узкий луч света направлен на роговицу.
Длительность процедуры составляет до 15 минут, после чего осуществляется интерпретация (расшифровка) результатов, на основе которых устанавливается точный диагноз и разрабатывается максимально эффективная схема лечения.
Варианты проведения биомикроскопии
Различают четыре основных разновидности исследования:
Различают два способа применения светового излучения:
Как производится расшифровка результатов
Расшифровка результатов биомикроскопии выполняется по данным осмотра, что находит свое отражение в описании исследования, на основании которого можно заподозрить либо установить большой перечень заболеваний органов зрения.
Глаукома
Биомикроскопия позволяет выявить ранние стадии глаукомы, которая проявляется изменениями со стороны конъюнктивальных и эписклеральных сосудов, отечностью конъюнктивы, новообразованием капилляров, прорастающих в бессосудистую зону, и другими признаками.
Катаракта
При диагностировании катаракты обследование с помощью щелевой лампы позволяет выявить катарактальные изменения раньше других методов. В том числе определяются явления, предшествующие развитию катаракты, что позволяет проводить эффективную консервативную терапию, отслеживать динамику процессов, планировать сроки хирургического лечения.
Инородное тело роговицы
При попадании в глаз инородные тела могут как оставаться на поверхности, так и проникать в глубину тканей. При повреждении эпителия роговицы инородное тело вызывает воспалительные явления, а глубоко расположенные тела могут проникать в переднюю камеру глаза. Со временем неудаленные частицы провоцируют развитие инфекции и гнойных процессов. Биомикроскопия устанавливает глубину нахождения и проникающий или нет характер инородного тела.
Колобома радужки
Колобомой радужки называют дефект радужной оболочки, который сопровождается изменением формы зрачка, нарушается работа сфинктера зрачка и возможность регулировать количество света, попадающего на сетчатку. При колобоме биомикроскопия является обязательным методом обследования для определения состояния переднего отдела глаза.
Воспалительные заболевания
Показанием для проведения биомикроскопии являются воспалительные заболевания конъюнктивы, роговицы, радужки.
Биомикроскопия глаза является доступным и неинвазивным методом исследования, и в то же время информативным и не требующим сложной подготовки пациента.
Оформите заявку на сайте, мы свяжемся с вами в ближайшее время и ответим на все интересующие вопросы.
Возможности конфокальной микроскопии.(Предварительное сообщение)
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Possibilities of confocal microscopy (Preliminary report)
S.Ae. Avetisov, G.B. Egorova
GU NII of Eye Diseases RAMN, Moscow
Для успешного решения задач оптической и хирургической коррекции различных рефракционных нарушений большое значение имеет адекватная оценка функционального и морфологического состояния роговой оболочки. Изучение структурных изменений при различных заболеваниях роговицы необходимо также для оценки тяжести патологического процесса, эффективности лечения и определения тактики ведения больного.
В связи с этим целесообразность разработки неинвазивных методов исследования, позволяющих оценить степень морфологических изменений в роговице, является неоспоримой.
В течение последнего десятилетия все большее распространение получают офтальмологические методы диагностики, позволяющие получать информацию с визуализацией результатов исследования. Ультразвуковые методы, компьютерная видеокератография позволили значительно расширить и углубить знания и понятия о различных аспектах болезней роговицы и хирургических процедур.
Одним из наиболее современных методов исследования роговицы является прижизненная конфокальная микроскопия. Данный метод в силу оригинальной конструкции микроскопа и его большой разрешающей способности позволяет визуализировать живые ткани роговицы на клеточном уровне, измерить толщину каждого из ее слоев, оценить количество, форму, размер клеток эпителия, стромы, заднего эпителия роговицы, степень десквамации эпителиальных клеток при воздействии контактных линз и хирургических вмешательств [1 –7].
Цель данного исследования – изучение возможностей и информативности конфокальной микроскопии в норме и при некоторых патологических состояниях роговой оболочки глаза.
Материал и методы исследования
Конфокальная микроскопия роговицы была проведена у 40 пациентов (75 глаз): 6 пациентов (12 глаз) были здоровыми добровольцами или имели миопию слабой степени, 24 (48 глаз) –с кератоконусом 1–4 стадий, 4 пациента (4 глаза) –после сквозной пересадки роговицы, 4 (8 глаз) –после рефракционных операций на роговице, 1пациент (1 глаз) –после перенесенного герпетического кератита, 1 пациент (2 глаза ) –с дистрофией Фукса.
Исследование проводили с помощью конфокального микроскопа «Confoscan – 4», Nidek (увеличение х 500).
Данный прибор позволяет исследовать роговицу по всей ее толщине, размер исследуемой зоны составляет 440 х 330 мкм. Толщина слоя сканирования составляет 5 мкм. Исследование проводится с использованием иммерсионной жидкости, которая находится между роговицей и объективом линзы, в результате чего исключается непосредственный контакт линзы и роговицы и сводится к минимуму риск повреждения эпителия. Проведение данного исследования возможно без применения анестетиков. В качестве иммерсионной жидкости используется гель («Видисик»). Линза с каплей геля подводится к роговице до касания, толщина слоя иммерсионной жидкости должна быть равна 2 мм. Конструкция прибора позволяет исследовать роговицу в центральной зоне и ее парацентральных участках (рис.1, 2).
Результаты проведенных исследований
При обследовании здоровых добровольцев и пациентов с миопией слабой степени получены данные, характеризующие нормальную картину всех слоев роговой оболочки глаза.
Роговичный эпителий состоит из 5–6 слоев и трех разных видов клеток:
1– плоские поверхностные (2–3 слоя);
2 – шиповидные (крылатые) (2–3) слоя;
3 –цилиндрические базальные (1 слой).
Цилиндрические базальные клетки обладают митотической активностью. Средняя толщина всего эпителия приблизительно 50 мкм. С помощью конфокальной микроскопии можно определить особенности различных клеток.
Поверхностный слой эпителия представлен полигональными клетками, обычно с четким ядром, четкими границами и гомогенной плотностью. Ядра обычно ярче, чем окружающая их цитоплазма, также можно различить перинуклеарное темное кольцо (рис. 3).
Базальные клетки – маленькие полигональные, более плотные без четкого ядра и с очень четкими яркими границами (рис.4). Крылатые клетки обладают переходными характеристиками, ядра могут быть нечеткими или могут не определяться.
Боуменова и десцеметова мембраны в норме не визуализируются, т.к. прозрачны и не отражают свет.
Конфокальная микроскопия дает возможность визуализировать волокна нервных сплетений роговицы. Субэпителиальное нервное сплетение находится под боуменовой мембраной. Его нервные волокна, перфорируя боуменову мембрану на уровне базального эпителия, формируют суббазальное нервное сплетение, волокна которого идут поверхностно, обеспечивая иннервацию базального эпителиального слоя, и заканчиваются в области поверхностных эпителиальных слоев.
В качестве критериев оценки нервных волокон используют такие показатели, как плотность, ширина, извилистость, рефлективность, ориентация, ветвление. В норме можно увидеть длинные, параллельно идущие тяжи или пучки нервов [2,7]. Часто нервные волокна яркие, хорошо контрастирующие на фоне непрозрачного темного фона (рис. 5).
Строма роговицы занимает от 80 до 90% толщины роговицы и состоит из 3 основных компонентов: клеточного, бесклеточного и нейросенсорного.
Клеточный компонет в основном состоит из кератоцитов и составляет примерно 5% всего вещества. Бесклеточный –от 90 до 95 % стромы, включает правильные (регулярные) коллагеновые пластинчатые структуры и интерстициальную ткань. Нейросенсорный компонент представлен стромальным глубоким нервным сплетением.
Типичная конфокальная микроскопическая картина стромы включает несколько ярких неправильной овальной формы тел, которые являются ядрами кератоцитов и лежат в толще прозрачного (темно–серого или черного) бесклеточного матрикса. При отсутствии патологических изменений стромы визуализация внеклеточных структур невозможна из–за их прозрачности. Строма может быть условно разделена на субслои: передний (непосредственно под боуменовой мембраной), передне–средний, средний и задний. Средняя плотность кератоцитов выше в передней строме (10% толщины), их количество уменьшается по направлению к задним слоям. Плотность клеток прогрессивно уменьшается от передней (100%) к задней строме (53,7%).
В передней строме ядра кератоцитов имеют округлую бобовидную форму, в задней строме – овальную (рис. 6,7).
В ряде случаев кератоциты имеют различную яркость. Различие в рефлективности зависит от их метаболического возбуждения, поэтому их называют активированными кератоцитами (рис. 8). Их можно обнаружить и в здоровых роговицах – это «стрессовые» клетки, их деятельность направлена на поддержание внутреннего гомеостаза роговицы и они являются типичными для воспалительных и рубцовых процессов (например, при заживлении после эксимер–лазерных операций) [2].
В строме (особенно в передне–средней и средней) возможна визуализация нервных волокон из глубокого роговичного сплетения. Эти волокна визуализируются в виде тонких, ярких рефлектирующих полос, ориентированных либо вертикально, либо по косой параллельно друг другу, часто видна бифуркация в виде буквы Y (рис. 9).
Задний эпителий роговицы выглядит как яркий одноклеточный слой из гексогональных или полигональных плоских клеток. Ядра не определяются, а тело клетки гомогенно яркое, светлое. Края клеток визуализируются, как тонкие серые линии. Чем выше плотность клеток, тем меньше их размер. Возможен мануальный или автоматический подсчет количества клеток, расчет их плотности, площади, коэффициента вариабельности (рис. 10).
При кератоконусе морфологические изменения достаточно многообразны, особенно в области роговицы, вовлеченной в эктатический процесс.
В эпителиальном слое могут определяться различные варианты эпителиопатии. Поверхностные клетки становятся деформированными и вытянутыми в косом направлении, клеточные границы нечеткие. Участки с большей отражательной способностью свидетельствуют о нарушении прозрачности (рис. 11).
Цвет клеток характеризует состояние их жизнедеятельности. Светлые клетки – с более сглаженной поверхностью и большей отражательной способностью, что является следствием их атрофии. Большое количество светлых клеток свидетельствует об их повышенной десквамации (рис. 12).
Неравномерный рефлекс с боуменовой мембраны косвенно свидетельствует о нарушении ее структуры и прозрачности.
В базальном эпителии обнаруживается деформация и неправильность формы клеток и иногда возможно определить небольшие зоны, в которых базальный эпителий отсутствует (рис. 13).
Субэпителиальное нервное сплетение в общем хорошо визуализируется и может иметь нормальную морфологию (рис. 14).
Строма роговицы при кератоконусе всегда вовлечена в патологический процесс: повышенная отражательная способность передних отделов стромы и стрии Вогта в задних отделах стромы являются типичными находками. Основные изменения стромы представлены микростриями, которые выглядят, как разнородные тонкие линии со сниженной отражательной способностью (гипорефлекторные), контрастирующие с более светлой стромой и располагаются внеклеточно.
Эти проявления являются следствием дегенеративных процессов и могут быть микроскладками (как и стрии Вогта) или микротрещинами экстрацеллюлярного матрикса. Микрострии обнаруживаются во всех слоях роговичной стромы. Количество кератоцитов уменьшено, видны их значительные дегенеративные изменения (рис. 15).
Изменения в строме могут быть многообразными. В частности, примером может служить изменение формы и ориентации кератоцитов в средней строме при кератоконусе 3 стадии. Отмечаются наличие большого количества кератоцитов с повышенной отражательной способностью, выраженная тенденция к помутнению (рис. 16).
Необходимо отметить, что чем больше выражены клинические признаки кератоконуса и тяжелее патологический процесс, тем большие изменения выявляются при конфокальной микроскопии.
С помощью данного метода можно исследовать состояние трансплантата после операции сквозной пересадки роговицы. Изменения могут быть разнообразными и выраженными в различной степени. На рисунке 17 представлена картина передней стромы роговичного трансплантата: визуализируются кератоциты с нечеткими размытыми границами, выявляются участки стромы с пониженной прозрачностью, что может быть следствием дистрофического процесса с элементами отека. В различных слоях трансплантата могут определяться стромальные складки (рис.18).
На рисунке 19 представлен пример морфологической картины после операции кератомилеза. Можно отметить снижение прозрачности стромы роговицы, нарушение архитектоники волокнистых структур, очень малое количество кератоцитов, нечетко контурируемых. Яркие рефлектирующие точки являются включениями металлической пыли, которые образовались, по–видимому, в результате использования режущего инструмента низкого качества. При биомикроскопии в этом случае можно видеть световые блики. Кроме этого, можно выявить участки помутнения в области боуменовой мембраны, отек нервных волокон и другие изменения (рис. 20).
Герпетические поражения роговицы приводят к грубым структурным изменениям. На рисунке 21 представлены изменения роговицы после перенесенного герпетического кератита (при биомикроскопии выявляется облачковидное помутнение в эпителии и субэпителиальных слоях). Морфологические изменения характеризуются отсутствием различимых межклеточных границ, большим количеством рефлексирующих зон, что свидетельствует о появлении новых характеристик эпителиальной ткани, связанных с явлением кератинизации. Возможно, причиной является нейротрофический процесс, вызывающий понижение структурной и функциональной организации эпителия.
На рисунке 22 представлены изменения, характерные для тяжелого поражения эндотелия с формированием поверхности по типу шагреневой кожи при дистрофии Фукса.
Таким образом, можно утверждать, что конфокальная микроскопия является высокоинформативным неинвазивным методом исследования, позволяющим выявить тонкие изменения роговицы на клеточном и микроструктурном уровне, более полно изучить патогенетические механизмы при различных заболеваниях или хирургических вмешательствах.
Метод дает возможность детального изучения и визуализации всех роговичных структур. Дальнейшие исследования должны быть направлены на накопление материала и стандартизацию микроскопической картины роговицы в различных клинических ситуациях.
Публикации в СМИ
«Нетипичный» актиномикоз – микробиологические аспекты и клинические проявления
Одним их таких «двойных» агентов нормобиоты человека являются актиномицеты.
Они широко распространены в окружающей среде: в почве, воде, в том числе в водопроводной и ключевой, в горячих минеральных источниках, на растениях, на каменистых породах и даже в пустынях. В организме человека актиномицеты сапрофитируют на коже, в ротовой полости, зубном налете, лакунах миндалин, верхних дыхательных путях, бронхах, на слизистой оболочке желудочно-кишечного тракта, влагалища, анальных складок и т. д.
Термин актиномицеты (устаревшее название лучистые грибки) распространяется в настоящее время на широкий круг грамположительных аэробных и микроаэрофильных бактерий, обладающих способностью к формированию ветвящегося мицелия с характерным спороношением, атакже палочек неправильной формы и кокковидных элементов, которые образуются в результате фрагментации мицелия.
К актиномицетам относятся бактерии родов Actinomyces, Actinomadura, Bifidobacterium, Nocardia, Micromonospora, Rhodococcus, Streptomyces, Tsukamurella и др.
Переходу актиномицетов из сапрофитического в паразитическое состояние способствуют снижение иммунозащитных сил организма, наличие тяжелых инфекционных или соматических заболеваний (хронической пневмонии, гнойного гидраденита, диабета и т. д.), воспалительные заболевания слизистых оболочек полости рта, респираторного и желудочно-кишечного тракта, оперативные вмешательства, длительное применение внутриматочных контрацептивов, переохлаждение, травмы и др.
В таких случаях развивается актиномикоз — хроническое гнойное неконтагиозное заболевание, обусловленное формированием характерных синюшно-красных, а затем багровых инфильтратов плотной консистенции с множественными очагами флюктуации и свищами с гнойным отделяемым в мягких и костных тканях практически любых локализаций. Длительность инкубационного периода может колебаться от 2–3 недель до нескольких лет (от времени инфицирования до развития манифестных форм актиномикоза).
Ведущим в развитии актиномикоза является эндогенный способ, при котором возбудитель проникает в ткани из мест его сапрофитического обитания, чаще всего через пищеварительный тракт и полость рта (кариозные зубы, десневые карманы, крипты миндалин). Наиболее благоприятные условия для внедрения актиномицетов создаются в толстой кишке, вследствие застоя пищевых масс и большей вероятности травматизации стенки. При экзогенном способе возбудители проникают в организм из окружающей среды аэрогенно или при травматических повреждениях кожи и слизистых оболочек.
Распространение актиномицетов из первичного очага поражения происходит контактным путем по подкожной клетчатке и соединительнотканным прослойкам органов и тканей. Возможен также и гематогенный путь при прорыве актиномикотической гранулемы в кровеносный сосуд.
Основными возбудителями актиномикоза являются Actinomyces israelii, A. bovis, Streptomyces albus, Micromonospora monospora; нокардиоза («атипичного актиномикоза») и мицетомы — Nocardia asteroides, N. brasiliensis. Список выявляемых патогенных актиномицетов расширяется. В современной литературе все чаще описываются случаи актиномикоза, вызванного редкими видами: Actinomyces viscosus, A. graevenitzii, A. turicensis, A. radingae, A. meyeri, A. gerencseriae, Propionibacterium propionicum и др.
В возникновении и формировании актиномикотического процесса также существенную роль играют сопутствующие аэробные и анаэробные бактерии. Большинство случаев актиномикоза обусловлены полимикробной флорой. Обычно наряду с актиномицетами выделяют Staphylococcus spp., Streptococcus spp., Fusobacterium spp., Capnocytophaga spp., Bacteroides spp., представителей семейства Enterobacteriaceae и др. Присоединение гноеродных микроорганизмов обостряет течение актиномикоза, изменяет его клиническую картину, способствует распространению процесса.
Клиническая картина актиномикоза разнообразна, встречается во всех странах в практике врачей различных специальностей (стоматологов, хирургов, дерматологов, гинекологов и др.). Основные локализации — челюстно-лицевая (до 80%), торакальная, абдоминальная, параректальная, мицетома (мадурская стопа). Кроме того, актиномикотические поражения проявляются не только в классическом виде с характерной инфильтрацией тканей, абсцессами и свищами, но и в виде доминирующей патогенной флоры неспецифического воспалительного процесса, осложняющего течение основного заболевания.
Актиномицеты могут играть активную роль в этиологии хронического тонзиллита. Небные миндалины колонизируются актиномицетами при хроническом тонзиллите и в ассоциации с другими бактериями часто провоцируют воспалительные реакции. Вследствие стоматологических процедур может возникнуть актиномикотическая бактеримия полости рта. В 30% случаев от 80% выявленных бактеримий определяется актиномикотическая природа стоматита, этиологическими агентами которого являются сапрофиты ротовой полости — A. viscosus, A. odontolyticus и A. naeslundi. Присоединяясь к местной патогенной флоре, актиномицеты способствуют развитию длительно незаживающего воспалительного процесса при угревой сыпи, трофических язвах, гиперемиях, мацерациях и мокнутиях на коже. Обладая высокой степенью колонизации кишечника, они являются одним из основных агентов дисбактериоза. Обобщая все вышеизложенное, нужно отметить, что бактерии из обширной группы актиномицетов могут фигурировать как участники любых инфекционных и воспалительных проявлений организма человека от дерматита до эндокардита.
Таким образом, актиномикоз, отличающийся многообразием локализаций и клинических проявлений, нужно своевременно диагностировать и возможно эффективно лечить, зная закономерности патогенетического развития, предрасполагающих факторов инфицирования, характеристик возбудителей и методов лечения.
Однако диагностика и лечение заболеваний, связанных с участием актиномицетов, являются предметами единичных специализированных лабораторий и клиник в мире. Трудности в их дифференциальной диагностике служат препятствием широкой известности этих микроорганизмов в клинической практике.
Диагностика актиномикоза
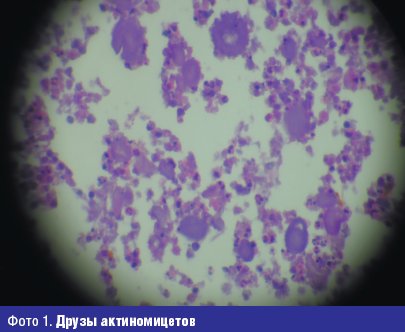
Достоверным признаком актиномикоза является обнаружение характерных актиномикотических друз в виде маленьких желтоватых зерен, напоминающих крупинки песка, в гное из свищей, в биоптатах пораженных тканей. В нативном (не окрашенном) и гистологических препаратах друзы хорошо видны на фоне гнойного детрита в виде лучистых образований с более плотным гомогенно-зернистым центром из тонкого, густо переплетенного мицелия (фото 1). За способность образовывать радиально расположенные нити мицелия, часто с «колбочками» на концах, актиномицеты и были названы в свое время «лучистыми грибами». Ведущее значение в образовании друз — тканевых колоний актиномицетов — имеет ответная реакция макроорганизма на антигены, секретируемые актиномицетами в окружающую среду. Друзообразование способствует замедлению диссеминации возбудителя в пораженном организме, а также локализации патологического процесса. Для актиномикоза характерны специфические тканевые реакции: гранулематозное продуктивное воспаление, лейкоцитарная инфильтрация, микроабсцессы, «ячеистая» структура тканей, специфическая гранулема, окруженная полинуклеарами, гигантскими и плазматическими клетками, лимфоцитами и гистиоцитами.
В организме больных друзы развиваются не на всех этапах заболевания и свойственны не каждой разновидности «лучистого гриба», поэтому их находят не всегда, и отсутствие друз на начальных этапах диагностики не отрицает актиномикоз. Кроме того, эти образования способны спонтанно лизироваться, обызвествляться, деформироваться, кальцинироваться и подвергаться другим дегенеративным изменениям.
Друзы не образуются при нокардиозе. В тканях Nocardia обнаруживается в виде тонких нитей мицелия 0,5–0,8 мкм и палочковидных форм такой же толщины. Благодаря своей кислотоустойчивости Nocardia хорошо окрашивается по Граму–Вейгерту в синий цвет и по Цилю–Нильсену — в красный: все это позволяет проводить дифференциальную диагностику между актиномикозом и нокардиозом, т. к. это диктуется различием методов лечения при этих болезнях.
Важное значение для верификации актиномикоза любых локализаций имеет микробиологическое исследование, которое включает микроскопию и посев патологического материала на питательные среды. Оптимальная температура для роста 35–37°С.
При микроскопии клинического материала и выросших культур, окрашенных по Граму или метиленовой синькой, актиномицеты выглядят как ветвистые нити длиной 10–50 мкм или представлены полиморфными короткими палочками 0,2–1,0×2–5 мкм, часто с булавовидными концами, одиночные, в парах V- и Y-образной конфигураций и в стопках. Грамположительные, но часто окрашивание не типичное, в виде четок.
Многие аэробные актиномицеты хорошо растут на обычных бактериологических средах — мясо-пептонном, триптиказо-соевом, кровяном и сердечно-мозговом агарах. Для выявления микроаэрофильных видов используют тиогликолевую среду. Культуральные признаки актиномицетов весьма разнообразны. На плотных агаровых средах колонии по размерам напоминают бактериальные — диаметром 0,3–0,5 мм. Поверхность колоний может быть плоской, гладкой, бугристой, складчатой, зернистой или мучнистой. Консистенция тестовидная, крошковатая или кожистая. Многие актиномицеты образуют пигменты, придающие колониям самые различные оттенки: сероватые, синеватые, оранжевые, малиновые, зеленоватые, коричневые, черновато-фиолетовые и др.
Клинические аэробные изоляты, например Nocardia asteroids и Streptomyces somaliensis, на богатой питательной среде дают так называемый атипичный рост — плотные кожистые колонии, обычно не опушенные столь типичным для штаммов воздушным мицелием и без спороношения. Для проявления дифференцировки, образования характерных спор и пигментов требуются специальные среды: с коллоидным хитином, почвенным экстрактом или отварами растительных материалов.
В жидкой питательной среде чистые культуры микроаэрофильных актиномицетов образуют взвешенные в субстрате беловатые «комочки». Среда остается прозрачной. При бактериальных примесях — среда мутная, гомогенная.
Описание клинических случаев «нетипичного» актиномикоза
За период 2007 года под нашим наблюдением находилось 25 больных с различными клиническими формами актиномикоза. Среди обследованных пациентов было 12 женщин и 13 мужчин (в возрасте 15–25 лет — 4 человека, 26–35 лет — 4 человека, 36–45 — 2, 46–55 — 5 человек и 56–66 лет — 10 человек).
Помимо «классического» актиномикоза челюстно-лицевой, подмышечной и паховой областей в свищевой стадии нами были диагностированы актиномикотические осложнения различных патологических процессов. Так, например, актиномицеты обнаруживались в вагинальном отделяемом у больной с неспецифическим кольпитом и вульвовагинитом, что серьезно утяжеляло течение основного заболевания, требовало проведения неоднократного курса противовоспалительной терапии. Актиномицеты в диагностически значимом количестве были выявлены при воспалительных процессах в полости рта (в соскобах с зева, миндалин, языка), при отомикозе, при длительно незаживающих мацерациях и гиперемии кожи в перианальной области, со слизистых оболочек ампулы прямой кишки. Присоединение актиномицетов к гноеродной микробиоте трофических язв значительно утяжеляло течение заболевания, осложняло процесс лечения таких больных, замедляя регрессию очагов поражения. У пациентов с угревой болезнью при вскрытии очагов воспаления в себуме нередко обнаруживались актиномицеты, присутствие которых способствовало развитию затяжного течения заболевания.
Под нашим наблюдением находилась больная К., 43 лет с редким случаем первичного актиномикоза кожи мягких тканей паховых областей, свищевая форма.
Больна в течение 1 года, когда появились изменения в паховой области слева вследствие постоянного натирания кожи неудобным нижним бельем. К врачам не обращалась. Ухудшение в декабре 2007 г., когда появились 2 язвы, свищи с гнойным отделяемым. Консультирована дерматологом, который заподозрил неопластический процесс. Обследована онкологом, паразитологом. Диагноз онкологического или паразитарного заболевания установить не удалось. Направлена к микологу с подозрением на глубокий микоз. При осмотре: очаг поражения расположен в левой паховой области размером около 1,7×5 см, функционируют 2 свища со скудным гнойным и сукровичным отделяемым. Больная обследована в микологической лаборатории института им. Е. И. Марциновского ММА им. И. М. Сеченова на актиномикоз и бактериальную инфекцию. В исследуемом патологическом материале при микроскопии препаратов обнаружены актиномицеты, палочки, кокки, лептотрихии. При посеве гнойного отделяемого из свищей на питательные среды получен рост актиномицетов и кокковой флоры.
Диагноз актиномикоза кожи и мягких тканей верифицирован. Больная проходит наблюдение и лечение у миколога.
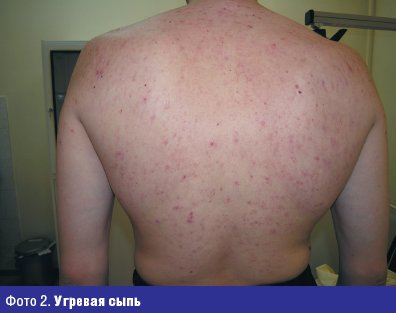
Больной Н., 24 лет с диагнозом угревая болезнь, актиномикоз (фото 2).
Жалобы на высыпания на коже туловища с детства. Достоверно можно говорить о давности заболевания 10 лет, когда в 14-летнем возрасте был установлен диагноз угревая болезнь. Больной лечился наружными средствами и антибиотиками различных групп с временным эффектом. Общее состояние в настоящее время осложнилось хроническим гастритом. При осмотре: кожа туловища, лица, спины поражены воспалительными элементами (папуло-пустулезная сыпь, открытые и закрытые комедоны), в некоторых местах сливного характера, инфильтрация кожи и мягких тканей. При микроскопическом исследовании себума из элементов угревой сыпи у больного обнаружены кокки и единичные палочки. В посеве из исследуемого материала в условиях микологической лаборатории (фото 3).
Диагноз: угревая болезнь, актиномикоз лица, туловища, спины кожи и мягких тканей вторичного характера, инфильтративная форма в стадии умеренно выраженного обострения. В настоящее время больному проводится лечение микологом в поликлинике института им. Е. И. Марциновского ММА им. И. М. Сеченова.
Лечение
Лечение больных актиномикозом проводится комплексное в различных сочетаниях в зависимости от локализации и клинических проявлений — препаратами йода, антибиотиками, иммунокоррегирующими и общеукрепляющими средствами, актинолизатом, проводят местное лечение мазями, физиотерапевтическими процедурами и хирургическим вмешательством.
Йодистые препараты (до 3 г йодистого калия в день), ранее доминирующие в терапии актиномикоза, в настоящее время могут применяться в комбинации с антибиотиками или рентгенотерапией, как дополнительное средство для размягчения и рассасывания инфильтрата.
Ведущее место в лечении актиномикоза занимают антибиотики. Наиболее часто используются антибактериальные препараты из группы тетрациклинов, пенициллинов, карбопенемов, линкозаминов, аминогликозидов, цефалоспоринов, действующими веществами которых являются гентамицин, амикацин, тобрамицин, линкомицин, левофлоксацин, цефаклор, цефалексин. Хорошо себя зарекомендовали препараты «Панклав», «Флемоксин Солютаб», «Юнидокс Солютаб» и др. Необходим длительный курс антимикробной терапии (от 6 месяцев до 1 года) и высокие дозы препаратов. Традиционная терапия актиномикоза включает внутривенное введение пенициллина в дозе 18–24 миллионов ЕД ежедневно в течение 2–6 недель, с последующим пероральным приемом пенициллина, амоксициллина или ампициллина в течение 6–12 месяцев. В более легких случаях, в частности при шейно-челюстно-лицевом актиномикозе, достаточно менее интенсивного лечения короткими курсами антибактериальной терапии. Имеется опыт эффективного краткосрочного лечения актиномикоза имипенемом в течение 6–10 недель и цефтриаксоном ежедневно в течение 3 недель. Антимикробную терапию продолжают некоторое время после исчезновения симптоматики для предотвращения рецидива.
При лечении актиномикоза также необходимо учитывать присоединяющуюся патогенную микрофлору, которая может проявлять повышенную резистентность к антибиотикам, что объясняется длительным предшествующим применением различных химиопрепаратов. С целью воздействия на сопутствующую флору используют метронидазол (Метрогил, Трихопол, Эфлоран) и клиндамицин (Далацин, Климицин). Хороший противовоспалительный эффект показывает применение сульфаниламидных препаратов (ко-тримоксазол, сульфадиметоксин, сульфакарбамид). При присоединении микотической инфекции назначают противогрибковые препараты: флуконазол, итраконазол, тербинафин, кетоконазол и др.
Иммунокоррегирующие средства. Для коррекции иммунодефицита показан Диуцифон внутрь — по 0,1 г 3 раза в день или внутримышечно в виде 5%-го раствора по 5 мл через день в течение 3–4 недель. По нашему мнению, также хорошо зарекомендовал себя иммунокоррегирующий препарат «Циклоферон» — 2 мл внутримышечно через день, 10 дней.
Общеукрепляющая терапия стимулирует реактивность организма и повышает эффективность иммунотерапии. Дезинтоксикационная терапия проводится внутривенными растворами Гемодеза, 5% раствором глюкозы и др. С целью активации регенерации применяется аутогемотерапия — еженедельно, всего на курс 3–4 переливания. Витамины назначают в среднетерапевтических дозах.
Иммунотерапия Актинолизатом способствует накоплению специфических иммунных тел и улучшает результаты лечения, позволяя снизить объем антибактериальных средств и избежать нежелательных побочных воздействий. Актинолизат вводят внутримышечно 2 раза в неделю по 3 мл, на курс 25 инъекций, курсы повторяют 2–3 раза с интервалом в 1 месяц.
В качестве местной терапии показано мазевое лечение с антибактериальными препаратами указанных групп, промывание свищей растворами антисептиков, препаратами фуранового типа, введение 1%, 2%, 5% спиртового раствора йода, которые способствуют очищению актиномикозных очагов и ликвидации воспалительных явлений.
Физиотерапевтические процедуры. В стадии формирования очага проводят электрофорез кальция хлорида и Димедрола. После вскрытия очагов при остаточных инфильтратах назначают электрофорез йода, Лидазы, флюкторизацию. Ультразвук применяется непосредственно на область очага поражения по общепринятой схеме в течение 12–25 дней (в зависимости от состояния больного и очага поражения) с интервалами в 3–4 месяца.
Хирургическое лечение проводится на фоне консервативной терапии и заключается в радикальном иссечении очагов поражения в пределах видимо здоровых тканей. При невозможности проведения радикальной операции (например, при шейно-челюстно-лицевом актиномикозе) показано вскрытие и дренирование очагов абсцесса.
Код вставки на сайт
«Нетипичный» актиномикоз – микробиологические аспекты и клинические проявления
Одним их таких «двойных» агентов нормобиоты человека являются актиномицеты.
Они широко распространены в окружающей среде: в почве, воде, в том числе в водопроводной и ключевой, в горячих минеральных источниках, на растениях, на каменистых породах и даже в пустынях. В организме человека актиномицеты сапрофитируют на коже, в ротовой полости, зубном налете, лакунах миндалин, верхних дыхательных путях, бронхах, на слизистой оболочке желудочно-кишечного тракта, влагалища, анальных складок и т. д.
Термин актиномицеты (устаревшее название лучистые грибки) распространяется в настоящее время на широкий круг грамположительных аэробных и микроаэрофильных бактерий, обладающих способностью к формированию ветвящегося мицелия с характерным спороношением, атакже палочек неправильной формы и кокковидных элементов, которые образуются в результате фрагментации мицелия.
К актиномицетам относятся бактерии родов Actinomyces, Actinomadura, Bifidobacterium, Nocardia, Micromonospora, Rhodococcus, Streptomyces, Tsukamurella и др.
Переходу актиномицетов из сапрофитического в паразитическое состояние способствуют снижение иммунозащитных сил организма, наличие тяжелых инфекционных или соматических заболеваний (хронической пневмонии, гнойного гидраденита, диабета и т. д.), воспалительные заболевания слизистых оболочек полости рта, респираторного и желудочно-кишечного тракта, оперативные вмешательства, длительное применение внутриматочных контрацептивов, переохлаждение, травмы и др.
В таких случаях развивается актиномикоз — хроническое гнойное неконтагиозное заболевание, обусловленное формированием характерных синюшно-красных, а затем багровых инфильтратов плотной консистенции с множественными очагами флюктуации и свищами с гнойным отделяемым в мягких и костных тканях практически любых локализаций. Длительность инкубационного периода может колебаться от 2–3 недель до нескольких лет (от времени инфицирования до развития манифестных форм актиномикоза).
Ведущим в развитии актиномикоза является эндогенный способ, при котором возбудитель проникает в ткани из мест его сапрофитического обитания, чаще всего через пищеварительный тракт и полость рта (кариозные зубы, десневые карманы, крипты миндалин). Наиболее благоприятные условия для внедрения актиномицетов создаются в толстой кишке, вследствие застоя пищевых масс и большей вероятности травматизации стенки. При экзогенном способе возбудители проникают в организм из окружающей среды аэрогенно или при травматических повреждениях кожи и слизистых оболочек.
Распространение актиномицетов из первичного очага поражения происходит контактным путем по подкожной клетчатке и соединительнотканным прослойкам органов и тканей. Возможен также и гематогенный путь при прорыве актиномикотической гранулемы в кровеносный сосуд.
Основными возбудителями актиномикоза являются Actinomyces israelii, A. bovis, Streptomyces albus, Micromonospora monospora; нокардиоза («атипичного актиномикоза») и мицетомы — Nocardia asteroides, N. brasiliensis. Список выявляемых патогенных актиномицетов расширяется. В современной литературе все чаще описываются случаи актиномикоза, вызванного редкими видами: Actinomyces viscosus, A. graevenitzii, A. turicensis, A. radingae, A. meyeri, A. gerencseriae, Propionibacterium propionicum и др.
В возникновении и формировании актиномикотического процесса также существенную роль играют сопутствующие аэробные и анаэробные бактерии. Большинство случаев актиномикоза обусловлены полимикробной флорой. Обычно наряду с актиномицетами выделяют Staphylococcus spp., Streptococcus spp., Fusobacterium spp., Capnocytophaga spp., Bacteroides spp., представителей семейства Enterobacteriaceae и др. Присоединение гноеродных микроорганизмов обостряет течение актиномикоза, изменяет его клиническую картину, способствует распространению процесса.
Клиническая картина актиномикоза разнообразна, встречается во всех странах в практике врачей различных специальностей (стоматологов, хирургов, дерматологов, гинекологов и др.). Основные локализации — челюстно-лицевая (до 80%), торакальная, абдоминальная, параректальная, мицетома (мадурская стопа). Кроме того, актиномикотические поражения проявляются не только в классическом виде с характерной инфильтрацией тканей, абсцессами и свищами, но и в виде доминирующей патогенной флоры неспецифического воспалительного процесса, осложняющего течение основного заболевания.
Актиномицеты могут играть активную роль в этиологии хронического тонзиллита. Небные миндалины колонизируются актиномицетами при хроническом тонзиллите и в ассоциации с другими бактериями часто провоцируют воспалительные реакции. Вследствие стоматологических процедур может возникнуть актиномикотическая бактеримия полости рта. В 30% случаев от 80% выявленных бактеримий определяется актиномикотическая природа стоматита, этиологическими агентами которого являются сапрофиты ротовой полости — A. viscosus, A. odontolyticus и A. naeslundi. Присоединяясь к местной патогенной флоре, актиномицеты способствуют развитию длительно незаживающего воспалительного процесса при угревой сыпи, трофических язвах, гиперемиях, мацерациях и мокнутиях на коже. Обладая высокой степенью колонизации кишечника, они являются одним из основных агентов дисбактериоза. Обобщая все вышеизложенное, нужно отметить, что бактерии из обширной группы актиномицетов могут фигурировать как участники любых инфекционных и воспалительных проявлений организма человека от дерматита до эндокардита.
Таким образом, актиномикоз, отличающийся многообразием локализаций и клинических проявлений, нужно своевременно диагностировать и возможно эффективно лечить, зная закономерности патогенетического развития, предрасполагающих факторов инфицирования, характеристик возбудителей и методов лечения.
Однако диагностика и лечение заболеваний, связанных с участием актиномицетов, являются предметами единичных специализированных лабораторий и клиник в мире. Трудности в их дифференциальной диагностике служат препятствием широкой известности этих микроорганизмов в клинической практике.
Диагностика актиномикоза
Достоверным признаком актиномикоза является обнаружение характерных актиномикотических друз в виде маленьких желтоватых зерен, напоминающих крупинки песка, в гное из свищей, в биоптатах пораженных тканей. В нативном (не окрашенном) и гистологических препаратах друзы хорошо видны на фоне гнойного детрита в виде лучистых образований с более плотным гомогенно-зернистым центром из тонкого, густо переплетенного мицелия (фото 1). За способность образовывать радиально расположенные нити мицелия, часто с «колбочками» на концах, актиномицеты и были названы в свое время «лучистыми грибами». Ведущее значение в образовании друз — тканевых колоний актиномицетов — имеет ответная реакция макроорганизма на антигены, секретируемые актиномицетами в окружающую среду. Друзообразование способствует замедлению диссеминации возбудителя в пораженном организме, а также локализации патологического процесса. Для актиномикоза характерны специфические тканевые реакции: гранулематозное продуктивное воспаление, лейкоцитарная инфильтрация, микроабсцессы, «ячеистая» структура тканей, специфическая гранулема, окруженная полинуклеарами, гигантскими и плазматическими клетками, лимфоцитами и гистиоцитами.
В организме больных друзы развиваются не на всех этапах заболевания и свойственны не каждой разновидности «лучистого гриба», поэтому их находят не всегда, и отсутствие друз на начальных этапах диагностики не отрицает актиномикоз. Кроме того, эти образования способны спонтанно лизироваться, обызвествляться, деформироваться, кальцинироваться и подвергаться другим дегенеративным изменениям.
Друзы не образуются при нокардиозе. В тканях Nocardia обнаруживается в виде тонких нитей мицелия 0,5–0,8 мкм и палочковидных форм такой же толщины. Благодаря своей кислотоустойчивости Nocardia хорошо окрашивается по Граму–Вейгерту в синий цвет и по Цилю–Нильсену — в красный: все это позволяет проводить дифференциальную диагностику между актиномикозом и нокардиозом, т. к. это диктуется различием методов лечения при этих болезнях.
Важное значение для верификации актиномикоза любых локализаций имеет микробиологическое исследование, которое включает микроскопию и посев патологического материала на питательные среды. Оптимальная температура для роста 35–37°С.
При микроскопии клинического материала и выросших культур, окрашенных по Граму или метиленовой синькой, актиномицеты выглядят как ветвистые нити длиной 10–50 мкм или представлены полиморфными короткими палочками 0,2–1,0×2–5 мкм, часто с булавовидными концами, одиночные, в парах V- и Y-образной конфигураций и в стопках. Грамположительные, но часто окрашивание не типичное, в виде четок.
Многие аэробные актиномицеты хорошо растут на обычных бактериологических средах — мясо-пептонном, триптиказо-соевом, кровяном и сердечно-мозговом агарах. Для выявления микроаэрофильных видов используют тиогликолевую среду. Культуральные признаки актиномицетов весьма разнообразны. На плотных агаровых средах колонии по размерам напоминают бактериальные — диаметром 0,3–0,5 мм. Поверхность колоний может быть плоской, гладкой, бугристой, складчатой, зернистой или мучнистой. Консистенция тестовидная, крошковатая или кожистая. Многие актиномицеты образуют пигменты, придающие колониям самые различные оттенки: сероватые, синеватые, оранжевые, малиновые, зеленоватые, коричневые, черновато-фиолетовые и др.
Клинические аэробные изоляты, например Nocardia asteroids и Streptomyces somaliensis, на богатой питательной среде дают так называемый атипичный рост — плотные кожистые колонии, обычно не опушенные столь типичным для штаммов воздушным мицелием и без спороношения. Для проявления дифференцировки, образования характерных спор и пигментов требуются специальные среды: с коллоидным хитином, почвенным экстрактом или отварами растительных материалов.
В жидкой питательной среде чистые культуры микроаэрофильных актиномицетов образуют взвешенные в субстрате беловатые «комочки». Среда остается прозрачной. При бактериальных примесях — среда мутная, гомогенная.
Описание клинических случаев «нетипичного» актиномикоза
За период 2007 года под нашим наблюдением находилось 25 больных с различными клиническими формами актиномикоза. Среди обследованных пациентов было 12 женщин и 13 мужчин (в возрасте 15–25 лет — 4 человека, 26–35 лет — 4 человека, 36–45 — 2, 46–55 — 5 человек и 56–66 лет — 10 человек).
Помимо «классического» актиномикоза челюстно-лицевой, подмышечной и паховой областей в свищевой стадии нами были диагностированы актиномикотические осложнения различных патологических процессов. Так, например, актиномицеты обнаруживались в вагинальном отделяемом у больной с неспецифическим кольпитом и вульвовагинитом, что серьезно утяжеляло течение основного заболевания, требовало проведения неоднократного курса противовоспалительной терапии. Актиномицеты в диагностически значимом количестве были выявлены при воспалительных процессах в полости рта (в соскобах с зева, миндалин, языка), при отомикозе, при длительно незаживающих мацерациях и гиперемии кожи в перианальной области, со слизистых оболочек ампулы прямой кишки. Присоединение актиномицетов к гноеродной микробиоте трофических язв значительно утяжеляло течение заболевания, осложняло процесс лечения таких больных, замедляя регрессию очагов поражения. У пациентов с угревой болезнью при вскрытии очагов воспаления в себуме нередко обнаруживались актиномицеты, присутствие которых способствовало развитию затяжного течения заболевания.
Под нашим наблюдением находилась больная К., 43 лет с редким случаем первичного актиномикоза кожи мягких тканей паховых областей, свищевая форма.
Больна в течение 1 года, когда появились изменения в паховой области слева вследствие постоянного натирания кожи неудобным нижним бельем. К врачам не обращалась. Ухудшение в декабре 2007 г., когда появились 2 язвы, свищи с гнойным отделяемым. Консультирована дерматологом, который заподозрил неопластический процесс. Обследована онкологом, паразитологом. Диагноз онкологического или паразитарного заболевания установить не удалось. Направлена к микологу с подозрением на глубокий микоз. При осмотре: очаг поражения расположен в левой паховой области размером около 1,7×5 см, функционируют 2 свища со скудным гнойным и сукровичным отделяемым. Больная обследована в микологической лаборатории института им. Е. И. Марциновского ММА им. И. М. Сеченова на актиномикоз и бактериальную инфекцию. В исследуемом патологическом материале при микроскопии препаратов обнаружены актиномицеты, палочки, кокки, лептотрихии. При посеве гнойного отделяемого из свищей на питательные среды получен рост актиномицетов и кокковой флоры.
Диагноз актиномикоза кожи и мягких тканей верифицирован. Больная проходит наблюдение и лечение у миколога.
Больной Н., 24 лет с диагнозом угревая болезнь, актиномикоз (фото 2).
Жалобы на высыпания на коже туловища с детства. Достоверно можно говорить о давности заболевания 10 лет, когда в 14-летнем возрасте был установлен диагноз угревая болезнь. Больной лечился наружными средствами и антибиотиками различных групп с временным эффектом. Общее состояние в настоящее время осложнилось хроническим гастритом. При осмотре: кожа туловища, лица, спины поражены воспалительными элементами (папуло-пустулезная сыпь, открытые и закрытые комедоны), в некоторых местах сливного характера, инфильтрация кожи и мягких тканей. При микроскопическом исследовании себума из элементов угревой сыпи у больного обнаружены кокки и единичные палочки. В посеве из исследуемого материала в условиях микологической лаборатории (фото 3).
Диагноз: угревая болезнь, актиномикоз лица, туловища, спины кожи и мягких тканей вторичного характера, инфильтративная форма в стадии умеренно выраженного обострения. В настоящее время больному проводится лечение микологом в поликлинике института им. Е. И. Марциновского ММА им. И. М. Сеченова.
Лечение
Лечение больных актиномикозом проводится комплексное в различных сочетаниях в зависимости от локализации и клинических проявлений — препаратами йода, антибиотиками, иммунокоррегирующими и общеукрепляющими средствами, актинолизатом, проводят местное лечение мазями, физиотерапевтическими процедурами и хирургическим вмешательством.
Йодистые препараты (до 3 г йодистого калия в день), ранее доминирующие в терапии актиномикоза, в настоящее время могут применяться в комбинации с антибиотиками или рентгенотерапией, как дополнительное средство для размягчения и рассасывания инфильтрата.
Ведущее место в лечении актиномикоза занимают антибиотики. Наиболее часто используются антибактериальные препараты из группы тетрациклинов, пенициллинов, карбопенемов, линкозаминов, аминогликозидов, цефалоспоринов, действующими веществами которых являются гентамицин, амикацин, тобрамицин, линкомицин, левофлоксацин, цефаклор, цефалексин. Хорошо себя зарекомендовали препараты «Панклав», «Флемоксин Солютаб», «Юнидокс Солютаб» и др. Необходим длительный курс антимикробной терапии (от 6 месяцев до 1 года) и высокие дозы препаратов. Традиционная терапия актиномикоза включает внутривенное введение пенициллина в дозе 18–24 миллионов ЕД ежедневно в течение 2–6 недель, с последующим пероральным приемом пенициллина, амоксициллина или ампициллина в течение 6–12 месяцев. В более легких случаях, в частности при шейно-челюстно-лицевом актиномикозе, достаточно менее интенсивного лечения короткими курсами антибактериальной терапии. Имеется опыт эффективного краткосрочного лечения актиномикоза имипенемом в течение 6–10 недель и цефтриаксоном ежедневно в течение 3 недель. Антимикробную терапию продолжают некоторое время после исчезновения симптоматики для предотвращения рецидива.
При лечении актиномикоза также необходимо учитывать присоединяющуюся патогенную микрофлору, которая может проявлять повышенную резистентность к антибиотикам, что объясняется длительным предшествующим применением различных химиопрепаратов. С целью воздействия на сопутствующую флору используют метронидазол (Метрогил, Трихопол, Эфлоран) и клиндамицин (Далацин, Климицин). Хороший противовоспалительный эффект показывает применение сульфаниламидных препаратов (ко-тримоксазол, сульфадиметоксин, сульфакарбамид). При присоединении микотической инфекции назначают противогрибковые препараты: флуконазол, итраконазол, тербинафин, кетоконазол и др.
Иммунокоррегирующие средства. Для коррекции иммунодефицита показан Диуцифон внутрь — по 0,1 г 3 раза в день или внутримышечно в виде 5%-го раствора по 5 мл через день в течение 3–4 недель. По нашему мнению, также хорошо зарекомендовал себя иммунокоррегирующий препарат «Циклоферон» — 2 мл внутримышечно через день, 10 дней.
Общеукрепляющая терапия стимулирует реактивность организма и повышает эффективность иммунотерапии. Дезинтоксикационная терапия проводится внутривенными растворами Гемодеза, 5% раствором глюкозы и др. С целью активации регенерации применяется аутогемотерапия — еженедельно, всего на курс 3–4 переливания. Витамины назначают в среднетерапевтических дозах.
Иммунотерапия Актинолизатом способствует накоплению специфических иммунных тел и улучшает результаты лечения, позволяя снизить объем антибактериальных средств и избежать нежелательных побочных воздействий. Актинолизат вводят внутримышечно 2 раза в неделю по 3 мл, на курс 25 инъекций, курсы повторяют 2–3 раза с интервалом в 1 месяц.
В качестве местной терапии показано мазевое лечение с антибактериальными препаратами указанных групп, промывание свищей растворами антисептиков, препаратами фуранового типа, введение 1%, 2%, 5% спиртового раствора йода, которые способствуют очищению актиномикозных очагов и ликвидации воспалительных явлений.
Физиотерапевтические процедуры. В стадии формирования очага проводят электрофорез кальция хлорида и Димедрола. После вскрытия очагов при остаточных инфильтратах назначают электрофорез йода, Лидазы, флюкторизацию. Ультразвук применяется непосредственно на область очага поражения по общепринятой схеме в течение 12–25 дней (в зависимости от состояния больного и очага поражения) с интервалами в 3–4 месяца.
Хирургическое лечение проводится на фоне консервативной терапии и заключается в радикальном иссечении очагов поражения в пределах видимо здоровых тканей. При невозможности проведения радикальной операции (например, при шейно-челюстно-лицевом актиномикозе) показано вскрытие и дренирование очагов абсцесса.