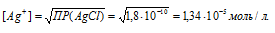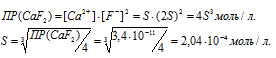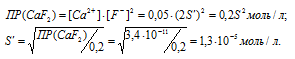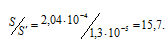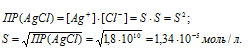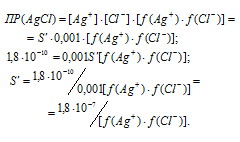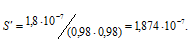Концентрация кислоты во втором растворе в 6 раз меньше чем в первом
Расчет концентрации ионов металла в насыщенном растворе
0,03/(1,34 . 10-5) = 2239.
Ответ: в 2239 раз.
Задача 572.
Вычислить растворимость (в моль/л) CaF2 в воде и в 0,05 М растворе CaCl2. Во сколько раз растворимость во втором случае меньше, чем в первом?
Решение:
а) Вычисление растворимости соли CaF2 в воде
б) Вычисление растворимости соли CaF2 в 0,05 М растворе CaCl2
Находим растворимость соли CaF2 в 0,05М раствора CaCl2, обозначив её через S’. Концентрация ионов F- в насыщенном растворе будет равна 2S’, а концентрация ионов Ca 2+ составит (S’ + 0,05) Поскольку S’ 2+ ] = 0,05 моль/л. Тогда можно записать:
Находим, во сколько раз растворимость соли CaF2 уменьшилась в присутствии 0,05М раствора CaCl2:
Выразим произведение растворимости соли AgCl через активности ионов:
Для нахождения значений коэффициентов активностей ионов нужно вычислить значение ионной силы раствора сильного электролита NaCl:
Согласно табличным данным при ионной силе раствора равной 0,001 коэффициенты активностей однозарядных ионов равны 0,98.
Рассчитаем, во сколько раз S’ меньше, чем S:
Задачи на атомистику
Задачи на атомистику — это задачи на соотношения частиц (атомов, молекул, ионов и т.д.) в гомогенных и гетерогенных системах (растворах, твердых и газообразных смесях). Это могут быть массовые соотношения (например, массовая доля элемента в смеси), мольные соотношения (например, соотношение числа атомов водорода и кислорода или мольная доля), объемные соотношения (объемная доля и др.).
Ниже я выкладываю задачи на атомистику из реального ЕГЭ по химии 16 июля 2020 года.
Для решения задач на атомистику используются довольно простые идеи. Во-первых, понятие массовой доли. Во-вторых, умение выражать число атомов через число молекул или других структурных единиц.
1 молекула SO3 — 1 атом серы, 3 атома кислорода
Несложно пропорцией определить, что на две молекулы триоксида серы будет приходиться два атома серы и шесть атомов кислорода:
2 молекулы SO3 — 2 атома S, 6 атомов О
На 20 молекул триоксида:
20 молекул SO3 — 20 атомов S, 60 атомов О
А вот сколько атомов приходится на х молекуле триоксида? Это также легко определить через пропорцию:
х молекул SO3 — х атомов S, 3х атомов О
Иначе говоря, количество атомов кислорода в молекуле SO3 в три раза больше, чем количество молекул. А количество атомов серы равно количеству молекул триоксида серы. Это простая, но не всегда очевидная идея. То есть индексы в формуле вещества показывают не только, как соотносится количество атомов между собой, но и какое число атомов приходится на 1 молекулу или другую структурную единицу вещества.
Если так соотносится число атомов и молекул, то также будет соотноситься и количество вещества атомов и молекул, выраженное в молях. Потому что 1 моль — это не что иное, как порция, состоящая из одинакового числа данных частиц.
То есть на х моль триоксида серы приходится:
х моль SO3 — х моль атомов S, 3х моль атомов О
Представьте себе, что атомы — это элементы изделия, а молекула состоит из некоторого числа таких деталей. Таким образом, число деталей разного типа всегда больше или равно числа изделий. Получается, в молекуле число атомов всегда больше или равно, чем количество молекул.
И наоборот, число молекуле триоксида серы в 3 раза меньше, чем число атомов кислорода в составе SO3. И число молекул равно количеству атомов серы.
Молярное соотношение — это отношение количества одного вещества к количеству другого вещества.
n(NaCl)/ n(H2O) = 1/20 = 0,5
Молярное соотношение можно задавать отдельным числом, а можно соотношением:
n(NaCl) : n(H2O) = 1:20
А вот выражать молярное соотношение через проценты нельзя. Это безразмерная величина.
Научиться решать задачи на атомистику не очень сложно. В ЕГЭ по химии атомистика станет, скорее всего, лишь частью более сложной комплексной задачи 34. Но я бы рекомендовал не пытаться сразу решать задачи на атомистику уровня ЕГЭ по химии. Занимаясь в спортзале, вы же не пытаетесь на первой тренировке поднять сразу тяжелую штангу. Точнее, попытаться вы можете, но последствия будут плачевными.
Для начала сделайте разминку возьмите простые задачи, чтобы освоить основные приемы и понять логику решения таких заданий. А после легких задач можно постепенно перейти к более сложным. Именно в таком порядке и расположены задачи в данной подборке «Атомистика», которые позволяют понять, как именно удобно работать с такими заданиями.
Публикую подборку задач, в которых используются идеи атомистики. Все задачи взяты из сборника С.А. Пузакова, В.А. Попкова «Пособие по химии. Вопросы. Упражнения. Задачи». В скобках я привожу нумерацию этих задач в задачнике.
1. (66) В смеси оксида меди (I) и оксида меди (II) на 4 атома меди приходится 3 атома кислорода. Вычислите массовые доли веществ в такой смеси.
Пусть n (количество вещества) (Cu2O) = х моль, n(CuO) = y моль, тогда:
количество вещества атомов меди в первом оксиде n1(Cu) = 2х моль, во втором оксиде: n2(Cu) = у моль
количество вещества атомов кислорода в первом оксиде n1(О) = х моль, во втором оксиде: n2(О) = у моль
общее количество вещества атомов меди: n(Cu) = (2x + y) моль, атомов кислорода: n(O) = (x + y) моль.
По условию задачи их отношение равно как 4 : 3, т. е. (2x + y) / (x + y) = 4 / 3.
Преобразуем приведённое выше равенство, получаем y = 2x.
Выразим через х массы соединений:
m(CuO) = n(CuO) * M(CuO) = 80 * у = 80 * 2x = (160x) г
Масса смеси двух оксидов будет равна:
m(смеси) = (144x + 160x) г = (304x) г
Теперь рассчитываем массовую долю оксидов в смеси:
ω(Cu2O) = m(Cu2O) / m(смеси) = 144x / 304x = 0.4737 (47.37%)
ω(CuO) = m(CuO) / m(смеси) = 160x / 304x = 0.5263 (52.63%)
Ответ: ω(CuO) = 52,6%, ω(Cu2O) = 47,4%
2. (67) В смеси двух хлоридов железа на 5 атомов железа приходится 13 атомов хлора. Вычислите массовые доли веществ в такой смеси.
Железо образует два устойчивых хлорида: FeCl2 и FeCl3.
Пусть n(FeCl2) = х моль, n(FeCl3) = y моль, тогда:
количество вещества атомов железа в первом хлориде n1(Fe) = х моль, во втором хлориде: n2(Fe) = у моль,
количество вещества атомов хлора в первом хлориде n1(Cl) = 2х моль, во втором хлориде: n2(Сl) = 3у моль,
общее количество вещества атомов железа: n(Fe) = (x + y) моль, атомов хлора: n(Cl) = (2x + 3y) моль.
По условию задачи их отношение равно как 5 : 13, т. е. (x + y) / (2x + 3y) = 5 / 13.
Преобразуя приведённое выше равенство, получаем y = 1,5x.
Выразим через х массы соединений:
m(FeCl3) = n(FeCl3) * M(FeCl3) = 162,5 * у = 162,5 * 1,5x = (243,75x) г
Масса смеси двух хлоридов будет равна:
m(смеси) = (127x + 243,75x) г = (370,75x) г
Теперь рассчитываем массовую долю хлоридов в смеси:
ω(FeCl2) = m(FeCl2) / m(смеси) = 127x / 370,75x = 0,343 (34,3%)
ω(FeCl3) = m(FeCl3) / m(смеси) = 243,75x / 370,75x = 0,657 (65,7%)
Ответ: ω(FeCl2) = 34,3%, ω(FeCl3) = 65,7%
3. (70) В каком молярном соотношении были смешаны карбид кальция и карбонат кальция, если массовая доля углерода в полученной смеси равна 25%?
Формулы карбида и карбоната кальция: CaC2 и CaCO3.
Пусть n(CaC2) = х моль, n(CaCO3) = y моль, тогда:
количество вещества атомов углерода в карбиде кальция n1(С) = 2х моль, в карбонате: n2(С) = у моль,
общее количество вещества атомов углерода: n(С) = (2x + y) моль.
масса атомов углерода: m(С) = 12(2x + y) г.
Выразим через х массы соединений:
m(CaCO3) = n(CaCO3) * M(CaCO3) = 100у г
Масса смеси двух веществ будет равна:
m(смеси) = (64x + 100у) г
Теперь записываем выражение для массовой доли атомов углерода в смеси:
ω(C) = m(C) / m(смеси)
0,25 = 12(2x + y) / (64x + 100у)
Преобразуем выражение, выражаем х через у:
Это и есть искомое молярное соотношение карбида кальция и карбоната кальция:
n(CaC2)/ n(CaCO3) = х/у = 1,625
Ответ: n(CaC2)/ n(CaCO3) = 1,625
4. (71) В каком молярном соотношении были смешаны гидросульфит натрия и гидросульфид натрия, если массовая доля серы в полученной смеси равна 45%?
Ответ: n(NaHS)/ n(NaHSO3) = 2,18
5. (72) Какую массу сульфата калия следует добавить к 5,5г сульфида калия, чтобы в полученной смеси массовая доля серы стала равной 20%?
Ответ: 31,3 г
6. (73) В смеси нитрата аммония и нитрата свинца (II) массовая доля азота равна 25%. Вычислите массовую долю свинца в этой смеси.
Ответ: 23,6%
7. (74) В смеси нитрата аммония и нитрата бария массовая доля азота равна 30%. Вычислите массовую долю нитрат-ионов в смеси.
Ответ: 71,3%
8. (75) В смеси двух оксидов углерода на 5 атомов углерода приходится 7 атомов кислорода. Вычислите объемную долю более тяжелого оксида в этой смеси
Ответ: φ(СO2) = 40%
9. (619) Через 13,1 г смеси бромида калия и йодида калия, в которой массовая доля брома равна 24,5%, пропустили смесь хлора и брома, в результате чего получилась смесь двух солей, в которой массовая доля брома равна 57%. Вычислите массу смеси галогенов, вступившую в реакцию.
Масса брома в исходной смеси равна:
m(Br) = mсмеси·ω(Br) = 13,1·0,245 = 3,21 г
Количество вещества атомов брома:
n(Br) = m/M = 3,21 г/80 г/моль = 0,04 моль
Количество вещества бромида калия:
n(KBr) = n(Br) = 0,04 моль
Масса этого образца бромида калия:
m(KBr) = n·M = 0.04 моль·119 г/моль = 4,77 г
Масса йодида калия:
m(KI) = m(смеси) — m(KBr) =13,1 — 4,77 = 8,33 г
Количество вещества йодида калия:
n(KI) = m/M = 8,33 г/166 г/моль = 0,05 моль
По условию задачи, смесь йодида калия и бромида калия вступила в реакцию не полностью, но в конечной смеси осталось только две соли. При этом йодид калия, скорее всего, вступил в реакцию полностью, так как иначе конечная смесь будет содержать более двух солей.
Предположим, что сначала прореагируют наиболее активные окислитель и восстановитель — йодид калия и хлор:
2KI + Cl2 = 2KCl + I2
Если весь йодид калия вступил в эту реакцию, то в конечной смеси присутствуют только исходный бромид калия и образовавшийся хлорид калия. Количество хлорида калия:
n(KCl) = n(KI) = 0,05 моль
m(KCl) = n·M = 0,05 моль·74,5 г/моль = 37,25 г
Массовая доля брома в такой смеси:
ω(Br) = m(Br) / m(смеси) = 3,21 г / (3,725 г + 4,77) = 0,378 или 37,8%, что не соответствует условию задачи.
Следовательно, йодид калия реагирует не только с хлором, но и с бромом:
2KI + Cl2 = 2KCl + I2
2KI + Br2 = 2KBr + I2
Пусть с хлором прореагировало х моль йодида калия, тогда с бромом 0,05-х моль
Тогда образуется х моль хлорида калия и 0,05-х моль бромида калия.
Масса образовавшегося хлорида калия:
m(KCl) = n·M = x моль·74,5 г/моль = 74,5x г
m2(KBr) = n·M = (0,05-х) моль·119 г/моль = (5,95 — 119x) г
Масса конечной смеси солей:
mсмеси = mисх(KBr) + m2(KBr) + m(KCl) = 4,77 г + (5,95 — 119x) г + 74.5х = (10,72 — 44,5х) г
Количество атомов брома в конечной смеси:
n(Br) = 0,04 моль + (0,05 — х) моль = (0,09 — х) моль
Масса атомов брома:
m(Br) = n·M = (0,09 — х) моль·80 г/моль = (7,2 — 80х) г
Массовая доля брома в конечной смеси:
ω(Br) = (7,2 — 80х) / (10,72 — 44,5х) = 0,57
Решаем полученное уравнение, находим х:
Количество вещества и масса хлора, который вступил в первую реакцию:
n(Cl2) = 0,5х = 0,5·0,02 = 0,01 моль
m(Cl2) = n·M = 0,01·71 г/моль = 0,71 г
Количество вещества брома, который вступил во вторую реакцию:
n(Br2) = n·M = 0,5(0,05 — 0,02) моль = 0,015 моль
m(Br2) = n·M =0,015 моль·160 г/моль = 2,4 г
Масса смеси галогенов, которые прореагировали с йодидом калия:
m(смеси) = m(Cl2) + m(Br2) = 0,71 г + 2,4 г = 3,11 г
Ответ: 3,11 г
10. (620) Через смесь натрия и бромида калия, в которой массовая доля брома равна 60%, пропустили хлор, в результате чего масса брома в смеси солей оказалась в 2 раза меньше, чем в исходной смеси. Вычислите массовую долю брома в полученной смеси солей.
Примем массу исходной смеси за 100 г, тогда масса брома в исходной смеси равна:
m(Br) = mсмеси·ω(Br) = 100·0,6 = 60 г
Количество вещества атомов брома:
n(Br) = m/M = 60 г/80 г/моль = 0,75 моль
Количество вещества бромида калия:
n(KBr) = n(Br) = 0,75 моль
Масса этого образца бромида калия:
m(KBr) = n·M = 0,75 моль·119 г/моль = 89,25 г
m(Na) = m(смеси) — m(KBr) =100 — 89,25 = 10,75 г
Количество вещества натрия:
n(Na) = m/M = 10,75 г/23 г/моль = 0,467 моль
Поскольку масса брома в смеси уменьшилась в два раза, в реакцию вступила половина исходного бромида калия, то есть 0,375 моль KBr. При этом натрий прореагировал полностью, так как, по условию, образовалась смесь солей:
2Na + Cl2 = 2NaCl
2KBr + Cl2 = 2KCl + Br2
В первой реакции образовался хлорид натрия:
n(NaCl) = n(Na) = 0,467 моль
m(NaCl) = n·M = 0,467 моль ·58,5 г/моль = 27,32 г
Во второй образовался хлорид калия:
n(KCl) = 0,5·n(KBr) = 0,375 моль
m(KCl) = n·M = 0,375 моль ·74,5 г/моль = 27,94 г
И остался бромид калия:
mост(KBr) = n·M = 0,375 моль ·74,5 г/моль = 44,625 г
В конечной смеси масса брома равна:
mост(Br) = n·M = 0,375 моль ·80 г/моль = 30 г
Масса конечной смеси:
mсм = mост(KBr) + m(KCl) + m(NaCl) = 44,625 г + 27,94 г + 27,32 г = 99,89 г
Массовая доля брома в конечной смеси солей:
ω(Br) = mост(Br)=/mсм = 30 г/99,89 г = 0,30 или 30%
Ответ: ω(Br) = 30%
11. (621) К смеси калия и иодида натрия, в которой массовая доля калия равна 40%, добавили бром, в результате чего масса йода в полученной смеси солей уменьшилась в 5 раз по сравнению с исходной. Вычислите массовую долю йода в полученной смеси солей.
Ответ: 6,08%
12. (827) Аммиак, образовавшийся при гидролизе смеси нитрида кальция и нитрида лития, в которой массовая доля азота равнялась 30%, пропустили через 80 мл бромоводородной кислоты. В результате реакции молярная концентрация кислоты уменьшилась с 2,8 до 1,2 моль/л (изменением объема раствора за счет поглощения газа пренебречь). Вычислите массу исходного образца смеси нитридов.
Ответ: 5,97 г.
13. (828) К 1,59%-му раствору карбоната натрия добавили по каплям 40 г 3,78%-го раствора азотной кислоты; в результате в образовавшемся растворе число атомов азота оказалось в 2 раза больше числа атомов углерода. Вычислите массовые доли веществ в получившемся растворе.
Ответ: 1,28% NaNO3, 0,631 NaHCO3.
14. (855)Через 15 г 9,45%-го раствора азотной кислоты пропустили аммиак; в результате в образовавшемся растворе массовая доля азота оказалась равной 3,5%. Вычислите массовые доли веществ в образовавшемся растворе.
15. (951) К смеси фосфата натрия, дигидрофосфата натрия и гидрофосфата натрия общей массой 15 г (молярное соотношение солей в порядке перечисления 3:2:1) добавили 100 г 4%-го раствора гидроксида натрия. Установите количественный состав раствора (в массовых долях).
Ответ: w(Na3PO4) = 14,7%, w(NaOH) = 34,3%.
16. (952) К 2 г смеси гидрофосфата калия и дигидрофосфата калия, в которой массовая доля фосфора равна 20%, добавили 20 г 2%-го раствора фосфорной кислоты. Вычислите массовые доли всех веществ в получившемся растворе.
17. (992) В смеси карбида алюминия и карбида кальция число атомов алюминия равно числу атомов кальция. При гидролизе этой смеси выделяется 1,12 л (н.у.) смеси газов. Вычислите массу исходной смеси карбидов.
Ответ: 2,86 г
18. (1007) Смесь карбоната стронция и гидрокарбоната аммония общей массой 12 г, в которой масса атомов углерода в 12 раз больше массы атомов водорода, добавили к избытку 10%-го раствора серной кислоты. Вычислите массу выпавшего осадка и объем выделившегося газа (н.у.)
Ответ: 2 л, 13,2 г
19. (1009) Какой объем газа (н.у.) выделится при добавлении к 20 г 20%-го раствора серной кислоты 20 г смеси карбоната калия и гидрокарбоната натрия с одинаковым числом атомов калия и водорода?
Ответ: 0,914 л.
20. (1021) В смеси сульфита кальция и гидрокарбоната кальция число атомов кальция в 6 раз больше числа атомов серы. Вычислите плотность по воздуху газовой смеси, образующейся при обработке этой смеси избытком разбавленного раствора серной кислоты.
Ответ: 1,58
21. (1059) Массовая доля калия в растворе, содержащем силикат калия и сульфат калия, равна 0,909%, а масса серы равна массе кремния. К этому раствору добавили в 4 раза меньшую массу соляной кислоты с массовой долей хлороводорода 1,46%. Вычислите, во сколько раз масса серы оказалась больше массы кремния в образовавшемся растворе.
22. (1162) Смесь натрия с другим щелочным металлом поместили в воду. По окончании реакции воду полностью испарили. Массовая доля кислорода в полученной смеси веществ оказалась равной 50%. Вычислите массовые доли веществ в полученной смеси.
Ответ: w(NaOH) =62,5%, w(LiOH) = 37,5%
23. (1215) В смеси оксида ванадия (V) и оксида ванадия (III) массовая доля кислорода равна 40%. Какое количество вещества алюминия понадобится для полного восстановления ванадия из 100 г этой смеси?
Ответ: 1,67 моль
Задача на атомистику, которую составители ЕГЭ по химии рекомендовали к прорешиванию:
24. Некоторое количество смеси гидрата дигидрофосфата калия и дигидрата гидрофосфата калия с равными массовыми долями веществ растворили в воде, которую взяли в 10 раз больше по массе, чем смеси. Сколько атомов кислорода приходится на один атом фосфора в полученном растворе? (104)
Пусть количество вещества гидрата дигидрофосфата калия равно х моль, а дигидрата гидрофосфата — у моль.
m(KH2PO4·H2O) = n·M = 154x г
m(K2HPO4·2H2O) = n·M = 210у г
Поскольку массовые доли кристаллогидратов в исходной смеси равны, массы кристаллогидратов также равны:
m(KH2PO4·H2O) = m(K2HPO4·2H2O)
154х = 210у
Отсюда: х = 1,364у
Масса исходной смеси:
mсм = m(KH2PO4·H2O) + m(K2HPO4·2H2O) = 154x + 210у = 154·1,364у + 210у = 420,056·y г
Количество чистых солей в составе кристаллогидратов:
n(KH2PO4·H2O) = n(KH2PO4) = x моль = 1,36·у моль
n(K2HPO4·2H2O) = n(K2HPO4) = у моль
Масса добавленной воды отличается в 10 раз от массы смеси солей:
m(H2O) = 10mсм = 10·420,056·у = 4200,56у г
Количество вещества добавленной воды:
n(H2O) = 4200,56·у/18 = 233,36·у моль
Определим количество атомов кислорода и фосфора:
в гидрате дигидрофосфата калия KH2PO4·H2O: n1(O) = 5x = 6,82·у моль n(Р) = 1,364·у моль
в дигидрате гидрофосфата калия K2HPO4·2H2O:
n2(O) = 6·у моль = 6·у моль
n(Р) = у моль = у моль
в добавленной воде: n3(O) = 233,36у моль
Общее количество атомов кислорода: n(O) = 233,36у + 6,82у + 6у = 246,18 моль
Атомов фосфора: n(Р) = у + 1,364у = 2,363у моль
Отношение числа атомов кислорода к числу атомов фосфора равно:
Ответ: n(O)/n(Р) = 104
24. Некоторое количество смеси гидрата дигидрофосфата калия и дигидрата гидрофосфата калия с равными массовыми долями веществ растворили в воде, которую взяли в 10 раз больше по массе, чем смеси. Сколько атомов кислорода приходится на один атом фосфора в полученном растворе? (104)
Пусть количество вещества гидрата дигидрофосфата калия равно х моль, а дигидрата гидрофосфата — у моль.
m(KH2PO4·H2O) = n·M = 154x г
m(K2HPO4·2H2O) = n·M = 210у г
Поскольку массовые доли кристаллогидратов в исходной смеси равны, массы кристаллогидратов также равны:
m(KH2PO4·H2O) = m(K2HPO4·2H2O)
154х = 210у
Отсюда: х = 1,364у
Масса исходной смеси:
mсм = m(KH2PO4·H2O) + m(K2HPO4·2H2O) = 154x + 210у = 154·1,364у + 210у = 420,056·y г
Количество чистых солей в составе кристаллогидратов:
n(KH2PO4·H2O) = n(KH2PO4) = x моль = 1,36·у моль
n(K2HPO4·2H2O) = n(K2HPO4) = у моль
Масса добавленной воды отличается в 10 раз от массы смеси солей:
m(H2O) = 10mсм = 10·420,056·у = 4200,56у г
Количество вещества добавленной воды:
n(H2O) = 4200,56·у/18 = 233,36·у моль
Определим количество атомов кислорода и фосфора:
в гидрате дигидрофосфата калия KH2PO4·H2O: n1(O) = 5x = 6,82·у моль n(Р) = 1,364·у моль
в дигидрате гидрофосфата калия K2HPO4·2H2O:
n2(O) = 6·у моль = 6·у моль
n(Р) = у моль = у моль
в добавленной воде: n3(O) = 233,36у моль
Общее количество атомов кислорода: n(O) = 233,36у + 6,82у + 6у = 246,18 моль
Атомов фосфора: n(Р) = у + 1,364у = 2,363у моль
Отношение числа атомов кислорода к числу атомов фосфора равно:
Ответ: n(O)/n(Р) = 104
Задачи на атомистику из реального ЕГЭ по химии 16 июля 2020 года
1. В смеси оксида магния и фосфида магния массовая доля атомов магния равна 54,4%. Они полностью прореагировала с соляной кислотой массой 365 г 34-% раствора. К полученному раствору добавили раствор фторида калия массой 232 грамма 30-% раствора. Найти массовую долю хлорида калия в конечном растворе.
2. Взяли смесь оксида кальция и карбоната кальция. Массовая доля кальция в смеси 50%. Смесь растворили в 300 г раствора избытка соляной кислоты. Выделившийся газ полностью прореагировал с раствором гидроксида натрия массой 200г и массовой долей 8%. Вычислите массовую долю образовавшейся соли.
4. Смесь из оксида и сульфида алюминия, где массовая доля алюминия 50%, залили 700 г, раствора соляной кислоты, взятой в избытке. Выделившийся газ полностью поглотили 240 г 20% раствора сульфата меди. Вычислите концентрацию соли после того, как залили соляную кислоту.
5. Смесь оксида кальция и карбоната кальция с массовой долей кальция 62,5% растворили в 300 г раствора соляной кислоты. Масса раствора стала 361,6 г. Выделившийся газ пропустили через 80 г 10%-ного раствора гидроксида натрия. Вычислите массовую долю соли в конечном растворе.
Пусть n(CaO) = х моль, n(CaCO3) = y моль, тогда:
количество вещества атомов кальция в оксида n1(Ca) = х моль, в карбонате: n2(Са) = у моль,
общее количество вещества атомов кальция: n(Са) = (x + y) моль.
Масса атомов кальция: m(Ca) = n(Са)·M(Ca) = 40(x + y) г.
Масса оксида кальция: m(CaО) = n(СаО)·M(CaО) = 56x г.
Масса карбоната кальция: m(CaCO3) = n(CaCO3)·M(CaCO3) = 100у г.
Масса смеси: mсм = m(CaО) + m(CaCO3) = (56х + 100у) г
40(x + y)/(56х + 100у) = 0,625
Преобразуя приведённое выше равенство, получаем х = 4,5у.
Далее протекают реакции:
CaO + 2HCl = CaCl2 + H2O
Количество образовавшегося углекислого газа n(CO2) = y моль, масса m(CO2) = 44y г.
Запишем уравнение материального баланса для конечного раствора:
361,6 = 56х + 100у + 300 — 44у
у = 0,2 моль, х = 0,9 моль.
Количество углекислого газа: n(CO2) = 0,2 моль, масса m(CO2) = 44·0,2 = 8,8 г.
При взаимодействии углекислого газа с гидроксидом натрия возможно образование средней или кислой соли:
NaOH + CO2 = NaHCO3 (2)
Какие продукты образуются, определяется соотношением количества вещества реагентов.
Масса щелочи: m(NaOH) = mр-ра(NaOH) · ω(NaOH) = 80 · 0,1 = 8 г
Количество вещества: n(NaOH) = m(NaOH) / M(NaOH) = 8/40 = 0,2 моль
Соотношение количества вещества реагентов n(NaOH):n(CO2) = 0,2:0,2 = 1:1
Следовательно, протекает только вторая реакция с образованием кислой соли — гидрокарбоната натрия.
n(NaHCO3) = n(CO2) = 0,2 моль
m(NaHCO3) = n(NaHCO3)·M(NaHCO3) = 0,2·84 = 16,8 г
Масса конечного раствора гидрокарбоната:
mр-ра = m(CO2) + mр-ра(NaOH) = 8,8 + 80 = 88,8 г
Массовая доля гидрокарбоната натрия в конечном растворе:
ω(NaHCO3) = m(NaHCO3)/mр-ра = 16,8/88,8 = 0,1892 или 18,92%
Ответ: ω(NaHCO3) = 18,92%
6. Смесь оксида и пероксида натрия, в которой соотношение атомов натрия к атомам кислорода равно 3:2, нагрели с избытком углекислого газа. Полученное вещество растворили в воде. В результате образовалось 600 г раствора. К полученному раствору добавили 229,6 г раствора хлорида железа(III).Найдите массовую долю оксида натрия в исходной смеси, если масса конечного раствора 795 г и массовая доля карбоната натрия в этом растворе 4%.
7. Смесь карбида алюминия и карбида кальция, в которой массовая доля углерода равна 30%, полностью растворили в 547.5 г соляной кислоте. При этом кислота прореагировала без остатка. К образовавшемуся раствору добавили 1260г 8% раствора гидрокарбоната натрия. Найдите массовую долю кислоты в растворе, в котором растворили исходную смесь.
8. В смесь железной окалины и оксида железа(III) добавили 500 г раствора конц. азотной кислоты, причём соотношение атомов железа к атомам кислорода в смеси равно 7:10. Чтобы полностью поглотить выделившийся газ использовали 20 г раствора NaOH с массовой долей 20%.. Найдите массу соли, образовавшейся при добавлении кислоты в смесь.
9. Дана смесь оксида и пероксида бария, в которой число атомов бария относится к числу атомов кислорода как 5:9. Добавили 490 г 20% холодной серной кислоты при этом смесь прореагировала полностью и раствор стал нейтральным. Определить массовую долю воды в полученном растворе.
10. Смесь из оксида лития и нитрида лития с массовой долей атомов лития 56%, смешали с 265 г раствора соляной кислоты с массовой долей 20%. (все вещества полностью прореагировали). После к образовавшемуся раствору добавили 410г 20%- ного фосфата натрия. Найдите массовую долю образовавшегося хлорида натрия.
11. Дан холодный раствор серной кислоты. К нему добавили пероксид бария, при этом вещества прореагировали полностью. В полученном растворе соотношение атомов водорода к кислороду составило 9 к 5. Затем к этому раствору добавили каталитическое количество оксида марганца (IV), в результате масса раствора уменьшилась на 6,4 г. Вычислите массовую долю серной кислоты в исходном растворе.
Холодный раствор серной кислоты реагирует с пероксидом бария без ОВР:
При этом в растворе присутствует пероксид водорода, а сульфат бария выпадает в осадок.
Пусть n(H2O2) = х моль, n(H2O) = y моль, тогда:
количество вещества атомов водорода в пероксиде n1(H) = 2х моль, в воде: n2(Н) = 2у моль,
количество вещества атомов кислорода в пероксиде n1(О) = 2х моль, в воде: n2(О) = у моль,
общее количество вещества атомов водорода: n(Н) = (2x + 2y) моль,
общее количество вещества атомов кислорода: n(О) = (2x + y) моль.
у = 8х
При добавлении каталитического количества оксида марганца (IV) пероксид водорода разлагается:
Пусть весь пероксид водорода разложился, тогда изменение массы раствора равно массе выделившегося газа, то есть массе кислорода:
m(O2) = 6,4 г
n(O2) = m(O2)/M(O2) = 6,4 / 32 = 0,2 моль
Отсюда количество вещества серной кислоты с исходном растворе:
Количество и масса воды не изменялись:
m(H2O) = n(H2O)·M(H2O) = 3,2·18 = 57,6 г
Массовая доля серной кислоты в исходном растворе:
Задачи на «атомистику» из реального ЕГЭ по химии-2020