Концентрическое ремоделирование лж что это такое простыми словами
Концентрическое ремоделирование левого желудочка: что это такое
Что такое концентрическое ремоделирование левого желудочка
Концентрическое ремоделирование миокарда левого желудочка считается наиболее распространенной формой данной болезни. Как правило, оно развивается в первую очередь у людей, имеющих артериальную гипертензию. Данный тип не имеет способности изменять внутреннее пространство левого желудочка, происходит лишь изменение стенок сердца и увеличение перегородки между сердечными отделами. Стоит сказать, что эта форма может начать свое развитие на фоне имеющейся гипертрофии левого желудочка. Кстати, гипертрофия, как правило, развивается при увеличенных физических нагрузках, либо же, как следствие гипертонии. Помимо стандартных причин возникновения, имеются и другие, которые не лучшим образом влияют на здоровье человека, а это могут быть пагубные привычки, такие как курение, злоупотребление алкоголем и др.
Начинается заболевание с гипертрофии левого желудочка и проявляется повышением толщины его стенки
Важно знать, что самостоятельная диагностика ремоделирования миокарда не приведет ни к чему хорошему, но, все-таки следует разбираться в первоначальных признаках, которые способствуют возникновению болезни, это такие, как:
При первых же проявлениях подобных симптомов необходимо обратиться к специалисту, который должен назначить кардиограмму. Только этот метод исследования поможет определить наличие данной болезни. Следует сказать, что запущенная форма может привести к необратимым последствиям, например, к развитию хронической сердечной недостаточности.
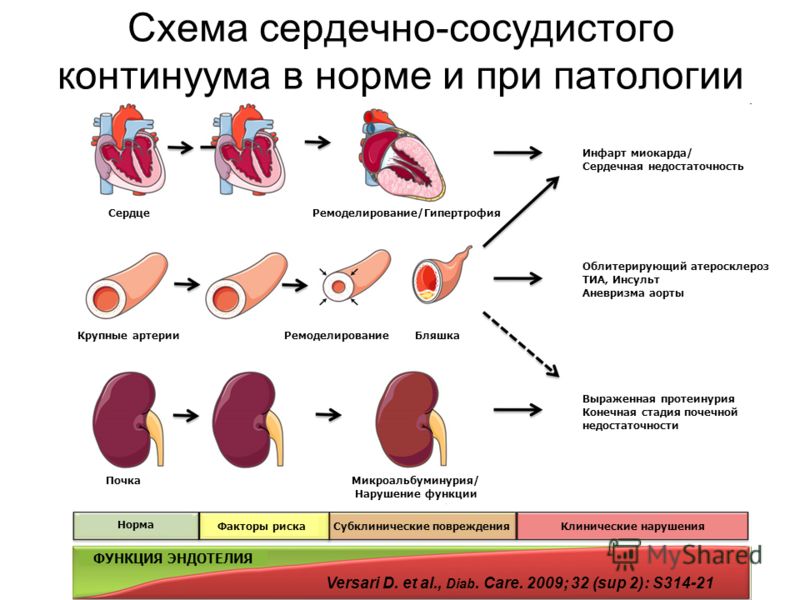
Ремоделирование сердца
Нет ничего сложнее, нежели перенести тяжелую болезнь сердца, которая приводит также к определенным последствиям. Одной из таковых является ремоделирование сердца. Ремоделирование сердца — это структурные изменения органа, разрушающие его свойства в ответ на внешние воздействия и другие патологические процессы в организме человека.
Ремоделирование сердца проишодит под воздействием негативных факторов и заболеваний
Причины возникновения
Необходимо уточнить, что данный недуг может развиваться и на почве других сердечных заболеваний, это и приводит к особенным формам развития. Помимо таких негативных факторов, как болезни, ремоделирование миокарда может проявиться и как следствие некачественного лечения. Важно знать, что абсолютно разные причины влияют на развитие той или иной физиологической особенности сердца. О важности правильного диагностирования причин возникновения говорить не стоит, ведь это и так понятно, что следует в первую очередь обращать внимание на фактор, который способствовал возникновению данного анатомического изменения.
Вследствие повышенного артериального давления возникают некоторые болезни, которые приводят к данным изменениям. Помимо этих деформаций сердца, можно также наблюдать и другие нарушения:
Большое значение имеет масштабность ремоделирования миокарда, которое имеет разные значения и объясняется двумя основными причинами возникновения:
| активация нейрогормонов | Подобный случай возникает в результате поражения организма инфарктом миокарда. Стоит сказать, что данная активация обусловлена значительным повреждением сердечной мышцы. Кстати, данная повышенная активация должна работать над регулированием общей работы сердечного органа и нормализацией артериального давления. Но, если не принять вовремя меры предосторожности, то такая патология перерастает в более тяжелую форму ремоделирования миокарда |
| симпатическая нервная система и ее активация | Данная причина возникновения основного недуга объясняется увеличенным напряжением левого желудочка. Это приводит к тому, что данному отделу необходимо большее количество кислорода |
Если говорить об эксцентрическом ремоделировании миокарда, то оно может быть вызвано значительной перегрузкой данной мышечной ткани. Кроме того, это сопровождается удлинением одноядерных клеток и уменьшением в размерах стенок сердца.
Патофизиология болезни
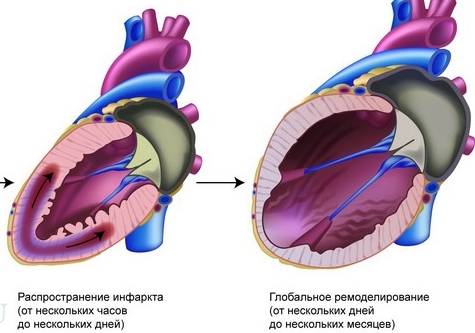
Сегодня инфаркт миокарда звучит не так страшно, как несколько лет назад. В большинстве случаев пациенты имеют возможность продолжать свою стандартную жизнедеятельность, несмотря на перенесенный стресс для сердца, да и всего организма. Стоит сказать, что качественное лечение и хорошая реабилитация, дают свои плоды, но, к сожалению, помимо этого, все же остаются последствия перенесенного инфаркта. Ремоделирование миокарда патофизиология которого только обостряется, имеет достаточно неприятные последствия. В данном случае, если своевременно не проводить квалифицированные осмотры, можно придать свой организм осложнениям, таким как плохое кровообращение и хроническая сердечная недостаточность.
Инфаркт миокарда, как правило, приводит к серьезным физиологическим изменениям левого желудочка, что не очень хорошо сказывается на общем состоянии пациента. Такое изменение структуры сердечного отдела приводит также к следующим изменениям:
Если проследить данную особенность, то можно заметить, что все процессы в организме взаимосвязаны, и ничего не возникает просто так. Из-за того что постоянно повышается артериальное давление, наша сердечная мышца пытается приспособиться к данному явлению. Как следствие, происходит изменение в размерах мышечной ткани. Именно так возникает данное заболевание, которое сопровождается рядом других недугов.
Концентрическая гипертрофия левого желудочка
Одним из осложнений заболеваний сердечно-сосудистой системы является формирование гипертрофии миокарда. Коварность ее в том, что долгое время гипертрофия не проявляет себя клинически, а первые ее симптомы возникают поздно.
Понятие и причины
Концентрическая гипертрофия левого желудочка
Избыток массы тела
Формирование «перестройки»
Схема формирования двух типов дисфункции миокарда
Можно встретить определение гипертрофии как ремоделирование. Эти термины являются синонимами между собой, хотя правильно сказать, что гипертрофия представляет собой частный ремоделирования. Второе понятие является более широким. Ремоделирование означает процесс изменения существующей структуры, ее переустройство или дополнение чем-либо. Ремоделирование миокарда — это изменение его геометрической структуры под влиянием какого-то определенного фактора. Причем перестраивается не только структура, но происходят и функциональные перестройки.
Цель ремоделироания — адаптация левого желудочка к сформировавшимся условиям гемодинамики, часто приобретающих патологический характер. При постоянном влиянии повышенного давления на миокард ЛЖ происходит ответное увеличение числа саркомеров и толщины сердечной клетки (кардиомиоцитов). В итоге стенка ЛЖ утолщается, что имеет место при концентрическом ремоделировании миокарда левого желудочка. В случае эксцентрического ремоделирования желудочек испытывает перегрузку объемом. В этом случае кардиомиоциты растягиваются, а стенка камеры сердца уменьшается.
В развитии ремоделирования миокарда левого желудочка (ЛЖ) участвуют следующие компоненты:
Типы гипертрофии
Гипертрофия левого желудочка
Концентрическая. Концентрическая гипертрофия миокарда левого желудочка (концентрическая гипертрофия миокарда ЛЖ) характеризуется равномерным утолщением его стенок. Такое равномерное утолщение стенки может приводить к уменьшению просвета камеры. Отсюда второе название этого типа гипертрофии — симметричная. Чаще всего концентрическая гипертрофия ЛЖ развивается по причине перегрузки его давлением. Некоторые патологические состояния и заболевания, такие как аортальный стеноз, артериальная гипертензия (АГ) приводят к повышению сосудистого сопротивления в аорте. Левому желудочку приходиться работать с большей силой, чтобы протолкнуть всю порцию крови в аорту. Отсюда и развивается концентрическая гипертрофия ЛЖ.
Эксцентрическая. В отличие от предыдущего типа эксцентрическая гипертрофия левого желудочка формируется в том случае, если ЛЖ перегружается объемом. Недостаточность митрального или аортального клапана, а также какие-то иные причины могут приводить к тому, что кровь из левого желудочка не полностью изгоняется в аорту. Там остается какое-то ее количество. Стенки ЛЖ начинают растягиваться, а его форма напоминает раздутый шарик. Второе название данного вида ремоделирования — асимметричное. При эксцентрической гипертрофии ЛЖ толщина его стенки может не изменяться, а просвет, наоборот расширяется. В таких условиях снижается насосная функция левого желудочка.
Смешанный тип гипертрофии чаще всего встречается при занятии спортом. Лица, занимающиеся греблей, конькобежным или велосипедным спортом, могут иметь такой тип гипертрофии миокарда ЛЖ.
Отдельно авторы выделяют концентрическое ремоделирование миокарда ЛЖ. Отличием его от концентрической ГЛЖ является не измененная масса миокарда ЛЖ и нормальная толина его стенка. При данном типе происходит уменьешние конечно-диастолического размера (КДР) и объема ЛЖ.
Диагностика и лечение
Основными методами диагностики ГЛЖ являются эхокардиография (УЗИ сердца), магнитно-резонансная томография и другие методы. Однако, в самом начале весь диагностический поиск направлен на установление основного заболевания. Первыми жалобами пациента с ГЛЖ могут быть одышка, которую он испытывает при выполнении интенсивных физических нагрузок. При прогрессировании процесса данный симптом может проявляться и в момент выполнения нагрузок меньшей интенсивности, а после и в покое. Последний момент указывает на развитие у пациента сердечной недостаточности (СН).
Кроме одышки, пациенты предъявляют жалобы, касающиеся основного заболевания. Могут беспокоить болевые ощущения или дискомфорт в области сердца или за грудиной, которые имеют связь с нагрузками или стрессами. Также могут присутствовать сердцебиение, головокружение, головные боли, обморочные состояния. Список симптомов может быть дополнен ощущениями перебоев в работе сердца, повышенной утомляемостью, слабостью и другими признаками основного заболевания.
Ведущим инструментальным методом гипертрофии миокарда левого желудочка является эхокардиография (ЭхоКГ или УЗИ сердца). Несмотря на то, что такой простой и доступный метод инструментальной диагностики как электрокардиография (ЭКГ) также имеет свои диагностические критерии в отношении ГЛЖ, все же, УЗИ сердца по своей диагностической чувствительности превосходит ЭКГ более чем в 5 раз. Основным эхокардиографическим показателем, который учитывается при постановке диагнозе ГЛЖ, является масса миокарда левого желудочка (ММЛЖ), а точнее ее индекс.
Для разграничения концнтрического или эксцентрического ремоделирования используется также такой эхокардиографический показатель как относительная толщина стенки (ОТС). В зависимости от состояния этих двух показателей — ИММЛЖ и ОТС, определяется тип ремоделирования миокарда ЛЖ:
Прогностически более неблагоприятной считается концентрическая гипертрофия ЛЖ, так как именно этот тип ремоделирования миокарда влечет за собой диастолическую дисфункцию и электрическую нестабильность миокарда, повышая тем самым риск развития внезапной сердечной смерти среди таких пациентов. На выраженность диастолической диасфункции независимо от типа гипертрофии влияет относительная толщина стенки. Чем больше степень ее увеличения, тем неблагоприятнее прогноз. А вот возрастание конечно-диастолического разера коррелирует с выраженностью систолической дисфункции ЛЖ.
Стентирование коронарных артерий
Признаки концентрического ремоделирования левого желудочка. Концентрическое ремоделирование левого желудочка что это такое. Основные компоненты ремоделирования
Главная » Статьи2 » Ремоделирование сердца
Октябрь 25, 2020 Нет комментариев

Термин «ремоделирование» вошел в медицинский лексикон в начале 80-х годов прошлого столетия. Вначале он был отнесен к сердечно-сосудистой системе — «ремоделирование сердца», «ремоделирование сосудов», а затем — и к другим структурно-функциональным образованиям.
Интенсивное изучение процесса ремоделирования сердца (в основном, левого желудочка) началось после исследований SAVE (Международное многоцентровое рандомизированное двойное слепое исследование), установивших, что торможение процесса постинфаркгного ремоделирования левого желудочка сопровождается значительным улучшением течения и прогноза инфаркта миокарда
Что такое ремоделирование сердца
Согласно соглашению, принятому на Международном Форуме по Ремоделированию сердца в 2000 году (США), понятие «ремоделирование сердца» включает изменения на генетическом, молекулярном и клеточном уровнях, которые манифестируются изменениями структуры, размера, формы (архитектуры) и функции сердца, возникающими в ответ на долговременные повреждающие воздействия. К основные формам патологии, инициирующим ремоделирование сердца, относят ишемическую болезнь сердца, гипертоническую болезнь, гипертрофические кардиомиопатии и другие первичные заболевания сердца.
Одним из основных триггеров, запускающих процесс ремоделирования, является гибель кардиомиоцитов — их некроз (пассивная насильственная форма смерти), некроптоз (регулируемый некроз), апоптоз (активная программируемая смерть), аутофагия (смерть вследствие лиэосомального аутокатализа органелл, белков, липидов и других компонентов клетки). Некроз кардиомиоцитов сопровождается развитием асептической воспалительной реакции, при которой происходит активация транскрипционного ящерного фактора kappa В (NF-kB), детерминирующего синтез провоспалительных цитокинов, играющих ключевую роль в патогенезе многих процессов, включая ремоделирование сердца.
Ранее основными продуцентами провоспалительных цитокинов в поврежденном миокарде считали эндотелиоциты и тучные клетки. Затем было выявлено, что, кроме этих клеток, значительный вклад в процесс ремоделирования вносят фибробласты. Сравнительно недавно установлено, что эти клетки, кроме участия в пролиферации соединительной ткани, способны активировать инфламмасомы. Инфламмасомы (от лат. inflammatio- воспаление) — это цитоплазматические, формирующиеся в макрофагах и других клетках супрамолекулярные образования, которые способны опосредованно через стимуляцию каспазы-1 активизировать семейство интерлейкинов-1 (IL-la, IL-1J3, IL-IRa). В свою очередь стимуляцию кардиальных фибробластов могут вызывать активные формы кислорода — постоянные спутники ишемии, а также провоспалительные цитокины. Кроме того, ИЛ-la, ФНО-a, онкостатин-М и другие цитокины наряду с ангиотензином II, эндотели-ном 1 и катехоламинами активируют продукцию фибробластами матриксных металлопротеаз, которые являются членами семейства протеолитических ферментов, участвующих во многих биологических процессах.
Имеются основания считать, что матриксные металлопротеазы 3 и 9 принимают участие в процессе ремоделирования сердца. Контроль активности этих ферментов в значительной степени осуществляют тканевые ингибиторы матриксных металлопротеиназ — TIMPs (Tissue inhibitors of matrix metalloproteinases), которые образуют высокоаффинные комплексы с металлопротеазами, блокируя их активный домен, и таким образом предотвращают деградацию коллагена. К настоящему времени установлено, что преобладание активных матриксных металлопротеаз приводит к дилатации левого желудочка, а активная выработка TIMPs может способствовать его фиброзу.
Таким образом, в механизмах ремоделирования сердца участвует большой спектр кардиальных биологически активных молекул.
Геометрия левого желудочка изменяется на протяжении сердечного цикла от преимущественно эллипсоидной формы в систолу к более сферической в диастолу. Такие изменения закономерны в условиях нормальной насосной функции желудочка. Относительное удлинение левого желудочка во время систолы является механизмом, посредством которого желудочек выбрасывает больший объем крови при меньшем напряжении миокарда. Обратный процесс — сферификация левого желудочка во время ранней диастолы сопровождается увеличением объема желудочка и служит дополнением к раннему диастолическому наполнению, в котором участвует только пассивное удлинение кардиомиоцитов.



Причины возникновения
Начальной стадией ремоделирования сердечной мышцы является увеличение массы мышечного слоя левого желудочка. Изменения в миокарде могут происходить в одном из двух направлений:
Данные процессы, зачастую, запускают люди, которые неправильно распределяют физические нагрузки. Так, утолщение мышцы данного органа происходит у тех, кто тренируется чересчур интенсивно, особенно это относится к игровым видам спорта и к тем, где требуется применение силы. В данном случае, резко возрастает необходимость клеток в кислороде, поэтому сердце вынуждено в ускоренном режиме выталкивать богатую кислородом кровь в артерии, преодолевая усиленное сопротивление, что не дает возможности мышце полноценно расслабиться в стадии диастолы.
Компенсируя данные факторы, сердечная мышца накачивает объем. Таким образом, нагрузка давлением вызывает концентрическое ремоделирование миокарда левого желудочка.
Занятие динамическими видами спорта, развивающими выносливость, может привести к развитию эксцентрического ремоделирования мышцы сердца, которое состоит в увеличении длины и ширины кардиомиоцитов. Данный процесс является компенсаторной мерой сердечной мышцы на возврат увеличенного объема венозной крови и вызван необходимостью перемещать ее резко возросший объем в артерии.
Кроме спортсменов и людей тяжелого физического труда в группу риска входят:
Два основных типа ремоделирования сердца
Выделяют два основных типа ремоделирования сердца: эксцентрический и концентрический (рис. 3.1). Критерием их дифференцировки является форма гипертрофии желудочка, которая представляет собой начальный этап ремоделирования. Тип ремоделирования детерминируется условиями, в которых он формируется. Например, объемная перегрузка левого желудочка при недостаточности аортального клапана вызывает увеличение длины кардиомиоцитов, уменьшение толщины стенок, увеличение объема и формирование эксцентрического типа гипертрофии левого желудочка. В отличие от такого типа ремоделирования перегрузка давлением левого желудочка (напр., в условиях стеноза аортального отверстия, системной артериальной гипертензии) приводит к увеличению количества саркомеров и объема кардиомиоцитов, толщины стенок и формированию концентрического типа гипертрофии левого желудочка.
В ходе изучения проблемы ремоделирования наряду с понятием «структурное ремоделирование» (изменения геометрии, архитектоники, объема, толщины стенки и т. п.) появилось понятие «функциональное ремоделирование». Применительно к насосной функции сердца функциональное ремоделирование ассоциируют с понятиями «систолическая и диастолическая дисфункция желудочка». Функциональное ремоделирование левого желудочка возникает и развивается независимо от процесса его структурно-геометрической перестройки. В настоящее время понятие «ремоделирование сердца» распространяется на все формы хронической сердечной недостаточности независимо от ее происхождения, т. е. от этиологических факторов.
На формирование и динамику процесса структурного ремоделирования сердца влияют гемодинамические, нейрогенные, гормональные и другие факторы, которые в настоящее время активно изучают.
При формировании концентрической гипертрофии повышение систолического давления стимулирует увеличение синтеза саркомеров в их параллельной ориентации, что вызывает нарастание массы миокарда и утолщение стенок желудочка, но не изменяет диаметр его полости.
При формировании эксцентрической гипертрофии повышение диастолического давления вызывает синтез последовательно располагающихся саркомеров. Для эксцентрической формы характерно увеличение массы желудочка и размеров его полости, но при этом средняя толщина стенок остается неизменной.
Гипертрофия левого желудочка закономерно развивается при артериальной гипертензии и способствует поддержанию напряжения его стенки. При этом развитие гипертрофии зависит не столько от уровня артериального давления (гемодинамической перегрузки), сколько от активности ренин-ангиотензин-альдостероновой системы. Вначале гипертрофия левого желудочка развивается по концентрическому типу (добавление саркомеров внутри кардиомиоцита). Ангиотензин II при этом стимулирует рост мышечных волокон, а альдостерон изменяет внутриклеточный матрикс с формированием диастолической дисфункции. Диастолическую дисфункцию, возникающую уже на начальном этапе ремоделирования левого желудочка, рассматривают в качестве маркера фиброза миокарда.
Расслабление миокарда
Расслабление миокарда — это весьма энерготребовательный процесс, и поэтому при гипертрофии желудочка он страдает в первую очередь. Наибольшую гемодинамическую перегрузку при диастолической дисфункции испытывает левое предсердие. Дилатация левого предсердия вызывает митральную регургитацию, что детерминирует переход концентрической гипертрофии левого желудочка в ее эксцентрическую форму. К систолической перегрузке повышенным артериальным давлением добавляется диастолическая перегрузка объемом, т.е. левый желудочек подвергается хронически повышенному конечно-диастолическому давлению. Дилатация левого желудочка осложняется систолической дисфункцией, что увеличивает риск летального исхода примерно на 50%.
При гистологическом исследовании стенки левого желудочка обнаружено повышение длины отдельных саркомеров и повышенное количество последовательно ориентированных саркомеров, которые, по видимому, приводят к увеличению длины миоцитов.
В процессе гипертрофии может развиться относительная коронарная недостаточность из-за отставания роста сосудов (ангиогенеза) от увеличения массы миокарда. Вследствие циркуляторной гипоксии и относительной недостаточности митохондриопоэза увеличивается количество необратимо поврежденных кардиомиоцитов, что приводит к снижению сократимости миокарда. В таких условиях кривая изоволюмического систолического давления продолжает смещаться вправо, а кривая диастолического давления может еще больше смещаться вниз (из-за фиброза), что детерминирует значительное снижение ударного объема и наступление у пациента терминальной стадии сердечной недостаточности.
Кардиомиоциты
Основными участниками процесса ремоделирования сердца являются кардиомиоциты, а также фибробласты и коронарные сосуды, а структурнофункциональной единицей сердечной мышечной ткани — сократительный (типичный) кардиомиоцит. Эти клетки образуют функциональные волокна, стыкуясь друг с другом. Места контактов соседних кардиомиоцитов называют вставочными дисками, которые свидетельствуют о клеточном строении миокарда.
Кардиомиоциты — это полностью созревшие, достигшие терминальной дифференцировки клетки, утратившие способность к делению в раннем постнатальном периоде. В связи с этим увеличение массы миокарда может обеспечиваться не образованием новых кардиомиоцитов и функциональных волокон, а лишь гипертрофией предсуществующих кардиомиоцитов. В ответ на возрастающую нагрузку кардиомиоциты не размножаются, а гипертрофируются — в них повышается синтез белка и саркоплазматических сократительных единиц. Индукторами гипертрофии являются норадреналин, ангиотензин И, эндотелии, локальные пептиды — стимуляторы роста клеток (инсулиноподобный фактор роста I, кардиотропин I, фактор роста фибробластов и др.), а также физические факторы, вызывающие растяжение кардиомиоцитов и повышение напряжения стенки полостей сердца. Взаимодействуя со специфическими рецепторами на мембране кардиомиоцитов, биологически активные индукторы запускают каскад внутриклеточных сигнальных цепочек.
В результате активируются гены раннего ответа (так называемые протоонкогены), ответственные за синтез малых регуляторных протеинов, контролирующих транскрипцию других генов. За этим следует реэкспрессия фетальной генной программы, которая, как показали экспериментальные исследования, индуцирует синтез сократительных белков и неконтрактиль-ных протеинов, таких, напр., как фермент р2
Na+/K+-ATO-a3a, который обычно выявляют только у эмбрионов, т.е. в периоде, для которого характерна тотальная пролиферация клеток в организме. В отличие от других клеток, кардиомиоциты, остановленные в Gl-фазе клеточного цикла, способны отвечать на молекулярные стимулы лишь гипертрофией, но не пролиферацией.
В процессе ремоделирования активируется пролиферация фибробластов, что приводит к фиброзу — разрастанию соединительной ткани с появлением рубцовых изменений в сердце. Увеличивающаяся при этом «жесткость» миокарда детерминирует возникновение диастолической дисфункции, проявляющейся снижением насосной функции сердца.
Причины возникновения
Начальной стадией ремоделирования сердечной мышцы является увеличение массы мышечного слоя левого желудочка. Изменения в миокарде могут происходить в одном из двух направлений:
Данные процессы, зачастую, запускают люди, которые неправильно распределяют физические нагрузки. Так, утолщение мышцы данного органа происходит у тех, кто тренируется чересчур интенсивно, особенно это относится к игровым видам спорта и к тем, где требуется применение силы. В данном случае, резко возрастает необходимость клеток в кислороде, поэтому сердце вынуждено в ускоренном режиме выталкивать богатую кислородом кровь в артерии, преодолевая усиленное сопротивление, что не дает возможности мышце полноценно расслабиться в стадии диастолы.
Компенсируя данные факторы, сердечная мышца накачивает объем. Таким образом, нагрузка давлением вызывает концентрическое ремоделирование миокарда левого желудочка.
Занятие динамическими видами спорта, развивающими выносливость, может привести к развитию эксцентрического ремоделирования мышцы сердца, которое состоит в увеличении длины и ширины кардиомиоцитов. Данный процесс является компенсаторной мерой сердечной мышцы на возврат увеличенного объема венозной крови и вызван необходимостью перемещать ее резко возросший объем в артерии.
Кроме спортсменов и людей тяжелого физического труда в группу риска входят:
Факторы регулирующие процесс ремоделирования
Симпатическая нервная система
Циркуляторная гипоксия, развивающаяся при сердечной недостаточности, вызывает активацию симпатической нервной системы, имеющую адаптивный характер и направленную на поддержание сердечного выброса (благодаря положительным хроно- и инотропным эффектам катехоламинов) и артериального давления. Однако пролонгация такой относительно несовершенной, т. к. используют лишь предуготовленные довольно лимитированные в своих возможностях компенсаторные механизмы, адаптации может придать ей патогенный характер из-за ее способности обусловливать прогрессирование ремоделирования и, таким образом, усугублять выраженность сердечной недостаточности.
Периферическая артериальная вазоконстрикция, наиболее выраженная в почках, висцеральных органах, коже и скелетных мышцах, направлена в основном на централизацию кровообращения, т. е. на сохранение притока крови к сердцу и головному мозгу.
Вазоконстрикция приводит к увеличению периферического сопротивления и, следовательно, постнагрузки на сердце. Вместе с тем, возможно также увеличение преднагрузки, т. к. при активации симпатической нервной системы повышается тонус венозных сосудов, что детерминирует увеличение притока крови к сердцу. Кроме того, неблагоприятные последствия пролонгированной активации симпатической нервной системы обусловлены повышением потребности миокарда в кислороде и энергетических субстратах, а также усилением в нем процессов перекисного окисления липидов (конечный продукт распада катехоламинов — ксантин является источником активных форм кислорода) и развитием проаритмогенного эффекта катехоламинов.
На более поздних этапах ремоделирования активированная симпатическая нервная система влияет на процессы реэкспрессии фетальных генов и гипертрофии кардиомиоцитов. В ряде исследований зафиксировано, что повышенный уровень циркулирующего норадреналина коррелирует с неблагоприятным долговременным прогнозом сердечной недостаточости у пациентов с дисфункцией левого желудочка, а использование (3-адреноблокаторов снижает летальность при данной форме патологии не только благодаря их антиаритмическому действию, но и способности тормозить процесс ремоделирования левого желудочка. Например, обнаружено, что (З-адреноблокатор метопролол может вызывать редукцию объема и регрессию массы левого желудочка, улучшая тем самым его геометрию.
Ренин-ангиотензин-алъдостероновая система
Спустя нескольких часов после начала развития острой сердечной недостаточности юкстагломеру-лярный аппарат (ЮГА) в почках увеличивает синтез ренина в ответ на снижение перфузии клубочков, точнее на снижение пульсового давления в v. afferens, которое отслеживают механорецепторы ЮГА, и активацию симпатико-адреналовой системы (в ЮГА имеются |32-адренорецепторы).
Таким образом включается ренин-ангиотензин-альдостероновая система (РААС). Современные научные данные свидетельствуют о параллельном функционировании гуморальной (циркулирующей) и тканевой (локальной) РААС. Локальные РААС функционируют в органах-мишенях, прежде всего в сердце, почках, мозге, сосудах, периферической мускулатуре. Ренин катализирует деградацию ангиотензиногена (относится к а2-глобулинам, синтезируется в печени) в гормон ангиотензин I, который затем при воздействии ангиотензин-превращающегося фермента (АПФ), находящегося в легких, почках и плазме, преобразуется в ангиотензин II.
Ген АПФ картирован в хромосоме 17q23. Различают две формы АПФ: мембранно-связанную (кининаза-2), которая обнаружена в макрофагах, Т-лимфоцитах, фибробластах; эпителиальных клетках почек, кишечника, плаценты, репродуктивных органах, и гуморальную (кининаза-1), которая образуется в различных тканях и органах, в основном, в эндотелии кровеносных сосудов легких.
В настоящее время установлено, что наряду с АПФ-зависимым механизмом преобразования ангиотензина I в ангиотензин II, существуют альтернативные пути — с участием химаз, катепсина G, тонина и других сериновых протеаз. Химазы, или химотрипсиноподобные протеазы, представляют собой гликопротеины с молекулярной массой около 30 000, обладают высокой специфичностью по отношению к ангиотензину.
В разных органах и тканях преобладают либо АПФ-зависимый, либо альтернативные пути образования ангиотензина И. Так, в ткани миокарда человека обнаружена кардиальная се-ринпротеаза. При этом доказано, что наибольшее количество данного фермента содержится в миокарде левого желудочка, где на долю химазного пути трансформации ангиотензину I приходится более 80%. Химазозависимое образование ангиотензина II превалирует также в миокардиальном интер-стиции, адвентиции и медии сосудов, тогда как АПФ-зависимое — в плазме крови.
Полагают, что активация альтернативных путей образования ангиотензина II играет большую роль в процессах сердечно-сосудистого ремоделирования. AT II является мощным вазоконстриктором, повышающим артериальное давление и стимулирующим секрецию альдостерона. Биологические эффекты ангиотензина II осуществляются через ряд рецепторов: I типа (имеются подтипы А и В) и II типа. Активация рецепторов 1 типа вызывает вазоконстрикцию и пролиферацию гладкомышечных клеток, а также стимуляцию процесса ремоделирования органов-мишеней.
На клеточном уровне AT II выступает в качестве индуктора синтеза трансформирующего фактора роста-р (ТФР-Р), который в свою очередь стимулирует хемотаксис макрофагов и фибробластов, индуцируя воспаление и активируя миофи-бробласты. Последние начинают синтезировать в избыточном количестве компоненты экстрацеллюлярного матрикса, что приводит к ускорению фиброзной перестройки сердечно-сосудистой системы. Структурные изменения стенок коронарных сосудов при воздействии AT II обусловлены пролиферацией гладкомышечных клеток и интерстициальных фибробластов, а также увеличением синтеза компонентов экстрацеллюлярного, соединительнотканного матрикса.
Из AT II образуется его метаболит АТШ, который обладает слабовыраженным прессорным свойством, но в значительной степени стимулирует секрецию альдостерона корой надпочечников. Альдо-стерон участвует в процессах задержки в организме ионов натрия, развитии вторичного гиперальдостеронизма и является фактором стабилизации АГ. Альдостерон обладает значительным профиброгенным эффектом, участвует в процессах ремоделирования левого желудочка сердца и сосудистой стенки, способствует развитию в органах-мишенях фиброза и функциональной недостаточности.
Антидиуретический гормон
Антидиуретический гормон (АДГ) — это пептид, состоящий из 9 аминокислотных остатков. У большинства млекопитающих, включая человека, в позиции 8 находится аргинин, такую форму АДГ обозначают, как аргинин-вазопрессин (AVP). Через VlA-рецепторы вазопрессин способен повышать сосудистый тонус. При физиологических концентрациях гормона его прессорный сосудистый эффект невелик.
В больших концентрациях АДГ вызывает спазмирование артериол, что приводит к увеличению АД и соответственно общего периферического сопротивления сосудов, отсюда название гормона — вазопрессин. Кроме того, АДГ поддерживает на должном уровне факультативную реабсорбцию воды в почках, уменьшая при этом диурез (антидиуретический эффект). АДГ образуется в супраоптическом и паравентрикулярном ядрах гипоталамуса, депонируется в задней доле гипофиза, откуда выделяется в кровь при возбуждении осморецепторов гипоталамуса.
При повышении осмотического давления плазмы АДГ выходит в кровь из нейрогипофиза. Способствуя реабсорбции воды в почечных канальцах, АДГ тем самым поддерживает венозный возврат к сердцу, т.е. его преднагрузку Такой эффект АДГ может иметь патогенное влияние на сердце в долгосрочной перспективе, особенно в условиях развития сердечной недостаточности.
К другим факторам, регулирующим процесс ремоделирования, относят натрийуретические пептиды, эндотелин 1, про воспалительные цитокины, оксид азота.
Натрийуретические пептиды
Различают три основных представителя семейства натрийуретических пептидов — предсердный, мозговой и С-конце-вой предсердный. При уменьшении сердечного выброса у больных с дисфункцией левого желудочка, а также при хронической сердечной недостаточности синтез натрийуретических пептидов увеличивается. Предсердный натрийуретический пептид выделяется в ответ на увеличение объема и давления в предсердиях. Мозговой натрийуретический пептид (тип В) образуется в головном мозге при растяжении его желудочков. Периферическая вазодилатация и натрийурез, вызываемые предсердным и мозговым натрийуретическими пептидами, противодействуют эффектам активации симпатической нервной системы и РААС, т.е. системной и почечной вазоконстрикции, задержке натрия и воды. В дополнение к их раннему благоприятному воздействию на гемодинамику, баланс жидкости и диурез, по данным некоторых экспериментальных исследований, долговременным эффектом натрийуретических пептидов может быть подавление гипертрофии кардиомиоцитов и. следовательно, создание благоприятных условий для «полезного» ремоделирования.
Эндотелии
Продуцентами этого пептидного гормона, представленного тремя изоформами, являются. Эндотелии является одним из сильнейших вазоконстрикторов; он гораздо более активен, чем ангиотензин II. Повышение уровня эндотелина в крови может быть причиной возникновения и утяжеления ишемической болезни сердца. В ряде исследований зафиксирован благоприятный результат блокады рецепторов к эндотелину у пациентов с сердечной недостаточностью. Не случайно поэтому эндотелии является маркером коронарного атеросклероза и эндотелиальной дисфункции коронарных сосудов.
В экспериментах установлено, что коррекция эндотелиальной дисфункции приводит к уменьшению массы миокарда левого желудочка, улучшению коронарной гемодинамики, увеличению силы сокращения миокарда, а также к подавлению синтеза внеклеточного матрикса фибробластов, что уменьшает степень выраженности периваскулярного фиброза венечных сосудов и предотвращает развитие интерстициального ремоделирования сердца.
Результаты исследования SOLVD (от англ., Studies of Left Nfentricular Dysfunction — Исследования дисфункции левого желудочка) подтвердили, что у пациентов с прогрессирующей сердечной недостаточностью повышается уровень провоспалительных цитокинов (ФНО-а, ИЛ-1, ИЛ-6 и др.), а за рубежом по критерию преимущественной «лекарственной терапии» XXI в. называют «веком иитокиновой терапии» В медицинском мире работы по изучению процесса ремоделирования продолжаются с перспективой использования их результатов для повышения эффективности патогенетической терапии пациентов с сердечно-сосудистой патологией.
Оценка ремоделирования
Установлено,что ремоделирование происходит на всех уровнях структурно-функциональной организации сердца и выражается в изменениях его размеров, формы и функциональных возможностей. Патофизиологический анализ и клиническую оценку ремоделирования левого желудочка проводят на основании измерения его линейных размеров и расчета ряда объемных показателей: индексов относительной толщины стенки, сферичности, миокардиального напряжения, нарушения желудочковой сократимости.
В настоящее время наиболее часто применяют методы определения геометрии и функциональных возможностей сердца: двухмерную эхокардиографию, магнитно-резонансную томографию и радионуклидную вентрикулографию. Необходимым условием динамического контроля за процессом ремоделирования является использование одного и того же метода в последовательных наблюдениях за состоянием левого желудочка каждого обследуемого пациента. Геометрия (архитектура) желудочка играет центральную роль в нормальной его функции и в процессе ремоделирования при различных заболеваниях сердечно-сосудистой системы.
При ухудшении насосной функции желудочков сердца увеличение преднагрузки направлено на под держание сердечного выброса. Длительная перегрузка инициирует ремоделирование левого желудочка: он становится более эллиптоидным, расширяется и гипертрофируется. Будучи изначально компенсаторными, эти изменения, которые иногда называют миокардиальным стрессом, со временем приводят к увеличению диастолической ригидности и напряжения стенки желудочка, что нарушает насосную функцию сердца, особенно во время физических нагрузок.
Увеличенное напряжение миокарда повышает потребность в макроэргах и при определенной степени развивающего дефицита энергии активирует апоптоз миокардиальных клеток. Итак, утрата нормальной эллипсоидной формы желудочка является ранним морфологическим признаком повреждения сердца, которая может стать пусковым стимулом развития хронической сердечной недостаточности.
Ремоделирование сердца предшествует клиническим проявлениям сердечной недостаточности и сопутствует им, т. к. способно усугублять систолическую и диастолическую дисфункции желудочка. На определенном этапе развития синдром ремоделированного сердца (другое его редкое название синдром «структурной кардиомиопатии») отодвигает на второй план значимость этиологического фактора, т.е. причины повреждения сердца, приводящего к развитию сердечной недостаточности.
На первый план выходит синдром «структурной кардиомиопатии» — патогенетический фактор сердечной недостаточности, определяющий механизмы ее развития, прогноз данной формы патологии и качество жизни больных. Изучение и понимание адаптивной и патогенетической роли ремоделирования сердца в каждом конкретном случае необходимо для избежания необоснованных терапевтических вмешательств, т.е. для оптимизации лечения пациентов с сердечно-сосудистой патологией.
Причины возникновения
Начальной стадией ремоделирования сердечной мышцы является увеличение массы мышечного слоя левого желудочка. Изменения в миокарде могут происходить в одном из двух направлений:
Данные процессы, зачастую, запускают люди, которые неправильно распределяют физические нагрузки. Так, утолщение мышцы данного органа происходит у тех, кто тренируется чересчур интенсивно, особенно это относится к игровым видам спорта и к тем, где требуется применение силы. В данном случае, резко возрастает необходимость клеток в кислороде, поэтому сердце вынуждено в ускоренном режиме выталкивать богатую кислородом кровь в артерии, преодолевая усиленное сопротивление, что не дает возможности мышце полноценно расслабиться в стадии диастолы.
Компенсируя данные факторы, сердечная мышца накачивает объем. Таким образом, нагрузка давлением вызывает концентрическое ремоделирование миокарда левого желудочка.
Занятие динамическими видами спорта, развивающими выносливость, может привести к развитию эксцентрического ремоделирования мышцы сердца, которое состоит в увеличении длины и ширины кардиомиоцитов. Данный процесс является компенсаторной мерой сердечной мышцы на возврат увеличенного объема венозной крови и вызван необходимостью перемещать ее резко возросший объем в артерии.
Кроме спортсменов и людей тяжелого физического труда в группу риска входят:
Концентрическая форма
Концентрическое ремоделирование миокарда левого желудочка – это достаточно распространенное заключение, которое применяется по отношению к пациентам с гипертензией. Начинается процесс с гипертрофии ЛЖ, которая проявляется увеличением толщины его стенки. Также отмечаются изменения в перегородке. Внутреннее пространство не изменено.
Нужно отметить, что причиной ГЛЖ может стать не только стойкое повышение артериального давления, но и другие факторы, такие как:
Таким образом, сделаем заключение – для предотвращения запуска процесса ремоделирования миокарда необходимо как можно раньше диагностировать гипертоническую болезнь или ГЛЖ и заняться их эффективным лечением. Чтобы это сделать, требуется изучить симптомы, которые могут сказать о наличии подобных заболеваний, это:
Если имеют место подобные признаки, необходимо обратиться за медицинской помощью, пройти полноценное обследование, позволяющее получить полную информацию о состоянии собственного здоровья.
Важно! Главным методом диагностики остается электрокардиография. Она позволяет определить ремоделирование миокарда по повышенному сегменту
STи сниженному либо полностью отсутствующему зубцуR. Подобные показатели свидетельствуют про концентрический тип патологического состояния, могут указывать на перенесенный инфаркт, что усугубляет положение.