Кортизол чем понизить препараты
Дисфункция надпочечников. Человек Уставший, продолжение.
Дисфункция – это как предболезнь. Заболевание еще не развилось, а жалобы есть, но они стертые, поэтому человеку плохо, но он не может понять, что с ним и с каким органом это состояние связать.
В современном обществе формируется неправильная тенденция социального поведения. Тебя постоянно подгоняют «еще, еще. больше работай, будь успешным, делай карьеру, но не забудь про семью, роди 2-3 детей (надо поднимать демографию страны), имей хобби, выучи языки, имей 2 образования, занимайся спортом, путешествуй, не забывай посещать театр (для кого-то ночной клуб, дискотеку), води машину и т.д.»
И как, скажите мне, человеку выдержать такой прессинг? Ни малейшего времени на передышку, на созерцание. Резервы организма ИМЕЮТ ПРЕДЕЛ, и у каждого свой срок «до срыва». И этим пределом часто является истощение функции надпочечников, одного из важнейших эндокринных органов.
Какими же симптомами дисфункция надпочечников может выражаться: (симптомы могут быть разной степени выраженности от минимальных до максимальных)
Как проверить работу надпочечников?
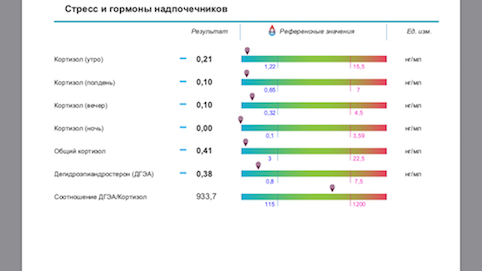
До 2015 года основным способом были: анализ крови на кортизол, АКТГ по часам 8:00- 24:00 (или еще промежуточно 13:00) и сбор суточной мочи на кортизол, кровь на ДГА-С. Это было крайне неудобно. Ни одна лаборатория, кроме расположенных в стационаре, кортизол в 24:00 не брала. А без этого показателя оценить функцию надпочечников правильно не возможно. Собирать суточную мочу не все соглашались, очень трудоемко и может быть не так достоверно.
С 2015-2016 года появился метод оценки кортизола слюны.
Собирается суточный профиль слюны на кортизол по 4 точкам 8:00- 13:00 и 17:00- 24:00.
Ниже привожу материал лаборатории «CHROMOLAB» по исследованию состояния надпочечников и его интерпретации.
«Организм человека постоянно подвергается воздействию различных факторов внешней и внутренней среды. Это могут быть абиотические факторы, такие как холод, жара, атмосферное давление, влажность, недостаток кислорода. Избыток или дефицит поступающих в организм веществ (белков, углеводов, липидов), недостаток витаминов и микроэлементов, вирусная или микробная инфекция, токсины также оказывают определенное влияние. Негативные последствия имеют вредные привычки, физическая перегрузка, переедание, гиподинамия, нарушение ритма сна и бодрствования. Кроме того, к серьезным стрессорам относят техногенные и психологические воздействия: переизбыток компьютерной и телевизионной информации, монотонный труд, конфликты, чрезмерную рабочую нагрузку, эмоциональное истощение, завышенный уровень ответственности, общую неудовлетворенность и прочее. Все эти и многие другие причины ведут к постоянному напряжению физиологических резервов организма, который вынужден приспосабливаться (адаптироваться) к этим факторам или защищаться. Если воздействия носят интенсивный, внезапный или незнакомый («новый») характер, то организм отвечает на них универсальной (в формате «скорой помощи») физиологической реакцией, называемой СТРЕССОМ (стрессорной реакцией). Стрессорная реакция не связана с положительным или отрицательным восприятием внешних раздражителей, с которыми сталкивается человек. Она необходима для скорейшей адаптации организма с целью его защиты от гибели. Стресс – это защитная реакция организма. Однако длительная стрессорная реакция приводит к избыточному нерегулируемому ответу организма на повреждающий фактор и обратному эффекту. Вместо защитных процессов активируются деструктивные, что может стать пусковым механизмом для развития патологических состояний: сахарного диабета, тромбозов, инсультов, инфарктов, аритмии, бесплодия, эректильной дисфункции, аллергии, онкологических заболеваний, иммунодефицитов, ранней менопаузы, остеопороза, гипотиреоза, бессонницы, депрессии, ожирения, анорексии и многого другого. Стресс инициирует различные патологические состояния, и это зависит от провоцирующих факторов внешней и внутренней среды.»
Стадийность стрессорных реакций. Выделяют три стадии стресса (согласно Г. Селье):
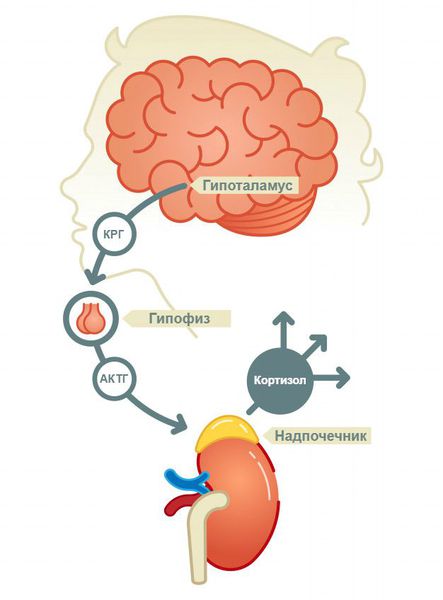
Глубокое понимание механизмов регуляции стресса стало возможным благодаря исследованию процессов синтеза, обмена и метаболизма стероидных гормонов коры надпочечников: кортизола и дегидроэпиандростерона (ДГЭА), которые регулируют реализацию стрессорной реакции.
Согласно современным исследованиям, физиологический смысл этого феномена заключается в том, что ДГЭА – это мощный естественный антиглюкокортикоид, противостоящий кортизолу, уровень которого резко повышается при любом стрессе. Известно, что отношение ДГЭА к кортизолу следует рассматривать как ключевой маркер устойчивости организма к любому стрессу, для обеспечения которой в целях адекватной защиты в организме всегда должен превалировать уровень ДГЭА.
Оценку суточного ритма секреции кортизола по его концентрации в слюне (4-кратное определение в течение дня в разных порциях слюны) применяют для отличия стрессорной реакции от иных патологических состояний, связанных с дисфункцией секреции стероидных гормонов.
Оценка проводится только врачом.
Известно, что уровень кортизола – величина непостоянная, и он подвержен колебаниям в течение суток.
С 7 до 9 часов утра концентрация кортизола максимальна, в связи с чем утренний уровень этого гормона считается хорошим индикатором для определения функционального состояния надпочечников.
С 11 часов утра до 13 часов дня концентрация кортизола возвращается к среднему значению, что служит показателем адаптивной функции надпочечников.
С 15 до 17 часов дня уровень кортизола постепенно опускается.
С 22 часов вечера до полуночи концентрация гормона находится на самом низком уровне, что отражает нормальную надпочечниковую функцию.
Такое развернутое исследование надпочечников поможет определиться с диагнозом, нет ли здесь дебюта надпочечниковой недостаточности или это просто дисфункция и определиться с лечебной тактикой. Ведь кому-то надо будет отдохнуть и правильно питаться. А кому-то понадобится подобрать препараты гормонов надпочечников сроком от 1,5-3-х месяцев до пожизненной терапии при выявленной надпочечниковой недостаточности. Радует то, что надпочечниковая недостаточность встречается очень редко.
НО очень часто встречается дисфункция.
Особенную благодарность в идее составления этой статьи выражаю своему учителю Гострому Андрею Владимировичу.
Синдром Кушинга: как поставить диагноз
В каких случаях врач общей практики должен заподозрить синдром Кушинга? Как подтвердить диагноз? Нужно ли отменять короткие курсы экзогенных кортикостероидов постепенно? Рисунок 1. Плетора и лунообразность лица, присущие синдрому К
В каких случаях врач общей практики должен заподозрить синдром Кушинга?
Как подтвердить диагноз?
Нужно ли отменять короткие курсы экзогенных кортикостероидов постепенно?
 |
| Рисунок 1. Плетора и лунообразность лица, присущие синдрому Кушинга |
Есть прекрасное определение, позволяющее различить синдром Кушинга (СК) и болезнь Кушинга (БК). Описанный впервые Гарви Кушингом в 1912 году, синдром Кушинга объединяет симптомы, вызываемые постоянно повышенным уровнем свободного кортизола в крови. Понятие «болезнь Кушинга» оставлено за особым гипофизарным АКТГ-зависимым подтипом синдрома.
Ярко выраженный СК не представляет особых диагностических трудностей, но заболевание с умеренными проявлениями может вызвать у врача общей практики ряд проблем. Диагноз ставится клинически, а подтверждается данными лабораторных исследований.
Большинство случаев СК имеет ятрогенное происхождение и обусловлено длительным приемом преднизолона, дексаметазона или других кортикостероидов. К развитию клинических проявлений заболевания приводит ежедневное применение кортикостероидов в дозах, превышающих эквивалент 7,5 мг преднизолона.
Детям для развития кушингоидных черт достаточно меньших доз.
Хотя СК встречается относительно редко, любой врач общей практики сталкивается с его ятрогенными случаями, вызванными длительным приемом кортикостероидов по поводу таких распространенных заболеваний, как, например, ревматоидный артрит.
Таблица 1. Симптомы синдрома Кушинга (в порядке частоты встречаемости)
БК — наиболее распространенная причина неятрогенного СК (70%); оставшиеся 30% приходятся на случаи эктопической секреции АКТГ и надпочечниковое происхождение болезни (АКТГ-независимый СК).
Клиническая картина. Симптомы СК (см. табл. 1) могут, в зависимости от причины, развиваться остро или исподволь в течение нескольких лет.
Как правило, симптомы неспецифичны и включают сонливость, депрессию, увеличение веса, жажду, полиурию, слабость, легкость появления синяков и гирсутизм [1].
К классическим признакам СК у взрослых относятся «лунообразное» лицо (рис. 1), центральное ожирение (рис. 2), плетора лица, буйволиный горб, надключичные жировые подушечки и периферические отеки. У детей самым ранним признаком служит задержка роста; нормальная кривая роста фактически исключает СК [2].
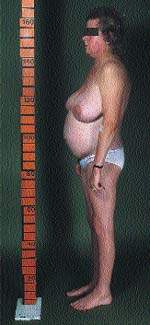 |
| Рисунок 2. Типичная конституция пациента с СК. Обратите внимание на центральное ожирение и относительно тонкие руки и ноги, что вызвано проксимальной миопатией |
Конечно, ожирение в общей практике встречается часто, и трудность состоит в том, чтобы отличить общее ожирение от центрального. Главным признаком является накопление жира в центральной части тела с одновременной его потерей на бедрах, ягодицах и руках. Атрофия поперечнополосатых мышц обусловливает внешний вид пациента, подобный «лимону на палочках».
Еще одним клиническим признаком СК служат истончение кожи и ломкость капилляров, приводящие к легкому и часто спонтанному образованию синяков. Таким больным присущи кожные инфекции, например отрубевидный лишай, молочница и онихомикоз, причем кожные повреждения заживают с трудом. Почти всегда можно обнаружить абдоминальные стрии, развивающиеся вторично за счет центрального ожирения (рис. 3).
Больные могут страдать от гирсутизма вследствие избыточного образования надпочечниковых андрогенов под воздействием повышенного АКТГ.
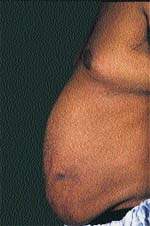 |
| Рисунок 3. Стрии живота у мужчины с СК |
Метаболические изменения, вызываемые повышенным уровнем кортизола, приводят к развитию сахарного диабета, гипертензии и дислипидемии. С длительным повышением циркулирующего в крови кортизола связано также уменьшение минеральной плотности костей и остеопороз.
Биохимическое подтверждение. Важно исключить использование кортикостероидных препаратов и злоупотребление алкоголем («алкогольный псевдо-Кушинг»).
Применение стероидных ингаляторов (например, беклометазона в дозе 200 мкг каждые 6 часов в течение более чем трех месяцев) и других местных стероидных препаратов может приводить к значительному системному всасыванию и развитию клинических проявлений СК с подавлением гипоталамо-гипофизарно-адреналовой оси.
Если пациент не принимает подобных лекарств, первым шагом будет подтверждение избытка кортизола путем определения свободного кортизола мочи (СКМ) в двух суточных пробах [3].
Следующая задача — показать, что эндогенная секреция кортизола не подавлена экзогенными глюкокортикоидами. Для этого проводится ночная дексаметазоновая проба (ДП): в 11 часов вечера пациент принимает 1 мг дексаметазона, а на следующее утро между 8 и 9 часами берется проба крови на кортизол. СК предполагается в том случае, если уровень кортизола не упал ниже 50 нмоль/л. Однако вследствие низкой специфичности теста могут быть ложноположительные результаты.
Направление к специалисту. При подозрении на СК необходимо сразу же направить пациента к эндокринологу. После направления, как правило, дважды проводится определение СКМ и выполняется более специфическое исследование — проба с дексаметазоном в низкой дозе (ДПНД) [4]. Пациент принимает по 0,5 мг дексаметазона восемь раз каждые 6 часов. Отсутствие падения кортизола ниже 50 нмоль/л в 9 часов утра по окончании ДПНД указывает на СК.
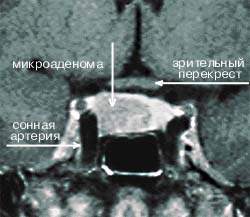 |
| Рисунок 4. МР-томограмма гипофиза, на которой видна правосторонняя микроаденома, секретирующая АКТГ (гипофиз-зависимая болезнь Кушинга) |
Определение СКМ дает нормальные результаты практически постоянно, если у пациента циклический СК (то есть активность заболевания нарастает и падает в течение недель или месяцев), поэтому данное исследование считается низкочувствительным. Более важная проба — ДПНД, и при обнаружении отклонений от нормы пациента следует направить на дальнейшее обследование.
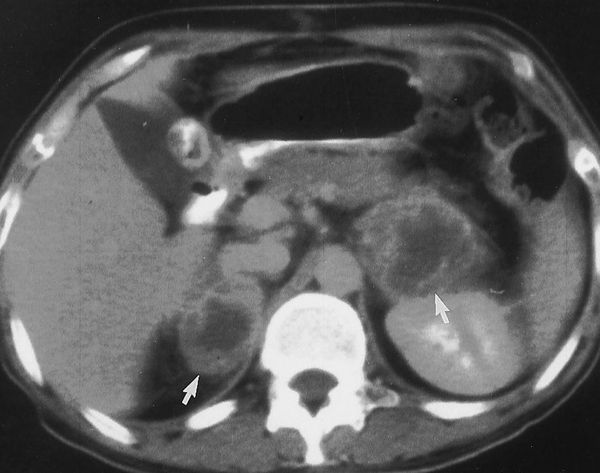
Амбулаторные исследования включают изучение суточного ритма кортизола (рис. 5), дексаметазоновую пробу с высокой дозой [5] (ДПВД, рис. 6) и определение кортикотропин-рилизинг гормона (КРГ). Подтверждение гипофиз-зависимого заболевания основывается на заборе крови из нижнего каменистого синуса для определения в ней уровня АКТГ и последующего введения КРГ [6, 7]. Как правило, требуется визуализация: компьютерное сканирование надпочечников, чтобы дифференцировать надпочечниковое и АКТГ-зависимое состояние; МР-томография гипофиза (рис. 4); компьютерное сканирование грудной клетки и брюшной полости при подозрении на эктопическую секрецию АКТГ.
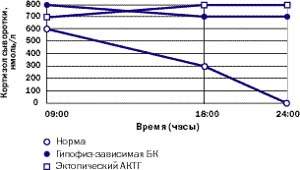 |
| Рисунок 5. Так выглядит типичный суточный ритм кортизола у здорового человека, пациента с БК и пациента с эктопическим СК |
Лечение СК зависит от причины заболевания. Методом выбора при БК служит селективная транссфеноидальная микроаденомэктомия: излечения удается добиться в 80% случаев (эффективным лечение считается тогда, когда наличие кортизола через 24-48 часов после операции не обнаруживается) [8].
При успешном исходе операции по поводу БК пациенту понадобится заместительный курс гидрокортизона, пока не восстановится его собственная гипоталамо-гипофизарно-надпочечниковая (ГГН) функция. Как правило, достаточно 20 мг гидрокортизона утром и 10 мг — в 6 часов вечера.
В случае обнаружения аденомы надпочечников показана односторонняя адреналэктомия. Железа с другой стороны оказывается атрофичной (по принципу обратной связи) в результате длительного подавления секрецией АКТГ, поэтому пациенту также понадобится заместительная терапия гидрокортизоном вплоть до восстановления ГГН.
Эктопические АКТГ-секретирующие опухоли (например, карциноиды бронхов или тимуса) требуют удаления. После операции вновь проводится гидрокортизоновое прикрытие. Процесс включения ГГН может занять несколько месяцев. При отсутствии эффекта от операции проводят облучение гипофиза из внешнего источника (4500 Гр в 25 сериях).
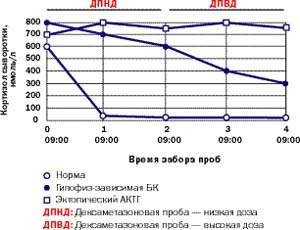 |
| Рисунок 6. Типичные реакции кортизола на дексаметазоновую супрессию низкими (0,5 мг каждые 6 часов в течение 48 часов) и высокими дозами (2 мг каждые 6 часов в течение 48 часов) у здорового человека, пациента с БК и пациента с эктопическим СК |
Если есть противопоказания к проведению оперативного вмешательства, связанные непосредственно с СК, снизить уровень кортизола можно кетоконазолом (начиная с 200 мг). Дозы препаратов подбирают индивидуально, ориентируясь на средний уровень кортизола 200-300 нмоль/л.
После медикаментозного лечения пациент может успешно перенести операцию. При отказе от операции остается возможность длительного лечения кетоконазолом, проводящимся под наблюдением госпитального эндокринолога.
Двусторонняя адреналэктомия проводится только в самых тяжелых случаях, когда безуспешно испробованы все остальные методы. Она неизбежно приводит к необходимости пожизненной заместительной терапии кортикостероидами и минералокортикоидами.
Ведение больных с СК. Самая распространенная причина СК — ятрогенная, особенно если доза принимаемых внутрь стероидов превышает эквивалент 7,5 мг преднизолона у взрослых.
Для профилактики остеопороза пациентам, принимающим стероиды более шести месяцев, назначают бисфосфонаты.
Решение о снижении дозы стероида следует принимать, проконсультировавшись с соответствующим специалистом. Экзогенные стероиды, назначаемые коротким курсом (менее 6 недель), редко вызывают клинически значимую надпочечниковую супрессию, поэтому их можно резко отменять.
При подозрении на неятрогенный СК измерение СКМ и ночная ДП могут помочь в подтверждении этого диагноза (vide supra). Но пациента, у которого обнаружены клинические признаки неятрогенного СК (см. табл.), рекомендуется обязательно направить к эндокринологу.
Случай из практики
Друзья и члены семьи 24-летней женщины заметили, что она полнеет и как бы «сама не своя». Она часто находилась в подавленном настроении и с трудом могла сосредоточиться на своей работе.
Врач общей практики, к которому она обратилась, отметил «лунообразное лицо» и умеренный гирсутизм. Артериальное давление, прежде нормальное, составляло 150/100 мм рт. ст.
Она была срочно направлена к эндокринологу по месту жительства. При обследовании выявлена повышенная суточная экскреция с мочой свободного кортизола и потеря суточного кортизольного ритма. Дексаметазоновая проба не выявила супрессии ни при низкой, ни при высокой дозе дексаметазона; реакция кортизола на экзогенный КРГ оказалась плоской.
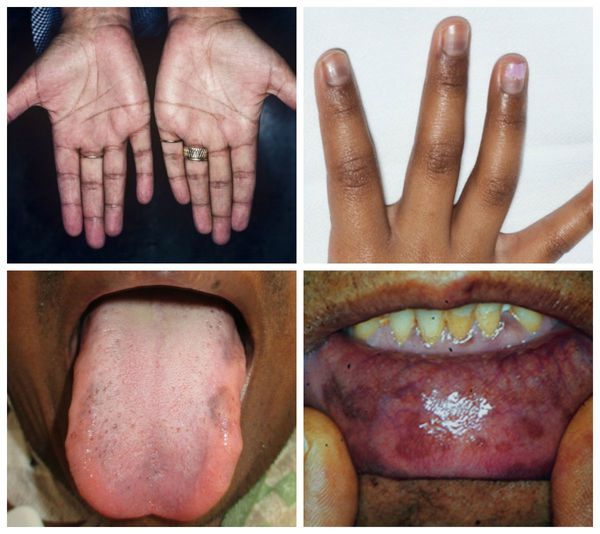
МРТ-скан гипофиза был нормальным, а при компьютерном сканировании брюшной полости обнаружены утолщенные гиперплазированные надпочечники, характерные для АКТГ-зависимости. Пигментация ладонных складок также подтверждала повышение продукции АКТГ.
Был поставлен клинический и биохимический диагноз эктопического АКТГ-синдрома, и больную отправили в соответствующий центр. Компьютерное сканирование грудной клетки выявило опухоль размером 1 см в верхушке правого легкого, которая была удалена под прикрытием гидрокортизона.
После четырехмесячного курса преднизолона (5 мг на ночь и 2,5 мг днем) наблюдалось восстановление ее ГГН-оси, и стероиды постепенно отменили. Тело приобрело нормальные формы в течение 6 месяцев, восстановилась супрессорная активность дексаметазона.
Стероидные гормоны при психических расстройствах ( по результатам исследований нашей клиники)
Прегненолон — стероидный гормон, первый метаболит в цепочке стероидогенеза. Образуется из холестерина и служит прекурсором 17-гидроксипрегненолону и прогестерону, которые, в свою очередь, преобразуются в другие стероиды. Помимо участия в гормональной системе, прегненолон воздействует на процессы центральной нервной системы, являясь нейростероидом. У мужчин и женщин прегненолон, продуцируемый в надпочечниках, имеет высокую вероятность (но не 100%) преобразования в дегидроэпиандростерон (DHЕA) или кортизол. У мужчин прегненолон, продуцируемый в яичках, имеет высокую вероятность превращения в тестостерон, а прегненолон, образованный в женских яичниках, возможно, будет преобразован в эстроген. Возможно, повышение уровня этого гормона у наших пациентов связано с активацией стероидогенеза на его начальных этапах и представляет собой компенсаторную защитную реакцию организма на возникновение психического расстройства.
Андростендион — основной андроген, секретируемый яичниками. Также в небольших количествах андростендион секретируется корой надпочечников у обоих полов и яичками у мужчин. Андрогенное действие андростендиона значительно слабее, чем у тестостерона.
Выделившийся в кровь кортизол достигает клеток-мишеней (в частности, клеток печени). Благодаря своей липофильной природе легко проникает через клеточную мембрану в цитоплазму и ядро, где связывается со специфическими рецепторами. Гормон-рецепторный комплекс является фактором транскрипции, — активирует транскрипцию определённых участков ДНК. В результате синтез глюкозы в гепатоцитах усиливается, тогда как в мышцах снижается распад глюкозы. В клетках печени глюкоза запасается в виде гликогена. Таким образом, эффект кортизола состоит в сохранении энергетических ресурсов организма.
По принципу отрицательной обратной связи повышение уровня кортизола в крови снижает секрецию кортиколиберина (а значит, и АКТГ).
Уровень кортизола изменяется в зависимости от времени суток, а также стадии менструального цикла (у женщин), поэтому важно знать оптимальное время для сдачи анализа крови для проверки уровня кортизола.
Что такое надпочечниковая недостаточность (гипокортицизм)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Зотовой Ю. А., эндокринолога со стажем в 24 года.
Определение болезни. Причины заболевания
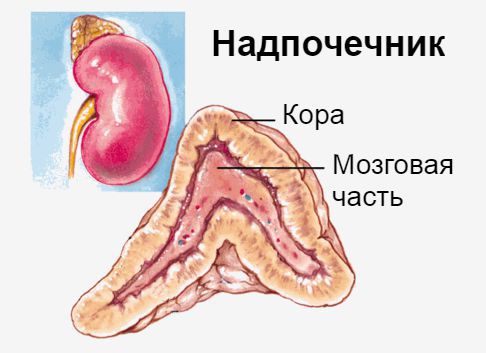
Надпочечники — это эндокринные железы. Их внутренняя (мозговая) часть производит гормон адреналин, который мобилизует все защитные силы организма. Наружная часть надпочечников — кора — вырабатывает кортикостероиды:
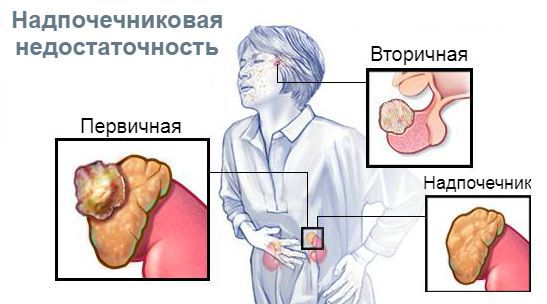
Причины первичной надпочечниковой недостаточности:
1. Нарушение развития надпочечников:
2. Деструкция надпочечников (разрушение):
3. Нарушения стероидогенеза (образования стероидов):
Причины вторичной и третичной надпочечниковой недостаточности:
1. Врождённый вторичный гипокортицизм.
2. Деструкция гипоталамо-гипофизарных структур:
Симптомы надпочечниковой недостаточности
Часть симптомов недостаточности маскируется под синдром хронической усталости: необъяснимая утомляемость, отсутствие бодрости в утренние часы. Человек начинает хуже переносить физические нагрузки, самочувствие становится лучше в горизонтальном положении. Астению сопровождает раздражительность, нетерпимость, проблемы с памятью.
Нарушается работа желудочно-кишечного тракта: снижается аппетит вплоть до полного отсутствия, возникает тошнота, рвота, боли в животе. Уменьшение массы тела связано с ухудшением аппетита, нарушением всасывания в кишечнике, обезвоживанием.
При дефиците надпочечниковых андрогенов у женщин снижается либидо, оволосение в подмышечной впадине становится скудным.
В ситуации стресса, острой инфекции, операции значительно повышается потребность организма в гормонах коры надпочечников, поэтому в таких случаях состояние может значительно ухудшиться из-за декомпенсации надпочечниковой недостаточности — опасного для жизни нарушения работы надпочечников, при котором у организма исчерпаны возможности механизмов приспособления. Обращают на себя внимание необычно быстрая утомляемость и чрезмерная усталость, головокружение, очень низкое артериальное давление, тяга к солёной пище, плохой аппетит, тошнота, рвота, понос (диарея), боли в животе, мышечная слабость, похудание без видимых причин, снижение настроения.
Патогенез надпочечниковой недостаточности
Глюко- и минералокортикоиды участвуют в белковом, углеводном, жировом и водно-электролитном обмене. Поэтому при их нехватке данные процессы нарушаются и снижается артериальное давление.
Дефицит альдостерона — естественного минералокортикоида — становится причиной выраженных сердечно-сосудистых нарушений из-за снижения реабсорбции (обратного всасывания) Na+ в почках. В связи с этим уменьшается объём циркулирующей крови и снижается артериальное давление вплоть до шока. При повышении уровня калия нарушается сердечный ритм и развиваются миопатии — заболевания, проявляющиеся мышечной слабостью. При снижении реабсорбции Na+ в кишечнике возникает целый каскад симптомов нарушения пищеварения, таких как боли в животе, нарушение всасывания.
Дефицит андрогенов, которые вырабатывают надпочечники, усиливает процессы распада сложных веществ в организме и повышает уровень остаточного азота.
Отличия центральных форм гипокортицизма от первичного:
Классификация и стадии развития надпочечниковой недостаточности
В зависимости от уровня поражения гипоталамо-гипофизарно-надпочечниковой системы различают три вида надпочечниковой недостаточности:
По клиническому течению выделяют два вида надпочечниковой недостаточности:
При заместительной гормонотерапии первичного хронического гипокортицизма лечащий врач подбирает своему пациенту дозу глюкокортикоидов для возмещения недостающих гормонов, причём важно, чтобы в итоге уровень гормонов был строго в норме — не меньше и не больше.
Если лекарства полностью возмещают дефицит и не дают избытка гормонов в организме, то пациент чувствует себя гораздо лучше. Это означает, что заболевание не излечено раз и навсегда, так как оно хроническое, но находится в фазе компенсации.
Осложнения надпочечниковой недостаточности
Диагностика надпочечниковой недостаточности
Иногда при частичном поражении надпочечников эти показатели остаются в пределах нормы. Чтобы получить более надёжный результат, исследовать функцию коры надпочечников лучше с помощью стимулирующих тестов. Данный этап необходим, если по результатам клинико-лабораторного обследования не удалось однозначно подтвердить наличие надпочечниковой недостаточности.
Лечение надпочечниковой недостаточности
Лечение надпочечниковой недостаточности жизненно необходимо. Оно направлено на ликвидацию процесса, который вызвал поражение надпочечников, и на замещение дефицита гормонов и электролитов.
Все перечисленные препараты всегда нужно принимать строго в определённое время. Пропуск приёма лекарств может быть очень опасен. Если по какой-то причине приём был пропущен, обязательно нужно принять ту же дозу препарата позже или увеличить дозу вдвое.
Если пациенту с недостаточностью предстоит операция, то нужно обязательно обсудить с лечащим врачом изменение дозы: она будет зависеть от сложности вмешательства.
Прогноз. Профилактика
При своевременной диагностике заболевания и адекватном лечении прогноз для жизни благоприятный.
Пациент с этой болезнью может делать всё: учиться, работать, заниматься спортом, иметь семью, как и все здоровые люди. Для этого нужно соблюдать простые правила:
1. Важно всегда иметь при себе информационную карточку. В ней должно быть указано следующее: «У меня надпочечниковая недостаточность. Если я без сознания или у меня судороги, рвота, бред, мне нужно СРОЧНО сделать инъекцию гидрокортизона 100 мг внутримышечно или внутривенно. Промедление опасно для жизни». Также в карточке нужно указать телефон, по которому можно связать с родственниками или лечащим врачом. Эта информация крайне важна для людей или врачей, которые будут помогать в экстренной ситуации.