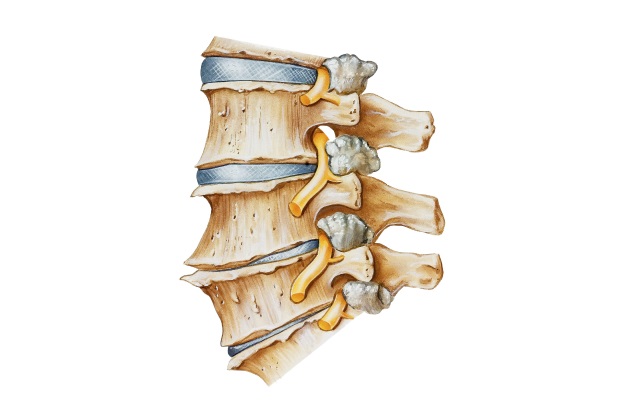
Костный блок позвоночника что это
Применение мезенхимальных стволовых клеток для формирования костного блока (сращения) между позвонками
В ряде случаев пациентам с дегенеративными поражениями и деформациями позвоночника показано выполнение спондилодеза – оперативного вмешательства, направленного на создание неподвижности между смежными позвонками. При наступлении сращения у пациентов наблюдается уменьшение симптомов заболевания и клиническое улучшение.
К сожалению, в некоторых случаях сращение не наступает, что приводит к стойкой инвалидизации пациентов, увеличению стоимости и трудоемкости последующего лечения.
При выявлении псевдоартроза или наличии факторов, которые могут к нему привести, альтернативой традиционным методам лечения является технология применения трансплантата на основе биомедицинского клеточного продукта, разработанная РНПЦ травматологии и ортопедии совместно с РНПЦ трансфузиологии и медицинских биотехнологий и описанная в инструкции по применению № 032-0520 «Метод спондилодеза с использованием биомедицинского клеточного продукта на основе аутологичных мезенхимальных стволовых клеток костного мозга» (утверждена Министерством здравоохранения Республики Беларусь 04.06.2020 г.).
Технология выполнения метода
Этап 1. Получение костного мозга.
В качестве биологического материала для получения биомедицинского клеточного продукта используют костный мозг, полученный по общепринятой методике из грудины или крыла подвздошной кости пациента объемом 20 мл в стерильную пробирку.
Этап 2. Получение биомедицинского клеточного продукта из костного мозга.
Из пунктата костного мозга выделяются мезенхимальные стволовые клетки, которые наращиваются по определенной технологии.
Этап 3. Контроль качества биомедицинского клеточного продукта проводят по следующим показателям:
-подсчет количества и оценка жизнеспособности клеток – жизнеспособность клеток не должна быть ниже 95%;
— оценка подлинности – фенотипический профиль мезенхимальных стволовых клеток определяется по выраженности/отсутствию поверхностных антигенов;
— микробиологический контроль стерильности – проводится после каждого пересева и смены среды в процессе наращивания клеток на автоматическом анализаторе и посевом на питательную среду Сабуро и тиогликолевую среду.
Этап 4. Интраоперационное применение биомедицинского клеточного продукта.
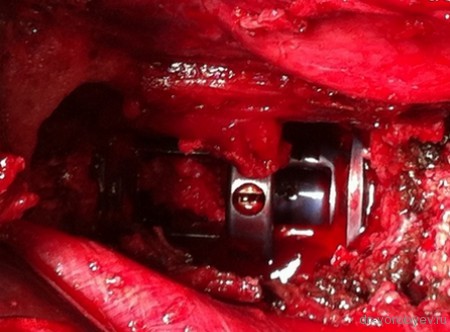
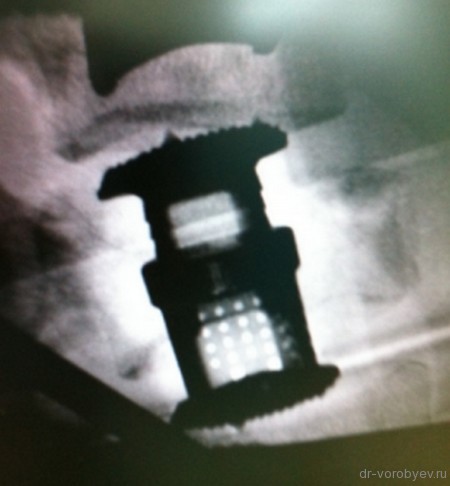
Хирургическая операция выполняется под общей анестезией по общепринятой методике. Основой конструкции служит кейдж или сетчатый имплантат. Для их фиксации могут применяться транспедикулярные винты и пластины. В качестве материала-носителя для биомедицинского клеточного продукта применяется коллагеновая губка. Сетчатый титановый имплантат или кейдж (в зависимости от объема дефекта) заполняется резецируемой костной тканью позвонка и коллагеновой губкой, на которую нанесен биомедицинский клеточный продукт, послойно.
Этап 5. Контроль эффективности лечения.
В раннем послеоперационном периоде (через 3-10 дней после хирургической операции) выполняется рентгеновская компьютерная томография. Для уточнения степени консолидации и корректности стояния имплантатов выполняется: рентгенография через 3 и 12 месяцев и рентгеновская компьютерная томография через 6 месяцев (сроки и методы исследования могут отличаться в каждом конкретном случае).
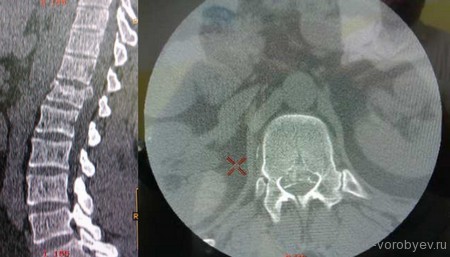
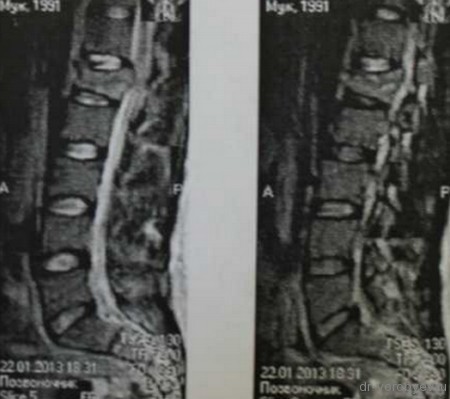
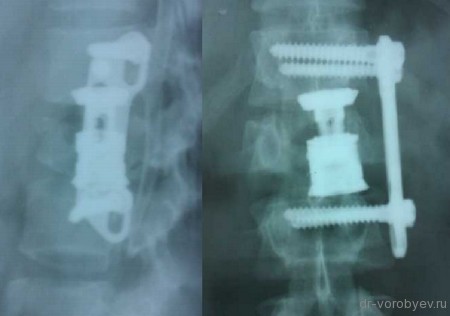
Рентгеновская компьютерная томография пациента с псевдоартрозом в сегменте L5-S1
Рентгеновская компьютерная томография того же пациента через 6 месяцев после применения метода клеточной терапии (сформировался костный блок) – результат лечения достигнут
Применение метода позволило улучшить качество лечения пациентов, нуждающихся в межтеловом спондилодезе позвоночника с нарушениями костной регенерации и известными факторами риска формирования ложного сустава позвоночника, с предшествующими хирургическими вмешательствами, не приведшие к формированию сращения.
Ориентировочная стоимость производства биомедицинского клеточного продукта составляет от 1 000 долларов США.
Подробнее с технологией и нашими результатами Вы можете ознакомиться в следующих публикациях:
Остеофиты позвоночника
Специалисты ЦМРТ более 15 лет специализируются на диагностике и лечении заболеваний позвоночника. Читайте подробнее на странице Лечение позвоночника.
Остеофиты — патологическое разрастание костной ткани или перерождение ткани связок, образующее заостренные шипы или наросты по краям сегментов позвоночника. Развитию патологии способствуют возрастные дегенеративные изменения, постоянные нагрузки, излишняя масса тела и малоподвижный образ жизни. В качестве последствий больному человеку грозят неврологические осложнения, возникновение сильных болей, потеря подвижности и инвалидность. Для лечения используют консервативный и хирургический методы. Рассмотрим, что это такое остеофиты или краевые костные разрастания тел позвонков, возможно ли приостановить процесс и какое лечение эффективно.
Рассказывает специалист ЦМРТ
Дата публикации: 19 Мая 2021 года
Дата проверки: 30 Ноября 2021 года
Содержание статьи
Причины образования остеофитов
Медиками выявлен ряд причин, влияющих на развития остеофитов:
На образования остеофитов влияют недостаток витаминов и недостаточное питание, стрессы, вредные привычки, гормональные сбои, малоподвижный образ жизни и плохая экология. Риск увеличивается с возрастом, поэтому с 40 лет необходимо проходить ежегодные обследования.
Симптомы
Патология дает общие и различающиеся в зависимости от локализации симптомы.
Остеофиты шейного отдела позвоночника — головокружение и головные боли, звон в ушах, иррадиация боли в плечи, руки.
Остеофиты грудного отдела позвоночника — усиление боли при чихании, глубоких вдохах или кашле.
Остеофиты поясничного отдела позвоночника — иррадиация боли в ягодицы, стопы, нарушение мочеиспускания.
К общей симптоматике относят:
При разрастании костной ткани происходит сдавливание спинного мозга и сосудов, нарушение нервной проводимости и питания поврежденных областей, возникают осложнения неврологического характера.
Классификация и виды
Остеофиты классифицируют по локализации, генезу, структуре и форме наростов. По области образования выделяют следующие виды: передние, задние, переднебоковые (клювовидные) и заднебоковые. Последние опасны при локализации в шейном отделе — при разрастании или дорсальном выпячивании диска воздействуют на спинной мозг и нервные окончания.
В зависимости от причины возникновения, различают следующие виды:
Как диагностировать
Диагностика заключена в проведении детального и неврологического осмотра для оценки чувствительности нервных корешков, выявления компрессии.
Аппаратная диагностика включает:
Комплексное обследование поможет составить полную клиническую картину и выработать адекватные меры лечения.
Cистемы стабилизации позвоночника
Содержание:
За последние десятилетия хирургия позвоночника совершила огромный прорыв в своем развитии, благодаря развитию и внедрению различных доступов — вентральных, дорзальных, переднебоковых, комбинированных; анестезиологии и реанимации, которые позволяют пациентам выдерживать многочасовые, травматичные операции со значительной кровопотерей и конечно же постоянному совершенствованию стабилизирующих систем.
В данном небольшом обзоре собственного опыта лечения заболеваний позвоночника хотелось бы уделить особенное внимание именно современным конструкциям для стабилизации позвоночника, отметить слабые и сильные стороны, продемонстрировать различные сочетания имплантов между собой в той или иной клинической ситуации. Медицинский рынок имплантов в нашей стране стремительно развивается, на арену выходят все новые конструкции, представляемые различными производителями, что обусловлено технологическим прогрессом, конкуренцией и огромной коммерческой составляющей.
Традиционно лидируют западноевропейские и американские производители, но все чаще в нашу ежедневную практику приходят азиатские импланты, произведенные в Китае, Южной Корее и т.д.
Самым первым телозамещающим протезом позвонка была собственная кость (аутокость из гребня подвздошной кости, участок ребра или малая берцовая кость), которая устанавливалась между телами позвонков в специальные пазы вместо удаленного. Дополнительная фиксация не проводилась, в связи с чем сохранялась опасность миграции аутокости, а пациент был вынужден соблюдать длительный постельный режим до образования надежного костного сращения. Это значительно снижало качество жизни пациента, было сопряжено с гиподинамическими осложнениями. Со временем появились устройства, которые способствовали неподвижному положению костного трансплантата, в результате чего пациент мог быть активизирован в раннем послеоперационном периоде. До сих пор собственная кость считается «золотым» стандартом в создании корпородеза.
Клинический пример
Представлены КТ пациента до и после оперативного лечения по поводу осложненного перелома пятого шейного позвонка. Выполнена корпорэктомия пятого шейного позвонка с комбинированным корпородезом аутокостью из подвздошного гребня и пластиной китайского производства.
Все большее количество клиник овладевает техникой «передних вмешательств на грудном и поясничном отделах позвоночника», где так же используется аутокость для межтелового корпородеза.
Клинический пример
На данных томограммах представлен нестабильный перелом тела Тн12 позвонка
Первым этапом выполнена ламинэктомия с транспедикулярной фиксацией китайской системой, а затем проведена корпорэктомия, корпородез аутокостью и тораколюмбальной пластиной китайского производства.
Клинический пример
Пациент с неспецифическим спондилодисцитом в грудном отделе позвоночника
Выполнена операция торакотомия, трансплевральная корпорэктомия, комбинированный корпородез аутокостью и пластиной Centaur фирмы Stryker
Как уже упоминалось, собственная кость считается идеальным материалом и «золотым» стандартом для протезирования тела позвонка и создания прочного корпородеза, но данная методика не идеальна и имеет ряд недостатков:
1. Взятие аутокости является самостоятельной дополнительной операцией, которая удлинняет время основного оперативного вмешательства.
2. Она является дополнительным ослабляющим фактором у ослабленных, пожилых пациентов (в том числе с опухолевым поражением позвоночника), является дополнительным источником кровотечения из костной раны.
3. Не всегда возможна и удобна операция взятия аутотрансплантата из гребня подвздошной кости у пациентов с переломом костей таза.
4. Возможна резорбция костного аутотрансплантата с развитием нестабильности оперированного сегмента. Все эти доводы подталкивают на создание искусственных металлических, керамических и др. заменителей тела позвонка.
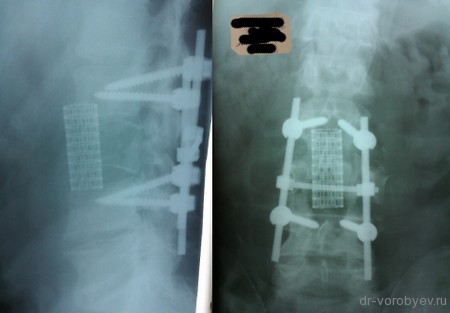
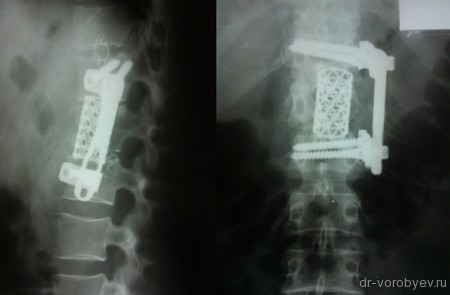
Титановый сетчатый МЭШ является распространенным заменителем тела позвонка и используется для всех отделов позвоночника. Он представляет из себя участок трубки различного диаметра и длины (в зависимости от того, в какой отдел позвоночника будет имплантирован) с ромбовидными отверстиями. С учетом высоты межпозвонкового промежутка после выполненной корпорэктомии МЭШ моделируется (обрезается по необходимой длине), заполняется собственной костью или остеоиндуктивным материалом и устанавливается между телами позвонков. Самостоятельно МЭШ не может обеспечить ротационную стабильность в оперированном сегменте позвоночника, в связи с чем требует дополнительной фиксации передней или передне-боковой пластиной, установки транспедикулярной системы.
Клинический пример
Первым этапом проведена корпорэктомия третьего поясничного позвонка и корпородез МЭШем, заполненным аутокостью
Вторым этапом, с целью создания ротационной стабильности, компрессии позвонков проведена транспедикулярная фиксация.
Клинический пример
Пациентка с метастазом в рака молочной железы в первый поясничный позвонок
Выполнена корпорэктомия первого поясничного позвонка и комбинированный корпородез МЭШем и боковой пластиной Centaur фирма Stryker. Наряду с преимуществами, главным из которых является относительная дешевизна данного импланта, МЭШ так же не является идеальной конструкцией для переднего корпородеза и имеет на наш взгляд ряд недостатков:
1. Большинство отечественных МЭШей не имеют установочного инструментария для обрезания и моделирования по длине, что требует со стороны хирурга больших физических затрат с использованием подручного неприспособленного инструментария (различного вида кусачки и проволочные пилы).
2. При имплантации в свое ложе МЭШ может легко деформироваться и погнуться (не терпит подбивания импакторами).
3. МЭШи, лишенные торцевых площадок (чаще всего отечественные), имеют острые края, благодаря которым возможно продавливание замыкательных пластин опорных позвонков с нарушением стабильности в оперированном сегменте.
4. Требуют использования дополнительных фиксаторов.
Различные импланты из неорганических соединений – корундовая керамика, никелид титана, гидроксиапатиты.
Преимуществами данных телозамещающих изделий является хорошая биосовместимость с костной тканью и способность к ее прорастанию в имплант благодаря высокой порозности, относительная дешевизна, легкость при моделировании необходимой формы и размера. Данные импланты по своим характеристикам и своиствам схожи с аутокостью, но лишены такого ее недостатка, как возможное рассасывание, но к сожалению некоторые импланты данного вида достаточно хрупки и при имплантации могут крошиться и трескаться, кроме того, как и в ситуации с аутокостью требуют использования дополнительных устройств для фиксации – пластин, транспедикулярных фиксаторов и т.д.
Клинический пример
В данной конкретной ситуации выполнена дискэктомия С5-С6 и межтеловой корпородез имплантом из гидроксиапатита производство Франции и пластиной.
Телескопические протезы тела позвонка
Традиционно в условиях российского рынка лидируют западноевропейские и американские производители телескопических протезов тел позвонков.
Сами по себе данные устройства имеют огромное количество преимуществ перед своими конструктивными предшественниками:
1. Существует большое количество типов и размеров имплантов, прилагается высоко технологичный инструментарий для качественной установки.
2. Благодаря концевым площадкам с различными кифотическими и лордозными углами моделируют естественные изгибы позвоночника.
3. С помощью раздвижного телескопического устройства плотно фиксируются в своем ложе.
4. При необходимости легко демонтируются.
5. Имеют возможность малоинвазивной эндоскопической установки (протез тела позвонка Obelisk, Ulrich, Германия в комбинации с боковой пластиной Golden Gate) и т д и т п Но, к сожалению высокая стоимость часто лимитирует использование данных устройств в российской практической медицине. Кроме того, телескопические протезы тела позвонка так же требуют дополнительной фиксации с помощью пластин или транспедикулярных устройств для придания ротационной стабильности.
Клинический пример
Перелом тела первого поясничного позвонка
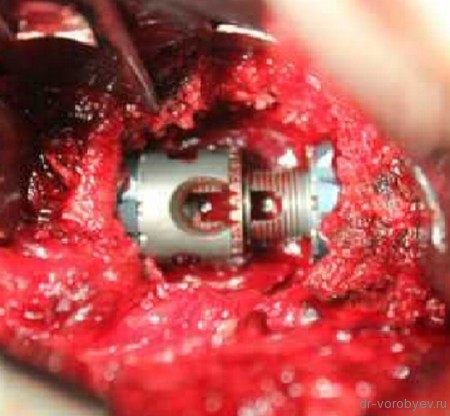
Вид операционной раны. На место удаленного тела позвонка, после декомпрессии установлен протез тела позвонка Obelisk, Ulrich, Германия
Протез дополнительно фиксирован тораколюмбальной пластиной.
Рентгенологический контроль после операции.
Клинический пример
Передний корпородез с использованием телескопического протеза тела позвонка Synex, фирма Synthes, США.
Внешний вид импланта
Протез помещен между телами смежных позвонков.
Интраоперационный рентгенологический контроль.
Вопросы о необходимости операции с использованием импланта можно задать по телефону +7-903-526-78-77
Вертебропластика тел позвонков
Вертебропластика – малоинвазивная хирургическая операция на позвоночнике, подразумевающая введение специального костного цемента в тело позвонка с целью его укрепления. Применяется при лечении остеопороза, опухолевых образований, гемангиом, болевых синдро
ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ
Мягко, приятно, нас не боятся дети
ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ
Мягко, приятно, нас не боятся дети
Вертебропластика – малоинвазивная (с минимальным травмированием мягких тканей) хирургическая операция, направленная на укрепление или восстановление тел позвонков. Проводится путем введения в поврежденный позвонок специального костного цемента или полиметилметакрилата.
Процедура выполняется чрезкожно и назначается при компрессионных переломах тел позвонков в результате прогрессирования остеопороза, для предотвращения переломов при опухолевых образованиях или метастазах в позвоночнике, гемангиомах или при травматических повреждениях спины. Все манипуляции проводятся специальными иглами под постоянным контролем действий с помощью микроскопа и рентгенографического оборудования.
Суть методики
Первая вертебральная хирургическая операция была проведена в 1984 году 54-летней женщине, страдающей агрессивной гемангиомой тел позвонков. С тех пор методика нашла широкое применение в лечении патологий, связанных с компрессионными переломами или высоким риском их получения.
В большинстве случаев компрессионный перелом одного тела позвонка при остеопорозе практически не вызывает болевых синдромов (если не сдавливаются нервные корешки), а проявляется только ограничением подвижности патологического сегмента.
Характерные ноющие или острые боли после активных физических действий возникают при травмировании двух или более соседних сочленений. В этой ситуации вертебропластика уже просто необходима, прежде всего, для устранения болевых ощущений и для предотвращения развития дисфункций внутренних органов.
Суть методики состоит в том, что врач чрезкожно вводит в тело пациента металлическую иглу, проходя между остистыми отростками и связками позвоночника, достигает поврежденного позвонка и через щель заполняет его костной смесью. Доступ к разным отделам позвоночника не одинаков и может быть: передним, задним, боковым. Операция проводится под местной анестезией.
Кроме основного материала (полиметилметакрилата) вводимая смесь содержит контрастное вещество, которое светится на рентгеновских снимках и позволяет наблюдать за процессом заполнения полости позвонка и антибиотик. Антибиотик необходим для лучшей адаптации костных тканей к вводимому чужеродному веществу.
Скорость застывания костного цемента составляет 6-11 минут, за которые хирург должен успеть равномерно распределить смесь в патологической зоне. Застывая, вводимое вещество полимеризуется с нагреванием до 70оС, что обеспечивает лучшее сцепление с молекулами костных тканей и оказывает дополнительное дезинфицирующее воздействие на опухолевые клетки (если они присутствуют).
Помимо малой инвазивности, вертебропластика предусматривает активизацию больного уже через 2-3 часа после проведения операции и сокращение пребывания пациента в условиях стационара до 1-2 дней. В минимальные сроки укладывается и реабилитационный период, а по истечении 1 месяца уже возможен полный возврат к нормальной жизни и трудовой деятельности.
Показания к операции
Вертебропластику рекомендуется проводить:
Противопоказания
Несмотря на щадящий режим проведения, вертебропластика, как и все хирургические операции имеет свои противопоказания.
Процедура проведения
Операция вертебропластики не требует никакой специальной подготовки пациента кроме воздержания от приема пищи в день проведения манипуляций.
Больного укладывают на операционный стол, обрабатывают необходимую поверхность кожи антисептическим раствором. Введение иглы в зону пораженного позвонка выполняется под местной анестезией. С профилактическими целями для предотвращения возможного заражения мягких тканей проводится курс терапии антибиотиками.
Все дальнейшие действия проводятся под рентгенографическим контролем. При необходимости, если позвонок поражен опухолью, врач берет на исследование небольшой кусочек биоптата и только после получения результатов анализа операция продолжается.
В большинстве случаев (если существует такая возможность) заполнение цементом зоны поврежденного позвонка целесообразно осуществлять с двух сторон. После того как костный цемент начнет застывать весь инструмент извлекается, разрезанные кожные покровы и ткани ушиваются послойно, накладывается стерильная повязка.
В среднем для заполнения шейных и грудных тел позвонков достаточно 2-3 мл костного раствора, для поясничных (они более массивны) – 3-5 мл. После окончания операции пациенту прописывается полный покой и постельный режим от 1 до 2 часов в зависимости от состояния организма. Действие анестезирующих веществ прекращается примерно в это же время и в зоне проведения манипуляций может возникнуть боль, тянущие или сдавливающие ощущения, которые при необходимости купируются обычными обезболивающими препаратами.
Если проведение вертебропластики было обусловлено прогрессированием остеопороза, то обязательным условием успешного исхода хирургического вмешательства является дальнейшая терапия состояния костных тканей. В противном случае, как свидетельствует статистика, у пятой части всех пациентов, перенесших вертебропластику, образуются повторные компрессионные переломы в течение 1-2 лет после операции.
Возможные осложнения
Как отмечает статистика, чаще всего осложнения после вертебропластики возникают у пациентов, страдающих онкологическими новообразованиями (примерно 10%), гемангиомой позвоночника (2-5%) и остеопорозом костей скелета (1-3%).
Основным нежелательным последствием является неконтролируемый выход цементной смеси в мягкие ткани или позвоночный канал, что может вызвать сдавливание спинного мозга или развитие воспаления. Подобная ситуация требует повторного оперирования.
Достаточно редко при таких вмешательствах отмечаются инфекционные поражения тканей или крови так как проводиться дополнительная терапия антибиотиками и сам цементный материал застывая, нагревается, дезинфицирует окружающие костные ткани и как бы сваривается с ними.
Менее значимые побочные эффекты: