Костный и косный в чем разница
Современные подходы к диагностике и лечению остеопороза
Рисунок 1. Микроархитектоника здоровой (слева) и остеопоретической (справа) трабекулярной кости. Методы диагностики остеопороза Денситометрия. Ультразвуковая сонография. Рентгенография. Исследование биохимических маркеров костного метаболи
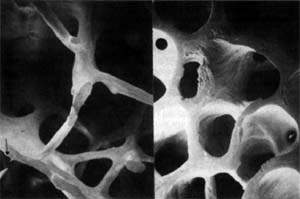 |
| Рисунок 1. Микроархитектоника здоровой (слева) и остеопоретической (справа) трабекулярной кости. |
Методы диагностики остеопороза Денситометрия. Ультразвуковая сонография. Рентгенография. Исследование биохимических маркеров костного метаболизма.
Остеопороз — это системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники костной ткани, ведущими к повышенной хрупкости костей с последующим увеличением риска их переломов (рис. 1). Помимо наиболее распространенного постменопаузального остеопороза, в настоящее время в цивилизованных странах в связи с растущей продолжительностью жизни все чаще встречается сенильный остеопороз, а также вторичный остеопороз, обусловленный различными заболеваниями (эндокринная патология, ревматические болезни, заболевания желудочно-кишечного тракта и пр.) или связанный с длительным приемом некоторых лекарственных препаратов, например кортикостероидов.
В настоящее время для диагностики остеопороза используются преимущественно неинвазивные методы, которые легковыполнимы, безопасны и могут повторяться неоднократно у одного и того же больного. К таким методам относятся рентгенографическое исследование, костная денситометрия и исследование биохимических маркеров костного метаболизма. Каждый из этих методов занимает свою нишу в диагностике заболе-вания.
С целью ранней диагностики остеопороза применяются различные технологии, объединенные под общим названием «костная денситометрия», с ее помощью можно определить минимальную плотность костной ткани (МПК), являющуюся главным критерием прочности кости. В настоящее время выделяют четыре типа и два подтипа технологий для измерения МПК:
В данном перечне отсутствует фотонная денситометрия — предшественница рентгеновской денситометрии, в последнее время используемая весьма редко.
 |
| Рисунок 2 |
Системы DXA являются наиболее изученными и широко применяются в клинической практике (рис. 2). DXA позволяет измерять МПК в центральных отделах скелета: в поясничном отделе позвоночника и в проксимальном отделе бедренной кости. В этих участках происходят наиболее тяжелые переломы. Кроме того, многие из этих приборов снабжены программой «все тело», позволяющей определить содержание минералов во всем скелете, а также исследовать мягкие ткани — мышечную и жировую. В новых модификациях приборов DXA имеется возможность латерального сканирования и морфометрического измерения позвонков,что значительно повышает информативность этого метода. Метод DXA также адаптирован для оценки состояния МПК в области периферических участков скелета, в частности в области предплечья и пяточной кости (рис. 3).
Радиографическая абсорбциометрия используется редко, поскольку требует специально оборудованного центра, где при помощи микроденситометра производится сканирование рентгеновских снимков фаланг и определяется их оптическая плотность.
 |
| Рисунок 3 |
Для определения МПК позвоночника можно использовать и QCT, которая является единственным методом, представляющим результаты исследования в трехмерном измерении. Возможность проведения измерений в поперечном сечении, заложенная в QCT, позволяет выделить этот метод среди других, так как он дает возможность дифференцированно оценивать МПК в трабекулярной и кортикальной костной ткани, фиксируя истинные значения МПК в г/см3 [1]. В отличие от DXA при QCT нет искажений МПК, связанных с тучностью пациента, а также вызванных сопутствующей патологией, например спондилоартритом и остеофитами, обызвествлением стенки аорты или участками остеосклероза, развивающимися в результате дегенеративных заболеваний или переломов позвонков. Но большие дозы облучения при QCT, а также высокая стоимость обследования ограничивают широкое применение этой технологии в диагностике остеопороза, использование ее оправданно лишь в ситуациях, требующих дифференциальной диагностики (рис. 4).
 |
| Рисунок 4 |
В последние годы активно развивается ультразвуковая сонография, которая, в отличие от рентгеновской денситометрии, позволяет обследовать другие характеристики костной ткани: SOS — скорость распространения ультразвука в кости и BUA — широковолновое рассеивание (затухание) ультразвуковой волны в исследуемом участке скелета. Эти параметры, по данным многих исследователей, отражают степень эластичности и прочности костной ткани и достаточно высоко коррелируют с МПК позвоночника и шейки бедра [2]. В настоящее время многие специалисты высказывают мнение о том, что с помощью ультразвуковой денситометрии можно предсказывать риск переломов, тем самым обосновывая ее значение как метода для скрининга. Вопрос о возможности применения этих приборов в диагностике остеопороза и оценке эффективности терапии продолжает дискутироваться.
Рентгенография довольно активно используется для диагностики остеопороза и его осложнений. Однако ее нельзя отнести к методам ранней диагностики, поскольку рентгенологические признаки остеопороза появляются тогда, когда 20 — 30% костной массы уже потеряно [3]. Наиболее сложно оценить выраженность остеопороза в позвоночнике, поскольку ни один из его рентгенологических признаков не является специфичным. Часто рентгенография позволяет выявить остеопороз лишь на поздней стадии, когда уже имеются остеопоретические переломы. Для объективной оценки степени снижения минерализации костей разработаны так называемые полуколичественные методы. В основе их лежит вычисление вертебральных, феморальных и метакарпальных индексов. Но они также не могут претендовать на достаточную точность и чувствительность при выявлении ранней стадии заболевания (остеопении), хотя успешно применяются при эпидемиологических исследованиях распространенности остеопороза в популяции [4, 5]. Таким образом, основной функцией ренгенографического метода в диагностике остеопороза является обнаружение переломов, динамическое наблюдение за появлением новых переломов и дифференциальная диагностика остеопоретических переломов от других типов деформаций позвоночника.
С помощью методов «костной денситометрии» можно судить об основных параметрах прочности костной ткани, однако эти методы не дают никакой информации об уровне костного метаболизма. Уровень формирования и резорбции костной ткани может быть оценен несколькими способами: путем измерения ферментной активности костных клеток (остеобластов и остеокластов) или определения продуктов деградации костного матрикса, которые высвобождаются в циркуляцию в процессе костного обмена (табл. 1).
Таблица 1. Биохимические маркеры костного метаболизма
маркеры
мочи
Представленные в таблице костные маркеры являются предикторами потери костной массы, переломов костей скелета и используются для мониторинга антиостеопоретической терапии. По этим биохимическим показателям можно судить об эффективности терапии, об адекватности дозы препарата и о его переносимости. Особенно полезны костные маркеры для оценки эффективности терапии в сравнительно короткие промежутки времени, когда денситометрическое исследование еще не информативно (полагают, что повторные денситометрические исследования надо выполнять не чаще одного раза в год). Уровень маркеров костного метаболизма изучался в основном у женщин постменопаузального периода. Оказалось, что уровень почти всех маркеров, за исключением IPCP, повышен и коррелирует со снижением МПК [6]. Полагают, что сочетание денситометрии и исследования биохимических маркеров костного метаболизма позволит получить более полную информацию о риске развития постменопаузального остеопороза. По мнению P. Delmas (1996) увеличение скорости костной резорбции (по оценке уровней биохимических маркеров) существенно повышает риск развития переломов независимо от исходной костной массы пациентов [7]. Это связано с тем, что хрупкость кости при остеопорозе зависит не только от МПК, но и от нарушения микроархитектоники костной ткани, выраженность которой можно оценить с помощью биохимических маркеров костной резорбции. Это предположение подтверждается данными P. Garnero et al. (1996), полученными в рамках исследования EPIDOS [6]. Доказано, что увеличение уровня СТх или свободного диоксипиридинолина на 1SD от нормы ассоциировалось с 1,3- и 1,4-кратным увеличением риска переломов шейки бедра (рис. 5).
 |
| Рисунок 5. Комбинированная оценка МПК и скрытой костной резорбции для определения риска перелома шейки бедра у пожилых. МПК определялась по критериям ВОЗ с учетом показателей ниже 2,5 SD от нормальных показателей МПК у молодых здоровых женщин (Ts core |
При этом снижение МПК шейки бедра и увеличение маркеров костной резорбции, независимо друг от друга, связаны с высоким риском переломов шейки бедра. Для оценки эффективности проводимой терапии рекомендуется исследовать биохимические маркеры через каждые три месяца после начала лечения. При исследовании биохимических маркеров необходимо принимать во внимание факторы, влияющие на воспроизводимость результатов: диета, условия хранения материала, биологические факторы (циркадные и сезонные колебания, менструальный цикл, возраст, пол, наличие сопутствующих заболеваний и т. д.).
Многолетний опыт изучения остеопороза за рубежом показывает, что ни один из существующих в настоящее время лекарственных препаратов не может надежно восстановить количество и качество кости, поэтому основной мерой в борьбе с этим заболеванием является профилактика. Профилактику остеопороза надо начинать рано и уделять особое внимание средовым факторам, влияющим на достижение пика костной массы, который наступает примерно к тридцати годам. В числе этих факторов — питание и физическая активность, адекватное поступление в организм витамина D и инсоляция. К наиболее важным периодам относятся период роста кости (юношество), беременность, лактация и перименопауза. Пик костной массы может быть значительно улучшен за счет включения в рацион продуктов с повышенным содержанием кальция (прежде всего молочные и рыбные продукты). Суточное потребление кальция должно составлять в среднем 1000 — 1500 мг, предпочтительно с пищей. Регулярные физические упражнения с весовой нагрузкой в период роста кости приводят к увеличению пика костной массы. У взрослых после достижения пика костной массы адекватное потребление кальция, постоянная физическая нагрузка и наличие регулярного менструального цикла также способствует сохранению костной массы. Профилактику остеопороза среди взрослого населения нужно проводить в «группах риска».
Проблема лечения остеопороза за рубежом изучается давно, причем особенно активно в последнее десятилетие, что связано с введением денситометрии. Однако до настоящего времени не разработаны общепринятые терапевтические программы и режимы лечения этого заболевания, что, по-видимому объясняется его многофакторной природой и сложным патогенезом. Основная цель лечебных мероприятий — сбалансирование процессов костного метаболизма и сохранение или улучшение качества жизни пациента. Для этого необходимо добиться замедления или прекращения потери костной массы; уменьшить болевой синдром в позвоночнике и периферических костях; улучшить функциональное состояние больного и предотвратить возможные падения; восстановить трудоспособность и психоэмоциональное состояние. Наряду с этиопатогенетической терапией препаратами, направленными на нормализацию процессов ремоделирования костной ткани и на сохранение минерального гомеостаза, применяется и симптоматическая терапия, включающая в себя диету с повышенным содержанием солей кальция и фосфора, нестероидные противовоспалительные средства, анальгетики, миорелаксанты, которые позволяют уменьшить болевой синдром, мышечное напряжение и тем самым расширить двигательную активность пациента и ускорить начало реабилитационных мероприятий.
Реабилитация подразумевает лечебную физкультуру, ношение корсетов, плавание, курсы легкого массажа.
Все препараты для лечения остеопороза можно разделить на три группы:
В этиопатогенетической терапии остеопороза предпочтение отдается группе препаратов, подавляющих резорбцию костной ткани, вследствие их более высокой эффективности и сравнительно небольшого побочного действия.
В целом терапия остеопороза должна быть комплексной и проводить ее следует длительно в виде непрерывного или курсового лечения. Поскольку в настоящее время нет идеального препарата для лечения остеопороза, перспективна комбинированная терапия, в которой сочетаются препараты с различным механизмом действия, что позволяет потенцировать их антиостеопоретическое действие, снизить частоту и выраженность побочных эффектов.
| Профилактика остеопороза заключается в сбалансированном питании, физической активности, и адекватном поступлении в организм витамина D |
При комбинированной терапии лекарственные средства назначают одновременно или последовательно. Их выбор осуществляется индивидуально для каждого больного в зависимости от формы остеопороза, скорости костного обмена, тяжести клинического течения, сопутствующих заболеваний. Основным критерием эффективности любого антиостеопоретического средства является снижение частоты переломов, однако в каждом конкретном случае надо ориентироваться в первую очередь на показатели МПК по данным костной денситометрии и на биохимические маркеры костного обмена. Увеличение МПК более чем на 1% и нормализация биохимических показателей, если они были изменены, свидетельствуют об эффективности проводимой терапии. Учитываться должна и положительная динамика клинической картины: уменьшение болевого синдрома, повышение функциональной активности.
Таким образом, в настоящее время имеется довольно большой выбор диагностических методов, позволяющих установить диагноз остеопороза на разных стадиях, а также эффективных лекарственных препаратов, влияющих на различные звенья патогенеза остеопороза, способных уменьшить или купировать клинически выраженные симптомы заболевания, а также предупредить развитие переломов.
Костный и косный в чем разница
Структура костной ткани и кровообращение
Кость представляет собой сложную материю, это сложный анизотропный неравномерный жизненный материал, обладающий упругими и вязкими свойствами, а также хорошей адаптивной функцией. Все превосходные свойства костей составляют неразрывное единство с их функциями.
Форма и структура костей являются различными в зависимости от выполняемых ими функций. Разные части одной и той же кости вследствие своих функциональных различий имеют разную форму и структуру, например, диафиз бедренной кости и головка бедренной кости. Поэтому полное описание свойств, структуры и функций костного материала является важной и сложной задачей.
Структура костной ткани
«Ткань» представляет собой комбинированное образование, состоящее из особых однородных клеток и выполняющих определенную функцию. В костных тканях содержатся три компонента: клетки, волокна и костный матрикс. Ниже представлены характеристики каждого из них:
Клетки: В костных тканях существуют три вида клеток, это остеоциты, остеобласт и остеокласт. Эти три вида клеток взаимно превращаются и взаимно сочетаются друг с другом, поглощая старые кости и порождая новые кости.
Костные клетки находятся внутри костного матрикса, это основные клетки костей в нормальном состоянии, они имеют форму сплющенного эллипсоида. В костных тканях они обеспечивают обмен веществ для поддержания нормального состояния костей, а в особых условиях они могут превращаться в два других вида клеток.
Остеобласт имеет форму куба или карликового столбика, они представляют собой маленькие клеточные выступы, расположенные в довольно правильном порядке и имеют большое и круглое клеточное ядро. Они расположены в одном конце тела клетки, протоплазма имеет щелочные свойства, они могут образовывать межклеточное вещество из волокон и мукополисахаридных белков, а также из щелочной цитоплазмы. Это приводит к осаждению солей кальция в идее игловидных кристаллов, расположенных среди межклеточного вещества, которое затем окружается клетками остеобласта и постепенно превращается в остеобласт.
Остеокласт представляет собой многоядерные гигантские клетки, диаметр может достигать 30 – 100 µm, они чаще всего расположены на поверхности абсорбируемой костной ткани. Их цитоплазма имеет кислотный характер, внутри ее содержится кислотная фосфотаза, способная растворять костные неорганические соли и органические вещества, перенося или выбрасывая их в другие места, тем самым ослабляя или убирая костные ткани в данном месте.
Костные волокна в основном состоит из коллагенового волокна, поэтому оно называется костным коллагеновым волокном, пучки которого расположены послойно правильными рядами. Это волокно плотно соединено с неорганическими составными частями кости, образуя доскообразную структуру, поэтому оно называется костной пластинкой или ламеллярной костью. В одной и той же костной пластинке большая часть волокон расположена параллельно друг другу, а слои волокон в двух соседних пластинках переплетаются в одном направлении, и костные клетки зажаты между пластинками. Вследствие того, что костные пластинки расположены в разных направлениях, то костное вещество обладает довольно высокой прочностью и пластичностью, оно способно рационально воспринимать сжатие со всех направлений.
Морфология кости
С точки зрения морфологии, размеры костей неодинаковы, их можно подразделить на длинные, короткие, плоские кости и кости неправильной формы. Длинные кости имеют форму трубки, средняя часть которых представляет собой диафиз, а оба конца – эпифиз. Эпифиз сравнительно толстый, имеет суставную поверхность, образованную вместе с соседними костями. Длинные кости главным образом располагаются на конечностях. Короткие кости имеют почти кубическую форму, чаще всего находятся в частях тела, испытывающих довольно значительное давление, и в то же время они должны быть подвижными, например, это кости запястья рук и кости предплюсны ног. Плоские кости имеют форму пластинок, они образуют стенки костных полостей и выполняют защитную роль для органов, находящихся внутри этих полостей, например, как кости черепа.
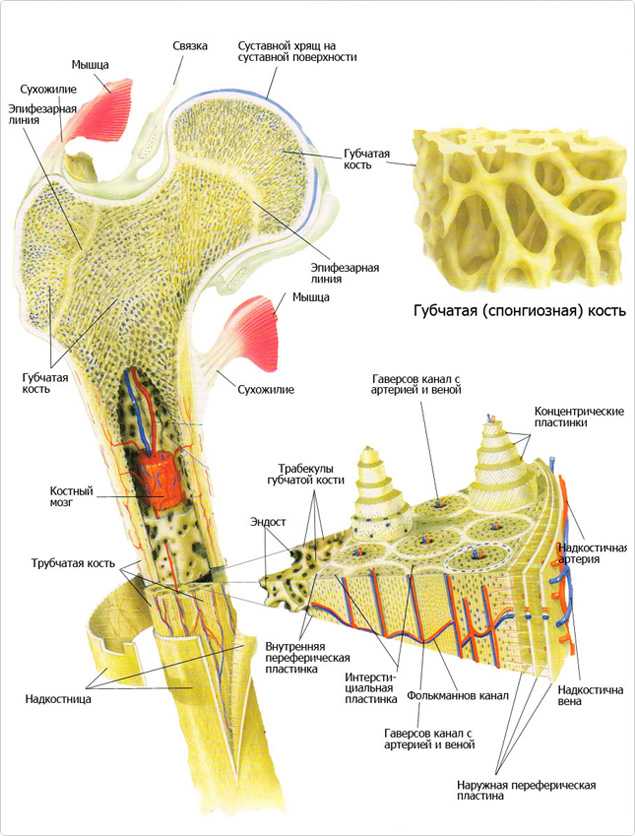
Кость состоит из костного вещества, костного мозга и надкостницы, а также имеет разветвленную сеть кровеносных сосудов и нервов, как показано на рисунке. Длинная бедренная кость состоит из диафиза и двух выпуклых эпифизарных концов. Поверхность каждого эпифизарного конца покрыта хрящом и образует гладкую суставную поверхность. Коэффициент трения в пространстве между хрящами в месте соединения сустава очень мал, он может быть ниже 0.0026. Это самый низкий известный показатель силы трения между твердыми телами, что позволяет хрящу и соседним костным тканям создать высокоэффективный сустав. Эпифизарная пластинка образована из кальцинированного хряща, соединенного с хрящом. Диафиз представляет собой полую кость, стенки которой образованы из плотной кости, которая является довольно толстой по всей ее длине и постепенно утончающейся к краям.
Костный мозг заполняет костномозговую полость и губчатую кость. У плода и у детей в костномозговой полости находится красный костный мозг, это важный орган кроветворения в человеческом организме. В зрелом возрасте мозг в костномозговой полости постепенно замещается жирами и образуется желтый костный мозг, который утрачивает способность к кроветворению, но в костном мозге по-прежнему имеется красный костный мозг, выполняющий эту функцию.
Надкостница представляет собой уплотненную соединительную ткань, тесно прилегающую к поверхности кости. Она содержит кровеносные сосуды и нервы, выполняющие питательную функцию. Внутри надкостницы находится большое количество остеобласта, обладающего высокой активностью, который в период роста и развития человека способен создавать кость и постепенно делать ее толще. Когда кость повреждается, остеобласт, находящийся в состоянии покоя внутри надкостницы, начинает активизироваться и превращается в костные клетки, что имеет важное значение для регенерации и восстановления кости.
Микроструктура кости
Костное вещество в диафизе большей частью представляет собой плотную кость, и лишь возле костномозговой полости имеется небольшое количество губчатой кости. В зависимости от расположения костных пластинок, плотная кость делится на три зоны, как показано на рисунке: кольцевидные пластинки, гаверсовы (Haversion) костные пластинки и межкостные пластинки.
Кольцевидные пластинки представляют собой пластинки, расположенные по окружности на внутренней и внешней стороне диафиза, и они подразделяются на внешние и внутренние кольцевидные пластинки. Внешние кольцевидные пластинки имеют от нескольких до более десятка слоев, они располагаются стройными рядами на внешней стороне диафиза, их поверхность покрыта надкостницей. Мелкие кровеносные сосуды в надкостнице пронизывают внешние кольцевидные пластинки и проникают вглубь костного вещества. Каналы для кровеносных сосудов, проходящие через внешние кольцевидные пластинки, называются фолькмановскими каналами (Volkmann’s Canal). Внутренние кольцевидные пластинки располагаются на поверхности костномозговой полости диафиза, они имеют небольшое количество слоев. Внутренние кольцевидные пластинки покрыты внутренней надкостницей, и через эти пластинки также проходят фолькмановские каналы, соединяющие мелкие кровеносные сосуды с сосудами костного мозга. Костные пластинки, концентрично расположенные между внутренними и внешними кольцевидными пластинками, называются гаверсовыми пластинками. Они имеют от нескольких до более десятка слоев, расположенных параллельно оси кости. В гаверсовых пластинках имеется один продольный маленький канал, называемый гаверсовым каналом, в котором находятся кровеносные сосуды, а также нервы и небольшое количество рыхлой соединительной ткани. Гаверсовы пластинки и гаверсовы каналы образуют гаверсову систему. Вследствие того, что в диафизе имеется большое число гаверсовых систем, эти системы называются остеонами (Osteon). Остеоны имеют цилиндрическую форму, их поверхность покрыта слоем цементина, в котором содержится большое количество неорганических составных частей кости, костного коллагенового волокна и крайне незначительное количество костного матрикса.
Межкостные пластинки представляют собой пластинки неправильной формы, расположенные между остеонами, в них нет гаверсовых каналов и кровеносных сосудов, они состоят из остаточных гаверсовых пластинок.
Внутрикостное кровообращение
В кости имеется система кровообращения, например, на рисунке показа модель кровообращения в плотной длинной кости. В диафизе есть главная питающая артерия и вены. В надкостнице нижней части кости имеется маленькое отверстие, через которое внутрь кости проходит питающая артерия. В костном мозге эта артерия разделяется на верхнюю и нижнюю ветви, каждая из которых в дальнейшем расходится на множество ответвлений, образующих на конечном участке капилляры, питающие ткани мозга и снабжающие питательными веществами плотную кость.
Кровеносные сосуды в конечной части эпифиза соединяются с питающей артерией, входящей в костномозговую полость эпифиза. Кровь в сосудах надкостницы поступает из нее наружу, средняя часть эпифиза в основном снабжается кровью из питающей артерии и лишь небольшое количество крови поступает в эпифиз из сосудов надкостницы. Если питающая артерия повреждается или перерезается при операции, то, возможно, что снабжение кровью эпифиза будет заменяться на питание из надкостницы, поскольку эти кровеносные сосуды взаимно связываются друг с другом при развитии плода.
Кровеносные сосуды в эпифизе проходят в него из боковых частей эпифизарной пластинки, развиваясь, превращаются в эпифизарные артерии, снабжающие кровью мозг эпифиза. Есть также большое количество ответвлений, снабжающих кровью хрящи вокруг эпифиза и его боковые части.
Верхняя часть кости представляет собой суставный хрящ, под которым находится эпифизарная артерия, а еще ниже ростовой хрящ, после чего имеются три вида кости: внутрихрящевая кость, костные пластинки и надкостница. Направление кровотока в этих трех видах кости неодинаково: во внутрихрящевой кости движение крови происходит вверх и наружу, в средней части диафиза сосуды имеют поперечное направление, а в нижней части диафиза сосуды направлены вниз и наружу. Поэтому кровеносные сосуды во всей плотной кости расположены в форме зонтика и расходятся лучеобразно.
Поскольку кровеносные сосуды в кости очень тонкие, и их невозможно наблюдать непосредственно, поэтому изучение динамики кровотока в них довольно затруднительно. В настоящее время с помощью радиоизотопов, внедряемых в кровеносные сосуды кости, судя по количеству их остатков и количеству выделяемого ими тепла в сопоставлении с пропорцией кровотока, можно измерить распределение температур в кости, чтобы определить состояние кровообращения.
В процессе лечения дегенеративно-дистрофических заболеваний суставов безоперационным методом в головке бедренной кости создается внутренняя электрохимическая среда, которая способствует восстановлению нарушенной микроциркуляции и активному удалению продуктов обмена разрушенных заболеванием тканей, стимулирует деление и дифференциацию костных клеток, постепенно замещающих дефект кости.