Краниальная замыкательная пластинка что это
Склероз замыкательных пластинок позвонков: что это такое
Через замыкательные пластинки происходит питание межпозвоночных дисков, а также удаление продуктов обмена из них. Но когда эти пластинки уплотняются, все обменные процессы в межпозвоночном пространстве нарушаются. Такой симптом развивается постепенно и длительно, часто на начальном этапе пациент узнает о своем недуге лишь на профилактических осмотрах и обследованиях позвоночника. Со временем при прогрессирующем течении заболевания появляется боль и ограничения движений в позвоночнике.
Данное заболевание позвоночника на сегодня очень широко диагностируется как в пожилом возрасте, так и более раннем.
Причины образования склероза замыкательных пластинок:
Симптомы
Главный симптом, который может заметить пациент, это боль. Именно боль, которую трудно устранить одним обезболивающим препаратом, заставляет обратиться за помощью. При игнорировании болевого синдрома, появляется ограничение подвижности в пораженной области позвоночника. При обращении пациентов с данным симптомом в Юсуповскую больницу неврологи в кратчайшие сроки проведут всю необходимую диагностику и, в зависимости от выявленной причины, назначат адекватную терапию заболевания, проявлением которого является склероз замыкательных пластинок.
Диагностика
Наиболее часто симптом склероза замыкательных пластинок позвонков диагностируется на рентгенографических снимках, где хорошо видны участки уплотнений позвонков. Далее для более детальной информации по наличию мелких изменений структур тканей обязательно назначают КТ подозреваемой области поражения позвоночного столба.
Также необходимыми диагностическими исследованиями являются лабораторные показатели крови и мочи (для исключения нарушений обменных процессов в организме).
Лечение
Лечение проводят не самого симптома склероза позвоночника, а устраняют точную причину его возникновения (чаще всего это остеохондроз). От правильно определенного основного заболевания позвоночника зависит и эффект проведенных лечебных мероприятий.
В Юсуповской больнице из медикаментозного лечения назначаются:
Для достижения полного лечебного эффекта в клинике реабилитации Юсуповской больницы пациентам назначаются дополнительные процедуры: физиопроцедуры, специальные массажные техники, ЛФК.
В тяжелых случаях болезни необходимо будет провести хирургическое лечение, с помощью которого можно получить более эффективный результат.
В настоящее время существуют разнообразные высокоэффективные методы устранения любых дефектов позвоночника с помощью современной аппаратуры и квалифицированных специалистов. Врачи Юсуповской больницы проведут как основное лечение Вашего заболевания, так и сконцентрируются на профилактических методах. Для записи в клинику позвоните по телефону.
Краниальная замыкательная пластинка что это
Для проведения хирургических вмешательств на позвоночнике крайне важным условием является доскональное знание анатомии и биомеханики. Шейный отдел позвоночника — это часть осевого скелета шеи. Особенности строения шейных позвонков, лежащих ниже осевого позвонка, а именно — позвонков С3-С7, уникальны и играют важную роль как в физиологии и патофизиологии данной анатомической области, так и в осуществлении доступа при хирургическом лечении. В этой статье описаны основные детали анатомии и биомеханики этой важной части шейного отдела позвоночника.
а) Анатомия поверхностных структур шейного отдела позвоночника среднего и нижнего сегментов. Осмотр и пальпация поверхности шеи позволяют получить большой объем информации. Знание анатомии поверхностных структур помогает хирургу при выборе места разреза кожи, от расположения которого зависит возможность доступа к тем или иным позвонкам.
Верхней границей шеи являются нижняя челюсть и сосцевидный отросток, нижней границей — ключицы и рукоятка грудины. Стоит отметить, что обычно выше уровня рукоятки грудины лежат и позвонки Т1 и Т2 из-за наклона первого ребра в передненижнем направлении.
На передней поверхности шеи располагается множество пальпируемых структур, помогающих ориентироваться в уровнях позвонков. Подъязычная кость расположена на уровне позвонка С3, щитовидный хрящ — на уровне позвонка С4, а перстневидный хрящ — на уровне позвонка С6. Также на уровне позвонка С6 расположен сонный бугорок, или бугорок Шассеньяка (Chassaignac), представляющий собой передний бугорок поперечного отростка позвонка С6, который отделяет сонную артерию от позвоночной артерии. В клиническом аспекте, к сонному бугорку может быть прижата сонная артерия при таких состояниях, как наджелудочковая тахикардия.
На задней поверхности шеи определяется хорошо выраженный выступ, соответствующий пальпируемому остистому отростку позвонка С7 или, в редких случаях, позвонков С6 или Т1.
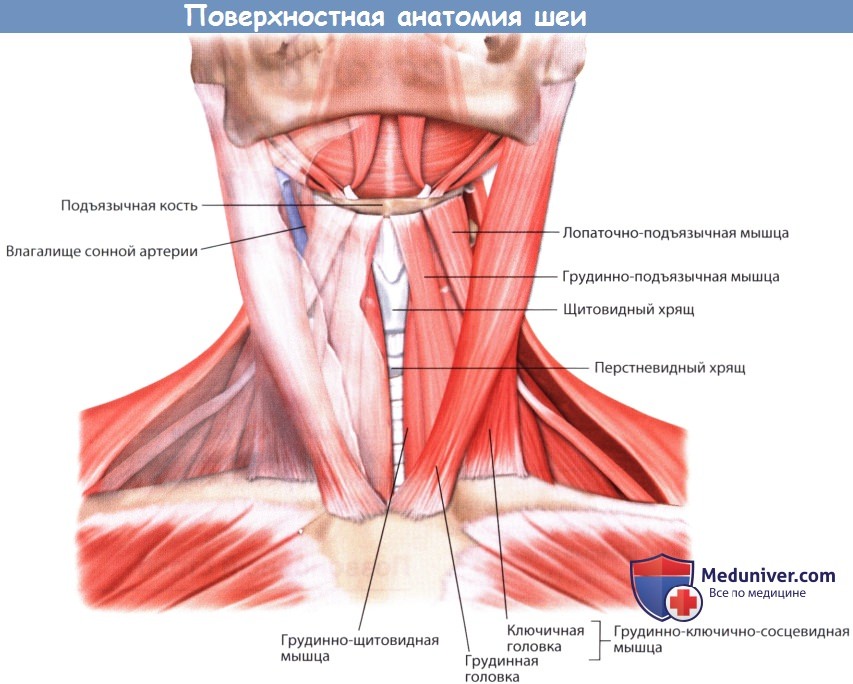
Грудинно-ключично-сосцевидная мышца, подъязычная кость, щитовидный хрящ и перстневидный хрящ легко определяются при визуальном осмотре кожных покровов и поверхностной пальпации.
Подъязычная кость примерно соответствует уровню позвонка С3, щитовидный хрящ—уровню позвонка С4, а перстневидный хрящ — уровню позвонка С6.
Влагалище сонной артерии расположено медиальнее и глубже грудинно-ключично-сосцевидной мышцы.
б) Позвоночный столб. В норме, каждый из пяти шейных позвонков, лежащих ниже осевого позвонка, состоит из тела, ножек дуги, латеральных масс, пластинки дуги и остистого отростка. Позвонки являются подвижными структурами, соединенными между собой спереди межпозвонковым диском, формирующим передний сустав, а сзади — посредством парных суставных отростков.
Главной задачей шейных позвонков, лежащих ниже осевого позвонка, как и позвоночного столба в целом, является противостояние сжимающей силе; сжимающая сила возрастает в нисходящем направлении. Нормальным является изгиб шейного отдела позвоночника в виде неглубокого лордоза с кривизной 16-25°, который продолжается от зубного отростка до позвонка Т2. Уровни, обеспечивающие максимальную амплитуду сгибания-разгибания — С4-С5 и С5-С6, тогда как наибольшую амплитуду бокового сгибания обеспечивают суставы С2-СЗ, С3-С4 и С4-С5. Наименее подвижным сегментом является уровень С7-Т1.
1. Тело позвонка. Тело позвонка является несущим осевую нагрузку элементом позвоночного столба. В плане строения, высота тела позвонка увеличивается по позвоночнику по направлению вниз, исключая шейный позвонок С6, где отмечается обратная зависимость. Тело позвонка С6 может быть короче тел позвонков С5 или С7.
Тело позвонка имеет цилиндрическую форму, выпуклую поверхность спереди, и дугу позвонка, выступающую сзади. Тонкая наружная оболочка, представленная плотной кортикальной пластинкой, окружает пористое губчатое вещество, содержащее костный мозг; таково строение тела позвонка. Кортикальная пластинка состоит из вертикальных перегородок, что усиливает способность противостоять сжимающей силе. Внутреннее губчатое вещество кости построено из костных балок, схожих со столбами. Тела позвонков шире в поперечном, чем в передне-заднем направлении, а их размеры увеличиваются по уровням в нисходящем направлении. Обычно ширина составляет 17-20 мм.
2. Замыкательные пластинки. Замыкательная пластинка тела позвонка — это утолщение кортикальной костной ткани с вогнутой поверхностью, направленной к фиброзно-хрящевому межпозвонковому диску, и тонкий слой хряща толщиной около 1 мм. Замыкательная пластинка наиболее плотная и крепкая по периферии. Хрящевые замыкательные пластинки покрывают сверху и снизу тонким слоем межпозвонковый диск, и отделяют его от костной части замыкательной пластинки. Решетчатая пластинка, состоящая из кальция, соединяет хрящевую и костную части замыкательной пластинки между собой.
Эта поверхность, похожая на сито, обеспечивает осмотическую диффузию и тем самым позволяет питательным веществам проникать в межпозвонковый диск.
3. Крючковидный отросток. Крючковидный отросток — это парный выступ на верхней стороне тела позвонка, придающий ей вогнутую форму во фронтальной плоскости. Отросток вместе с нижней поверхностью вышележащего позвонка формирует унковертебральный сустав, а иногда перекрывает следующий уровень на треть высоты тела позвонка. Унковертебральные суставы играют роль в ограничении бокового сгибания и улучшают соединение позвонков при осевом вращении и боковом сгибании в шейном отделе позвоночника.
В хирургическом аспекте, унковертебральные суставы служат боковой границей при переднем доступе для удаления тела позвонка или межпозвонкового диска, а также помогают определить срединную линию при передней установке шейных пластин.
4. Поперечный отросток. Поперечные отростки шейных позвонков уникальны, потому что имеют поперечное отверстие на уровнях С1-С6. Позвоночная артерия проходит через эти отверстия, которые сформированы боковой поверхностью ножки дуги позвонка, задней поверхностью переднего бугорка и передней поверхностью заднего бугорка.
Кроме того, по выраженной борозде нервного корешка на верхней поверхности выходит нервный корешок соответствующего уровня. Необходимо помнить, что эта борозда находится позади поперечного отверстия.
5. Невральные отверстия. Через невральные, или межпозвонковые, отверстия выходят шейные нервные корешки. В отличие от атланто-затылочного и атланто-осевого уровней, имеющих неполные отверстия, шейные позвонки, лежащие ниже осевого позвонка, имеют полные отверстия с четырьмя четкими стенками. Ножки дуг позвонков образуют верхнюю и нижнюю стенки. Передняя стенка образована телом позвонка сверху и унковертебральным суставом, покрывающим межпозвонковый диск, снизу. Задняя стенка образована капсулой межпозвонкового сустава. Нервные корешки проходят над соответствующей их уровню ножкой дуги позвонка по борозде нервного корешка на поперечном отростке вблизи межпозвонкового диска и унковертебрального сустава.
В связи с близким расположением, дегенерация унковертебрального или межпозвонкового сустава может приводить к стенозу неврального отверстия и сдавлению нервного корешка.
6. Передний и задний бугорки. Передний бугорок начинается от верхней поверхности тела позвонка и выступает в боковом направлении. Он служит местом прикрепления передней лестничной мышцы, длинной мышцы головы, длинной мышцы шеи и передних межпоперечных мышц. Задний бугорок служит местом прикрепления ременной мышцы шеи, длиннейшей мышцы шеи, средней лестничной мышцы, задней лестничной мышцы, подвздошно-реберной мышцы шеи и мышцы, поднимающей лопатку. Задний бугорок начинается от средней части латеральной массы и выступает в переднемедиальном направлении, приближаясь к переднему бугорку.
7. Ножки дуги позвонка. Ножки дуги позвонка — это заднебоковые выступы на теле позвонка. Они соединяют тело позвонка с латеральными массами. В отличие от грудных и поясничных позвонков, у шейных позвонков, лежащих ниже осевого позвонка, ножки короткие, маленькие и ориентированы в медиальном направлении. Поэтому при установке конструкций часто винты размещают в латеральных массах.
Еще одной отличительной особенностью ножек дуг позвонков данной анатомической области является отхождение ножек от середины тела позвонка между верхней и нижней его частями, что не отмечается в грудном и поясничном отделах. Высота ножек в сагиттальной плоскости возрастает по уровням в нисходящем направлении. Поперечная ширина ножек уменьшается от шейного к среднему грудному отделу позвоночника.
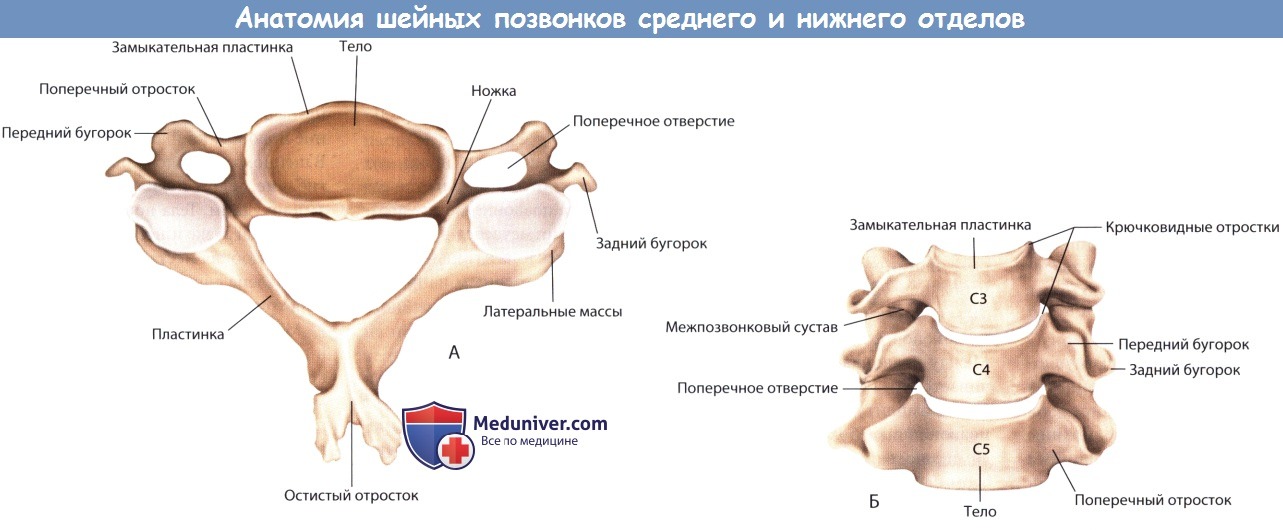
А: Вид сверху. Б: Вид спереди.
8. Позвоночный канал. Задняя вогнутая поверхность тела позвонка формирует переднюю стенку позвоночного канала, имеющего треугольную форму в горизонтальной плоскости. Боковые стенки сформированы медиальной поверхностью ножек, а задняя стенка образована передней стороной пластинки дуги позвонка. В средней и нижней частях шейного отдела позвоночника, передне-задний размер канала уменьшается в нисходящем направлении. На уровне С3 размер составляет примерно 17 мм, тогда как на уровне С7 — около 15 мм.
9. Латеральные массы. Латеральные массы являются цилиндрическими уплощенными короткими структурами, расположенными кзади и латеральнее ножек и фактически представлены межсуставной частью дуги, а также верхним и нижним суставными отростками с поверхностями, образующими межпозвонковые суставы с каждой стороны. Спереди расположен задний поперечный отросток, спереди и медиально расположена ножка, а медиально — пластинка дуги позвонка. На каждом уровне в непосредственной близости проходит нервный корешок. Сагиттальный размер варьируется от 12 до 18 мм.
Латеральные массы могут быть использованы для установки конструкции в связи с малым размером ножек позвонков, лежащих ниже осевого позвонка. Обычно размеры и объем уменьшаются в нисходящем направлении до уровня С7, который является переходным, поскольку здесь латеральные массы заметно тоньше, а ножки шире чем на вышележащих уровнях.
10. Межпозвонковые суставы. Межпозвонковые суставы представляют собой ориентированные во фронтальной плоскости суставы, окруженные тонкой синовиальной оболочкой. К сагиттальной плоскости межпозвонковые суставы расположены примерно под углом 45°. Суставы кровоснабжаются из позвоночной, восходящей глоточной, глубокой шейной, наивысшей межреберной и затылочной артерий; иннервация суставов обеспечена задними ветвями спинномозговых нервов.
Отличие в ориентации межпозвонковых суставов в разных отделах позвоночника — промежуточной ориентации в грудном отделе, в сагиттальной плоскости в поясничном отделе, и во фронтальной плоскости в среднем и нижнем шейных отделах позвоночника — объясняет различную амплитуду движений в этих отделах, поскольку при таком расположении суставы в шейном отделе лишь незначительно ограничивают осевое вращение и движение в любом направлении, за исключением разгибания. В шейном отделе позвоночника возможны сгибание, разгибание, боковой наклон и осевое вращение с большими амплитудами.
Тела позвонков способны противостоять осевой нагрузке и нестабильности при смещении структур. Подобная нестабильность может быть эффективно исправлена с помощью установки задней фиксирующей конструкции, если тела позвонков не повреждены.
Межпозвонковые диски существенно помогают в поддержании осевых нагрузок на позвоночник только при разгибании. Суставные поверхности и капсулы межпозвонковых суставов способны амортизировать примерно пятую часть осевой нагрузки, оказываемой на поясничный отдел позвоночника. На протяжении всего шейного отдела позвоночника общая амплитуда сгибания-разгибания составляет 60-75°, а смещение структур в сагиттальной плоскости на всех уровнях шейного отдела составляет не более 2-3 мм. Это обеспечивается благодаря функции межпозвонковых суставов, дисков и связок; небольшое увеличение амплитуды смещения может оказаться травмирующим.
Боковое сгибание является значимым движением. Между позвонками С2 и С5 на каждом уровне обеспечивается 10-12° амплитуды бокового наклона. На уровне С7-Т1 амплитуда составляет всего 4-8°. Во всех отделах позвоночника, боковое сгибание может сочетаться с другими движениями, например — осевым вращением; при этом осевые отростки нижележащих позвонков поворачиваются в противоположном направлении.
11. Пластинка дуги позвонка и остистый отросток. Пластинка дуги позвонка — это тонкая заднемедиальная структура, которая замыкает заднюю стенку позвоночного канала. Пластинки часто могут перекрывать смежные уровни и продолжаются остистым отростком, который в шейном отделе позвоночника имеет небольшие размеры и раздвоенное окончание.
в) Межпозвоночное пространство:
1. Границы межпозвонкового пространства. Хрящевые замыкательные пластинки, покрывающие тела позвонков, являются верхней и нижней границей межпозвонкового пространства. Передние и задние продольные связки формируют переднюю и заднюю границы соответственно. Крючковидные отростки ограничивают межпозвонковое пространство с боковых сторон.
2. Межпозвонковый диск. Межпозвонковый диск занимает пространство между за-мыкательными пластинками смежных позвонков. Каждый диск сформирован из центрального студенистого ядра и окружающего его фиброзного кольца, состоящего из коллагена и эластических волокон.
3. Фиброзное кольцо. Фиброзное кольцо представляет собой круглый обруч, состоящий из пересекающихся слоев коллагеновых волокон, которые проходят в косом направлении от тела позвонка вверх и вниз и упорядочены винтообразно. Имеется несколько слоев, волокна каждого из которых ориентированы одинаково; ориентация волокон смежных уровней отличается на 30°.
4. Студенистое ядро. Центрально расположенное студенистое ядро состоит из мягкого, похожего на мякоть фрукта, высокоэластичного мукопротеинового геля с высоким содержанием воды. Характерные особенности геометрии данного отдела позвоночника совпадают с таковыми во всех отделах; например, в поперечном сечении размер диска увеличивается по уровням от С2 до Т1. Любая нагрузка, которой противостоит тело позвонка, передается на тело нижележащего позвонка через межпозвонковый диск.
Неоднородность комплекса тела позвонка с межпозвонковым диском обусловливает особенности передачи осевой нагрузки и ее возрастные изменения. Первым компонентом, чья функция нарушается раньше других, является замыкательная пластинка, а не межпозвонковый диск.
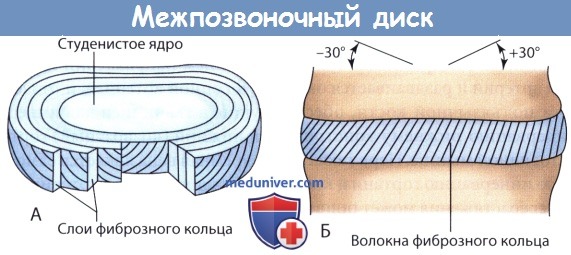
А: Студенистое ядро расположено в центре; концентрические волокна фиброзного кольца расположены по периферии.
Б: Межпозвонковый диск находится между тел смежных позвонков.
Каждый слой волокон фиброзного кольца ориентирован в одном направлении, а смежные слои ориентированы под углом 30° друг к другу.
Видео анатомия позвоночника и спинного мозга по атласу
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
СТРОЕНИЕ, ФУНКЦИИ И РОЛЬ ЗАМЫКАТЕЛЬНЫХ ПЛАСТИНОК В РАЗВИТИИ ДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ ПОЗВОНОЧНИКА: ОБЗОР ЛИТЕРАТУРЫ
Полный текст:
Аннотация
Ключевые слова
Об авторах
канд. биол. наук, старший научный сотрудник лабораторно-экспериментального отдела, Новосибирский НИИ травматологии и ортопедии им. Я.Л. Цивьяна
630091, Россия, Новосибирск, ул. Фрунзе, 17
канд. биол. наук, научный сотрудник лабораторно-экспериментального отдела, Новосибирский НИИ травматологии и ортопедии им. Я.Л. Цивьяна
630091, Россия, Новосибирск, ул. Фрунзе, 17
Список литературы
1. Abe Y, Akeda K, An HS, Aoki Y, Pichika R, Muehleman C, Kimura T, Masuda K. Proinflammatory cytokines stimulate the expression of nerve growth factor by human intervertebral disc cells. Spine. 2007;32:635–642. DOI: 10.1097/01.brs.0000257556.90850.53.
2. Adams MA, Freeman BJ, Morrison HP, Nelson IW, Dolan P. Mechanical initiation of intervertebral disc degeneration. Spine. 2000;25:1625–1636. DOI: 10.1097/00007632-200007010-00005.
3. Alkhatib B, Rosenzweig DH, Krock E, Roughley PJ, Beckman L, Steffen T, Weber MH, Ouellet JA, Haglund L. Acute mechanical injury of the human intervertebral disc: link to degeneration and pain. Eur Cell Mater. 2014;28:98–111.
4. Antonacci MD, Mody DR, Rutz K, Weilbaecher D, Heggeness MH. A histologic study of fractured human vertebral bodies. J Spinal Disord Tech. 2002;15:118–126.
5. Anatoniou J, Goudsouzian M, Heathfield TF, Winterbottom N, Steffen T, Poole AR, Aebi M, Alini M. The human lumbar endplate. Evidence of changes in biosynthesis and denaturation of the extracellular matrix with growth, maturation, aging, and degeneration. Spine. 1996;21:1153–1161.
6. Arana CJ, Diamandis EP, Kandel RA. Cartilage tissue enhances proteoglycan retention by nucleus pulposus cells in vitro. Arthritis Rheum. 2010;62:3395–3403. DOI: 10.1002/art.27651.
7. Benneker LM, Heini PF, Alini M, Anderson SE, Ito K. 2004 Young Investigator Award Winner: vertebral endplate marrow contact channel occlusions and intervertebral disc degeneration. Spine. 2005;30:167–173.
8. Bibby SR, Urban JP. Effect of nutrient deprivation on the viability of intervertebral disc cells. Eur Spine J. 2004;13:695–701. DOI: 10.1007/s00586-003-0616-x.
9. Bibby SR, Jones DA, Ripley RM, Urban JP. Metabolism of the intervertebral disc: effects of low levels of oxygen, glucose, and pH on rates of energy metabolism of bovine nucleus pulposus cells. Spine. 2005;30:487–496. DOI: 10.1097/01.brs.0000154619.38122.47.
10. Binch AL, Cole AA, Breakwell LM, Michael AL, Chiverton N, Cross AK, Le Maitre CL. Expression and regulation of neurotrophic and angiogenic factors during human intervertebral disc degeneration. Arthritis Res Ther. 2014;16:416. DOI: 10.1186/s13075-014-0416-1.
11. Boos N, Nerlich AG, Wiest I, von der Mark K, Aebi M. Immunolocalization of type X collagen in human lumbar intervertebral discs during ageing and degeneration. Histochem Cell Biol. 1997;108:471–480. DOI: 10.1007/s004180050187.
12. Buckwalter JA, Smith KC, Kazarien LE, Rosenberg LC, Ungar R. Articular cartilage and intervertebral disc proteoglycans differ in structure: an electron microscopic study. J Orthop Res. 1989;7:146–151. DOI: 10.1002/jor.1100070121.
13. Chen S, Huang Y, Zhou ZJ, Hu ZJ, Wang JY, Xu WB, Fang XQ, Fan SW. Upregulation of tumor necrosis factor alpha and ADAMTS-5, but not ADAMTS-4, in human intervertebral cartilage endplate with modic changes. Spine. 2014;39:E817–E825. DOI: 10.1097/BRS.0000000000000362.
14. Chevalier X, Eymard F, Richette P. Biologic agents in osteoarthritis: hopes and disappointments. Nat Rev Rheumatol. 2013;9:400-410. DOI: 10.1038/nrrheum.2013.44.
15. David G, Ciurea AV, Iencean SM, Mohan A. Angiogenesis in the degeneration of the lumbar intervertebral disc. J Med Life. 2010;3:154–161.
16. Fagan A, Moore R, Vernon Roberts B, Blumbergs P, Fraser R. ISSLS prize winner: The innervation of the intervertebral disc: a quantitative analysis. Spine. 2003;28:2570–2576. DOI: 10.1097/01.BRS.0000096942.29660.B1.
17. Fields AJ, Liebenberg EC, Lotz JC. Innervation of pathologies in the lumbar vertebral end plate and intervertebral disc. Spine J. 2014;14:513–521. DOI: 10.1016/j.spinee.2013.06.075.
18. Giers MB, Munter BT, Eyster KJ, Ide GD, Newcomb AGUS, Lehrman JN, Belykh E, Byvaltsev VA, Kelly BP, Preul MC, Theodore N. Biomechanical and endplate effects on nutrient transport in the intervertebral disc. World Neurosurg. 2017;99:395–402. DOI: 10.1016/j.wneu.2016.12.041.
19. Grant JP, Oxland TR, Dvorak MF. Mapping the structural properties of the lumbosacral vertebral endplates. Spine. 2001;26:889–896. DOI: 10.1097/00007632-200104150-00012.
20. Grant JP, Oxland TR, Dvorak MF, Fisher CG. The effects of bone density and disc degeneration on the structural property distributions in the lower lumbar vertebral endplates. J Orthop Res. 2002;20:1115–1120. DOI: 10.1016/S0736-0266(02)00039-6.
21. Grant MP, Epure LM, Bokhari R, Roughley P, Antoniou J, Mwale F. Human cartilaginous endplate degeneration is induced by calcium and the extracellular calcium-sensing receptor in the intervertebral disc. Eur Cell Mater. 2016;32:137–151. DOI: 10.22203/eCM.v032a09.
22. Grignon B, Grignon Y, Mainard D, Braun M, Netter P, Roland J. The structure of the cartilaginous end-plates in elder people. Surg Radiol Anat. 2000;22:13–19.
23. Gruber HE, Hoelscher GL, Bethea S, Hanley EN Jr. Interleukin 1-beta upregulates brain-derived neurotrophic factor, neurotrophin 3 and neuropilin 2 gene expression and NGF production in annulus cells. Biotech Histochem. 2012;87:506–511. DOI: 10.3109/10520295.2012.703692.
24. Gruber HE, Ingram JA, Cox MD, Hanley EN Jr. Matrix metalloproteinase-12 immunolocalization in the degenerating human intervertebral disc and sand rat spine: Biologic implications. Exp Mol Pathol. 2014;97:1–5. DOI: 10.1016/j.yexmp.2014.04.007.
25. Grunhagen T, Shirazi-Adl A, Fairbank JC, Urban JP. Intervertebral disk nutrition: a review of factors influencing concentrations of nutrients and metabolites. Orthop Clin North Am. 2011;42:465–477. DOI: 10.1016/j.ocl.2011.07.010.
26. Guehring T, Wilde G, Sumner M, Grunhagen T, Karney GB, Tirlapur UK, Urban JP. Notochordal intervertebral disc cells: sensitivity to nutrient deprivation. Arthritis Rheum. 2009;60:1026–1034. DOI: 10.1002/art.24407.
27. Gullbrand SE, Peterson J, Ahlborn J, Mastropolo R, Fricker A, Roberts TT, Abousayed M, Lawrence JP, Glennon JC, Ledet EH. ISSLS Prize Winner: Dynamic loading-induced convective transport enhances intervertebral disc nutrition. Spine. 2015;40:1158–1164. DOI: 10.1097/BRS.0000000000001012.
28. Hadjipavlou AG, Tzermiadianos MN, Bogduk N, Zindrick MR. The pathophysiology of disc degeneration: a critical review. J Bone Joint Surg Br. 2008;90:1261–1270. DOI: 10.1302/0301-620X.90B10.20910.
29. Handa T, Ishihara H, Ohshima H, Osada R, Tsuji H, Obata K. Effects of hydrostatic pressure on matrix synthesis and matrix metalloproteinase production in the human lumbar intervertebral disc. Spine. 1997;22:1085–1091. DOI: 10.1097/00007632-199705150-00006.
30. Hee HT, Chuah YJ, Tan BH, Setiobudi T, Wong HK. Vascularization and morphological changes of the endplate after axial compression and distraction of the intervertebral disc // Spine (Phila Pa 1976). 2011 Apr 1;36(7):505–11.
31. Herrero CF, Garcia SB, Garcia LV, Aparecido Defino HL. Endplates changes related to age and vertebral segment. BioMed Res Int. 2014;2014:545017. DOI: 10.1155/2014/545017.
32. Horner HA, Urban JP. 2001 Volvo Award Winner in Basic Science Studies: Effect of nutrient supply on the viability of cells from the nucleus pulposus of the intervertebral disc. Spine. 2001;26:2543–2549. DOI: 10.1097/00007632-200112010-00006.
33. Horner HA, Roberts S, Bielby RC, Menage J, Evans H, Urban JP. Cells from different regions of the intervertebral disc: effect of culture system on matrix expression and cell phenotype. Spine. 2002;27:1018–1028.
34. Huang CY, Yuan TY, Jackson AR, Hazbun L, Fraker C, Gu WY. Effects of low glucose concentrations on oxygen consumption rates of intervertebral disc cells. Spine. 2007;32:2063–2069. DOI: 10.1097/BRS.0b013e318145a521.
35. Hulme PA, Boyd SK, Ferguson SJ. Regional variation in vertebral bone morphology and its contribution to vertebral fracture strength. Bone. 2007;41:946–957. DOI: 10.1016/j.bone.2007.08.019.
36. Ito K, Creemers L. Mechanisms of intervertebral disk degeneration/injury and pain: a review. Global Spine J. 2013;3:145–152. DOI: 10.1055/s-0033-1347300.
37. Ishihara H, Urban JP. Effects of low oxygen concentrations and metabolic inhibitors on proteoglycan and protein synthesis rates in the intervertebral disc. J Orthop Res. 1999;17:829–835. DOI: 10.1002/jor.1100170607.
38. Jackson AR, Yuan TY, Huang CY, Brown MD, Gu WY. Nutrient transport in human annulus fibrosus is affected by compressive strain and anisotropy. Ann Biomed Eng. 2012;40:2551–2558. DOI: 10.1007/s10439-012-0606-4.
39. Kovacs FM, Arana E, Royuela A, Estremera A, Amengual G, Asenjo B, Sarasibar H, Galarraga I, Alonso A, Casillas C, Muriel A, Martinez C, Abraira V. Vertebral endplate changes are not associated with chronic low back pain among Southern European subjects: a case control study. AJNR Am J Neuroradiol. 2012;33:1519–1524. DOI: 10.3174/ajnr.A3087.
40. Langrana NA, Kale SP, Edwards WT, Lee CK, Kopacz KJ. Measurement and analyses of the effects of adjacent end plate curvatures on vertebral stresses. Spine J. 2006;6:267–278. DOI: 10.1016/j.spinee.2005.09.008.
41. Lee JM, Song JY, Baek M, Jung HY, Kang H, Han IB, Kwon YD, Shin DE. Interleukin-1beta induces angiogenesis and innervation in human intervertebral disc degeneration. J Orthop Res. 2011;29:265–269. DOI: 10.1002/jor.21210.
42. Liu C, Zhao QL, Wang LT, Wang H, Xu HG. The effect of the endplate cartilage in the degeneration of intervertebral disc. Austin J Orthopade & Rheumatol. 2016;3:1035.
43. Lotz JC, Chin JR. Intervertebral disc cell death is dependent on the magnitude and duration of spinal loading. Spine. 2000;25:1477–1483. DOI: 10.1097/00007632-200006150-00005.
44. Lotz JC, Fields AJ, Liebenberg EC. The role of the vertebral end plate in low back pain. Global Spine J. 2013;3:153–164. DOI: 10.1055/s-0033-1347298.
45. Malandrino A, Lacroix D, Hellmich C, Ito K, Ferguson SJ, Noailly J. The role of endplate poromechanical properties on the nutrient availability in the intervertebral disc. Osteoarthritis Cartilage 2014;22:1053–1060. DOI: 10.1016/j.joca.2014.05.005.
46. MacLean JJ, Owen JP, Iatridis JC. Role of endplates in contributing to compression behaviors of motion segments and intervertebral discs. J Biomech. 2007;40:55–63. DOI: 10.1016/j.jbiomech.2005.11.013.
47. Moore RJ. The vertebral end-plate: what do we know? Eur Spine J. 2000;9:92–96. DOI: 10.1007/s005860050217.
48. Moore RJ. The vertebral endplate: disc degeneration, disc regeneration. Eur Spine J. 2006;15(Suppl 3):333–337. DOI: 10.1007/s00586-006-0170-4.
49. Nazarian A, Snyder BD, Zurakowski D, Muller R. Quantitative micro-computed tomography: a non-invasive method to assess equivalent bone mineral density. Bone. 2008;43:302–311. DOI: 10.1016/j.bone.2008.04.009.
50. Nekkanty S, Yerramshetty J, Kim D G. Zauel R, Johnson E, Cody DD, Yeni YN. Stiffness of the endplate boundary layer and endplate surface topography are associated with brittleness of human whole vertebral bodies. Bone. 2010;47:783–789. DOI: 10.1016/j.bone.2010.07.001.
51. Niinimaki J, Korkiakoski A, Parviainen O, Haapea M, Kuisma M, Ojala RO, Karppinen J, Korpelainen R, Tervonen O, Nieminen MT. Association of lumbar artery narrowing, degenerative changes in disc and endplate and apparent diffusion in disc on postcontrast enhancement of lumbar intervertebral disc. Magn Reson Mater Phy. 2009;22:101–109. DOI: 10.1007/s10334-008-0151-1.
52. Peng B, Hou S, Shi Q, Jia L. The relationship between cartilage end-plate calcification and disc degeneration: an experimental study. Chin Med J (Engl). 2001;114:308–312.
53. Peng B, Chen J, Kuang Z, Li D, Pang X, Zhang X. Diagnosis and surgical treatment of back pain originating from endplate. Eur Spine J. 2009;18:1035–1040. DOI: 10.1007/s00586-009-0938-4.
54. Rajasekaran S, Babu JN, Arun R, Armstrong BR, Shetty AP, Murugan S. ISSLS prize winner: A study of diffusion in human lumbar discs: a serial magnetic resonance imaging study documenting the influence of the endplate on diffusion in normal and degenerate discs. Spine. 2004;29:2654–2667. DOI: 10.1097/01.brs.0000148014.15210.64.
55. Risbud MV, Shapiro IM. Role of cytokines in intervertebral disc degeneration: pain and disc content. Nat Rev Rheumatol. 2014;10:44–56. DOI: 10.1038/nrrheum.2013.160.
56. Roberts S, Menage J, Urban JP. Biochemical and structural properties of the cartilage end-plate and its relation to the intervertebral disc. Spine. 1989;14:166–174. DOI: 10.1097/00007632-198902000-00005.
57. Roberts S, Menage J, Eisenstein SM. The cartilage end-plate and intervertebral disc in scoliosis: calcification and other sequelae. J Orthop Res. 1993;11:747–757. DOI: 10.1002/jor.1100110517.
58. Rodriguez AG, Slichter CK, Acosta FL, Rodriguez-Soto AE, Burghardt AJ, Majumdar S, Lotz JC. Human disc nucleus properties and vertebral endplate permeability. Spine. 2011;36:512–520. DOI: 10.1097/BRS.0b013e3181f72b94.
59. Rodriguez AG, Rodriguez-Soto AE, Burghardt AJ, Berven S, Majumdar S, Lotz JC. Morphology of the human vertebral endplate. J Orthop Res. 2012;30:280–287. DOI: 10.1002/jor.21513.
60. Roughley PJ. Biology of intervertebral disc aging and degeneration: involvement of the extracellular matrix. Spine. 2004;29:2691–2699.
61. Shirazi-Adl A, Taheri M, Urban JP. Analysis of cell viability in intervertebral disc: Effect of endplate permeability on cell population. J Biomech. 2010;43:1330–1336. DOI: 10.1016/j.jbiomech.2010.01.023.
62. Taylor TK, Merlose J, Burkhardt D, Ghosh P, Claes LE, Kettler A, Wilke HJ. Spinal biomechanics and aging are major determinants of the proteoglycan metabolism of intervertebral disc cells. Spine. 2000;25:3014–3020. DOI: 10.1097/00007632-200012010-00008.
63. Tomaszewski KA, Adamek D, Konopka T, Tomaszewska R, Walocha JA. Endplate calcification and cervical intervertebral disc degeneration: the role of endplate marrow contact channel occlusion. Folia Morphol (Warsz). 2015;74:84–92. DOI: 10.5603/FM.2015.0014.
64. Urban JP, Smith S, Fairbank JC. Nutrition of the intervertebral disc. Spine. 2004;29:2700–2709. DOI: 10.1097/01.brs.0000146499.97948.52.
65. Wade KR, Robertson PA, Broom ND. A fresh look at the nucleus-endplate region: new evidence for significant structural integration. Eur Spine J. 2011;20:1225–1232. DOI: 10.1007/s00586-011-1704-y.
66. Wagner AL, Murtagh FR, Arrington JA, Stallworth D. Relationship of Schmorl’s nodes to vertebral body endplate fractures and acute endplate disk extrusions. AJNR Am J Neuroradiol 2000;21:276–281.
67. Walsh AJ, Lotz JC. Biological response of the intervertebral disc to dynamic loading. J Biomech. 2004;37:329–337. DOI: 10.1016/S0021-9290(03)00290-2.
68. Wang Y, Videman T, Battie MC. ISSLS prize winner: Lumbar vertebral endplate lesions associations with disc degeneration and back pain history. Spine. 2012;37:1490–1496. DOI: 10.1097/BRS.0b013e3182608ac4.
69. Williams FM, Manek NJ, Sambrook PN, Spector TD, Macgregor AJ. Schmorl’s nodes: common, highly heritable, and related to lumbar disc disease. Arthritis Rheum. 2007;57:855–860. DOI: 10.1002/art.22789.
70. Wong M, Siegrist M, Goodwin K. Cyclic tensile strain and cyclic hydrostatic pressure differentially regulate expression of hypertrophic markers in primary chondrocytes. Bone. 2003;33:685–693. DOI: 10.1016/S8756-3282(03)00242-4.
71. Wu Y, Cisewski S, Sachs BL, Yao H. Effect of cartilage endplate on cell based disc regeneration: a finite element analysis. Mol Cell Biomech. 2013;10:159–182.
72. Wu Y, Cisewski SE, Sachs BL, Pellegrini VD, Kern MJ, Slate EH, Yao H. The region-dependent biomechanical and biochemical properties of bovine cartilaginous endplate. J Biomech. 2015;48:3185–3191. DOI: 10.1016/j.jbiomech.2015.07.005.
73. Zhang Q, Huang M, Wang X, Xu X, Ni M, Wang Y. Negative effects of ADAMTS-7 and ADAMTS-12 on endplate cartilage differentiation. J Orthop Res. 2012;30:1238–1243. DOI: 10.1002/jor.22069.
74. Zhang Y, Lenart BA, Lee JK, Chen D, Shi P, Ren J, Muehleman C, Chen D, An HS. Histological features of endplates of the mammalian spine: from mice to men. Spine. 2014;39:E312–E317. DOI: 10.1097/BRS.0000000000000174.
75. Zhao FD, Pollintine P, Hole BD, Adams MA, Dolan P. Vertebral fractures usually affect the cranial endplate because it is thinner and supported by less-dense trabecular bone. Bone. 2009;44:372–379. DOI: 10.1016/j.bone.2008.10.048.
Для цитирования:
Русова Т.В., Воропаева А.А. СТРОЕНИЕ, ФУНКЦИИ И РОЛЬ ЗАМЫКАТЕЛЬНЫХ ПЛАСТИНОК В РАЗВИТИИ ДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ ПОЗВОНОЧНИКА: ОБЗОР ЛИТЕРАТУРЫ. «Хирургия позвоночника». 2017;14(4):95-102. https://doi.org/10.14531/ss2017.4.95-102
For citation:
Rusova T.V., Voropaeva A.A. STRUCTURE, FUNCTIONS AND ROLE OF ENDPLATES IN THE DEVELOPMENT OF DEGENERATIVE DISEASES OF THE SPINE: A LITERATURE REVIEW. Hirurgiâ pozvonočnika (Spine Surgery). 2017;14(4):95-102. https://doi.org/10.14531/ss2017.4.95-102