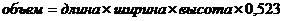Край резекции негативный что это
Методика морфологического исследования препарата после радикальной простатэктомии
Набебина Т.И., Дубровский А.Ч., Ролевич А.И., Поляков С.Л.
В последние годы отмечается значительный рост выявления рака предстательной железы (РПЖ) на территории Республики Беларусь. По всей видимости, этот рост отражает наметившуюся тенденцию в странах СНГ к раннему выявлению РПЖ вследствие участившегося определения уровня простат-специфического антигена (ПСА) в крови у бессимптомных пациентов [1]. Увеличение частоты выявления локализованного и местно-распространенного РПЖ привело к увеличению частоты выполнения радикальной простатэктомии (РП) в последние 3-5 лет в ГУ НИИ ОМР (рис. 1).
Одним из самых важных вопросов, стоящих перед патоморфологами и урологами, является грамотное определение прогноза после операции для каждого конкретного больного. Результаты патоморфологического исследования препарата после РП являются наиболее ценной информацией для ответа на этот вопрос. Так, по данным Stamey с соавт. [2] рецидив РПЖ после РП может быть предсказан с высокой степенью точности на основании результатов патоморфологического исследования. В настоящей работе, в основу которой положены последние рекомендации рабочей группы Европейского Общества Уропатологов [3], дается обзор методики морфологического исследования препарата после РП.
СТРОЕНИЕ И ФУНКЦИЯ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Роль и функция предстательной железы (ПЖ) в организме мужчины, по-видимому, до конца не выяснены. Секрет железы составляет около 20% объема семенной жидкости, в нем содержатся вещества, способствующие подвижности сперматозоидов, но не являющиеся жизненно необходимыми для оплодотворения. ПЖ охватывает проксимальную часть мочеиспускательного канала и имеет форму усеченного конуса, обращенного широкой частью к мочевому пузырю. Выделяют переднюю, заднюю и боковые поверхности, снизу – верхушку и сверху – основание. Проходящая по задней поверхности бороздка делит ПЖ на две доли.
ПЖ состоит из тубуло-альвеолярных желез, сгруппированных в дольки и окружающей железы стромы. Выводные протоки желез соединяются в более крупные, которые открываются в простатическую уретру. ПЖ окружена плотной капсулой, состоящей из коллагена, эластина и большого количества гладкой мускулатуры. ПЖ граничит с прямой кишкой сзади, мочевым пузырем сверху и лонной костью спереди, мышцами тазового дна латерально и произвольным поперечно-полосатым сфинктером снизу. Кзади и латеральнее ПЖ проходят т.н. сосудисто-нервные пучки. В их составе идут тонкие ветви внутренней подвздошной артерии, кровоснабжающие семенные пузырьки и простату. Эти сосуды сопровождают вегетативные нервные волокна (т. н. кавернозные нервы), которые идут от тазового сплетения и иннервируют ПЖ и кавернозные тела полового члена. ПЖ окружена венозным Санториниевым сплетением.
Зональная анатомия ПЖ. ПЖ состоит из пяти зон: центральной, периферической, переходной, периуретральной и передней фибромускулярной стромы (рис. 2). РПЖ развивается с различной частотой в каждой зоне, и эта частота не пропорциональна массе железистой ткани в ней. Центральная и периферическая зоны – наиболее крупные участки ПЖ – вместе составляют около 95% железистой ткани предстательной железы. Центральная зона окружает семявыносящие протоки на их пути от основания ПЖ к семенному бугорку. Центральная зона занимает 15-20% объема железы, однако в ней возникают только 5-10% от всех РПЖ. Периферическая зона – пальпируемая через прямую кишку часть железы. Она окружает центральную зону, включает 70% железистой ткани, и в ней возникает около 70% аденокарцином ПЖ. Переходная зона – парные участки ПЖ, которые располагаются по бокам от простатической уретры на уровне семенного бугорка, занимают оставшиеся 5% железы. Самой частой патологией этой зоны является доброкачественная гиперплазия предстательной железы (ДГПЖ), которая может приводить к значительному увеличению этих зон, иногда превышающему по объему остальные участки ПЖ. В этой зоне РПЖ развиваются реже, чем ДГПЖ, частота его составляет около 20%. Периуретральные железы располагаются между простатической уретрой и проксимальным гладкомышечным сфинктером мочевого пузыря. Фибромускулярная строма занимает переднюю поверхность ПЖ и состоит преимущественно из мышечной ткани. Аденокарциномы в двух последних зонах не развиваются.
МЕТОДИКА ОБРАБОТКИ МАКРОПРЕПАРАТА ПОСЛЕ РП
Свежий (нефиксированный) препарат после РП рекомендуется взвешивать и измерять в трех измерениях (длина, ширина и толщина). Оценка веса макропрепарата после РП достаточно важна, особенно в сочетании с комментариями патоморфолога, относящимися к оценке полноты резекции предстательной железы. Из-за того, что ПЖ имеет неправильную форму и симметрична только относительно сагиттальной плоскости, линейные размеры препарата менее точны, воспроизводимы и ценны чем вес препарата [5, 6]. Объем препарата может быть приблизительно определен по формуле, используемой для округлых образований [7]:
Поскольку поверхность ПЖ покрывает фиброзно-мышечная ткань, не образующая отдельной обособленный гистологической границы между железой и экстрапростатической соединительной тканью, оценить радикальность операции может быть весьма сложно как хирургу, так и патоморфологу, что привело к разработке специальной методики оценки краев резекции ПЖ. Для последующего определения состояния краев резекции органа вся поверхность удаленной и нефиксированной ПЖ должна быть окрашена. Если этого не выполнить, то морфолог не сможет определить в микропрепарате является ли обнаружение роста опухоли по краю позитивным хирургическим краем или это артефакт нарезки. Также достоверно судить о наличии опухоли по краю резекции на основании осмотра поверхности макропрепарата также нельзя. Для этого может использоваться черная тушь, поскольку черные края резекции проще распознаются при микроскопическом исследовании. Другим вариантом окраски поверхности железы является применение двух разных цветов для каждой стороны препарата для облегчения последующей ориентации и распознавания правой и левой стороны [8]. Обычно используются зеленый и красный (или синий) цвета. После окраски поверхности препарат погружается в фиксирующий раствор, например раствор Боуэна или уксусную кислоту, после чего тушь фиксируется на поверхности ПЖ и не смывается при проводке [8].
Перед разрезанием ПЖ на фрагменты рекомендуется ее фиксировать в формалине, что обеспечивает получение более тонких срезов. Для снижения времени фиксации и равномерной пенетрации формалина в железу, в препарат инъекционно вводится нейтральный 10% раствор формалина с использованием тонкой внутрикожной иглы. Обоснованием этой методики является то, что при обычном погружении железы в раствор формалина, проникновение его в толщу органа слишком медленное и неравномерное, кроме того, коагулированные формалином белки в ткани периферической зоны ПЖ затрудняют дальнейшую пенетрацию раствора [9].
После фиксации производится нарезка препарата на отдельные части (рис. 3). Сначала из макропрепарата удаляются семенные пузырьки. Семенные пузырьки исследуются после их секции через место вхождения в ПЖ (основание семенного пузырька) [10]. Практически все случаи опухолевой инвазии семенных пузырьков первоначально вовлекают основание семенного пузырька. Опухоль врастает в семенные пузырьки либо прямо через семяизвергающий проток либо вторично вследствие распространения опухоли за пределы ПЖ в перипростатические соединительные ткани и затем в просвет семенного пузырька [10].
После удаления семенных пузырьков двумя поперечными разрезами на расстоянии 4 мм от дистального и проксимального краев ПЖ от препарата отрезаются апикальная и базальная части железы. Эти участки затем нарезаются на части в парасагиттальном направлении перпендикулярно окрашенной поверхности с интервалом 4 мм как показано на рис. 3.
Оставшийся после удаления апикальной и базальной частей ПЖ макропрепарат последовательно нарезается с 4 мм интервалами перпендикулярно длинной (апико-базальной) оси ПЖ. Эти срезы ПЖ рекомендуется обозначать последовательными заглавными буквами алфавита, всегда начиная с наиболее апикального участка и заканчивая базальным. Такие срезы через всю ПЖ после заливки в парафин для микроскопического исследования рекомендуется нарезать таким же образом, т.е. перпендикулярно длинной (апико-базальной) оси на всю толщу ПЖ. Альтернативой такому приготовлению микропрепаратов может быть разделение 4-мм слоев на квадранты, которые нумеруются арабскими цифрами. При таком методе вся предстательная железа доступна для гистологического исследования [11]. Если для окраски поверхности ПЖ используется тушь, то для пометки правой стороны используется надрез скальпелем каждого среза по переднее-латеральной поверхности препарата справа. После такой нарезки препарата фрагменты можно дополнительно фиксировать в формалине в течение 24 ч.
Обоснованием необходимости полной заливки ПЖ в парафин является то, что идентификация локализации и распространения опухоли при макроскопическом исследовании порезанной ПЖ не всегда возможна, особенно при РПЖ, выявленном случайно или в ходе скрининга. Недавно опубликованное исследование Desai с соавт. [12] демонстрирует, что по сравнению с обычной методикой приготовления микропрепарата, полная заливка и частая нарезка макропрепарата после РП увеличивает частоту выявления распространения опухоли за пределы ПЖ, и приводит к повышению безрецидивной выживаемости при каждой стадии РПЖ.
Получившиеся фрагменты ПЖ ступенчато дегидратируются в разведенных спиртах, осветляются в ксилоле, заливаются в парафин, нарезаются на слои толщиной 5 мкм, окрашиваются гематоксилин-эозином, после чего могут исследоваться гистологически (рис. 4). При этом должны использоваться формовочные кассеты и предметные стекла специальных размеров. Предметные и покровные стекла должны быть как минимум 76 мм в длину и 50 мм в ширину [11, 13].
Выбор между получением срезов всего препарата или исследования его квадрантов зависит от предпочтений патоморфолога, на которое влияют удобство и простота исследования больших срезов и технические проблемы получения и хранения препаратов нестандартного размера. Единственным существенным отличием в методике получении препаратов при использовании этих двух подходов является то, что требуется более толстая нарезка целой ПЖ. Кроме того, выполнение ИГХ требует обычно большего количества реагента и может выполняться только вручную [13].
МЕТОДИКА ИССЛЕДОВАНИЯ МАКРОПРЕПАРАТА ПОСЛЕ РП В СЛУЧАЕ pT0
Если при исследовании микропрепаратов патоморфолог не находит РПЖ, рекомендуется следующее: если ПЖ не была залита в парафин полностью, то рекомендуется это выполнить; если ПЖ была полностью залита в парафин, для оценки локализации опухоли необходимо пересмотреть микропрепараты после биопсии. Необходимо перерезать участки препарата после РП в этой зоне после переворачивания блока.
Для обнаружения т.н. “минимального остаточного рака”, особенно у больных, получавших до операции неоадъювантную гормональную терапию можно выполнить иммуногистохимическое исследование с антителом против CAM 5,2 [14].
ЗАКЛЮЧЕНИЕ ПО ПРЕПАРАТУ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Полное и четкое заключение патоморфолога по удаленному в ходе РП препарату ПЖ весьма важно для выработки оптимальной тактики лечения больного. Заключение должно содержать клинически значимую информацию, полученную на основании макро- и микроскопического исследований препарата после РП. Основное внимание должно уделяться оценке факторов прогноза, включенных Коллегией Американских Патологов (College of American Pathologists) в категории 1 и 2 (табл. 1) [6]. Эти факторы с доказанной прогностической значимостью и используемые в лечении больного, включают гистологический тип опухоли, степень дифференцировки, объем рака, степень местной распространенности и стадию РПЖ а также состояние краев резекции. Также могут использоваться и другие изученные биологические и клинические факторы, прогностическая значимость которых еще не подтверждена в крупных исследованиях.
Гистологический тип РПЖ. Гистологическая классификация РПЖ представленная в табл. 2 [15]. Более 95% от всего РПЖ имеют типичное строение ацинарной аденокарциномы. В последние годы были описаны несколько новых и необычных гистологических вариантов РПЖ. Эти варианты представляют собой спектр изменений, которые могут происходить в аденокарциноме и должны указываться в морфологическом заключении, если обнаруживаются в препарате. Кроме того, существует ряд опухолей ПЖ, например, переходно-клеточный, плоскоклеточный, базалоидный и аденокистозный раки, биологическое поведение и методы лечения которых существенно отличаются от типичного РПЖ, что делает точную диагностику типа опухоли крайне важной для определения тактики лечения больного.
Степень дифференцировки (степень злокачественности). Наиболее значимым предиктором прогрессирования РПЖ после РП является сумма Глисона, определенная в препарате после РП (табл. 3) [16–19]. Система Глисона является методикой выбора при определении степени злокачественности опухоли, использовать термины “высокодифференцированный”, “умереннодифференцированный” и “низкодифференцированный” для определения степени злокачественности РПЖ не рекомендуется [6]. Сумма Глисона состоит из двух слагаемых: первичного (наиболее распространенного) и вторичного (второй по распространенности) показателей Глисона (Gleason grade). Если в препарате не выявляется вторичный показатель Глисона, то для получения сумы Глисона первичный показатель Глисона удваивается. Первичный и вторичный показатели Глисона должны указываться в скобках после указания суммы Глисона (например: сумма Глисона 7 (3 + 4)). Для группировки суммы Глисона в категории с целью обобщения результатов лечения и т.д., рекомендуется следующая группировка (табл. 4): 2-5, 6, 7, 8-10, или 2-6, 7, 8-10.
Если в препарате после РП идентифицируется две или более отдельных опухоли, можно указывать суммы Глисона каждой опухоли либо должна быть указана сумма Глисона наиболее значительной опухоли. Например, если имеется большая опухоль в переходной зоне ПЖ с суммой Глисона 5 и отдельная меньшая опухоль в периферической зоне с суммой Глисона 7, то должны указываться обе суммы Глисона или по меньшей мере сумма Глисона последней опухоли, а не усредненное значение суммы Глисона.
Из-за большего количества опухоли в препарате после РП, доступной для исследования, (в отличие от биопсийного материала), часто возможна ситуация, когда в опухоли обнаруживается более двух показателей Глисона (Gleason grade), т.е. имеется третичный показатель Глисона. Поскольку оригинальная система Глисона учитывает только первичный и вторичный показатели Глисона, в подходе к оценке степени злокачественности при опухолях с третичным показателем Глисона имеются разногласия, несмотря на то, что наличие третичного показателя Глисона влияет на прогноз. Так, частота прогрессирования РПЖ с суммой Глисона 5-6 и третичным показателем 4 почти такая же, как и при опухолях с суммой Глисона 7. В свою очередь опухоли с суммой Глисона 7 и третичным показателем 5 ведут себя как опухоли с суммой Глисона 8. С другой стороны таких различий не наблюдается при РПЖ с суммой Глисона 8 и третичным показателем 5, по-видимому вследствие небольшого количества больных с такой патологией а также настолько неблагоприятного прогноза при РПЖ с суммой Глисона 8, что присутствие третичного показателя 5 существенно не может его ухудшить [20].
Другим дискутабельным вопросом при определении степени злокачественности является вопрос об определении суммы Глисона в опухолях, состоящих на 95% из одного типа по Глисону, в которых имеется только небольшое количество более низкодифференцированной опухоли. Например, опухоль ПЖ, содержащую > 95% опухолевой ткани с показателем Глисона 3 и
Контроль хирургических краев резекции при органосохраняющем лечении рака молочной железы
1 НИИ онкологии им. Н.Н. Петрова Минздрава Россиии,
2 Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова МЗ РФ
3 Северо-Западный государственный медицинский университет им. И.И. Мечникова Санкт-Петербург, Россия
В настоящее время продолжаются споры по поводу определения «оптимального» хирургического края при органосохраняющем лечении (ОСЛ) рака молочной железы. Исторически основа данного спора берет начало от оригинальных испытаний, подтверждающих безопасность ОСЛ, и множества противоречивых ретроспективных исследований, пытавшихся за последние 20 лет определить связь между шириной хирургического края и отдаленными результатами.
Важно понимать, что оценка хирургического края является неточной, и современные лабораторные подходы к оценке краев резекции представляют собой только выборочную оценку краев. Имеющиеся в настоящее время данные свидетельствуют о том, что определение хирургического края при ОСЛ должно быть сделано с учетом биологических особенностей рака молочной железы, взаимосвязи биологии опухоли, адъювантной терапии и отдаленных результатов.
Достижение консенсуса по вопросам оценки хирургического края при ОСЛ должно быть клинически приоритетным, т.к. дает возможность снизить объем оперативного вмешательства на молочной железе без риска ухудшения отдаленных результатов лечения.
Ключевые слова: органосохраняющее лечение, рак молочной железы, резекция, хирургический край.
Органосохраняющее лечение (ОСЛ), включающее выполнение секторальной или сегментарной резекции с аксиллярной диссекцией или биопсией сторожевых лимфатических узлов, проведением последующей адъювантной лучевой терапии на молочную железу и системной терапии, стало распространенным подходом к лечению ранних стадий рака молочной железы [1, 2]. Многочисленные исследования показали очень высокую частоту развития местного рецидива (около 20% в течение 5 лет) рака молочной железы у пациентов, у которых не были достигнуты микроскопически чистые («негативные») края резекции при выполнении секторальной резекции, даже при проведении адъювантной лучевой терапии [3].
Полное хирургическое удаление рака молочной железы с достижением микроскопически чистых краев резекции является важным компонентом органосохраняющего лечения [3]. Продолжаются споры о значимости достижения «широких» микроскопических краев у пациентов, подвергавшихся ОСЛ, с целью улучшения отдаленных результатов и сокращения частоты рецидивов [4].
Некоторые хирурги стремятся достичь более широких хирургических краев с целью гарантированного удаления остаточной опухоли и улучшения результатов лечения [5]. Однако целью органосохраняющего лечения является сохранение объема и формы молочной железы и по возможности минимизация объема удаленной ткани вокруг опухоли, которая связана с минимальным риском рецидива [3].
«Оптимальный» хирургический край для удаления опухоли определяют как минимальную ширину нормальной ткани вокруг опухолевого узла, ассоциирующуюся с низкой частотой рецидивов и высокими показателями выживаемости при условии проведения современной адъювантной терапии. Исходя из этого определения, удаление объема ткани больше оптимального не улучшает результаты лечения и может ухудшить косметические результаты, повысить частоту повторных иссечений, затрат, вызвать беспокойство пациентов и отсрочку в адъювантной терапии [6].
Расстояние от края опухоли до хирургического края резекции («ширина края») во время резекции стало часто обсуждаемым метрическим параметром при лечении рака молочной железы. Тем не менее, нет единого мнения о том, как оптимально использовать этот параметр с целью оптимизации дальнейшего хирургического лечения [7]. Существует необходимость в разработке руководящих принципов в определении оптимального хирургического края при органосохраняющем лечении рака молочной железы.
Определение оптимального хирургического края имеет важное значение для минимизации избыточного лечения без негативного влияния на показатели выживаемости больных с ранними стадиями рака молочной железы. На сегодняшний день нет проспективных рандомизированных исследований, непосредственно касающихся влияния измеренной ширины краев резекции на результаты при органосохраняющем лечении по поводу инвазивного рака молочной железы или протокового рака in situ (DCIS).
В работе Gromyer и соавт. (2013) были рассмотрены фактические данные взаимосвязи между статусом краев резекции и результатами органосохраняющего лечения. Эти данные следует рассматривать с особой осторожностью, учитывая ограниченность существующих подходов к оценке краев резекции, наличие других клинических и биологических факторов, которые оказывают влияние на клинические исходы, а также факторов, связанных с остаточной опухолью после ее удаления.
Таблица 1. Рандомизированные исследования, сравнивающие отдаленные результаты
мастэктомии и секторальной резекции с последующей лучевой терапией.
| Исследование | Требование к краям резекции при лампэктомии | Период наблюдения (годы) | Общие различия в показателях выживаемости |
|---|---|---|---|
| Jacoson, 1995 [33] | Объем удаленной опухоли | 10 | NS |
| Arriogada, 1996 [34] | Ширина краев резекции 2 см | 14 | NS |
| Fisher, 2002 [2] | Гистологически негативные края резекции | 20 | NS |
| Van Dongen, 2000 [35] | Объем удаленной опухоли * | 13 | NS |
| Veronesi, 2002 [36] | Ширина крае в резекции 2–3 см, кожа, фасция | 20 | NS |
| Сокращения: NS – недостоверно, * – В целом, повторное иссечение применялось только в случае микроскопически определяемой (т.е. пальпируемой) опухоли. | |||
Инвазивный рак молочной железы
В таблице 1 приведены критерии хирургического края резекции, используемые исследователями в крупных рандомизированных испытаниях, которые стали основой современных принципов органосохраняющего лечения. Эти исследования значительно варьируют в определении минимальных критериев хирургического края резекции. Все исследования, проведенные в 1970-х и 1980-х годах, требовали по крайней мере полное удаление опухоли во время выполнения секторальной резекции. Они показали, что пациенты, перенесшие ОСЛ, имеют сопоставимые показатели общей выживаемости по сравнению с пациентами, подвергшимся мастэктомии.
Только в исследовании NSAP-06 [2] регистрировали ширину края резекции в операционных препаратах после секторальной резекции, но наличие только негативных краев резекции было достаточным критерием включения в исследование. Анализ результатов этих исследований показал, что различия в хирургических краях и, в частности, ширина хирургического края не являются факторами, определяющими выживаемость больных, перенесших ОСЛ по поводу инвазивного рака молочной железы.
После публикации проспективных исследований было проведено много ретроспективных исследований, изучавших понятие «близкий» край резекции и влияние эффекта «близких» краев резекции на отдаленные результаты [8]. В этих работах понятие «близкого» края различалось и определялось в каждом отдельном испытании (например, <1 мм или <2 мм). В некоторых исследованиях было показано, что при «близких» краях резекции частота рецидива схожа с теми больными, у которых отмечались «позитивные» края резекции [9].
Другие исследователи получили промежуточные результаты при близких краях резекции по сравнению с «позитивными» и «негативными». В ряде работ было показано, что «близкие» края по сравнению с широкими чистыми краями не оказывают никакого влияния на показатели безрецидивной выживаемости. Эта неопределенность побудила многих хирургов выполнять повторные резекции при «близких» краях в целях снижения угрозы местного рецидива (или улучшения показателей безрецидивной выживаемости). Указанные диапазоны местных рецидивов в течение 5 лет при чистых краях, близких краях и позитивных краях составили 2–3%, 2–8% и 10–25% соответственно [8].
Недавно сообщено о результатах мета-анализа 21 исследования по изучению взаимосвязи между статусом краев резекции и исходами для пациентов, подвергшихся органосохраняющему лечению по поводу инвазивного рака молочной железы [10]. Авторы показали, что несмотря на то, что увеличение ширины края резекции имеет слабую корреляцию с риском местного рецидива, эффект смягчается, когда вносятся коррективы при проведении адъювантной гормональной и лучевой терапии. Авторы приходят к выводу, что выбор широких краев резекции по сравнению с более узкими для достижения чистых краев резекции вряд ли имеет дополнительное преимущество при долгосрочном местном контроле после органосохраняющего лечения [10].
Дуктальная карцинома in situ
В двух крупных рандомизированных исследованиях у больных, получавших лучевую терапию после выполнения секторальной резекции по поводу DCIS (NSAP 17 и NSAP 24), края резекции были определены как патологически позитивные или негативные (т. е. опухоль не окрашивалась чернилами) [11]. В этих испытаниях была продемонстрирована низкая частота локальных рецидивов среди больных, получивших лучевую терапию, а самая низкая частота рецидивов была отмечена у пациентов с негативными краями резекции. В другом большом рандомизированном исследовании по лучевой терапии после выполнения секторальной резекции по поводу DCIS (EORTC 10853) позитивные хирургические края резекции были определены как расстояние от опухоли до края резекции, равное 1 мм или менее [12]. В данном исследовании при многовариантом анализе негативный статус краев резекции и проведение лучевой терапии были связаны со снижением риска местных рецидивов. У пациентов с позитивными краями резекции 10-летняя частота местных рецидивов достигала 39% без лучевой терапии и 24%, если она проводилась.
В исследовании Rudloff и соавт. (2010) сообщалось о ретроспективной группе из 294 пациентов, подвергшихся секторальной резекции по поводу DCIS с последующей лучевой терапией или без нее при среднем 11-летнем периоде наблюдения [13]. В этой группе был показан более высокий риск рецидива у пациентов с узкими (<1 мм) краями резекции. Десятилетняя частота местных рецидивов у пациентов, не получавших лучевую терапию, равнялась 42, 27 и 21% при ширине краев резекции менее 1 мм, от 1 до 9 мм и 10 мм или более соответственно. Было также продемонстрировано снижение частоты местных рецидивов у всех пациентов, получавших адъювантную лучевую терапию.
В мета-анализе данных на 4660 пациентов, получивших органосохраняющее лечение по поводу DCIS (секторальная резекция и адъювантная лучевая терапия), была продемонстрирована значительно более высокая частота рецидивов у пациентов с позитивными краями резекции, чем у пациентов с близкими или негативными краями резекции (р<0,01) [14]. Кроме того, при рассмотрении конкретных пороговых значений краев резекции при DCIS авторы установили пороговое значение, равное 2 мм. При размерах краев резекции более 2 мм отмечена незначительная дополнительная выгода в снижении частоты местных рецидивов.
Различия в определении «оптимальных» краев резекции и частоты повторных резекций при органосохраняющем лечении
В течение многих лет определение оптимального края резекции при ОСЛ является областью споров и дискуссий среди специалистов по лечению рака молочной железы [4, 8]. На сегодняшний день не существует единого консенсуса в определении оптимальных краев резекции. Имеются различные точки зрения среди радиологов и хирургов-онкологов, а также данных, приводимых врачами Северной Америки и Европы. В работе А. Taghian с соавт. (2005) сообщалось о результатах исследования, в котором были изучены подходы к хирургическим краям резекции при органосохраняющем лечении среди 1137 радиологов [5]. У респондентов были отмечены существенные различия в определении понятий «негативный» и «близкий» край резекции. Также отмечены значительные различия в ответах среди врачей Северной Америки и Европы. Более 50% респондентов считают «негативным» краем резекции при органосохраняющем лечении расстояние более 1 мм от окрашенных чернилами краев операционного материала. Были отмечены также различия в отношении рекомендаций для повторного иссечения краев резекции.
В нескольких исследованиях отмечались существенные различия между хирургами-онкологами в отношении их рекомендаций для повторного иссечения краев резекции как составной части органосохраняющего лечения. lair и соавт. (2009) проанализировали результаты исследования с участием 351 хирургов-онкологов в отношении минимально допустимой ширины краев резекции [15]. Авторы обнаружили существенные различия в рекомендациях относительно допустимой ширины хирургических краев как для инвазивного рака, так и для протокового рака in situ (DCIS). 65% хирургов считают приемлемой шириной краев резекции расстояние 2 мм или более, хотя 35% рассматривали приемлемой ширину края менее 2 мм. Аналогично, в исследовании Azu с соавт. (2010) обнаружены значительные различия в рекомендациях относительно безопасного края резекции. Более того, узкоспециализированные хирурги-онкологи рекомендовали менее широкие допустимые хирургические края [16]. Таким образом, в данных исследованиях были предложены значительные изменения в существующей практике для контроля хирургических краев при органосохраняющем лечении как инвазивного рака, так и DCIS молочной железы.
Несколько последних исследований показали существенные различия в частоте повторных резекций после секторальной резекции по поводу рака молочной железы в разных больницах и регионах. В исследовании McCahill с соавт. (2012) сообщалось о 2286 пациентах, подвергшихся секторальной резекции, 23% из которых потребовалось дополнительное оперативное вмешательство (повторная резекция) [7]. В этом исследовании различие в частоте повторных резекций было отмечено у пациентов с негативными патоморфологическими краями резекции. Оно составило от 1,7 до 20,9%. Хотя 47,9% пациентов с чистыми краями, но с шириной края резекции менее 1 мм подверглись повторному иссечению, только 20,2% пациентам с шириной краев резекции от 1,0 до 1,9 мм было выполнено повторное иссечение краев. Аналогично, в исследовании R. Jeevan с соавт. (2012) сообщалось о существенных различиях в частоте повторных резекций после секторальной резекции по поводу рака молочной железы среди специалистов Англии [17].
Микроскопическая остаточная опухоль в молочной железе после органосохраняющих операций
В классических исследованиях Rosen с соавт. (1975) выполняли моделированные секторальные резекции на удаленных операционных препаратах от пациентов, которым была выполнена мастэктомия по поводу предполагаемого монофокального рака молочной железы [18]. В результате исследования у значительного числа пациентов была обнаружена остаточная карцинома (in situ и инвазивная) в других квадрантах молочной железы. Вероятность обнаружения остаточной опухоли в других квадрантах молочной железы повышалась с увеличением размера первичной опухоли. У больных с опухолями менее 2 см остаточная опухоль в других квадрантах отмечалась в 26%, тогда как у пациентов с размером первичной опухоли более 2 см остаточную опухоль в других квадрантах наблюдали в 38%.
В нескольких недавно выполненных исследованиях были проанализированы предикторы остаточной опухоли, которые могут быть полезны в клинической практике в отношении повторных резекций. Молодой возраст, экстенсивный внутрипротоковый компонент (EIC) и трижды негативный фенотип (ER-, PR-, HER2-) были связаны с повышенным риском наличия остаточной опухоли после секторальной резекции при инвазивном раке молочной железы [19]. Другие исследования показали, что такие факторы, как размер опухоли, высокая степень гистологической злокачественности и степень вовлечения в опухолевый процесс краев резекции повышали риск выявления остаточной опухоли во время повторных резекций [20]. Факторами, повышающими вероятность выявления остаточной опухоли после секторальной резекции при DCIS, являлись наличие комедонекроза, мультифокальность, ширина края резекции и размер первичной опухоли [21].
Ограничения патоморфологической оценки краев резекции
Существуют практические ограничения патоморфологической оценки краев резекции, которые должны быть оценены при обсуждении «оптимального» хирургического края после секторальной резекции и при принятии тех или иных клинических решений. В настоящее время нет стандартизированного подхода к патоморфологической оценке хирургических краев резекции [22]. Важно понимать, что все технические методы оценки основаны на выборочном исследовании краев резекции [6], а патологи, как правило, не подвергают микроскопическому исследованию препараты ткани из всех краев резекции [22]. Обработка препаратов ткани, их исследование и техника оценки краев также влияет на результаты исследования [23]. Таким образом, соблюдение строгих клинических алгоритмов, основанных исключительно на измерении ширины краев резекции, не кажется клинически оправданным. Также представляется важным разработка единого стандарта патоморфологической обработки препаратов операционного материала и его анализа, что в конечном итоге приведет к более четкому определению взаимосвязи между краями резекции и отдаленными результатами.
Роль адъювантной терапии в снижении риска местных рецидивов после органосохраняющих операций
В нескольких сообщениях было показано снижение частоты местных рецидивов после органосохраняющего лечения в течение продолжительного времени, что, вероятно, связано с достижениями адъювантной терапии рака молочной железы [24]. Caioglu (2005) продемонстрировал снижение частоты местных рецидивов на протяжении длительного времени, что было связано как с высокой частотой негативных краев резекции, так и с применением адъювантной гормоно- и химиотерапии (р=0.001) [24]. В «старых» исследованиях была также показана связь между адъювантной гормонотерапией, химиотерапией и снижением частоты местных рецидивов у пациентов, перенесших органосохраняющее лечение [25, 26]. Среди пациентов с HER2-позитивными опухолями адъювантное применение трастузумаба в комбинации с химиотерапией было связано со снижением частоты местно-регионарных рецидивов [27].
Дополнительное облучение ложа опухоли (oost) также играет определенную роль в оптимизации локального контроля после органосохраняющего лечения. В исследовании EORTC 22881-10882 [28] было продемонстрировано снижение частоты местных рецидивов у пациентов, которые получили дополнительное облучение ложа опухоли после адъювантной лучевой терапии всей молочной железы (6,2%) по сравнению с больными, получившими только облучение всей молочной железы (10,2%).
Влияние биологических особенностей опухоли на частоту местных рецидивов
Хотя наличие опухоли в окрашенных краях резекции явно связано с высокой частотой местных рецидивов, как индивидуальные характеристики пациента, так и биологические особенности опухоли также связаны с повышением частоты местных рецидивов у пациентов, подвергавшихся органосохраняющему лечению. Индивидуальные характеристики пациента лежат в основе биологии опухоли, и степень их влияния на отдаленные результаты не уменьшается благодаря широким хирургическим краям резекции [4].
Молодой возраст пациента, экстенсивный внутрипротоковый компонент (EIC), базальный фенотип, HER2-позитивные опухоли, опухоли высокой степени гистологической злокачественности и лимфоваскулярная инвазия связаны с более высоким риском рецидива у пациентов, перенесших органосохраняющее лечение [29]. В недавних исследованиях были выявлены профили генной экспрессии, которые связаны с повышенным риском местно-регионарного рецидива рака молочной железы у пациентов, перенесших органосохраняющее лечение по поводу эстроген-рецептор-положительного инвазивного рака молочной железы [30]. Биологические характеристики, такие как степень гистологической злокачественности опухоли, размер и наличие комедонекроза являются важными при прогнозировании рецидивов у больных дуктальной карциномой in situ (DCIS) [31].
Последние достижения в области геномного секвенирования опухолей молочной железы у человека позволили выделить четыре биологические подтипа рака молочной железы, вызванных различными генетическими и эпигенетическими нарушениями [32]. Эти исследования демонстрируют возможность влияния на приемлемые критерии хирургических краев для каждого из этих подтипов.
Следовательно, и другие признаки (помимо измерения хирургических краев резекции) являются важными факторами риска рецидива, свидетельствуя о необходимости учета биологии опухоли и выбора адекватного системного лечения в оптимизации ОСЛ рака молочной железы.
Выводы
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.