Криоабляция или радиочастотная что лучше
РЧА или криоаблация?
Донецкая О.П., Дзвониская В.Н.
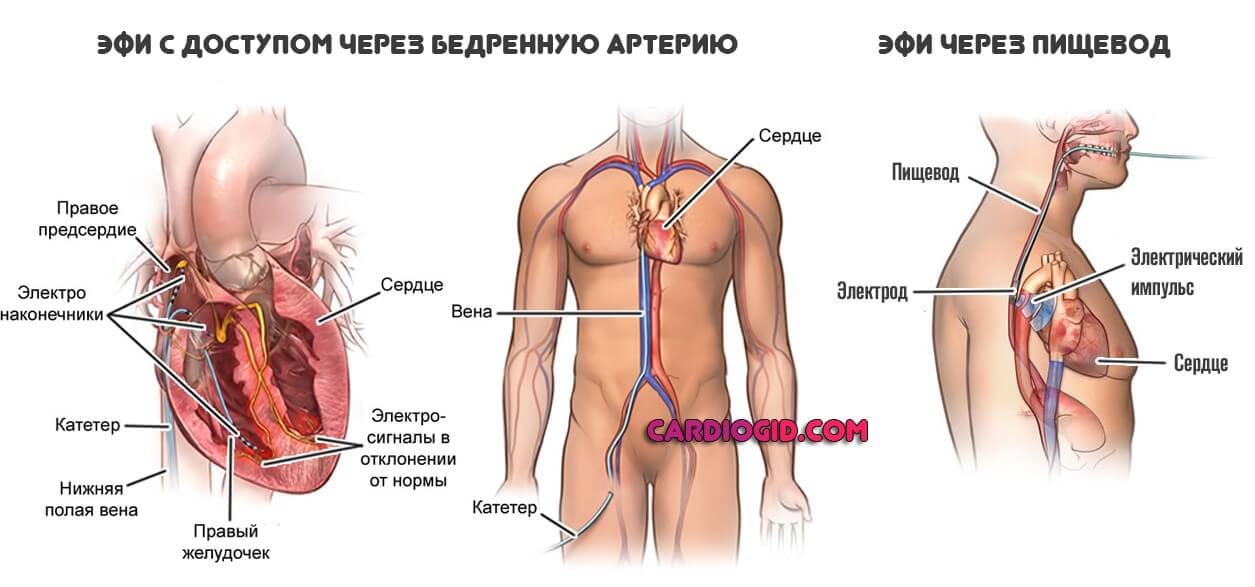
Как известно, изоляция легочных вен, порождающих хаотические электрические сигналы, которые вызывают фибрилляцию предсердий, – стандартный метод лечения пациентов с фибрилляцией предсердий. При криобаллонной абляции с помощью охлаждающего вещества создаются круговые смежные зоны поражения и таким образом изолируются легочные вены, тогда как при радиочастотной абляции для этих целей используется тепло (радиочастотная энергия), но при этом дополнительно необходимы трехмерное картирование и пошаговое воздействие.
«Пламя и Лед» ( FIRE AND ICE) – самое широкомасштабное рандомизированное международное клиническое исследование, цель которого – сравнить два метода аблации, используемых для лечения фибрилляции предсердий, а именно криоаблации («Лед»), в которой применяются криобаллоны Arctic Front, и радиочастотной абляции («Пламя») с помощью радиочастотных аблационных катетеров ThermoCool
Результаты исследования, были представленные на шестьдесят пятой ежегодной научной сессии Американского колледжа кардиологии 2-4 апреля 2016 года и одновременно опубликованы в журнале The New England Journal of Medicine.
Руководителем исследования выступил известный профессор Карл-Хайнц Кук (Karl-Heinz Kuck), директор кардиологического отделения клиники Asklepios Klinik St. Georg в Гамбурге, Германия.
В ходе исследования было задействовано 769 пациентов из 16 медицинских центров по всей Европе. Все субъекты исследования имели диагноз «пароксизмальная фибрилляция предсердий», у них был неэффективен хотя бы один антиаритмический лекарственный препарат, и после первой аблационной процедуры они наблюдались у врача не дольше 33 месяцев (среднее значение = 1,54 года). Основная задача исследований такого типа – доказать, что новая технология сопоставима с общепринятой существующей технологией.
В ходе исследования была достигнута первичная конечная точка по критерию эффективности – доказано, что криобаллонные аблация не уступает радиочастотной аблации (p=0,0004) с точки зрения снижения частоты рецидивов аритмии или необходимости в антиаритмической медикаментозной терапии и/или повторной абляции. Также была достигнута первичная конечная точка по критерию безопасности, а именно по времени до первой смерти по любой причине, до инсульта или ТИА (транзиторная ишемическая атака) по любой причине либо до серьезных нежелательных явлений в связи с лечением (p = 0,24).
Обе технологии показали сравнимые низкие коэффициенты возникновения осложнений. Согласно результатам исследования, технология криобаллонной аблации обеспечивает более короткую продолжительность процедур (среднее значение = 124 минуты) в сравнении с группой радиочастотной абляции (среднее значение = 141 минута; p = 0,0001), однако при этом применение радиочастотного катетера позволяет использовать рентгеноскопию более короткое время (среднее значение = 17 минут) по сравнению с криобаллонным аблационным катетером (среднее значение = 22 минуты; p = 0,0001).
Авторы исследования заявили, что, по их мнению, полученные результаты будут способствовать тому, что интервенционные аритмологические вмешательства перестанут быть уделом узкоспециализированных клиник и станут доступны врачам с менее высоким уровнем подготовки. Если аблацию фибрилляции предсердий можно будет проводить легко и с достаточным уровнем безопасности, то, вероятно, лечение будет получать большее количество пациентов и, возможно, на более ранней стадии заболевания. Возможно, когда-то с фибрилляцией будут поступать так же, как сейчас рекомендуется делать при синдроме WPW — выполнять вмешательство после первого же пароксизма.
Несмотря на то, что обсуждаемое исследование было проведено на не очень большой выборке пациентов, ожидается, что полученные результаты могут изменить существующие клинические рекомендации. В частности, возможно, ее учтут эксперты, работающие в настоящее время над третьим обновлении консенсусного заявления Общества по изучению сердечного ритма (HRS).
В июне 2016 года на последнем европейском конгрессе CARDIOSTIM были представлены результаты, касающиеся вторичных конечных точек. Исследование продемонстрировало значительно меньшее количество потребности в повторных аблациях и более низкие показатели госпитализации больных с пароксизмальной формой фибрилляции предсердий в группе изоляции легочных вен с помощью криобаллона. Качество жизни оценивали исходно и через 6 месяцев после процедуры, данные были сопоставимы в исследуемых группах.
Таким образом, криобаллонная аблация – безопасный и эффективный метод, который позволяет сократить продолжительность процедуры, сделать график лечения более предсказуемым по времени, уменьшить потребность в повторных процедурах, снизить количество госпитализаций и улучшить качество жизни больных.
Статья добавлена 27 июня 2016 г.
Криобаллонная или радиочастотная абляция, какой метод выбрать при фибрилляции предсердий?
Согласно современным клиническим рекомендациям, у пациентов с фибрилляцией предсердий (ФП), рефрактерных к лекарственной терапии, необходимо проведение изоляции легочных вен при помощи катерной абляции. Чаще всего в этом случае используют радиочастотную абляцию.
Материалы и методы
В мультицентровое рандомизированное исследование были включены 762 пациента с рефрактерной ФП. В соотношении 1:1 они были рандомизированы в группы: выполнение криобаллонной абляции или радиочастотной абляции.
Первичной конечной точкой являлось время до развития рецидива фибрилляции предсердий, предсердной тахикардии, использования антиаритмических препаратов. В качестве предела эффективности методик был выбран коэффициент риска (HR) в 1.43.
Также в исследовании оценивалась безопасность методик по частоте смертельных исходов, цереброваскулярных событий и серьезных осложнений (композитная точка безопасности).
Из 762 пациентов, 378 была выполнена криобаллонная абляция и 384 – радиочастотная абляция. Средний период наблюдения за пациентами составил 1,5 года.
Первичной конечной точки эффективности достигли 138 больных из группы криобаллонной абляции и 143 из группы радиочастотной абляции (1-год оценка Каплана–Мейера, 34.6% и 35.9%, соответственно; HR, 0.96; 95% CI, 0.76-1.22).
Анализ безопасности показал, что композитной точки достигли 40 пациентов, которым выполнялась криобаллонная абляция и 51 больной из группы радиочастотной абляции (1-год оценка Каплана–Мейера, 10.2% и 12.8%, соответственно; HR 0.78; 95% CI, 0.52-1.18; P=0.24).
Согласно результатам исследования, криобаллонная абляция не уступает по своей эффективности радиочастотной абляции у пациентов с фибрилляцией предсердий, рефрактерных к лекарственной терапии. Оба метода лечения демонстрируют одинаковую безопасность.
Радиочастотная катетерная абляция (РЧА)
Малоинвазивная операция, проводимая с помощью небольших проколов. Осуществляется с применением последних компьютерных технологий в условиях постоянного рентгеновского контроля.
Об операции РЧА
Радиочастотная катетерная абляция или РЧА – это малоинвазивный метод лечения нарушений сердечного ритма (аритмии). Процедура начала применяться в кардиологических стационарах с 1980-х годов. Этот метод стал эффективной альтернативной и лекарственной терапии, и сложным хирургическим операциям.
Устранить патологический очаг, который вызывает сбои в нормальной работе сердца, возможно с помощью физического воздействия. Поэтому существует несколько видов абляции:
К основным преимуществам радиочастотной катетерной абляции относят:
Показания к радиочастотной абляции
Основными показаниями к проведению радиочастотной катетерной абляции являются следующие патологии:
Противопоказания для проведения РЧА
У операции нет абсолютных противопоказаний: радиочастотная катетерная абляция проводится при аритмии и других вышеперечисленных патологиях даже у пожилых людей и детей. Однако проведение РЧА нежелательно при таких патологиях, как:
Подготовка к радиочастотной катетерной абляции
Для того чтобы операция РЧА прошла успешно, пациенту важно подготовиться к абляции:
С 2013 года в Федеральном научно-клиническом центре ФМБА России работает кардиологическое отделение лечения нарушений ритма сердца (аритмии). Мы оказываем высокотехнологичную специализированную медицинскую помощь пациентам и делаем все возможное, чтобы как можно скорее больной смог вернуться к полноценной жизни. Центр оснащен медицинским и диагностическим оборудованием последнего поколения для максимально точных результатов. Поэтому все предоперационные исследования и анализы вы можете сделать в нашей клинике.
Проведение РЧА
Радиочастотная катетерная абляция проводится с применением либо местной, либо комбинированной анестезии.
После выполнения анестезии прокалываются вена или артерия, через которые к сердцу больного подводятся диагностические катетеры. С помощью этих катетеров выполняется электрофизиологическое исследование сердца (ЭФИ). При ЭФИ удаётся установить локализацию аритмогенного субстрата сердца и поставить больному точный диагноз.
Затем тем же способом в сердце проводится «лечебный» катетер, на кончик которого подаётся высокочастотный ток для точечного воздействия на очаг аритмии.
В ряде случаев для облегчения работы хирурга и для диагностики аритмии выполняют 3D-реконструкцию камер сердца, по которой можно визуально оценить, как проходят электрические сигналы в сердце, а также учесть анатомические особенности камер сердца.
В отделении работают опытные врачи, многие кардиологи являются кандидатами и докторами медицинских наук. Наши специалисты постоянно развиваются, принимают участие в международных конференциях, публикуют результаты исследований в ведущих научных журналах.
После операции
После проведения радиочастотной абляции пациента переводят в палату. Первые 24 часа больному обеспечивают покой и рекомендуют постельный режим. Это необходимо, чтобы сердце перестроилось на новый лад, а также не открылись раны в области проведения катетера. В первые сутки каждые 6 часов пациенту проводят ЭКГ для контроля состояния. На вторые сутки разрешается медленно передвигаться по палате, нагрузка должна увеличиваться постепенно.
В стационаре пациент наблюдается первые три дня и находится под постоянным присмотром наших специалистов. Если осложнений нет, пациента отпускают домой на амбулаторное восстановление. Перед выпиской врач-кардиолог осматривает пациента, выписывает ему назначения и выдает памятку о том, что необходимо делать в период реабилитации.
В первую неделю важно, чтобы пациент находился в полном покое и не занимался привычными делами, требующих концентрации внимания. Лучше всего, когда в этот период с пациентом находятся родственники или нанятый медицинский работник.
Полный период восстановления длится около 2-3 месяцев. В это время необходимо:
Следующий прием у кардиолога должен быть через 3 месяца после проведенной операции, затем через 6 и 12 месяцев.
Восстановление после РЧА полностью зависит от пациента. Не забывайте следовать указаниям в памятке и своевременно посещать кардиолога.
Стоимость РЧА
Стоимость проведения РЧА зависит от индивидуальных особенностей пациента, необходимости дополнительных исследований и выбора программы реабилитации.
Криоабляция или радиочастотная что лучше
Институт клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ кардиологии» Минздрава России, Москва, Россия
Институт клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ кардиологии» Минздрава России, Москва, Россия
Институт клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ кардиологии» Минздрава России, Москва, Россия
ФГБУ «Национальный медицинский исследовательский центр профилактической медицины» Минздрава России, Москва, Россия
Возможности баллонной криоаблации в лечении больных с фибрилляцией предсердий
Журнал: Кардиологический вестник. 2018;13(3): 10-15
Новиков И. А., Миронов Н. Ю., Майков Е. Б., Коваленко А. С. Возможности баллонной криоаблации в лечении больных с фибрилляцией предсердий. Кардиологический вестник. 2018;13(3):10-15.
Novikov I A, Mironov N Yu, Maykov E B, Kovalenko A S. Advances of balloon cryoablation for treatment of atrial fibrillation. Russian Cardiology Bulletin. 2018;13(3):10-15.
https://doi.org/10.17116/Cardiobulletin20181303110
Институт клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ кардиологии» Минздрава России, Москва, Россия
Баллонная катетерная криоаблация (БКА) — новый метод катетерного лечения фибрилляции предсердий (ФП), при котором модификацию и изоляцию источника аритмии осуществляют посредством глубокого локального охлаждения миокарда. За 10 лет БКА стала общепринятым методом интервенционного лечения ФП. Эффективность и безопасность БКА подтверждены клиническими исследованиями. БКА сокращает время вмешательства за счет одномоментной изоляции устьев легочных вен (ИЛВ), в отличие от точечных воздействий при использовании техники множественных аппликаций при радиочастотной аблации. Использование баллонных катетеров 2-го поколения сделало процедуру ИЛВ более эффективной, безопасной и быстрой. В обзоре освещены технические аспекты и методика выполнения криоаблации, представлены результаты клинических исследований, а также перспективы развития методики.
Институт клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ кардиологии» Минздрава России, Москва, Россия
Институт клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ кардиологии» Минздрава России, Москва, Россия
Институт клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ кардиологии» Минздрава России, Москва, Россия
ФГБУ «Национальный медицинский исследовательский центр профилактической медицины» Минздрава России, Москва, Россия
Фибрилляция предсердий (ФП) является наиболее распространенным нарушением ритма сердца. К примеру, в Европе Ф.П. встречается у 3% взрослого населения и 13,6% лиц старше 80 лет [1]. Зачастую Ф.П. сопровождается выраженными клиническими проявлениями, снижающими качество жизни больных, а некоторые ее осложнения, в особенности инсульты и сердечная недостаточность, являются непосредственными причинами инвалидизации и смерти больных. Затраты на лечение ФП достигают в отдельных европейских странах 1% общего бюджета здравоохранения [2].
Недостаточная эффективность, побочные эффекты и ограничения при использовании средств медикаментозной антиаритмической терапии (ААТ) у пациентов со структурными заболеваниями сердца способствовали разработке интервенционных методов лечения ФП, основным из которых является катетерная аблация (КА). В соответствии с действующими международными рекомендациями целью КА является изоляция устьев легочных вен (ИЛВ). Данное вмешательство имеет I класс показаний у больных c пароксизмальной формой ФП и класс IIa у пациентов с персистирующей формой, если аритмия сопровождается значимыми клиническими проявлениями и при неэффективности или непереносимости хотя бы одного антиаритмического препарата I или III классов. В некоторых случаях (с учетом ожидаемой пользы, риска вмешательства и желания пациента) применение КА может быть рекомендовано до назначения антиаритмических препаратов [3].
Первым широко внедренным в клиническую практику методом внутрисердечных катетерных вмешательств стала радиочастотная аблация (РЧА), при которой происходит локальная коагуляция тканей сердца вследствие прямого повреждающего действия электрического тока сверхвысокой (около 500 кГц) частоты.
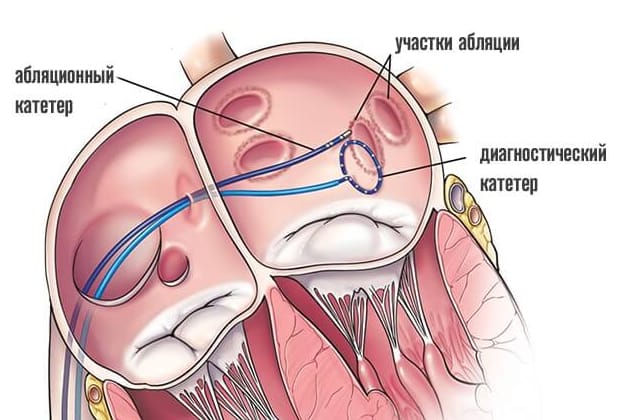
Чтобы изолировать легочные вены (ЛВ), необходимо нанести на их поверхность множество точечных аппликаций, формирующих трансмуральные и непрерывные (point-by-point) линии повреждения. Это трудоемкая длительная процедура, эффективность которой зависит от опыта врача, выполняющего вмешательство [4]. Указанные недостатки РЧА стали предпосылками к разработке метода, позволяющего добиться изоляции каждой ЛВ посредством однократного холодового воздействия.
Этапы развития катетерной аблации фибрилляции предсердий
В 1998 г. были опубликованы результаты исследования группы французских электрофизиологов во главе с М. Haïssaguerre, обнаруживших, что пароксизмы ФП могут быть вызваны патологической электрической активностью, исходящей из устьев ЛВ, и устранение этой эктопической активности посредством аблации может предупреждать рецидивы ФП [5]. М. Haïssaguerre предложил метод сегментарной аблации, суть которого заключалась в нанесении радиочастотных повреждений в пределах устьев Л.В. Этот подход оказался недостаточно эффективным для устранения аритмии, кроме того, у 40% больных зарегистрировали развитие стенозов ЛВ вследствие нанесения воздействий внутри вены [6—8]. С целью снижения риска стенозирования С. Pappone и его коллегами была предложена методика расширенной циркулярной (circumferential) аблации, при которой каждая ЛВ изолировалась посредством серии аблационных воздействий вокруг ЛВ, наносимых на некотором отдалении от их устья — в левом предсердии. Данная техника получила название антральной изоляции. В пилотных исследованиях циркулярная аблация показала высокую эффективность как при пароксизмальной, так и при персистирующей форме ФП (85 и 68% соответственно), что способствовало широкому внедрению этого метода в клиническую практику [9]. В настоящее время данная техника выполнения применяется в большинстве случаев с различными модификациями.
Технология катетерной криоаблации была разработана канадской компанией «CryoCath» (с 2008 г. принадлежит «Medtronic», США). Баллонные катетеры 1-го поколения для проведения криоаблации при ФП были допущены к использованию в клинической практике в 2006 г. В этой модели охлаждение осуществлялось с помощью 4 инъекционных портов, расположенных на дистальной поверхности баллона. Для достижения стойкой изоляции ЛВ требовалось 2 аппликации по 300 с. В качестве хладагента использовался жидкий азот, оптимальная температура охлаждения тканей составляет –40—50 °С. При разработке баллонных катетеров 2-го поколения система впрыска замораживающего газа была изменена, его распределение стало равномернее за счет увеличения количества портов до 8 и их более дистального расположения (рис. 1).

В международных рекомендациях «Консенсус по катетерной и хирургической аблации ФП» 2017 г. отмечается, что баллонная катетерная криоаблация (БКА) является эффективной альтернативой РЧА при лечении ФП. БКА сокращает время вмешательства вследствие проведения одномоментной (single shot) ИЛВ, в отличие от точечных воздействий при использовании техники множественных аппликаций (point-by-point) при РЧА [3].
Технические аспекты криобаллонной аблации
Криоаблация — относительно новый метод катетерного лечения нарушений ритма сердца, при котором модификацию и изоляцию источника аритмии осуществляют посредством глубокого локального охлаждения миокарда левого предсердия в области впадения Л.В. Механизмы повреждения ткани при криовоздействии таковы: при охлаждении ткани до –20 °С образуются кристаллы льда в межклеточном веществе, что сопровождается резким повышением давления, выходом молекул воды из клетки в межклеточное вещество. Дальнейшее охлаждение тканей до –50 °С приводит к образованию кристаллов льда внутри клеток, нарушается целостность мембран клеток с деструкцией внутриклеточных структур. Далее происходят повреждение сосудов, локальная ишемия и реперфузия ткани при ее оттаивании после воздействия (так называемый цикл заморозки и оттаивания — freeze-thaw cycle), что обусловливает отек и выраженные электролитные нарушения в зоне воздействия [11]. Некроз вследствие криоаблации провоцирует инфильтрацию ткани нейтрофилами и макрофагами с последующим лизисом кардиомиоцитов. Со временем воспалительный инфильтрат замещается фиброзной тканью.
При холодовом воздействии катетер примерзает к эндокарду, что обеспечивает устойчивый контакт с тканью и способствует глубокому трансмуральному повреждению и формированию более однородного рубца, таким образом повышается эффективность и снижается аритмогенность повреждающего воздействия. На макропрепаратах зона повреждения от криовоздействия имеет четкие и ровные границы с неповрежденными тканями сердца. При гистологическом исследовании область повреждения после криоаблации также имеет ровные границы, а размеры образующегося в месте воздействия эндокардиального тромба существенно меньше, чем при радиочастотном повреждении [12].
Для лечения ФП используют баллонные катетеры. Во время вмешательства катетер раздувают в полости левого предсердия и поочередно обтурируют им устья ЛВ (рис. 2).


Таким образом, по сравнению с РЧА при БКА существенно сокращается время вмешательства (174 мин против 161 мин; р=0,006). Отметим также, что обучение методике БКА для проведения ИЛВ требует меньше времени, чем технике РЧА. Это подтверждает меньшее количество осложнений при БКА, хотя многие операторы, выполнявшие БКА, провели меньшее количество процедур, чем специалисты, проводящие РЧА [13]. Самое опасное осложнение — тампонада сердца — при РЧА возникает вследствие перфорации стенки в момент аппликации радиочастотной энергии и избыточного давления на стенку левого предсердия кончиком катетера. Тогда как техника и механизм изоляции ЛВ при БКА минимизируют вероятность возникновения данного осложнения.
К недостаткам БКА можно отнести риск холодового повреждения прилежащих органов и тканей (прежде всего пищевода и диафрагмального нерва) и более высокую стоимость по сравнению с РЧА [11].
Результаты клинических исследований баллонной криоаблации у больных с пароксизмальной формой фибрилляции предсердий
Проведено несколько рандомизированных исследований, посвященных сравнению БКА с медикаментозной ААТ и РЧА ЛВ. В исследовании STOP AF было показано превосходство БКА над ААТ (69,9% против 7,3%; р 
В сравнительном исследовании баллонов 2-го и 3-го поколения ИЛВ в режиме реального времени была зафиксирована в 55,7 и 83,2% случаев соответственно (p
Антиаритмическая терапия до и после инвазивных методов лечения фибрилляции предсердий.
Оксана Михайловна Драпкина, профессор, доктор медицинских наук:
– Тарасов Алексей Владимирович. «Антиаритмическая терапия до и после инвазивных методов лечения фибрилляции предсердий».
Алексей Владимирович Тарасов, кандидат медицинских наук:
– Добрый день, уважаемые коллеги. Я хочу обсудить очень интересный, очень актуальный вопрос – тактика ведения до и после различных инвазивных методов лечения фибрилляции предсердий. На сегодняшний день на всех международных российских площадках обсуждается точка приложения радиочастотной абляции для лечения фибрилляции предсердия. Но почему-то очень забывают, как вести пациентов после радиочастотной абляции, хотя таких пациентов все больше и больше. И порой мы не знаем, как это делать, что с этими пациентами делать, потому что возникает ряд достаточно серьезных дискутабельных вопросов и даже порой антирекламных вопросов, потому что пациенты приходят после, например, изоляции устья легочных вен, но с рядом незакрытых вопросов. И как их вести, что есть на сегодняшний день, какой наш опыт, я постараюсь вам представить.
На сегодняшний день лечение пароксизмальной формы фибрилляции предсердий, безусловно, это антиаритмическая терапия и какие-то инвазивные методы лечения. Основным инвазивным методом лечения фибрилляции предсердий является катетерная радиочастотная абляция устья легочных вен. В основном сейчас делают антральную абляцию устья легочных вен. Основным показанием к радиочастотной абляции устья легочных вен является симптоматическая параксизмальная форма фибрилляции предсердий, резистентная как минимум к двум антиаритмическим препаратам. На сегодняшний день обсуждается – к одному антиаритмическому препарату или как минимум к двум антиаритмическим препаратам. Но пока это как минимум два антиаритмических препарата вы должны своему пациенту дать, если они не работают, только тогда решать вопрос о лечения фибрилляции предсердий именно методом катетерной абляции.
Также очень важно отметить, что такие пациенты должны быть без органической патологии сердца, потому что больные с органической патологией сердца имеют другие механизмы, не обязательно эктопия из устьев легочных вен, здесь уже вовлечены процессы в предсердной ткани, и у таких пациентов радиочастотная абляция будет либо малоэффективна, либо 50/50.
Что мы имеем после радиочастотной абляции. Послеоперационный период можно разделить на три периода. Первый период составляет три месяца, его называют ранним послеоперационным периодом, некоторые его называют слепым послеоперационным периодом. Это самый проблемный период, потому что возникают как рецидивы старой фибрилляций предсердий, так и рецидивы новых предсердных тахиаритмий, и дальше я объясню, почему. И на третьем месяце мы должны принять решение, как быть дальше. Далее следует непосредственно послеоперационный период от трех до двенадцати месяцев наблюдения. И после двенадцати месяцев – поздний послеоперационный период.
Какие проблемы нас ждут в раннем послеоперационном периоде? Прежде всего, самое неприятное то, что 15% направленных больных на инвазивное лечение фибрилляции предсердия чувствуют себя первых два-три месяца даже хуже. И в этом-то и вопрос антирекламы так называемой. Врач, направивший больного на радиочастотную абляцию, потому получает этого пациента через одну-две недели, и пациент ему говорит: «Доктор, мне стало хуже». Действительно, у 15% пациентов после радиочастотной абляции идет ухудшение какое-то. И связано это ухудшение с тем, что у 45% – 50% возникают предсердные тахиаритмии. И сейчас мы уже говорим, что если взять все эти предсердные тахиаритмии, в 50% возвращается фибрилляция предсердия, рецидивы, ранние рецидивы, и 50% новые регулярные предсердные тахикардии. И самое неприятное, что именно новые предсердные тахикардии и составляют сложность в терапии, в диагностике, потому что под ними могут лежать как левопредсердное трепетание, предсердные тахикардии – эктопические, которые очень сложно поддаются медикаментозной терапии.
И вот как пример кардиограмма, где представлена в раннем послеоперационном периоде левопредсердное трепетание предсердий. Раньше мы вообще практически мало видели левопредсердных трепетаний. И именно после радиочастотной абляции стали появляться вот эти параксизмы, которые доставляют нам порой достаточные сложности в выборе тактики лечения. И вот как пример такой неустойчивый параксизм предсердной тахикардии, причем непрерывно рецидивирующий, порой они идут у таких пациентов именно в ранний послеоперационный период.
С чем же связана проблема раннего послеоперационного периода? Прежде всего, вот эти рецидивы связаны с воспалительной реакцией, обусловленной термическим повреждением предсердной ткани. Надо не забывать также об автономной нервной системе. Дело в том, что внутренняя поверхность сердца не имеет болевых рецепторов, но она имеет очень мощную автономную нервную систему, и эта нервная система возбуждается. И, безусловно, пока существует воспаление, происходит запуск вот этих предсердных тахикардий порой новых. И надо не забывать об отсроченном эффекте радиочастотной абляции – опосредованном формировании так называемого рубцового препятствия. Потому что пока существует зона воспаления, аритмия может проводиться, но когда формируется рубец, безусловно, защита как изоляции устья легочных вен здесь уже происходит прочнее.
Но ранние рецидивы фибрилляции предсердий либо новых предсердных тахиаритмий не являются таким эталоном, что радиочастотная абляция неэффективна. 60% больных с ранними рецидивами предсердных тахикардий далее имели четкие устойчивый синусовый ритм, и процедура считалась эффективной. Поэтому нельзя считать, что если у пациента ранние рецидивы фибрилляции предсердий либо другие какие-то предсердные тахикардии, это неэффективность процедуры. Но у тех пациентов, у которых мы имеем полную эффективность радиочастотной абляции и в ранний и поздний послеоперационный период, мы уже будем говорить об абсолютной эффективности радиочастотной абляции. Поэтому существует такая терминология как абсолютная эффективность и ранняя эффективность. Мы говорим о ранней эффективности, если приступов в первые три месяца не возникает.
Какие методы обследования нужно проводить таким пациентам? Сбор анамнеза, выявление симптомных приступов аритмии. Безусловно, после радиочастотной абляции пациенты более к себе относятся внимательно и предъявляют жалобы. Нередко они могут предъявлять жалобы на учащение ритма, либо даже какие-то болевые ощущения в области сердца. Больному необходимо проводить ЭКГ в 12-ти отведениях для определения как нарушений проводимости ритма сердца, так и нарушений аритмии. Необходимо проводить 1–7-суточное Холтеровское мониторирование ЭКГ для выявления асимптомных аритмий. Мы рекомендуем проводить Холтеровское мониторирование через месяц, через два, три для оценки дальнейшей тактики лечения.
Сейчас существуют еще такие методы как имплантируемый подкожный кардиомонитор, петлевые кардиомониторы, ЭКГ, которые позволяют мониторировать кардиограмму до трех лет. И на каждом визите доктор может снимать показания и оценивать асимптомные рецидивы фибрилляции предсердий.
Какова тактика ведения больных после радиочастотной абляции в ранний период? Мы должны определиться с антиаритмической терапией, необходимость антиаритмической терапии, с антитромботической терапией – это очень важно, я в конце об этом скажу. И мы можем воспользоваться немедикаментозными методами лечения в слепой период. Сейчас очень активно используется чреспищеводная электрическая стимуляция для восстановления именно новых тахикардий, например, левопредсердное трепетание предсердий. И имеет эффективность восстановления при проведении чреспищеводной стимуляции. Если у больного страдает гемодинамика, мы должны проводить электрокардиоверсию.
В чем вопрос антиаритмической терапии в ранний послеоперационный период. Сейчас нет четкости – нужно ли восстанавливать ритм этим пациентам или же стараться удерживать синусный ритм. Потому что пока нет четких конкретных данных, какой выбор тактики лучше «ритм-контроль» или «частота-контроль»? В консенсусе о катетрной и хирургической абляции фибрилляции предсердий от 2007 года в тактике ведения для удержания синусного ритма рассматривался только амиодарон. Но я абсолютно не согласен, потому что мы берем пациентов достаточно молодого возраста, мы берем пациентов без органической патологии. И потом после радиочастотной абляции сажать на амиодарон – на токсичный препарат абсолютно неоправданно. Поэтому в консенсусе от 2012 года предлагается более расширенный список антиаритмических препаратов: флекаинид, пропафенон, соталол, дофетилид или дронедарон. Но пока на сегодняшний день четких конкретных рекомендаций нет.
Тактика ведения именно на третьем месяце, когда прекращается слепой период. На третьем месяце мы должны четко понять, как быть дальше с этим пациентом, необходимо ли проводить повторную радиочастотную абляцию. Дело в том, что повторная радиочастотная абляция проводится достаточно часто (по многим авторам до 20% до 40%) – в нашей клинике до 40%, и это абсолютно нормальная тактика ведения пациентов. Но только после третьего месяца, когда пройдет воспаление, мы должны сказать, нужно ли проводить повторную радиочастотную абляцию или же не нужно. Если проанализировать поздние рецедивы предсердный тахиаритмий, если больному проводилась только одна радиочастотная абляция, поздние рецидивы возникают в 11% – 29% случаев. Если больному проводили как минимум две радиочастотные абляции, к сожалению, поздние рецидивы все равно случаются (по разным авторам от 7% до 24% случаев).
Какие причины возникновения поздних рецидивов предсердных тахиаритмий? Прежде всего, это возобновление проведения в зоне радиочастотной абляции устья легочных вен, когда наша изоляция начала пропускать импульс. И чаще, что возникает, это наличие триггеров, расположенных вне легочных вен. Нередко мы направляем больных на изоляцию устья легочных вен нельзя сказать запущенных, но уже когда время уходит. И из источника устья легочных вен эктопия опускается на предсердную ткань. Мы изолировали только устье легочных вен, но все предсердия мы не можем изолировать, поэтому, безусловно, эти триггеры начинают выстреливать и начинают давать поздние рецидивы. Но могу сразу сказать, что поздние рецидивы достаточно хорошо лечатся нашей современной антиаритмической терапией.
Я хочу представить наше интересное исследование, которое было начато еще в 2009 году на базе Московского областного кардиологического центра и дальше продолжено в ГНИЦ ПМ. Это был пилотный проект. Нами было обследовано 134 пациента, которым была проведена антральная изоляция устья легочных вен. И вот какие результаты мы получили. Ранние рецидивы предсердных тахикардий до трех месяцев возникали практически в 50% случаев. Но лишь только к повторной радиочастотной абляции пришли порядка 30% данных пациентов.
Следующий очень важный момент. У 30% больных преобладали регулярные предсердные тахикардии, то есть достаточно много было регулярных предсердных тахикардий, которые ставили наших врачей порой в тупик, как их лечить. И чаще всего превалировало левопредсердное трепетание предсердия. И в 20 % случаев были рецидивы фибрилляции предсердий.
Данные пациенты наблюдались до 12 месяцев, но больше нас интересовал именно слепой период, потому что у нас были выбраны различные тактики ведения пациентов, и одна группа пациентов вообще не принимала антиаритмических препаратов. Мы сейчас стали включать пациентов с имплантацией ревили (00:15:58) для исключения асимптомных рецидивов фибрилляции предсердий, и таких пациентов с имплантированными устройствами мониторирования у нас уже 39, но исследование не закончено, поэтому окончательные данные я вам не могу сказать.
Хочется сказать пока по полученным результатам. 36% больных продолжают прием антиаритмических препаратов даже после раннего послеоперационного периода. И здесь есть такое понятие как клиническая эффективность радиочастотной абляции. То есть мы уменьшаем количество приступов фибрилляции предсердий на 75%, больной себя чувствует лучше, чем до радиочастотной абляции. Но радиочастотная абляция полностью не убирает эти приступы. Но совместно с приемом антиаритмических препаратов пациента это устраивает, и приступы достаточно редки – два-три раза в год, и это нас устраивает.
На сегодняшний день наиболее эффективным антиаритмическим препаратом в послеоперационном периоде через три месяца и после радиочастотной абляции является препарат 1С класса – пропафенон. Но это больше у больных с рецидивами фибрилляции предсердий. Если же у больных появляются новые регулярные предсердные тахикардии, то здесь пропафенон нередко сочетается с верапамилом, либо отдельно верапамил – у таких пациентов показал хороший результат.
В конце презентации я хочу показать несколько слайдов о проблемах тромбоэмболических осложнений у таких пациентов. Нельзя сказать, что радиочастотная абляция абсолютно безопасная процедура, и в 0,6% возникают тромбоэмболические или кардиогенные инсульты, а в 1% случаев это транзиторные ишемические атаки. Но на сегодняшний день самый обсуждаемый вопрос – появление «немых» ишемических инсультов. И некоторые авторы пишут, что до 35% у таких пациентов определяются «немые» ишемические инсульты. С чем может быть связано появление такого большого количества? Не только с тромбоэмболическими проблемами, но надо понимать, что специфика процедуры радиочастотной абляции и появление воздушных эмболов тоже может вносить серьезный вклад в определение «немых» ишемических инсультов.
В чем проблема тромбообразования, появления тромбоэмболических осложнений? 1) Это большая зона повреждения эндотелия предсердий. 2) Установка транссептального интродьюсера и катетеров-электродов. 3) Оглушение предсердий – это очень важный момент. Это примерно как при кардиоверсии происходит оглушение предсердий, и создаются все условия для образования тромбов. И этот риск тромбоэмболических осложнений напрямую зависит от количества баллов по шкале CHA2DS2-VASc.
И вот пример позаимствован из одного американского журнала, статья вышла пару месяцев тому назад, где четко представлены данные чреспищеводного эхо, и мы видим мягкие тромбы на транссептальной перегородке. И на втором рисунке представлены обугленные элементы на конце электрода после удаления из транссептальной перегородки, которые могут являться причиной как небольших, так и серьезных мозговых нарушений. Но это с одной стороны, с другой стороны надо понимать, что есть проблема тромбоэмболоических осложнений, но есть проблема и кровотечений. И такая проблема, как тампонада перикарда происходит от 0,8% до 6% в зависимости от разных источников. Сосудистые осложнения возникают от 0% до 13%. Поэтому мы должны все-таки с одной стороны подготовить больного антикоагулянтами, но с другой стороны понимать, что есть риск кровотечений.
На сегодняшний день существует следующая тактика. Подготовка больных к радиочастотной абляции должна быть такая же, как при проведении электрической кардиоверсии. Для пациентов с фибрилляцией больше 48 часов, если мы берем радиочастотную абляцию, безусловно, обязательно нужно делать чреспищеводное эхо, потому что тромбоз ушка левого предсердия является противопоказанием для проведения данной процедуры. Через 4-6 часов после радиочастотной абляции мы должны назначить либо варфарин, либо новые оральные антикоагулянты. И, безусловно, на сегодняшний день очень обсуждается применение новых оральных антикоагулянтов при проведении радиочастотной абляции. Но пока четких данных нет, какой все-таки выигрывает из новых оральных антикоагулянтов. Отмена антикоагулянтной терапии должна проводиться на втором-третьем месяце (по европейским данным на втором месяце, на третьем месяце – по российским рекомендациям). Но если у больного есть хоть один балл по шкале CHA2DS2-VASc. мы должны продолжать назначать этому пациенту антикоагулянтную терапию, потому что мы не можем четко сказать, что у этого пациента не будет поздних рецидивов фибрилляции предсердий. На этом я хочу закончить свой доклад. Спасибо за внимание.