Кровь на мутацию при онкологии что показывает
Молекулярная диагностика рака
Молекулярно-генетическое тестирование является неотъемлемой частью обследования и лечения онкологических больных во всем мире.
Анализ опухоли каждого конкретного пациента и формирование индивидуального перечня потенциальных молекул-мишеней стало возможным благодаря внедрению методик молекулярно-генетического анализа в клиническую практику. Научная лаборатория молекулярной онкологии НМИЦ онкологии им. Н.Н. Петрова выполняет полный спектр современных молекулярно-генетических исследований для онкологических пациентов и их родственников.
Кому и чем могут помочь генетические исследования?
НМИЦ онкологии им. Н.Н. Петрова осуществляет полный комплекс мероприятий, связанных с диагностикой наследственной предрасположенности к раку молочной железы.
Любой человек является носителем каких-то мутаций, опасных либо для нас, либо для потомства. Первое направление исследований онкогенетиков – выявление наследственных мутаций с помощью секвенирования генома. Второе направление – исследование собственно опухоли, спектра приобретенных клеткой мутаций, в связи с которыми она возникла. Для этого тоже требуется исследование генома всего организма, чтобы сравнить последовательность ДНК опухоли с последовательностью ДНК в организме. Поэтому в будущем оно потребуется для лечения любой опухоли.
Подробнее узнать о деятельности Лаборатории молекулярной онкологии здесь.
Подробнее узнать о Группе молекулярно-генетических методов исследований референс-центра по ссылке.
Онкомаркеры: что показывают, где сдать кровь на онкомаркеры бесплатно
Онкологические заболевания занимают второе место после сердечно-сосудистых патологий среди причин смерти пациентов в России. Негативная статистика связана с поздним обнаружением патологии. По мнению специалистов, с помощью ранней диагностики выживаемость онкопациентов можно увеличить в два раза. Методов для этого предостаточно.
В числе самых распространенных методов ранней диагностики рака – анализ крови на специфические химические соединения – онкомаркеры. По его результатам нельзя точно установить, болен человек раком или нет. Диагностическая ценность исследования состоит в возможности заподозрить начальную стадию заболевания, продолжив исследование клиническими методами.
Что такое онкомаркеры
Онкомаркеры – это специфические биомолекулы, продуцируемые патологически измененными раковыми клетками. Чаще они представляют собой белковые соединения, но могут иметь иную природу: ферментарную, гормональную либо рецепторную. Большинство таких маркеров синтезируют и здоровые клетки организма, но в гораздо меньших количествах.
Впервые термин «онкомаркер» был введен в 60-х годах прошлого века отечественными учеными Гарри Абелевым и Львом Зильбером. Проводя исследования, они обнаружили, что повышение белка АФП, вырабатываемого плацентой во время беременности, характерно для злокачественных новообразований печени. Этот маркер стал первым включенным в клиническую практику опухолевых исследований.
Сегодня выявлены более двух сотен видов специфических соединений, но анализу подлежат только около двадцати.
Маркеры обнаруживаются в различных биожидкостях на начальных стадиях образования злокачественных клеток, в доклинической (бессимптомной) стадии формирования опухоли. Соединения подразделяются на два вида. Маркеры высокой специфичности с большой долей вероятности выявляют определенное заболевание, низкой специфичности — характерны для ряда различных патологий.
По вероятной локализации опухоли специалисты выделяют онкомаркеры:
Врачи неоднозначно относятся к такой классификации. Это связано с тем, что идеального маркера к настоящему моменту не выявлено. Ни один из них не обладает 100% специфичностью, позволяющей однозначно вычленять рак конкретного органа.
Для чего проводят исследование крови на онкомаркеры
Анализ на онкомаркеры чаще используют как оценочный, для определения положительной (либо отрицательной) динамики в терапии рака. Основываясь на его результатах, можно предотвратить развитие рецидива.
В качестве самостоятельной диагностики исследование не рекомендовано из-за большого количества ложноположительных (ложноотрицательных) результатов. Но, в сочетании с другими методиками помогает выявить онкологическое заболевание на раннем этапе.
О чем говорит отклонение от нормы
В онкологии по количеству специфических белков диагностируют стадию заболевания, по их разновидности — вероятное место локализации новообразования.
Кроме рака соединения обнаруживаются при наличии в организме кист, инфицирований, воспалительных процессов, иных доброкачественных патологий.
Внимание: в небольшом количество онкомаркеры присутствуют в крови здоровых людей.
Приведем данные о норме содержания подобных веществ в организме и предполагаемых проблемах при обнаружении отклонений от нее.
| онкомаркер | максимальное нормативное значение | вероятное расположение опухоли | возможные прочие заболевания |
| ПСА | 4 нг/мл | предстательная железа | инфекционный простатит; аденома. |
| СА-125 | 30 МЕ/мл | женская репродуктивная система; поджелудочная железа; ЖКТ; дыхательные органы (редко). | эндометриоз; адемомиоз; воспаления половых органов; заболевания печени. |
| ХГЧ | для мужчин — 2,5 МЕ/мл; 5 МЕ/мл — для женщин | плацента; яичники; яички. | |
| СА-242 | 30 МЕ/мл | поджелудочная железа; прямая и толстая кишки. | воспаления ЖКТ; панкреатит. |
| РЭА | 5 нг/мл | предстательная, щитовидная либо молочная железы; желудок; печень; костная ткань; репродуктивная система; желудок. | патологии печени; полипоз кишечника; патологии поджелудочной железы; болезнь Крона; туберкулез; пневмония; муковисцидоз. |
| Cyfra 21-1 | 3,3 нг/л | мочевой пузырь; бронхи; лёгкие; средостение. | воспаления почек или печени; фиброзы тканей легких. |
| СА-19-9 | 30 МЕ/мл | печень; желчный пузырь; желудок; мочевой пузырь; половая система. | холецистит; холангит, желчнокаменная болезнь; муковисцидоз. |
| СА-15-3 | 38 МЕ/мл | молочная железа; ЖКТ; печень; женские половые органы (поздняя стадия). | цирроз; доброкачественная опухоль груди; аутоиммунные процессы. |
| Б-2-МГ | от 670 до 2140 нг/мл | система кроветворения | аутоиммунные патологии; воспалительные процессы; печёночные заболевания; почечная недостаточность. |
| CA 72-4 | 6,9 Ед/мл | желудок; яичники; матка; поджелудочная или молочная железы. | гинекологические воспаления; кисты; цирроз; аутоиммунные отклонения. |
Отдельно следует отметить маркер АФП. В гинекологии он применяется для оценки состояния течения беременности. В онкологии — сигнализирует о возможном развитии рака печени, яичников, молочной железы, бронхов и легких, ЖКТ.
Для беременных норма АФП по неделям следующая:
Внимание: превышение указанных показателей может свидетельствовать о патологиях в развитии плода.
Кроме того, повышенный АФП — признак гепатита или цирроза.
На основании данных, приведенных в таблице можно сделать вывод, что отклонения в показателях того или иного онкомаркера говорит о вероятности развития ряда различных заболеваний. Основываясь только на содержании в крови специфических белков поставить диагноз не представляется возможным. Чтобы подтвердить (либо опровергнуть) наличие раковой опухоли в организме потребуются дополнительные диагностические процедуры.
Степень достоверности маркеров в онкологии
Анализ содержания данных веществ очень информативен для оценки назначенного терапевтического курса при онкологическом заболевании. В первичной диагностике ни один из них не используется самостоятельно. Это связано с недостаточной специфичностью маркеров.
Достоверность показаний специфических белков можно рассмотреть на примере самых распространенных из них. К таковым относится тест ПСА. Этот онкомаркер нужно сдавать мужчинам для своевременного обнаружения рака простаты. При злокачественных опухолях железы данный показатель действительно превышает норму. Но, он также возрастает, если в простате формируется новообразование доброкачественного характера. Как показывает врачебная практика, у большинства мужчин с повышенным уровнем ПСА рак предстательной железы не подтверждался.
Внимание: бывают случаи, когда недобросовестные доктора в сомнительных клиниках назначают ненужные терапевтические манипуляции. Они не только требуют серьезных финансовых вложений, но и способны спровоцировать серьезные осложнения!
Еще один показательный маркер — CA-125. Он растет в крови женщин, у которых обнаружен рак яичников, но может повышаться при большом количестве иных патологий, не связанных с онкологией.
Медицине известны случаи, когда на поздних стадиях формирования злокачественных новообразований в яичниках, анализ крови не показывал отклонений в результатах ни по одному из 28 специфических для данного заболевания белковых соединений.
СА-125 не рекомендовано исследовать на начальных стадиях болезни при отсутствии характерной симптоматики. Для анализа течения диагностированной патологии его рассматривают совместно с иными белками, а также результатами УЗИ.
В составе комплексного обследования сдавать онкомаркеры каждые полгода нужно женщинам с плохой наследственностью либо генными мутациями.
В целом, вопрос о том, насколько можно доверять онкомаркерам, на сегодняшний день остается открытым. При расшифровке результатов исследования следует обращать внимание на ряд факторов, способных исказить данные:
Это наиболее распространенные нюансы, но могут быть и другие «тонкости». Разобраться в них способен только квалифицированный врач, который сможет грамотно расшифровать результаты.
Показания к анализу на онкомаркеры
Ткани раковой опухоли в период активного роста поглощают питательные вещества и выделяют продукты распада, многие из которых токсичны. Эти процессы отражаются на здоровье человека, вызывая характерную симптоматику.
Любой сбор анамнеза начинается с опроса пациента. Доктора могут насторожить следующие изменения в самочувствии:
Отражается онкологическая патология и на результатах стандартных исследований крови. Общий анализ может выявить рост СОЭ, падение лейкоцитов либо гемоглобина. Негативные изменения отмечаются также в «биохимии» крови.
Для злокачественных новообразований характерно понижение содержания белков, ускорение свертываемости крови, повышение СОЭ.
Подобные результаты исследований сами по себе не говорят о росте патологически измененных клеток, но выступают поводом для дополнительного обследования. В том числе, сдачи анализов на онкомаркеры.
Исключения составляют люди из групп риска, которым эту процедуру рекомендовано проводить регулярно.
К таковым относят пациентов:
Мужчинам после 50 лет тест на ПСА желательно делать ежегодно, для своевременного обнаружения изменений в деятельности предстательной железы. Также анализ показан тем, у кого рак уже диагностирован. Исследования назначают не только пациентам, проходящим лечение, но и успешно излечившимся. Это позволяет купировать возможные рецидивы болезни. Повышает вероятность получения точного результата предварительная подготовка человека к анализу.
Как правильно сдавать кровь на онкомаркеры
Конкретные рекомендации по ограничениям перед забором крови должен дать лечащий врач. Они зависят от того, какой конкретно белок будет исследоваться.
Общие правила следующие:
Может потребоваться соблюдение иных требований. Так, при подозрениях на опухоль простаты желательно 7 дней воздерживаться от половых контактов, на онкомаркеры женской репродуктивной системы кровь лучше не исследовать в период менструации.
Где можно сдать анализ на онкомаркеры
Сдать анализ на онкомаркеры бесплатно (по полису ОМС и направлению терапевта либо онколога) можно в поликлинике. Результат обычно готов уже через день. Однако не во всех медицинских учреждениях есть необходимое оборудование.
Пройти обследование можно в диагностических центрах либо частных клиниках, но самостоятельно принимать решение о его необходимости не стоит. Сдавать кровь надо исключительно по назначению лечащего врача. Специалист даст адекватную оценку состоянию больного, подберет наиболее специфичные соединения для конкретного случая. Исследование на все группы онкомаркеров лишено смысла. К тому стоит не дешево. Цены колеблются в диапазоне от 300 до 2000 рублей за каждое вещество в зависимости от региона и клиники.
Онкомаркеры – эффективные показатели отслеживания опухолевого ответа на проводимую пациенту терапию. В качестве способа первоначального выявления онкологических патологий, точного результата они не гарантируют. С помощью анализа специфических белков можно заподозрить наличие раковых клеток, другие опасные заболевания. Расшифровкой полученных данных должен заниматься врач-онколог. Самодиагностика часто приводит к ошибочным выводам, неправильному лечению и наступлению тяжких последствий для здоровья.
BRCA1 и BRCA2: что делать, если обнаружена мутация в этих генах?
Несмотря на множество теорий развития злокачественных опухолей специалисты и сегодня нередко затрудняются ответить на вопрос, почему развивается рак того или иного органа. Однако уже не вызывает сомнений тот факт, что некоторые его разновидности могут быть связаны с наследственной предрасположенностью, выявить которую позволяет специальное генетическое исследование.
Анализ BRCA1 и BRCA2. В каких случаях и для чего его проводят? Об этом и многом другом мы беседуем с врачом-акушером-гинекологом «Клиника Эксперт» Курск Татьяной Ивановной Еремеевой.
— Татьяна Ивановна, среди названий исследований, проводимых при подозрении на онкологическое заболевание, упоминаются такие аббревиатуры, как BRCA1 и BRCA2. Что они означают?
— Так называются гены, которые выступают в роли опухолевых супрессоров. Это значит, что они являются своеобразными «контролёрами», препятствующими неконтролируемому и нарушенному процессу деления клетки. Если в этих генах появляются мутации, то гены утрачивают способность отслеживать изменения в геноме клетки, а это, в свою очередь, может привести к атипичным трансформациям в клетках и развитию злокачественных опухолей.
— То есть получается, что можно унаследовать эти гены с такими мутациями и, соответственно, иметь повышенный риск развития опухоли?
— Да, это возможно. Если дети получают повреждённые гены BRCA1 и BRCA2 от родителей, то у них возрастает риск возникновения рака молочной железы, рака яичников и ряда других разновидностей злокачественных новообразований. Однако следует помнить, что ребёнок получает половину генома от матери, а вторую часть от отца, поэтому вероятность передачи генов с дефектами равна 50 % и она не зависит от пола ребёнка (то есть мутировавший ген может получить как девочка, так и мальчик).
— Может ли мутация встречаться лишь в одном из этих генов?
— Да, может. На сегодняшний день изучено более двух тысяч разновидностей мутаций в генах BRCA1 и BRCA2. На практике можно встретить как сочетанные дефекты обоих генов, так и изолированные повреждения одного из них. Среди населения нашей страны превалируют мутации в гене BRCA1 – они составляют около 80 % от общего количества повреждений в обоих генах. Причём здесь гораздо чаще встречаются повторяющиеся мутации, тогда как большинство дефектов гена BRCA2 уникальны.
— Кому и в каких случаях необходимо сдать анализ на мутации BRCA1 и BRCA2? Судя по тому, что вы сказали ранее, это не всегда только женщины?
— Да, верно. Такую диагностику проводят и мужчинам. Связано это с тем, что повреждение генов BRCA1 и BRCA2 указывает на высокую вероятность развития не только рака молочных желез или яичников, но и злокачественных новообразований других органов, в частности, рака поджелудочной железы, желудка, кишечника и других.
К примеру, если у мужчины обнаружена мутация гена BRCA1, это может говорить о высоком риске развития рака простаты. Согласно зарубежным исследованиям любые BRCA-мутации повышают вероятность развития нескольких разновидностей опухолей у мужчин в 8 раз. Поэтому такой вид диагностики для них также актуален.
Необходимость в определении мутации генов BRCA1 и BRCA2 возникает тогда, когда пациент (независимо от того, мужчина это или женщина) принадлежит к группе риска. Вероятность наследственной предрасположенности высока, если:
— Татьяна Ивановна, расскажите, пожалуйста, о процедуре проведения исследования на мутации в генах BRCA1 и BRCA2
— Начну с того, что прежде, чем сдать анализ на выявление повреждений в BRCA1 и BRCA2, проводится консультация с врачом-генетиком. Доктор информирует пациента о содержании проводимого исследования, а также о значении положительного и отрицательного результатов. Это делают с целью психологической подготовки пациента к возможному результату.
В качестве материала для генетического анализа служит кровь. Специальной подготовки перед сдачей анализа не предусмотрено. В нашей стране это исследование проводят методом ПЦР (полимеразной цепной реакции).
Подробнее о методе ПЦР читайте в нашей статье: Диагностика инфекций методом ПЦР: что это такое?
— Предположим, что анализ выявил мутацию. Что человеку делать дальше?
— Следует вновь обратиться к врачу-генетику. Если обнаружены мутации в BRCA1 и/или BRCA2, специалист даст пациенту необходимые рекомендации по дальнейшей профилактике онкологических заболеваний.
Важно помнить, что выявление подобных генетических дефектов – это не диагноз. Наличие повреждений в этих генах указывает только на возможность развития онкологической патологии в молочных железах или других органах. Хочу также заметить, что положительный анализ не позволяет утверждать, что мутация генов непременно обнаружится у всех близких родственников (мамы, дочери, тёти).
С другой стороны, отрицательный результат не означает, что у пациента никогда не разовьётся опухолевый процесс. В таком случае нет лишь повышенного риска развития злокачественного новообразования вышеуказанных органов.
Подчеркну, что независимо от результатов диагностики на наличие повреждений в генах BRCA1 и BRCA2 не отменяются, в частности, регулярные скрининговые меры профилактики рака молочной железы у женщин – это консультация врача-маммолога и проведение маммографии.
Беседовала Севиля Ибраимова
Редакция рекомендует:
Для справки:
Еремеева Татьяна Ивановна
Онкология: выявление мутаций в генах BRCA1, BRCA2, CHEK2
Полиморфизм генов, передающийся из поколения в поколение, позволяет оценить риск возникновения онкологического заболевания и скорректировать лечение при уже развившемся онкологическом процессе.
Огромные усилия учёных направлены на идентификацию других генов наследственного рака молочной железы и/или яичников. В ходе этих исследований удалось обнаружить новые значимые мутации, приводящие к инактивации генов CHEK2, NBS1, PALB2, TP53, PTEN и другие. Ген CHEK2 кодирует синтез белка-фермента чекпойнт-киназы 2. Белковый продукт гена CHEK2 участвует в поддержании стабильности генома, контролирует процессы клеточного деления и репарации ДНК. Фермент активируется в ответ на повреждение молекулы ДНК, блокируя клеточный цикл в фазе G1 или запуская процесс апоптоза, выступая в качестве супрессора злокачественной трансформации клеток. Мутации гена CHEK2 приводят к синтезу неполноценного укороченного белка и ассоциированы с возникновением наследственных форм рака молочной железы.
Мутации с.1100delC, IVS2+1G>A гена CHEK2 являются наиболее распространенными. Частота аллеля 1100delC в европейской популяции составляет 1,1–1,4%. Среди российских пациентов частота встречаемости аллеля 1100delC составляет 2-5%. Риск возникновения рака молочной железы у женщин–носительниц мутации 1100delC увеличивается в 1,4–4,7 раза. Мутация IVS2+1G>A гена CHEK2 более редкая, по сравнению с c.1100delC, чаще встречается у представительниц Белоруссии, Польши, Германии и Северной Америки. Аллель IVS2+1G>A CHEK2 ассоциирован с возникновением онкологической патологии различной локализации, чаще всего встречается у больных раком молочной железы.
Мутации гена CHEK2 наследуются по аутосомно-доминантному типу, передаются из поколения в поколение с вероятностью 50%. Встречаются с одинаковой частотой у мужчин и женщин. Вероятность возникновения болезни повышается даже при наличии одной мутации в гетерозиготной форме.
Частота наследственной предрасположенности к раку молочной железы составляет около 25% всех случаев рака молочной железы.
Распространенность мутации генов BRCA1 или BRCA2 значительно различается у этнических групп в географических регионах. Специфические мутации и рецидивы мутации в зависимости от популяции описаны в Исландии, Нидерландах, Швеции, Норвегии, Германии, Франции, Испании, Канаде, странах Центральной и Восточной Европы и среди потомков евреев, выходцев из Германии. В середине 1990 х гг. обнаружено, что относительно небольшие, биологически изолированные народности характеризуются выраженным эффектом предшественника – преобладанием, так называемых повторяющихся мутаций в BRCA1 и BRCA2. Например, у евреев европейского происхождения практически все повреждения генов BRCA1 и BRCA2 сводятся к мутациям BRCA1 185delAG, BRCA1 5382insC и BRCA2 6174delT, у жителей Исландии – к аллелю BRCA2 999del5. Особенности спектра мутаций в том или ином географическом регионе в значительной мере отражаются на организации диагностики наследственного рака молочной железы. В странах без выраженного эффекта предшественника генетическому анализу подвергаются преимущественно те случаи онкологического заболевания, при которых вероятность обнаружения мутаций достаточно высока, а именно пациенты с выраженным семейным онкологическим анамнезом и/или больные с первично множественными опухолями и/или молодые женщины с раком молочной железы или раком яичников.
Методом полимеразной цепной реакции в режиме реального времени в препаратах ДНК человека, полученных из периферической крови, выявляется мутация в генах BRCA1, BRCA2, CHEK2. Обнаружение генного дефекта у клинически здоровых женщин позволяет провести своевременную диагностику в случае возникновения онкологических заболеваний молочной железы и/или яичников и предупредить их тяжелые последствия. Для пациенток с уже подтвержденным онкологическим заболеванием данное исследование дает возможность определить его возможную наследственную природу и подобрать более адекватную терапию.
Анализ генов BRCA1 и BRCA2 для выявления синдрома наследственного рака молочной железы и яичника
Одним из самых частых видов семейных опухолей является наследственный рак молочной железы (РМЖ), он составляет 5-10% от всех случаев злокачественного поражения молочных желез. Часто наследственный РМЖ связан с высоким риском развития рака яичника (РЯ). Как правило, в научной и медицинской литературе используют единый термин «синдром РМЖ/РЯ» (breast-ovarian cancer syndrome). Причем, при опухолевых заболеваниях яичника доля наследственного рака даже выше, чем при РМЖ: 10-20% случаев РЯ обусловлены присутствием наследственного генетического дефекта.
С предрасположенностью к возникновению синдрома РМЖ/РЯ связано присутствие у таких пациентов мутаций в генах BRCA1 или BRCA2. Мутации являются наследственными – то есть, буквально в каждой клетке организма такого человека есть повреждение, которое передалось ему по наследству. Вероятность возникновения злокачественного новообразования у пациентов с мутациями BRCA1 или BRCA2 к 70 годам достигает 80%.
Гены BRCA1 и BRCA2 играют ключевую роль в поддержании целостности генома, в частности в процессах репарации (восстановления) ДНК. Мутации, затрагивающие эти гены, как правило приводят к синтезу укороченного, неправильного белка. Такой белок не может правильно выполнять свои функции – «следить» за стабильностью всего генетического материала клетки.
Однако, в каждой клетке присутствует две копии каждого гена — от мамы и от папы, поэтому вторая копия может компенсировать нарушение работы клеточных систем. Но вероятность выхода ее из строя также очень высока. При нарушении процессов восстановления ДНК в клетках начинают накапливаться и другие изменения, которые, в свою очередь, могут привести к злокачественной трансформации и росту опухоли.
Определение генетической предрасположенности к онкологическим заболеваниям:
На базе лаборатории молекулярной онкологии НМИЦ онкологии им. Н.Н. Петрова применяется проведение поэтапного анализа для пациентов:
 |  |
На данный момент известно более 2 000 вариантов патогенных мутаций в генах BRCA1 и BRCA2. Кроме того, данные гены являются довольно большими – 24 и 27 экзонов соответственно. Поэтому полный анализ последовательностей генов BRCA1 и BRCA2 является трудоемким, дорогостоящим и длительным по времени процессом.
Однако для некоторых национальностей характерен ограниченный спектр значимых мутаций (т.н. «эффект основателя»). Так в популяции российских пациентов славянского происхождения до 90% обнаруживаемых патогенных вариантов BRCA1 представлены всего тремя мутациями: 5382insC, 4153delA, 185delAG. Этот факт позволяет значительно ускорить генетическое тестирование пациентов с признаками наследственного РМЖ/РЯ.
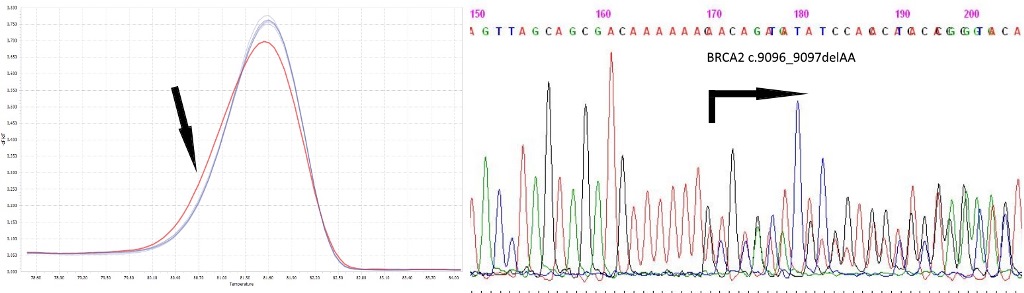
Анализ последовательности гена BRCA2, выявление мутации c.9096_9097delAA
В каких случаях нужно сдать анализ на мутации BRCA1 и BRCA2?
Национальная онкологическая сеть – National Comprehensive Cancer Network (NCCN) рекомендует направлять на генетическое исследование следующих пациентов:
Выполнение молекулярно-генетического анализа должно сопровождаться генетическим консультированием, в ходе которого обсуждаются содержание, смысл и последствия тестирования; значение позитивного, негативного и неинформативного результатов; технические ограничения предлагаемого теста; необходимость информировать родственников в случае обнаружения наследственной мутации; особенности скрининга и профилактики опухолей у носителей мутаций и др.
Как сдать анализ на мутации BRCA1 и BRCA2?
Материалом для анализа является кровь. Для генетических исследований используют пробирки с ЭДТА (фиолетовая крышка). Сдать кровь можно в лаборатории НМИЦ или привезти из любой другой лаборатории. Кровь хранится при комнатной температуре до 7 дней.
 |  |
Особая подготовка к исследованию не нужна, на результаты исследования не влияют приемы пищи, прием лекарств, введение контрастных веществ и пр.
Пересдавать анализ через некоторое время или после лечения не потребуется. Наследственная мутация не может исчезнуть или появиться в течение жизни или после полученного лечения.
Что делать, если у женщины обнаружена мутация BRCA1 или BRCA2?
Для носителей патогенных мутаций разработан комплекс мероприятий по ранней диагностике, профилактике и терапии новообразований молочной железы и рака яичников. Если среди здоровых женщин своевременно выявить тех, у кого имеется генный дефект, есть возможность диагностировать развитие заболевания на ранних стадиях.
Исследователями были выявлены особенности лекарственной чувствительности BRCA-ассоциированных опухолей. Они хорошо реагируют на некоторые цитостатические препараты, и лечение может быть весьма успешным.
Для здоровых носителей BRCA-мутаций рекомендовано:
Как предрасположенность к РМЖ и РЯ передается по наследству.
Часто у носителей мутаций BRCA1/BRCA2 возникает вопрос – всем ли детям она передалась и какие генетические причины появления наследственной формы РМЖ? Шансы передать повреждённый ген потомству составляют 50%.
Заболевание одинаково наследуется, как мальчиками, так и девочками. Ген, связанный с развитием рака молочной железы и рака яичников, расположен не на половых хромосомах, поэтому вероятность носительства мутации не зависит от пола ребенка.
Если мутация в нескольких поколениях передавалась через мужчин, очень сложно проводить анализ родословных, так как мужчины довольно редко болеют РМЖ даже при наличии генного дефекта.
Например: носителями были дедушка и отец пациентки, и у них заболевание не проявилось. На вопрос, были ли случаи онкологических заболеваний в семье, такая пациентка ответит отрицательно. При отсутствии других клинических признаков наследственных опухолей (ранний возраст/множественность опухолей), наследственная составляющая заболевания может быть не учтена.
При обнаружении мутации BRCA1 или BRCA2 всем кровным родственникам рекомендуется также пройти тестирование.
Почему при генетическом исследовании важно учитывать этнические корни?
Для многих этнических групп характерен свой набор частых мутаций. Национальные корни обследуемого необходимо учитывать при выборе глубины исследования.
Учеными было доказано, что для некоторых национальностей характерен ограниченный спектр значимых мутаций (т.н. «эффект основателя»). Так в популяции российских пациентов славянского происхождения до 90% обнаруживаемых патогенных вариантов BRCA1 представлены всего тремя мутациями: 5382insC, 4153delA, 185delAG. Этот факт позволяет значительно ускорить генетическое тестирование пациентов с признаками наследственного РМЖ/РЯ.
И, в заключение, наглядная инфографика «Синдром наследственного рака молочной железы и яичников». Автор — Кулигина Екатерина Шотовна, к.б.н., старший научный сотрудник Научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
Авторская публикация:
АЛЕКСАХИНА СВЕТЛАНА НИКОЛАЕВНА,
лаборант-исследователь научной лаборатории молекулярной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России