Кровь на рск что это
Кровь на рск что это
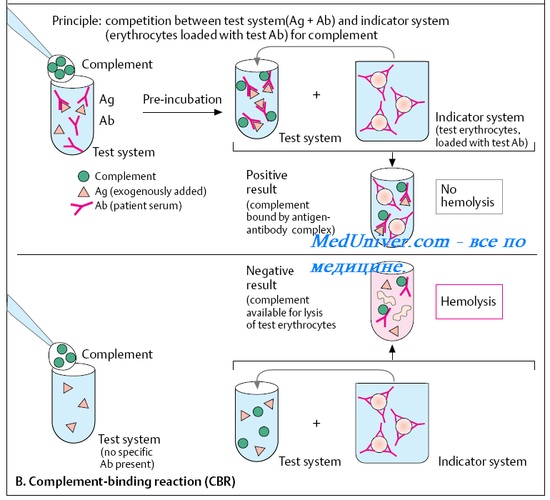
Реакция связывания комплемента (РСК) предложена Ж. Борде и О. Жангу. Реакция включает две фазы (рис. 10-18).
В фазе I (специфической) реакции связывания комплемента ( РСК ) искомый Аг (или AT) реагирует с диагностической антисывороткой (или Аг-диагностикумом) и комплементом. Образующийся комплекс Аг-АТ связывает комплемент.
Если в фазе I реакции связывания комплемента ( РСК ) AT и Аг соответствуют друг другу, то образующиеся иммунные комплексы связывают комплемент, разрушения эритроцитов после внесения гемолитической системы не наблюдают и реакцию считают положительной. Основные недостатки РСК: сложность (включает 5 компонентов), лабильность некоторых компонентов [их необходимо готовить прямо перед постановкой реакции (комплемент) либо за несколько суток (эритроциты барана)] и возможные антикомплементарные свойства у сывороток и Аг. Тем не менее РСК применяют в диагностике многих заболеваний, например при диагностике сифилиса (реакция Вассерманна).
Кровь на рск что это
Более простой и доступный подход — выявление противовирусных антител ( AT ) в сыворотке. Образцы крови необходимо отбирать дважды: немедленно после появления клинических признаков и через 2
3 нед. Чрезвычайно важно исследовать именно два образца сыворотки. Результаты однократного исследования нельзя считать окончательными из-за невозможности связать появление AT с настоящим случаем. Вполне возможно, что эти AT циркулируют после предшествующей инфекции. В подобной ситуации роль исследования сыворотки, полученной в период рекон-валесценции, трудно переоценить. На наличие заболевания в период отбора первой пробы указывает не менее чем четырёхкратное увеличение титра AT, выявленное при исследовании второй пробы.
Перечисленные ниже методы не позволяют дифференцировать антитела ( AT ), образующиеся во время болезни и циркулирующие после выздоровления (продолжительность этого периода вариабельна для различных инфекций). Поскольку для адекватной диагностики необходимо подтвердить достоверное увеличение титров AT в двух пробах, то первую пробу исследуют в острой фазе, а вторую — в период выздоровления (через 2-3 нед). Полученные результаты носят ретроспективный характер и более пригодны для проведения эпидемиологических обследований.
РТГА выявляет AT, синтезируемые против гемагглютининов вирусов (например, вируса гриппа). Метод позволяет легко выявлять подобные антитела ( AT ) в сыворотке больного.
РСК — основной метод серодиагностики вирусных инфекций (среди доступных). Реакция выявляет комплементсвязывающие IgM и IgG, но не дифференцирует их; для оптимизации получаемых результатов постановка реакции требует определённых навыков персонала.
РИФ. При возможности получить биоптат инфицированной ткани и доступности коммерческих наборов AT, меченных флюоресцеином, диагноз может подтвердить реакция прямой иммунофлюоресценции. Постановка реакции включает инкубацию исследуемой ткани с AT, их последующее удаление и люминесцентную микроскопию образца.
Иммуносорбционные методы выявления противовирусных антител
Иммуносорбционные методы (например, ИФА и РИА) более информативны, поскольку выявляют IgM и IgG по отдельности, что позволяет делать определённые выводы о динамике инфекционного процесса или состоянии реконвалесценции. Для выявления AT известный Аг сорбируют на твёрдом субстрате (например, на стенках пробирок, пластиковых микропланшетах, чашках Петри) и вносят различные разведения сыворотки пациента. После соответствующей инкубации несвязавшиеся AT удаляют, вносят антисыворотку к Ig человека, меченную ферментом, повторяют процедуру инкубирования и отмывания несвязанных AT и вносят какой-либо хромогенный субстрат (чувствительный к действию фермента). Поскольку изменение окраски пропорционально содержанию специфических AT, то вполне возможно определение их титра спектрофотометрическим способом. В диагностике ВИЧ-инфекции наи- большее распространение нашёл метод иммуноблотннга.
Иммунологические методы исследования в лабораторной практике
Преимущества иммунологического метода исследования.
Серологические реакции различаются по способности выявлять отдельные классы антител. Реакция агглютинации, например, хорошо выявляет lgM-антитела, но менее чувствительна для определения lgG-антител. Реакции связывания комплемента и гемолиза, которые требуют участия комплемента, не выявляют антитела, не присоединяющие комплемент, например lgA-антитела и lgE-антитела. В реакции нейтрализации вирусов участвуют лишь антитела, направленные против антигенных детерминант поверхности вириона, связанных с патогенностью. Чувствительность иммунулогических методов превосходит все другие методы исследования антигенов и антител, в частности радиоиммунный и иммуноферментный анализы позволяют улавливать присутствие белка в количествах, измеряемых в нанограммах и даже в пикограммах.
С помощью предложенного способа определяют группу и проверяют безопасность крови (гепатит В и ВИЧ-инфекция). При трансплантации тканей и органов, иммунологический метод позволяет определять совместимость тканей и тестировать методы подавления несовместимости. В судебной медицине используют реакцию Кастеллани для определения видовой специфичности белка и реакцию агглютинации для определения группы крови.
Иммунологические методы широко применяют в лабораторной диагностике инфекционных болезней. Этиологию заболевания устанавливают также на основании прироста антител к возбудителю в сыворотке крови реконвалесцента по сравнению с пробой, взятой в первые дни болезни. На основе исследования изучают иммунитет населения по отношению к массовым инфекциям, например к гриппу, а также оценивают эффективность профилактических прививок.
Развитию иммунологических методов способствовало создание моноклональных антител, продуцируемых гибридомой, полученной в результате слияния иммунокомпетентной клетки В-лимфоцита и клетки миеломы мышей. Моноклональные антитела несут только одну химически однородную популяцию антител, комплементарную специфической детерминанте антигена, что позволяет осуществлять тонкую дифференциацию белков. Развитие иммунологического метода исследования идет как по линии совершенствования реагентов (чистоты антигенов и антител), так и по линии создания автоматизированных систем постановки реакций и их инструментального учета.
Виды реакций метода иммунологического исследования.
В зависимости от их механизма и учета результатов, иммунологический метод исследования можно подразделить на 5 видов реакции.
1.Реакции, основанные на феномене агглютинации.
Агглютинация представляет собой склеивание клеток или отдельных частичек — носителей антигена с помощью иммунной сыворотки к этому антигену.
Реакция агглютинации бактерий с использованием соответствующей антибактериальной сыворотки относится к наиболее простым серологическим реакциям. Взвесь бактерий добавляют к различным разведениям испытуемой сыворотки крови и через определенное время контакта при t 37° регистрируют, при каком наивысшем разведении сыворотки крови происходит агглютинация. Реакцию агглютинации бактерий используют для диагностики многих инфекционных болезней: бруцеллеза, туляремии, брюшного тифа и паратифов, бациллярной дизентерии, сыпного тифа.
Реакции агглютинации для определения группы крови и резус-фактора основаны на взаимодействии аллоантител (изоантител) и антигенов эритроцитов. Антитела против резус-фактора являются неполными, они не способны к прямой реакции с резус-положительными эритроцитами, поэтому для их обнаружения используют реакцию Кумбса, основанную на выявлении неполных антител с помощью антиглобулиновых сывороток. К эритроцитам известной специфичности добавляют исследуемую сыворотку крови, а вслед за этим антиглобулиновую сыворотку против lgG (непрямая реакция Кумбса). Fab-фрагменты неполных антител исследуемой сыворотки крови присоединяются к эритроцитам, а к свободным Fc-фрагментам этих антител присоединяются антитела против lgG, и происходит агглютинация эритроцитов.
Реакция пассивной или непрямой гемагглютинации (РПГА, РНГА). В ней используют эритроциты или нейтральные синтетические материалы (например, частицы латекса), на поверхности которых сорбированы антигены (бактериальные, вирусные, тканевые) или антитела. Их агглютинация происходит при добавлении соответствующих сывороток или антигенов. Эритроциты, сенсибилизированные антигенами, называют антигенным эритроцитарным диагностикумом и используют для выявления и титрования антител. Эритроциты, сенсибилизированные антителами, называют иммуноглобулиновыми эритроцитарными диагностикумами и применяют для выявления антигенов.
Реакцию пассивной гемагглютинации используют для диагностики заболеваний, вызванных бактериями (брюшной тиф и паратифы, дизентерия, бруцеллез, чума, холера и др.), простейшими (малярия) и вирусами (грипп, аденовирусные инфекции, вирусный гепатит В, корь, клещевой энцефалит, крымская геморрагическая лихорадка и др.), а также для определения некоторых гормонов, выявления повышенной чувствительности больного к лекарственным препаратам и гормонам, например пенициллину и инсулину.
Реакция торможения гемагглютинации (РТГА) основана на феномене предотвращения (торможения) иммунной сыворотки гемагглютинации эритроцитов вирусами, используется для выявления и титрования противовирусных антител. Она служит основным методом серодиагностики гриппа, кори, краснухи, эпидемического паротита, клещевого энцефалита и других вирусных инфекций, возбудители которых обладают гемагглютинирующими свойствами, например, для серодиагностики клещевого энцефалита, в лунки панели разливают двукратные разведения сыворотки больного на щелочном боратном буферном растворе. Затем добавляют определенное количество, обычно 8 АЕ (агглютинирующих единиц), антигена клещевого энцефалита и после 18 ч экспозиции при t 4° вносят взвесь гусиных эритроцитов, приготовленную на кислом фосфатно-буферном растворе. Если в сыворотке крови больного есть антитела к вирусу клещевого энцефалита, то антиген нейтрализуется и агглютинация эритроцитов не происходит.
2.Реакции, основанные на феномене преципитации.
Преципитация происходит в результате взаимодействия антител с растворимыми антигенами. Простейшим примером реакции преципитации является образование в пробирке непрозрачной полосы преципитации на границе наслоения антигена на антитело. Широко применяют различные разновидности реакции преципитации в полужидких гелях агара или агарозы (метод двойной иммунодиффузии по Оухтерлоню, метод радиальной иммунодиффузии, иммуноэлетрофорез), которые носят одновременно качественный и количественный характер. В результате свободной диффузии, в геле антигенов и антител в зоне оптимального их соотношения образуются специфические комплексы — полосы преципитации, которые выявляют визуально или при окрашивании. Особенностью метода является то, что каждая пара антиген-антитело формирует индивидуальную полосу преципитации, и реакция не зависит от наличия в исследуемой системе других антигенов и антител.
Для постановки двойной иммунодиффузии наливают слой растопленного геля на стеклянную пластинку и после затвердевания вырезают лунки диаметром 1,5–3 мм. В расположенные по кругу лунки помещают исследуемые антигены, а в центральную лунку — иммунную сыворотку известной специфичности. Диффундируя навстречу друг другу, гомологичные сыворотки и антигены образуют преципитат.
При радиальной иммунодиффузии (по методу Манчини), иммунную сыворотку вносят в агар. Антиген, помещенный в лунки, диффундирует через агар, и в результате преципитации с иммунной сывороткой, вокруг лунок образуются непрозрачные кольца, внешний диаметр которых пропорционален концентрации антигена. Метод используют для определения классов иммуноглобулинов, а модификации метода можно применять для определения противомикробных антител, относящихся к различным классам иммуноглобулинов.
Иммуноэлектрофорез основан на усилении миграции в геле антигенов и антител путем помещения пластины геля с реагентами в электрическое поле. При этом достигается разделение антигенов и антител на компоненты в соответствии с их подвижностью и зарядом.
Разновидностью иммуноэлектрофореза является радиоиммунофорез. В этом случае после электрофоретического разделения антигенов в канавку, вырезанную параллельно движению антигенов в геле, наливают сначала меченную радиоактивным йодом иммунную сыворотку против определяемых антигенов, а затем иммунную сыворотку против lgG-антител, которая преципитирует образовавшиеся комплексы антитела с антигеном. Все несвязавшиеся реагенты вымывают, а комплекс антиген-антитело обнаруживает методом авторадиографии.
3.Реакции с участием комплемента.
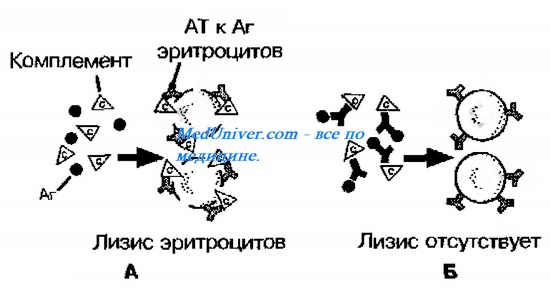
В качестве комплемента используют свежую сыворотку крови морской свинки, основанную на способности субкомпонента комплемента Clq и затем других компонентов комплемента присоединяться к иммунным комплексам.
Реакция связывания комплемента (РСК) позволяет титровать антигены или антитела по степени фиксации комплемента комплексом антиген-антитело. Эта реакция состоит из двух фаз: взаимодействия антигена с испытуемой сывороткой крови (исследуемая система) и взаимодействия гемолитической сыворотки с эритроцитами барана (индикаторная система). При положительной реакции в исследуемой системе происходит связывание комплемента, и тогда при добавлении сенсибилизированных антителами эритроцитов, гемолиза не наблюдается. Реакцию применяют для серодиагностики сифилиса (реакция Вассермана), вирусных и бактериальных инфекций.
Реакция радиального гемолиза эритроцитов может протекать в геле. Взвесь эритроцитов барана помещают в агарозный гель с комплементом; в застывшем на стекле слое делают лунки и вносят в них гемолитическую сыворотку. Вокруг лунок в результате радиальной диффузии антител образуется зона гемолиза, радиус которой прямо пропорционален титру сыворотки. Если сорбировать на эритроцитах какой-либо антиген, например гликопротеиновый гемагглютинин вируса гриппа, краснухи или клещевого энцефалита, то можно воспроизвести феномен гемолиза иммунными сыворотками к этим вирусам. Реакцию радиального гемолиза в геле применяют в диагностике вирусных инфекций. Она характеризуется простотой постановки, нечувствительностью к сывороточным ингибиторам, позволяет титровать сыворотки крови по диаметру зоны гемолиза, не прибегая к серийным разведениям.
Иммунное прилипание. Эритроциты, тромбоциты и другие клетки крови имеют на поверхности рецепторы к третьему компоненту комплемента (СЗ). Если к антигену (бактериям, вирусам и др.) добавить соответствующую иммунную сыворотку и комплемент, то образуется комплекс антиген-антитело, покрытый СЗ-компонентом комплемента. Эту реакцию применяют при изучении ряда вирусных инфекций (клещевого энцефалита, денге), которые сопровождаются иммунопатологическими процессами и циркуляцией в крови вирусных антигенов в комплексе с антителами.
Основана на способности антител нейтрализовать некоторые специфические функции макромолекулярных или растворимых антигенов, например активность ферментов, токсины бактерий, болезнетворность вирусов. В бактериологии эту реакцию используют для обнаружения антистрептолизинов, антистрептокиназы и антистафилолизинов. Реакцию нейтрализации токсинов можно оценивать по биологическому эффекту, так, например, титруют антистолбнячные и антиботулинические сыворотки. Смесь токсина с антисывороткой, введенная животным, не вызывает их гибели. Различные варианты реакции нейтрализации применяют в вирусологии. При смешивании вирусов с соответствующей антисывороткой и введении этой смеси животным или в клеточные культуры, патогенность вирусов нейтрализуется и при этом животные не заболевают, а клетки культур не подвергаются деструкции.
5.Реакции с использованием химических и физических меток (ИФА).
Иммунофлюоресценция заключается в использовании меченых флюорохромом антител, точнее, иммуноглобулиновой фракции антител lgG. Меченое флюорохромом антитело образует с антигеном комплекс антиген-антитело, который становится доступным наблюдению под микроскопом в УФ-лучах, возбуждающих свечение флюорохрома. Реакцию прямой иммунофлюоресценции используют для изучения клеточных антигенов, выявления вируса в зараженных клетках и обнаружения бактерий и риккетсий в мазках. Так, для диагностики бешенства, отпечатки кусочков мозга животных, подозреваемых на вирусоносительство, обрабатывают люминесцирующей антирабической сывороткой. При положительном результате, в цитоплазме нервных клеток выявляются глыбки ярко-зеленого цвета. На обнаружении антигенов вирусов в клетках отпечатков со слизистой оболочки носа основана экспресс-диагностика гриппа, парагриппа и аденовирусной инфекции.
Более широко применяют метод непрямой иммунофлюоресценции, основанный на выявлении комплекса антиген-антитело с помощью люминесцирующей иммунной сыворотки против lgG-антител и используемой для обнаружения не только антигенов, но и титрования антител. Метод нашел применение в серодиагностике герпеса, цитомегалии, лихорадки Ласса. Препараты с наслоенной исследуемой сывороткой крови помещают в термостат при t 37° для образования иммунных комплексов, а затем, после отмывания несвязавшихся реагентов, выявляют эти комплексы меченой люминесцирующей сывороткой против глобулинов человека. Применяя меченые иммунные сыворотки против lgM- или lgG-антител, можно дифференцировать тип антител и обнаруживать ранний иммунный ответ по наличию lgM-антител.
Иммунофлюоресценцию широко используют не только в бактериологии, вирусологии, паразитологии, но и в иммунопатологии для обнаружения антител к тканевым антигенам человека.
Иммуноферментные или энзим-иммунологические методы основаны на использовании антител, конъюгированных с ферментами, главным образом пероксидазой хрена или щелочной фосфатазой. Чтобы обнаружить соединение меченых антител с антигеном, добавляют субстрат, разлагаемый присоединенным к lgG ферментом, с окрашиванием в желто-коричневый (пероксидаза) или желто-зеленый (фосфатаза) цвет. Используют также ферменты, разлагающие не только хромогенный, но и люмогенный субстрат. В этом случае при положительной реакции появляется свечение. Подобно иммунофлюоресценции, иммуноферментный метод применяют для обнаружения антигенов в клетках или титрования антител на антигенсодержащих клетках.
Наиболее популярной разновидностью иммуноферментного метода является иммуносорбция. На твердом носителе, которым могут быть целлюлоза, полиакриламид, декстран и различные пластмассы, сорбируют антиген. Чаще носителем служит поверхность лунок микропанелей. В лунки с сорбированным антигеном вносят исследуемую сыворотку крови, затем меченую ферментом антисыворотку и субстрат. Положительные результаты учитывают по изменению цвета жидкой среды. Для обнаружения антигенов, на носитель сорбируют антитела, затем вносят в лунки исследуемый материал и проявляют реакцию меченой ферментом антимикробной сывороткой. Повышению чувствительности иммунофлюоресцентного и иммуноферментного методов способствует введение в систему реакции авидина и биотина.
Радиоиммунологический метод основан на применении радиоизотопной метки антигенов или антител. Является наиболее чувствительным методом определения антигенов и антител, используется для определения гормонов, лекарственных веществ и антибиотиков, для диагностики бактериальных, вирусных, риккетсиозных, протозойных заболеваний, исследования белков крови, тканевых антигенов. Первоначально он был разработан как специфический метод измерения уровня циркулирующих в крови гормонов. Тест-системой являлись меченый радионуклидом гормон (антиген) и антисыворотка к нему. Если к такой антисыворотке добавить материал, содержащий искомый гормон, то он свяжет часть антител, при последующем внесении меченого титрованного гормона с антителами свяжется уменьшенное по сравнению с контролем его количество. Результат оценивают по сопоставлению кривых связанной и несвязанной радиоактивной метки. Эта разновидность метода носит название конкурентной реакции. Существуют и другие модификации радиоиммунологического метода.
Иммуногистологические методы предназначены для определения антигенов на поверхности или внутри клетки, например для обнаружения маркеров лимфоцитов и иммунокомплексов при гломерулонефритах и других заболеваниях почек. В этой реакции для выявления антигенов пользуются или иммунофлюоресценцией, или иммуноферментными конъюгатами с пероксидазой. Количество специфических антигенов определяют по интенсивности окрашивания. Иногда используют автоматическую регистрацию с помощью спектрофотометра.
Серологические опухолевые маркеры в вопросах и ответах
Серологические опухолевые маркеры в вопросах и ответах
проф. Сергеева Н.С., к.б.н. Маршутина Н.В.
Что такое серологические опухолевые маркеры?
Какую информацию дают анализы опухолевых маркеров?
Возрастание в крови уровней опухолевых маркеров часто указывает на развитие опухолевого процесса, дает дополнительную информацию о степени его распространенности (стадии болезни) и, что особенно важно, об ответе на лечение, т.е. эффективности проведенной терапии. После окончания первичного лечения периодическое исследование опухолевых маркеров часто дает возможность заподозрить развитие рецидива опухолевого процесса раньше традиционно используемых в онкологии методов диагностики.
Для больных с какими злокачественными новообразованиями исследуют опухолевые маркеры?
Известны опухолевые маркеры рака яичников, тела и шейки матки, молочной железы, предстательной железы, органов желудочно-кишечного тракта, легкого других злокачественных новообразований.
Наиболее часто используемые серологические опухолевые маркёры
Серологические опухолевые маркеры
Рак молочной железы
СА 15-3, РЭА, СА 19-9, НЕ4, СА 72-4 (гормоны: пролактин, эстардиол)
СА 125, НЕ4, СА 72-4, СА 19-9
СА 125, НЕ4, СА 19-9, РЭА
Рак поджелудочной железы
Рак мочевого пузыря
Tu M2-PK, SCC, СА 125, НЕ4
Рак предстательной железы
ПСАобщ, ПСАсвоб/ ПСАобщ., [-2] проПСА, индекс здоровья простаты (ИЗП), НЕ4
Рак щитовидной железы:
Тиреоглобулин (ТГ), антитела к ТГ, ТТГ
Метастазы в костях
Хромогранин А, 5-ГИУК, гастрин 17
Если у человека повышен тот или иной опухолевый маркер, означает ли это диагноз «рак»?
Высокие уровни одних маркеров подтверждают подозрения, других- служат основанием для дополнительного обследования, так как концентрации маркеров могут повышаться и при доброкачественных опухолях и воспалительных заболеваниях. Поэтому, если у человека содержание опухолевого маркера превышает норму, следует провести дообследование для установления причины этого и прежде всего исключить наличие злокачественной опухоли. Кроме того, рекомендуется повторить анализ через 1-1,5 месяца. В целом же интерпретацией анализов опухолевых маркеров как и результатов других диагностических методов, занимается врач, имеющий специальную подготовку.
Таким образом, повышение маркера — это не всегда злокачественный процесс, но всегда патологический процесс, который требует дообследования.
Всегда ли повышен опухолевый маркер при наличии злокачественной опухоли?
В ряде случаев у больных со злокачественными заболеваниями уровень маркеров может оставаться в пределах нормы. Это означает, что у отдельных пациентов опухолевые клетки не выделяют в кровь данный маркер, что еще раз подтверждает необходимость использования опухолевых маркеров в комплексе с другими диагностическими методами. Маркеры могут оставаться в пределах нормы и при начальных стадиях опухолевого процесса, так как объем опухоли в этих случаях мал. В то же время для опухолей каждого типа подобрано несколько опухолевых маркеров. Поэтому для многих пациентов с установленным диагнозом злокачественной опухоли удается найти маркер, уровень которого повышен до начала лечения, и использовать этот маркер для мониторинга течения болезни.
Что дает регулярное определение содержания опухолевых маркеров у онкологических больных в процессе лечения и впоследствии при наблюдении за больными?
Оценка содержания опухолевых маркеров в крови дает возможность лечащему врачу получить дополнительную информацию, позволяющую, во-первых, оценить эффективность проведенного лечения и назначить, при необходимости, иную схему терапии. Во-вторых, уровни опухолевых маркеров учитывают и при решении вопроса о прекращении или продолжении химиотерапии больных. Особо следует отметить, что при наблюдении за больными после окончания лечения опухолевые маркеры часто позволяют уловить начало возобновления болезни до ее проявления и раньше других методов диагностики.
Какие опухолевые маркеры и для каких больных наиболее широко используются сегодня?
В настоящее время одним из наиболее успешно используемых в онкологической клинике опухолевых маркеров является простат специфический антиген (ПСА) В США, например, выполняется программа обязательного ежегодного исследования ПСА у всех мужчин старше 45 лет, направленная на выявление начальных форм рака предстательной железы. В нашей стране многие врачи – урологи также назначают пациентам анализ на ПСА. Результаты анализа позволяют выделить группу мужчин для дообследования и, таким образом, выявить рак предстательной железы в ранней стадии, когда терапия приводит к полному излечению. ПСА, кроме того, успешно используется для контроля эффективности лечения как у больных раком, так и пациентов, страдающих аденомой предстательной железы. С помощью ПСА выявляют также начало возобновления заболевания, поэтому уровень этого маркера следует периодически определять у пациентов после проведенного лечения.
Поскольку ПСА может быть повышен не только при раке предстательной железы, но и при доброкачественных процессах в простате (аденома, простатит), существуют методы оценки разных фракций ПСА, что позволяет проводить дифференциальную диагностику для этих заболеваний.
До 80% больных раком яичников имеют повышенный уровень СА125, который значительно снижается в процессе лечения. Это позволяет использовать данный маркер для оценки эффективности лечения рака яичников. При возобновлении опухолевого процесса концентрация СА 125 в крови начинают возрастать за 2-6 мес. до его клинического проявления. На этом свойстве белка СА125 основан метод динамического наблюдения больных раком яичников с целью раннего выявления рецидивов опухоли.
В то же время необходимо знать, что уровни СА125 могут несколько повышаться при доброкачественных опухолях яичников, воспалительных заболеваниях и эндометриозе (в меньшем проценте случаев и меньшей концентрации, чем при раке яичников), что позволяет использовать данный опухолевый маркер для мониторинга пациенток с этими заболеваниями.
В последнее десятилетие в арсенале онкогинекологов появился новый опухолевый маркер рака яичников – НЕ4 (human epididymis protein 4). Повышенные уровни белка НЕ4 обнаруживаются у 88,0% больных раком яичника. При этом НЕ4 значительно реже, чем СА125, повышен у пациенток с доброкачественными гинекологическими заболеваниями и практически не повышается при эндометриозе.
Комбинация НЕ4 с СА 125 позволяет улучшить чувствительность метода дифференциальной диагностики злокачественного и доброкачественного процесса в яичниках и, по мнению ряда авторов, является более точным предиктором злокачественного процесса при наличии у женщины образований в малом тазу. Это крайне важно для выработки адекватной тактики лечения таких пациенток на этапе диагностики.
Анализ данных по сочетанному использованию двух ОМ (СА 125 и НЕ4) в дифференциальной диагностике РЯ с использованием логистической регрессии позволил разработать алгоритм ROMA (risk of ovarian malignancy algorithm). ROMА учитывает концентрации онкомаркеров НЕ4 и СА 125, а также менопаузальный статус пациентки и позволяет рассчитать вероятность рака яичников, разделяя женщин с образованиями в малом тазу на группы с высоким и низким риском данного заболевания. Было показано, что значения ROMA ≥ 27,7% и ≥ 13,1% для женщины в постменопаузе и пременопаузе, соответственно, ассоциированы с высоким риском обнаружения раком яичников.
При колоректальном раке рекомендуется определять маркеры: РЭА, СА 19-9. Показано, что уровень РЭА на старте лечения коррелирует со стадией процесса, с продолжительностью безрецидивного после первичного лчения периода, а также с прогнозом течения опухолевого процесса.
Особенно высокий уровень обнаруживается у пациентов с метастазами в кости, печень, легкие и другие органы. Падение уровня РЭА после лечения является показателем его эффективности, вторичный подъем данного маркера свидетельствует о развитии рецидива и метастазов.
Маркером для мониторинга больных фолликулярным и папиллярным раком щитовидной железы является ТГ (тиреоглобулин). ТГ – гликопротеид коллоида щитовидной железы, предшественник тиреоидных гормонов.
Содержание ТГ в крови может повышаться не только при раке щитовидной железы, но и при тиреотоксикозе, токсической аденоме и тиреоидите. Поэтому по концентрации ТГ нельзя дифференцировать заболевания щитовидной железы. Определение уровня ТГ в крови показано, прежде всего, больным до и после удаления щитовидной железы по поводу рака в качестве контроля радикальности проведенной операции. Выявление ТГ в крови у больных без щитовидной железы свидетельствует о наличии в организме ткани щитовидной железы; при прогрессировании заболевания уровень этого белка возрастает.
Необходимо отметить, что определение ТГ следует проводить не ранее чем через 3 нед после пункционной биопсии щитовидной железы и через 3 мес после удаления органа по поводу рака щитовидной железы.
Таким образом, широко используемые в настоящее время тесты на опухолевые маркеры представляют собой информативные, простые в исполнении, доступные по цене, нетравматичные методы активного выявления злокачественных новообразований и наблюдения за онкологическими больными, позволяющие осуществлять оценку эффективности лечения и доклиническое выявление рецидива заболевания. Кроме того, исследовать опухолевые маркеры весьма полезно у лиц с повышенным онкологическим риском (наличие родственников, больных раком; работники вредных производств и др.) для раннего выявления онкологических заболеваний.
Когда не рекомендуется проводить исследования опухолевых маркеров?
Не рекомендуется исследовать маркеры при острых и обострении хронических заболеваний, а также после инвазивных диагностических процедур. В этих случаях можно получить ложноположительные результаты.
Может ли человек без назначения врача сдать анализ крови для определения конкретного опухолевого маркера?
Да. Это можно сделать и в нашем институте. Но еще раз хотим подчеркнуть, что грамотно назначить анализ и интерпретировать его результаты может только врач. Поэтому лучше до сдачи крови посоветоваться с врачом для решения вопроса о выборе опухолевых маркеров, наиболее информативных для конкретного пациента. В то же время мы не исключаем возможности, в частности, для мужчин, проявлять инициативу и самостоятельно сдавать анализ ПСА, а для женщин СА125.