Кроветворение в организме человека это что
Кровь – внутренняя среда организма
Кровь – внутренняя среда организма, образованная жидкой соединительной тканью.
Состоит из плазмы и клеток (лейкоцитов, эритроцитов и тромбоцитов). Циркулирует по системе сосудов под действием силы ритмически сокращающегося сердца и не сообщается непосредственно с другими тканями тела. В среднем, массовая доля крови к общей массе тела человека составляет 6,5-7 %.
Плазма крови – жидкая часть крови, которая содержит воду и взвешенные в ней вещества (белки и другие соединения). Основными белками плазмы являются альбумины, глобулины и фибриноген. Около 85 % плазмы составляет вода. Неорганические вещества составляют около 2-3 %; это катионы (Na+, K+, Mg2+, Ca2+) и анионы (HCO3-, Cl-, PO43-, SO42-). Органические вещества (около 9 %) в составе крови подразделяются на азотсодержащие (белки, аминокислоты, мочевина, креатинин, аммиак, продукты обмена пуриновых и пиримидиновых нуклеотидов) и безазотистые (глюкоза, жирные кислоты, пируват, лактат, фосфолипиды, триацилглицеролы, холестерин). Также в плазме крови содержатся газы (кислород, углекислый газ) и биологически активные вещества (гормоны, витамины, ферменты, медиаторы).
Эритроциты (красные кровяные тельца) – самые многочисленные из форменных элементов. Зрелые эритроциты не содержат ядра и имеют форму двояковогнутых дисков. Циркулируют 120 дней и разрушаются в печени и селезёнке. В эритроцитах содержится железосодержащий белок – гемоглобин. Он обеспечивает главную функцию эритроцитов – транспорт газов, в первую очередь – кислорода. Именно гемоглобин придаёт крови красную окраску. В лёгких гемоглобин связывает кислород, превращаясь в оксигемоглобин, который имеет светло-красный цвет. В тканях оксигемоглобин высвобождает кислород, снова образуя гемоглобин, и кровь темнеет. Кроме кислорода, гемоглобин в форме карбогемоглобина переносит из тканей в лёгкие углекислый газ.
Тромбоциты (кровяные пластинки) представляют собой ограниченные клеточной мембраной фрагменты цитоплазмы гигантских клеток костного мозга (мегакариоцитов). Совместно с белками плазмы крови (например, фибриногеном) они обеспечивают свёртывание крови, вытекающей из повреждённого сосуда, приводя к остановке кровотечения и тем самым защищая организм от кровопотери.
Лейкоциты (белые клетки крови) являются частью иммунной системы организма. Они способны к выходу за пределы кровяного русла в ткани. Главная функция лейкоцитов — защита от чужеродных тел и соединений. Они участвуют в иммунных реакциях, выделяя при этом Т-клетки, распознающие вирусы и всевозможные вредные вещества; В-клетки, вырабатывающие антитела, макрофаги, которые уничтожают эти вещества. В норме лейкоцитов в крови намного меньше, чем других форменных элементов.
Кровь относится к быстро обновляющимся тканям. Физиологическая регенерация форменных элементов крови осуществляется за счёт разрушения старых клеток и образования новых органами кроветворения. Главным из них у человека и других млекопитающих является костный мозг. У человека красный, или кроветворный, костный мозг расположен в основном в тазовых костях и в длинных трубчатых костях.
Функции крови в организме
Кровь непрерывно циркулирует в замкнутой системе кровеносных сосудов и выполняет в организме различные функции, такие как:
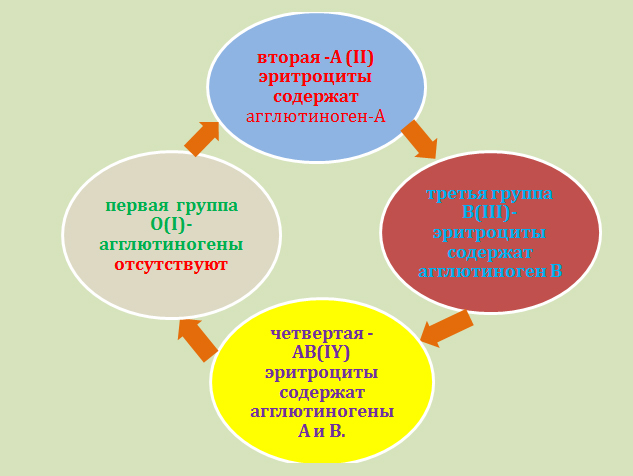
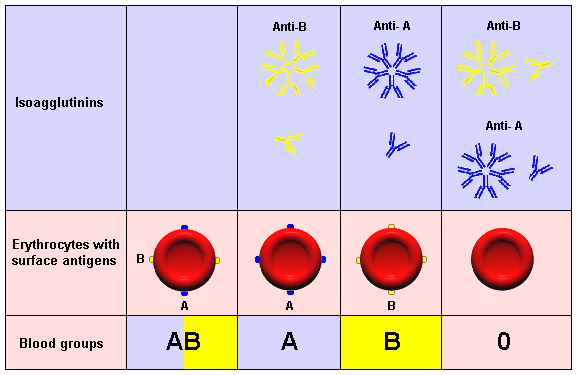
По общности некоторых антигенных свойств эритроцитов все люди подразделяются по принадлежности к определённой группе крови. У каждого человека группа крови индивидуальная. Принадлежность к определённой группе крови является врождённой и не изменяется на протяжении всей жизни. Наибольшее значение имеет разделение крови на четыре группы по системе «AB0» и на две группы по системе «резус фактор».
Соблюдение совместимости крови именно по этим группам имеет особое значение для безопасного переливания крови. Существуют и другие, менее значимые группы крови. Можно определить вероятность появления у ребёнка той или иной группы крови, зная группу крови его родителей.
Заболевания органов системы кроветворения
Правильно подобранная терапия нарушений работы кроветворной системы под строгим наблюдением врача. Запишитесь на прием в клинику.
Скидка 500 ₽!
При записи на лечение к специалистам Группы клиник Диадент в «горящие» окна текущего дня (не распространяется на консультации). Список «горящих» окон уточняйте у администраторов.
Важность процесса кроветворения сложно переоценить: от его качества напрямую зависит вся жизнедеятельность человеческого организма. Любые нарушения в работе кроветворной системы представляют серьёзную угрозу для жизни и здоровья человека. Дисфункция кроветворной системы, которая может быть как врождённой, так и приобретённой, проявляется в нарушениях строения и функционирования лейкоцитов, тромбоцитов, эритроцитов или плазмы крови, что приводит к развитию опасных заболеваний. Наиболее часто встречающимися заболеваниями кроветворной системы являются анемия, лейкоз и геморрагический диатез.
Симптомы нарушения кроветворения
Система кроветворения обеспечивает постоянное обновление клеток крови и пополнение их количества взамен утерянных. Дисфункции кроветворной системы неизбежно приводят к изменениям в составе крови, что напрямую сказывается на зависящих от неё дыхательной, питательной, выделительной, регуляторной, терморегуляторной, гомеостатической и защитной функциях организма. Симптомы дисфункции кроветворения могут быть различными, их проявление зависит от особенностей протекания патологического процесса.
Различные анемии, представляющие собой дефицит эритроцитов, характеризуются такими симптомами, как:
Симптомы анемии
Различные анемии, представляющие собой дефицит эритроцитов, характеризуются такими симптомами, как:
В зависимости от типа анемии, симптомы могут иметь различную степень выраженности.
Узнайте стоимость лечения на бесплатной консультации по телефону +7 (812) 40-000-60
Симптомы геморрагического диатеза
Геморрагические диатезы, представляющие собой довольно обширную группу заболеваний, имеют такой общий симптом, как повышенная предрасположенность организма к кровоизлияниям. В зависимости от типа диатеза, кровоизлияния могут быть:
В зависимости от типа анемии, симптомы могут иметь различную степень выраженности.
Мы предлагаем Вам множество способов оплаты услуг клиники для физических и юридических лиц: наличным и безналичным расчётом, картой или с помощью сертификата.
Записывайтесь на прием, и он пройдет в точно назначенное время.
В Диадент разработана совершенная система безопасности, которая сводит риск заболеваний (защита от ВИЧ, гепатита и других болезней) к нулю.
Симптомы лейкоза
Лейкоз, представляющий собой онкологическое заболевание костного мозга, приводящее к патологическим изменениям процессов распада и репродуцирования лейкоцитов, проявляется у каждого пациента индивидуально. Выраженность симптоматики в большой степени зависит от иммунитета больного. Как правило, распознать заболевание на ранней стадии позволяют сочетание симптомов анемического, геморрагического и инфекционного синдрома, а также значительное увеличение лимфоузлов.
При подозрении на наличие любых заболеваний, связанных с функционированием кроветворной системы, необходимо незамедлительно обращаться за квалифицированной медицинской помощью в клинику Диадент. Важно помнить, что выявление заболевания на ранней стадии способствует значительно более быстрому и эффективному исцелению недуга, чем в случаях, когда патологический процесс развивается и прогрессирует в течение длительного времени.
Диагностика заболеваний кроветворной системы
Основными диагностическими методами, используемыми врачами нашей клиники при подозрении на наличие у пациента патологий кроветворения, являются лабораторные исследования, как правило, включающие в себя:
Дополнительно врачом могут быть назначены инструментальные исследования, такие, как:
Как лечить заболевания крови?
Богатый опыт и высокая техническая оснащённость нашей клиники позволяют врачам Диадент успешно бороться с различными заболеваниями кроветворной системы. Терапия неонкологических заболеваний кроветворения может включать в себя такие шаги, как:
Медикаментозное лечение кроветворной системы
Медикаментозное лечение в большинстве случаев заключается в приёме кортикостероидов и гемостатиков. Довольно часто пациентам с дисфункцией кроветворной системы назначаются гемокоррекция и переливание крови.
Как лечат лейкоз крови?
При лечении лейкоза основными терапевтическими методами, дающими, при своевременном начале терапии, возможность добиться стойкой ремиссии, являются химиотерапия, лучевая терапия, биологическое лечение, а также хирургические операции, связанные с необходимостью трансплантации стволовых клеток или костного мозга.
Узнайте стоимость лечения на бесплатной консультации по телефону +7 (812) 40-000-60
Происхождение стволовых кроветворных клеток в эмбриональном развитии
В организме взрослых млекопитающих кроветворение происходит главным образом в костном мозге. На протяжении всей жизни в нем поддерживаются стволовые кроветворные клетки (СКК), образующие все типы форменных элементов крови. В эмбриональном развитии кроветворение происходит в нескольких анатомических образованиях – желточном мешке, аорто-гонадо-мезонефральной области, плаценте и печени. Однако до сих пор не вполне ясно, где именно в ходе развития эмбриона впервые появляются клетки-предшественники, дающие начало СКК зрелого костного мозга. В обзоре рассмотрены современные представления об особенностях кроветворных клеток, образующихся в желточном мешке, аорто-гонадо-мезонефральной области и плаценте, и их вкладе в заселение печени зародыша, а впоследствии и костного мозга взрослого организма.
Костный мозг – основной орган кроветворения у взрослых млекопитающих, в котором на протяжении всей жизни воспроизводятся стволовые кроветворные клетки (СКК) и образуются зрелые клетки крови. СКК взрослого организма способны давать все типы форменных элементов крови (нейтрофилы, базофилы, эозинофилы, моноциты, лимфоциты, эритроциты, тромбоциты). Кроме того, после деления СКК воспроизводят самих себя, т.е. самоподдерживаются. Благодаря этому они обеспечивают кроветворение неопределенно долгое время. Основным функциональным критерием наличия в ткани СКК является способность к восстановлению кроветворения как после естественной гибели клеток, так и в ходе патологических процессов или действия повреждающих агентов. Полный набор этих свойств появляется у СКК только после рождения, в результате созревания их предшественников, так называемых пре-стволовых кроветворных клеток (пре-СКК), которые возникают в раннем развитии задолго до формирования костного мозга. Хотя процесс образования кроветворной системы изучается более 100 лет, остается не ясным вопрос, где впервые возникают клетки, дающие начало СКК, существующим во взрослом организме.
В печени зародыша собственные предшественники кроветворных клеток не образуются. Кроветворение в ней начинается и поддерживается только за счет миграции клеток, приходящих из желточного мешка, АГМ и плаценты. В печени СКК не только самоподдерживаются и размножаются, но и впервые в эмбриогенезе образуют все типы кроветворных клеток красного и белого рядов. Таким образом, печень является основным кроветворным органом развивающегося плода и обеспечивает его потребность как в стволовых, так и в зрелых клетках крови, что становится особенно важным на тех стадиях развития, когда желточный мешок уже прекращает выполнять кроветворную функцию. В конце внутриутробного периода печень переключается на выполнение специфических функций, свойственных ей во взрослой жизни, а кроветворная активность ней угасает. СКК при этом покидают печень и перемещаются в костный мозг, где к тому моменту уже складываются условия для их существования и самообновления. Попав в костный мозг, СКК прекращают интенсивно делиться и переходят в состояние покоя.
Ведущая роль в смене мест, где в ходе индивидуального развития происходит кроветворение, принадлежит микроокружению. В желточном мешке, АГМ, плаценте и печени оно неодинаково, и это обуславливает различия в поведении кроветворных клеток в этих органах. Так, под влиянием микроокружения плаценты СКК активно размножаются, а микроокружение печени благоприятствует не только их делению, но и дифференцировке. Ключевую роль в формировании микроокружения, или ниши для СКК, играют мезенхимные стромальные клетки (МСК). В ходе развития эмбриона МСК появляются в местах кроветворной активности, по-видимому, подготавливая «ложе» для кроветворных клеток, причем обе системы – мезенхимная и кроветворная – развиваются скоординировано. В индивидуальном развитии МСК претерпевают не только количественные, но и функциональные изменения, что отражает процесс созревания кроветворной ниши. Именно качественные изменения качества кроветворного микроокружения, происходящее параллельно с изменениями СКК, могут иметь определяющее влияние на приобретение последними дефинитивных свойств, присущих клеткам взрослого организма.
Таким образом, эмбриональное кроветворение осуществляется во многих анатомических образованиях, обеспечивающих на протяжении пренатального периода разные этапы формирования и созревания кроветворных клеток. Кроветворные функции этих образований частично перекрываются, но каждое из них имеет и уникальные особенности: желточный мешок служит первым местом продукции функционально активных клеток крови (примитивных эритроцитов), в АГМ закладываются de novo предшественники дефинитивных СКК, плацента обеспечивает размножение СКК, а печень – их поддержание и дифференцировку в множественных направлениях. Существование нескольких мест для кроветворения способствует, с одной стороны, быстрому образованию первых дифференцированных клеток крови, необходимых эмбриону для выживания и роста, а с другой – продукции множества СКК, которые потребуется организму в дальнейшем, уже после рождения. Однажды возникнув, СКК собираются в печени зародыша для размножения и дифференцировки, после чего заселяют костный мозг. На этом пути они попадают в различные ниши и подвергаются различным воздействиям, способствующим их размножению и функциональному созреванию, в результате чего приобретают свойства СКК взрослого организма.
Хотя эмбриональное развитие кроветворной системы изучается уже много лет, многие вопросы, связанные с происхождением клеток крови в эмбриогенезе, до сих пор остаются без ответа. Дальнейшее изучение клеточных и молекулярных механизмов формирования СКК в индивидуальном развитии имеет несомненную значимость не только для понимания фундаментальных аспектов функционирования кроветворной системы, но и для совершенствования методов лечения гематологических заболеваний.
Обзор онкологических заболеваний крови
ЗЛОКАЧЕСТВЕННЫЕ ЗАБОЛЕАНИЯ КРОВИ
Опухоли кроветворной и лимфоидной тканей составляют приблизительно 8% от всех злокачественных новообразований, и все вместе входят в число 6 самых частых видов злокачественных заболеваний.
Предлагаем Вашему вниманию краткий, но очень подробный обзор онкологических заболеваний кроветворной системы.
Его подготовили высоко квалифицированные специалисты Отдела лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
Филиалы и отделения, где лечат злокачественные заболевания крови
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отдел лекарственного лечения опухолей
Заведующий отделом, д.м.н. ФЕДЕНКО Александр Александрович
тел: 8 (494) 150 11 22
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отдел лекарственного лечения злокачественных новообразований
Заведующая отделом, д.м.н. ФАЛАЛЕЕВА Наталья Александровна
тел: 8 (484) 399 – 31-30
Каждая новая клетка проходит строго определенные этапы своего развития, результатом которых является изменение ее внешнего вида и свойств. Если на каком-либо этапе в силу разных повреждающих причин происходит «замирание» одной единственной клетки (=блок дифференцировки), а затем эта клетка начнет деление и новые клетки будут также лишены возможности дальнейшего развития, то исходом этого процесса будет накопление не завершивших все необходимые этапы дифференцировки клеток (=опухолевого клона), что собственно и будет обозначать начало гемобластоза. Интересно, что злокачественные клетки крови в той или иной мере сохраняют морфологические, иммунологические свойства и «биологическое поведение» своих нормальных аналогов.
Существующие классификационные системы опухолей лимфоидной и кроветворной тканей основываются на детальной иммуноморфологической характеристике опухоли, подкрепленной в ряде случаев дополнительной информацией о генетической и молекулярной ее структуре.
Иммунофенотипирование при лейкозе или лимфоме
– необходимый диагностический этап при остром лейкозе или лимфоме. Это комплексная характеристика типа клеток. С использованием иммунологических методов возможно выявление особых структур, антигенов, на поверхности клетки (как правило, белковых молекул, так называемых CD (claster differentiation), кластер дифференцировки). Комплекс данных антигенов составляет иммунологический фенотип (иммунофенотип) на основании которого каждая клетка может быть отнесена к определенному классу: негемопоэтическая, гемопоэтическая, миелоидная, лимфоидная, T-клетка, В-клетка, клетка-предшественник. В соответствии с иммунофенотипом определяется иммунологический вариант заболевания, что является принципиальным для выбора правильной терапии на этапе диагноза.
Цитогенетический метод исследования крови
в настоящее время входит в перечень необходимых диагностических мероприятий при большинстве онкогематологических заболеваний. Данный метод позволяет:
• Провести точную диагностику большинства опухолевых заболеваний системы крови.
• Определить прогноз заболевания.
• Использовать таргетную (точечную, прицельную терапию) при обнаружении определенных цитогенетических перестроек.
В основе развития онкогематологических заболеваний лежат перестройки (поломки) генетического материала в клетках кроветворной и лимфоидной тканей. Эти события приводят к трансформации нормальных кроветворных клеток в опухолевые. Они не затрагивают другие клетки организма (в т.ч. половые клетки). По этой причине онкогематологические заболевания, за редким исключением, не передаются по наследству. Хромосомные перестройки можно обнаружить при помощи стандартного цитогенетического исследования или более чувствительного метода – интерфазного анализа с использованием зондов (маркеров) к конкретным участкам хромосом (метод FISH). В ряде случаев цитогенетические изменения могут происходить на субмикроскопическом уровне (т.к называемые точечные мутации). Такие изменения возможно детектировать только с помощью ультратонких высокочувствительных методов молекулярного исследования (метод ПЦР- полимеразная цепная реакция).
В ходе больших международных исследований было обнаружено различное течение онкогематологических заболеваний в зависимости от обнаружения тех или иных хромосомных перестроек или мутаций генов. Известны изменения, ассоциированные с благоприятным, промежуточным или неблагоприятным агрессивным течением заболевания. Таким образом, молекулярно-цитогенетические характеристики являются предикторами прогноза. На этой основе при различных онкогематологических заболеваниях на ряду с другими признаками разрабатываются программы терапии разной интенсивности (риск-адаптированная терапия).
Среди опухолей кроветворной и лимфоидной тканей различают лимфомы и лейкозы. Исторически сложилось разделение лимфоидных опухолей (лимфом) на лимфому Ходжкина и неходжкинские лимфомы. Неходжкинские лимфомы в зависимости от клеточной линии подразделяются на В-клеточные, Т- и NK-клеточные опухоли. На сегодняшний день на основании морфоиммунологических и генетических характеристик выделяется несколько десятков видов неходжкинских лимфом, для многих из которых созданы обособленные терапевтические программы. Лейкозы представляют собой разнородную группу заболеваний, делятся на острые и хронические в зависимости от субстрата опухоли: при острых лейкозах основная масса клеточного субстрата представлена незрелыми клетками (бластами ), при этом блок дифференцировки происходит очень рано, на этапе клеток-родоначальниц кроветворения, в отличие от хронических лейкозов, где опухолевые клетки представлены зрелыми и созревающими элементами. Также принципиально важным является деление лейкозов на миелоидные и лимфоидные, что возможно только при проведении качественного морфо- цитохимического, иммунофенотипического и молекулярно-генетического исследований клеток крови еще до начала лечения.
Опухоли кроветворной и лимфоидной тканей составляют приблизительно 8% от всех злокачественных новообразований, и все вместе входят в число 6 самых частых видов злокачественных заболеваний. Уровень смертности при этом значительно снизился в последнее два десятилетии, что является следствием появления новых высоко эффективных программ лечения.
Филиалы и отделения Центра, в которых лечат злокачественные заболевания кроветворной системы
ФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, химиотерапевтического и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.
Отдел лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующая отделом, д.м.н. ФАЛАЛЕЕВА Наталья Александровна
8 (484) 399 – 31-30, г. Обнинск, Калужской области
Отдел лекарственного лечения опухолей МНИОИ имени П.А. Герцена –филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий отделом, д.м.н. ФЕДЕНКО Александр Александрович
Кроветворение в организме человека это что
Лейкоциты. Общая характеристика элементов белой крови
Лейкоциты (греческое leukos – белый, kytos – вместилище) – одна из трех разновидностей форменных элементов крови позвоночных животных и человека.
Представление о лейкоцитах сформировалось более 100 лет назад одновременно с возникновением учения о крови и кроветворении, получило развитие в трудах Р. Вирхова (1955), И.И. Мечникова (1883), А.А. Максимова (1902), А.А. Заварзина (1945) и других отечественных и зарубежных исследователей.
Лейкоциты, в отличие от эритроцитов, это ядросодержащие клетки, структурная организация которых идентична другим клеткам нашего организма. Лейкоцитарная клетка ограничена цитоплазматической мембраной, в цитоплазме содержатся митохондрии, лизосомы с набором гидролитических ферментов и биологическиактивных соединений, имеется аппарат Гольджи, система эндоплазматического ретикулума, белоксинтезирующая система, представленная рибосомами и полирибосомами, и другие органоиды. Размеры лейкоцитов варьируют от 4 до 20 мкм. Продолжительность жизни также весьма вариабельна и составляет от 4–5 дней до 20 дней для элементов гранулоцито-моноцитарного ряда, а для лимфоцитов 100–200 дней. Количество лейкоцитов в периферической крови здорового взрослого человека колеблется от 4×10 9 /л до 9×10 9 /л.
Количество лейкоцитов у новорожденных уже в течение первых суток достигает 10×10 9 /л – 30×10 9 /л, а затем несколько уменьшается и со второй недели жизни составляет в среднем 10×10 9 /л – 12×10 9 /л. Однако следует отметить, что согласно данным многочисленных авторов содержание лейкоцитов в периферической крови в течение первых лет жизни, а по некоторым данным и до 10–15 лет, может быть значительно выше аналогичного показателя крови здорового взрослого человека (таблица).
Прежде чем остановиться на морфофункциональных особенностях отдельных видов лейкоцитов, необходимо рассмотреть гистогенез элементов белой крови в костном мозге, поскольку именно четкие представления о гистогенезе позволят не только хорошо усвоить вопросы физиологии белой крови, но и современные принципы классификации лейкозов, их гематологическую характеристику.
Как известно, лейкоциты позвоночных животных и человека образуются в специальных кроветворных органах: в период эмбрионального развития такими органами являются желточный мешок, печень, селезенка и костный мозг. Во взрослом организме лейкоциты образуются в костном мозге, а лимфоциты, кроме того, в селезенке, вилочковой железе и лимфатических узлах.
В костном мозге имеется две неравнозначные группы клеток: клетки ретикулярной стромы и клетки кроветворной ткани костного мозга с их производными – зрелыми клетками крови. К клеточным элементам ретиулярной стромы относят фибробласты, остеобласты, жировые клетки, эндотелиальные клетки. Указанные клетки объединяют собирательным названием «ретикулярные клетки».
Возрастная динамика количества лейкоцитов и лейкоцитарной формулы у детей
В настоящее время четко определена гистогенетическая независимость системы кроветворной стромы и кроветворных клеток. Ретикулярные клетки имеют самостоятельные стволовые клетки, способные дифференцироваться во все клеточные элементы.
Классификация лейкоцитов. Морфологические и функциональные особенности отдельных видов лейкоцитов
Существующая в настоящее время классификация лейкоцитарных элементов является морфофункциональной и отражает уровень современных знаний по физиологии лейкоцитов.
Все морфологически идентифицируемые лейкоцитарные элементы можно разделить на две группы с учетом одной из основных функциональных характеристик клеток – способности к делению. Так, различают две подгруппы клеток – пролиферирующих и утративших способность к пролиферации (сюда входят и лейкоциты, покинувшие органы кроветворения – циркулирующие в крови и перешедшие в ткани). Циркулирующие в кровотоке лейкоциты подразделяютя на два функциональных пула: а) свободно циркулирующие в крови, б) клетки, занимающие краевое положение в сосудах и не участвующие в циркуляции, – секвестрированные, или депонированные, лейкоциты.
С учетом морфологических особенностей (наличие зернистости и гранул) все лейкоцитарные элементы делятся на две большие группы: гранулоциты и агранулоциты.
Свойства лейкоцитов
1. Все виды лейкоцитов в большей или меньшей степени обладают способностью к амебовидному движению, что обеспечивает миграцию лейкоцитов в ткани через сосудистую стенку. Этот процесс называется диапедезом. Он определяет защитную функцию лейкоитов. 50 % лейкоцитов за пределами сосудистого русла находятся в межклеточном пространстве, а 30 % – в костном мозге.
2. Лейкоциты обладают положительным хемотаксисом по отношению к бактериальным токсинам, продуктам распада бактерий и дегенерирующим клеткам организма, комплексам антиген – антитело.
3. Одним из важных свойств лейкоцитов является способность к фагоцитозу и пиноциозу.
4. Лейкоциты обеспечивают механизмы резистентности за счет лизосомальных ферментов, в частности протеаз, пептидаз, диастазы, дезоксирибонуклеазы, липаз, поступающих в окружающие ткани при жировой дегенерации лейкоцитов. Бактерицидные свойства лейкоцитов обеспечиваются и освобождением лизоцима, катионных белков, лактоферрина, активных форм кислорода.
5. Лейкоциты являются регуляторами коагуляционного потенциала крови. Это свойство лейкоцитов обусловлено содержанием в них активаторов и проактиваторов плазминогена, а также наличием в лизосомах фибринолитическиактивных протеаз, которые могут расщеплять фибрин без участия плазминогена. Вышеуказанные факторы обеспечивают создание альтернативного механизма фибринолиза наряду с плазминовой фибринолитической системой, что играет важную роль в деблокировании сосудистого русла при ДВС-синдроме.
6. Лейкоциты участвуют в развитии синдрома системного воспалительного ответа, лихорадки, регуляции лейкопоэза за счет образования цитокинов с дистантным действием.
7. Лейкоциты обеспечивают индукцию и развитие специфических иммунологических механизмов защиты, а также аллергических реакций гуморального и клеточного типов.
Гемопоэз и его регуляция
Кровь является исключительнореактогенной системой, характеризующейся разнообразными изменениями клеточного состава, а также растворимых компонентов в ответ на действие патогенных факторов.
Система крови представляет собой производное мезенхимы и включает следующие основные компоненты: кровь и лимфу, органы кроветворения и иммунопоэза, а также клетки крови, эмигрирующие в соединительную ткань, и эпителиальные ткани. Естественно, чрезвычайно важная роль в регуляции гомеостаза периферической крови отводится органам кроветворения, в частности костному мозгу, где в условиях нормы имеют место сохранение динамического равновесия между процессами гемопоэза и распада клеток, а также определенная стадийность дифференцировки элементов миелоидного, лимфоидного, эритроцитарного и мегакариоцитарного рядов.
В процессе раннего эмбрионального периода жизни (около 2-х недель очаги системы гемостаза формируются в желточном мешке, где пролифирируют и дифференцируются участки мезенхимы, мезодермальных клеток).
Основными местами гемопоэза, начиная с 11-й недели гестации и прежде всего второго триместра, являются печень и селезенка. Гемопоэз смещается из печени и селезенки в мозговые полости костей лишь с 3-го триместра гестации и остается в этих структурах к моменту рождения ребенка. В течение юности и зрелого возраста места гемопоэза постепенно смещаются из трубчатых костей скелета в плоские кости (череп, позвонки, грудина, ребра, таз), которые становятся основными местами гемопоэза у взрослых людей.
Основные гемопоэтические факторы роста включают группы гормонов и цитокинов, продуцируемых в значительной мере стромальными клетками микроокружения.
В последние годы достигнуты определенные успехи в унификации представлений о характере и механизмах процессов гемопоэза в костном мозге, роли цитокинов в гистогенезе элементов крови.
Ежедневно у человека обновляется около 100 млрд форменных элементов периферической крови. В гемопоэтической ткани костного мозга гранулоциты и их предшественники составляют около 60 %, эритроидные предшественники – 20 %, лимфо- и моноциты – около 10 %, а недифференцированные и разрушающиеся клетки – также около 10 %.
Согласно унитарной теории кроветворения, сформулированной А.А. Максимовым, источником всех линий кроветворения в костном мозге являются «родоначальные клетки». Длительное время не существовало единой терминологии для их обозначения. В настоящее время используют термин «плюрипотентные стволовые клетки» (ППСК), трансформирующиеся в костном мозге в мультипотентные стволовые клетки.
Современная схема гемопоэза была разработана А.И. Воробьевым совместно с И.Л. Чертковым (1973), которая в основном используется в настоящее время с различными дополнениями и модификациями.
Кроветворная ткань является динамичной, постоянно обновляющейся системой, в связи с этим знание кинетики гемопоэза необходимо для понимания патогенеза заболеваний различной этиологии. Гемопоэтические клетки отличаются большим разнообразием структуры и функции, обеспечивающим в процессе их созревания самые различные биологические процессы, такие, как транспорт О2, гемостаз, фагоцитоз, иммунитет.
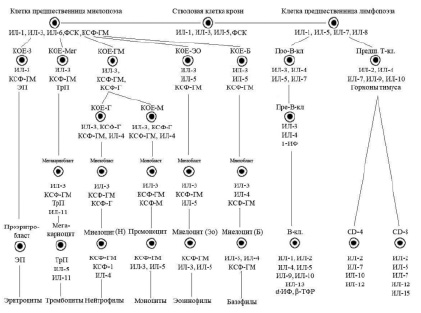
В настоящее время очевидно наличие шести классов дифференцировки клеток периферической крови (схема), причем первые два класса клеток включают плюрипотентные и мультипотентные клетки костного мозга, морфологически не распознаваемые элементы. К III классу относят коммитированные унипотентные клетки-предшественницы, к IV классу относятся бласты – ядросодержащие клетки эритроцитарного, лимфоидного, миелоидного и мегакариоцитарного рядов, V класс – это созревающие клетки. Часть клеток миелоидного ряда (юные и палочкоядерные) уже содержатся в периферической крови, а VI класс – это зрелые клетки крови и костного мозга.
Касаясь более детальной характеристики гемопоэтических клеток костного мозга, следует отметить, что ППСК, являющиеся источником образования клеток крови, составляют 0,01 % от всех ядросодержащих клеток костного мозга. Однако этого количества достаточно для восстановления гемопоэза в случаях аплазии и гипоплазии костного мозга. Ранее считалось, что клетки крови происходят из гемоцитобласта – производного гемогистиобласта.
ППСК – морфологически не распознаваемая клетка, условно относится к I классу кроветворения, маркерной молекулой этих клеток является CD34, экспрессируемая и эндотелиоцитами сосудов. ППСК относится к категории самоподдерживающихся клеток, способных к митотическому делению до 100 раз в течение своей жизни. Всего у человека примерно 4–400×105 стволовых клеток крови, некоторые из них выходят из костного мозга и обнаруживаются в крови.
Упрощенная схема регуляции кроветворения (Алмазов В.А., 1999): ФСК – фактор стволовой клетки, КОЕ – колониеобразующая единица, ИЛ – интелейкин, КСФ – колониестимулирующий фактор, ИФ – интерферон, ТФР – трансформирующий фактор роста, ЭП – эритропоэтин, ТрП – тромбопоэтин
Миграция стволовых клеток усиливается при нарушениях гомеостаза, в частности при гипоксиях, радиации, химиотерапии и других стрессорных воздествиях, находится под контролем хемокина CXCL-12, синтезируемого остеокластами, эндотелиальными клетками, клетками стромы. Регуляторами миграции стволовых клеток являются также КСФ-Г и ИЛ-1. Стволовые клетки в покоящемся состоянии выполняют две основные функции: 1) самоподдержание за счет низкого уровня пролиферативной активности; 2) дифференцировку в сторону образования коммитированных предшественников.
Дальнейшая дифференцировка ППСК обеспечивается различными специфическими и неспецифическими механизмами. Различают локальные и длиннодистантные механизмы регуляции. Локальные механизмы регуляции обеспечиваются за счет тканевого, микрососудистого, нервного компонентов и распространяются преимущественно на I и II классы клеток кроветворения в костном мозге. Тканевый компонент регуляции гемопоэза включает межклеточное взаимодействие, а также продукцию клетками соединительной ткани, моноцитарно-макрофагальной, мегакариоцитарной линий, эндотелием различных цитокинов с ростстимулирующим действием. Микрососудистый и нервный компоненты обеспечивают соответственно оксигенацию и трофику стромы и паренхиматозных элементов, а также выход в кровоток форменных элементов.
Начиная с коммитированных клеток костного мозга, в регуляции гемопоэза доминируют длиннодистантные механизмы, обеспечиваемые различными цитокинами, системой «кейлоны – антикейлоны», гормонами.
Касаясь динамики гемопоэза в костном мозге, следует отметить, что вслед за классом ППСК возникает образование мультипотентной полустволовой клетки, или клетки – предшественницы лимфопоэза, под влиянием фактора стволовой клетки (ФСК), ИЛ-1, ИЛ-6. Параллельно происходит образование из полипотентной стволовой клетки мультипотентной полустволовой клетки – предшественницы миелопоэза под влиянием ряда цитокинов: ФСК, ИЛ-1, ИЛ-3, ИЛ-6, КСФ-Г.
Третьим классом недифференцированных клеток гемопоэза костного мозга являются коммитированные, или унипотентные, клетки. Для лимфоидного ряда – это про-Т- и про-В-лимфоциты, а для миелоидного ряда – это колониеобразующие клетки эозинофильного и базофильного рядов (КОЕ-Эо, КОЕ-Б), нейтрофильного ряда (КОЕ-Г), моноцитарного ряда (КОЕ-М), а также эритроцитарного (КОЕ-Э) и мегакариоцитарного (КОЕ-Мег) рядов.
Гемопоэтические клетки III класса – короткоживущие, интенсивно пролиферирующие, идентифицируемые клетки. Регуляторами их пролиферации и дифференцировки являются цитокины и «специфические» гемопоэтины.
Последними пролиферирующими клетками гемопоэтического ряда являются клетки IV класса – бласты – морфологически и гистохимически распознаваемые элементы (миелобласты, лимфобласты, монобласты, эритробласты). V класс дифференцировки включает созревающие клеточные элементы (для миелоидного ряда это промиелоцит, миелоцит, метамиелоцит, палочкоядерные лейкоциты; для лимфоидного ряда – пре- и про-В- и Т-лимфоциты, протоплазмоциты; для эритроцитарного ряда – пронормоцит, базофильный, полихроматофильный, оксифильный нормоцит, ретикулоцит.
VI класс включает в себя зрелые клетки костного мозга и периферической крови.
Касаясь кинетики гемопоэза, следует отметить, что для делящихся клеток-предшественниц митотический цикл, помимо митоза, включает фазу G1, во время которой происходит подготовка гемопоэтических клеток к синтезу ДНК, а далее S-фазу, характеризующуюся удвоением количества ДНК, и фазу G2, включающую период подготовки к митотическому делению. Продолжительность митотического цикла для морфологическинераспознаваемых клеток-предшественников составляет в среднем около 20 часов.
Относительно регуляции гемопоэза необходимо отметить по крайней мере два его варианта – конститутивный и индуцированный гемопоэз. Конститутивный гемопоэз регулируется цитокинами и межклеточным взаимодействием, а осуществляется в особых зонах скопления стволовых клеток. Часть стволовых клеток, медленно размножаясь, мигрирует в другие зоны костного мозга, где и дифференцируется.
Индуцированный гемопоэз возможен при нарушениях гомеостаза при различных стрессорных воздействиях (гипоксия, интоксикация, ионизирующая радиация) и регулируется в основном КСФ-Г, ИЛ-1, ФСК.
Согласно данным литературы, важнейшими стимуляторами пролиферации и дифференцировки клеток гранулоцитарного и моноцитарного рядов оказываются колониестимулирующие факторы (КСФ). Последние являются пептидами, продуцируемыми у человека моноцитарно-макрофагальными клетками крови различных тканей, в частности костного мозга, а также лимфоцитами, эндотелиальными клетками, фибробластами, тучными клетками на фоне антигенной стимуляции. Наиболее изучены мульти-КСФ (ИЛ-3), гранулоцитарно-макрофагальный КСФ (КСФ-ГМ), макрофагальный КСФ (КСФ-М), гранулоцитарный КСФ (КСФ-Г). Усиление лейкопоэза возникает под влиянием провоспалительных цитокинов: ИЛ-1, ИЛ-6, ИЛ-8, а также под влиянием ряда медиаторов воспаления, в частности лейкотриенов В4, С4, ФСК, вырабатываемого клетками микроокружения стволовых клеток. Универсальными стимуляторами гранулоцитарно-моноцитарного лейкопоэза являются гормоны адаптации: катехоламины, глюкокортикоиды, реализующие свои эффекты на костный мозг через усиление образования КСФ и интерлейкинов. К числу стимуляторов лейкопоэза относятся витамин В12, аскорбиновая кислота, фолиевая кислота, железо. Подавление костно-мозгового кроветворения возможно под влиянием ряда медиаторов воспаления, таких, как простагландины Е1, Е2, ИЛ-10, ИЛ-13, ФНО-α, трансформирующий фактор роста бета (ТФР-β), а также лактоферрина и кислого изоферритина.
Регуляция пролиферации и дифференцировки лимфоцитов находится под влиянием цитокинов, интенсивно образующихся на фоне воздействия различных антигенов инфекционной и неинфекционной природы лимфоцитами и моноцитами, в частности ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-7, бластогенного и митогенного факторов. Классическими ингибиторами лимфопоэза являются гормоны адаптации: АКТГ, глюкокортикоиды, индуцирующие развитие реакции апоптоза и цитолиза в лимфоидной ткани.
В настоящее время очевидна определяющая роль цитокинов в регуляции костно-мозгового кроветворения, в частности ФСК, КСФ-Г, КСФ-М, КСФ-ГМ, а также ИЛ-3 или мульти-КСФ, регулирующих дифференцировку и созревание практически всех ростков кроветворения. К настоящему моменту для многих цитокинов определены структура и биологические свойства.
Далее приведены особенности биологических эффектов некоторых из указанных цитокинов, влияющих на процессы роста и дифференцировки гемопоэтических клеток костного мозга.
Фактор стволовых клеток (ФСК). ФСК – ростовой фактор для гемопоэтических стволовых клеток, образование которого детерминируется геном 12-й хромосомы (q22-q24). Биологическая активность ФСК проявляется в виде растворимой и мембранно-связанной форм. Трансмембранный белок состоит из 273 аминокислотных остатков, растворимая форма представлена нековалентно-связанным димером.
Рецептор ФСК, c-kit, обозначается как CD117, его связывание с ФСК приводит через ряд промежуточных реакций к активации протеинкиназы С и yak2/STAT пути клеточной активации [20]. ФСК интенсивно синтезируется в разных тканях плода, а в постнатальном периоде в фибробластах, эндотелиоцитах, недифференцированных стромальных клетках.
В организме человека ФСК оказывает интенсивное стимулирующее влияние на тучные клетки, пролиферацию предшественников Т- и В-лимфоцитов, интраэпителиальных γδ-лимфоцитов.
ФСК стимулирует CD34+ стволовые клетки человека и в сочетании с ИЛ-3, КСФ-Г, КСФ-ГМ усиливает формирование гранулоцитарно-макрофогальных и эритроцитарных колоний, предшественников тучных клеток.
Fit-3-лиганд. Другим стимулятором гемопоэза в костном мозге является Fit-3-лиганд, взаимодействующий с тирозинкиназными рецепторами. Подобно ФСК и КСФ-М, Fit-3-лиганд продуцируется стромальными клетками, клетками эндотелия и Т-лимфоцитами, а его рецептор экспрессируется на ранних гемопоэтических клетках – предшественницах миеломоноцитарного ряда и на пре-В-лимфоцитах.
Эффекты fit-3-лиганда на костно-мозговые клетки усиливаются цитокинами ИЛ-3 и КСФ-ГМ. Комбинация ФСК и Fit-3-лиганда значительно усиливает пролиферацию костно-мозговых стволовых клеток. Рекомбинантный fit-3-лиганд стимулирует пролиферацию CD34+ стволовых клеток костного мозга человека, а также ранних гемопоэтических клеток-предшественниц. Однако его эффекты слабее, чем у ФСК-ГМ.
Гранулоцитарный колониестимулирующий фактор (КСФ-Г). Образование КСФ-Г детерминируется геном хромосомы 17 у человека (С17, q11-q21). Зрелый цитокин имеет глобулярную структуру с ММ 18,6 кДа, синтезируется моноцитами, фибробластами, эндотелием, стромальными клетками, а далее поступает в системный кровоток и в костный мозг. Рецепторы цитокина экспрессируются на клетках миеломоноцитарного ростка кроветворения от миелобластов до зрелых гранулоцитов, а также на некоторых клетках моноцитарного ростка. Продукция КСФ-Г стимулируется вовлечением провоспалительных цитокинов ИЛ-1, ФНО, бактериальных эндотоксинов. Биологическое действие КСФ-Г связано с ускорением пролиферации и созревания ранних предшественников гранулоцитов, усилением фагоцитарной активности нейтрофилов, их кислородзависимого киллинга и антителонезависимой цитотоксичности, продукцией зрелыми нейтрофилами ИЛ-8 и активацией хемотаксиса под влиянием ИЛ-8.
КСФ-Г после стимулирующего влияния на гемопоэз в условиях воспаления, инфекции, оказывает активирующее влияние на продукцию ИЛ-4, ИЛ-10, стимулирует Th2, усиливает гуморальное звено иммунитета, обеспечивает антибактериальную защиту организма.
Макрофагальный колониестимулирующий фактор (КСФ-М). Макрофагальный колониестимулирующий фактор КСФ-М продуцируется стромальными клетками костного мозга, фибробластами, моноцитами, макрофагами, гепатоцитами, эндотелием, гладкомышечными клетками. КСФ-М кодируется геном, расположенным на коротком плече первой хромосомы в зоне р13-р21, а также на 5-й хромосоме(CD q33). Мономер КСФ-М состоит из 256 аминокислот, существует в виде растворимой и мембранно-связанной формы. КСФ-М увеличивает экспрессию антигенов МНС II на макрофагах, усиливает их цитотоксичность.
Рецепторы M-CSF относятся к семейству рецепторов ростовых факторов, кодируются протоонкогеном c-fmg, экспрессируются на всех клетках моноцитарного ряда, гладкомышечных клетках и на трофобласте.
Ген КСФ-М во многих клетках экспрессируется конститутивно, усиление синтеза цитокина возникает под влиянием ИЛ-10, ФНО-α, КСФ-ГМ, прогестероном, ИЛ-4.
КСФ-М стимулирует пролиферацию, дифференцировку клеток – предшественниц моноцитарного ряда, вызывает развитие моноцитоза, тромбоцитопении, иногда нейтропении, повышает противоопухолевую антителозависимую цитотоксичность моноцитов и антибактериальную активность клеток моноцитарно-макрофагального ряда.
Гранулоцитарно-макрофагальный колониестимулирующий фактор (КСФ-ГМ). КСФ-ГМ – ростовой фактор, он синтезируется в условиях нормы в незначительных количествах, а при воспалении различного генеза интенсивность синтеза возрастает под влиянием бактериальных эндотоксинов, провоспалительных цитокинов.
Зрелый КСФ-ГМ имеет ММ 14,5 кДа, состоит из 127 аминокислотных остатков. Интенсивное гликозилирование КСФ-ГМ в процессе синтеза приводит к увеличению его ММ и синтетической биологической активности.
Рецепторы КСФ-ГМ обладают высокой аффинностью связывания лиганда.
После связывания КСФ-ГМ с рецепторами активируется МАР-киназа, Scr-киназа и фосфатидилинозитол-3-зависимая киназа, киназа Jak-2.
Биологическая активность КСФ-ГМ направлена на стимуляцию и дифференцировку миеломоноцитарных предшественников гемопоэза, колоний мегакариоцитов, а также на усиление функциональной активности нейтрофилов, эозинофилов, моноцитов за счет стимуляции хемотаксиса, адгезии, продукции активных форм кислорода.
КСФ-ГМ вызвает усиление антигенпрезентирующей функции моноцитов, цитотоксичности моноцитов в отношении опухолевых клеток.