Кровоток низкорезистентный что это
Допплеросонография периферических сосудов. Часть I (опыт применения УЗИ сканеров фирмы «Медисон» в скрининговых исследованиях)
Введение
В современной функциональной диагностике для исследования сосудов все шире применяются ультразвуковые методики. Это связано с ее относительно низкой стоимостью, простотой, неинвазивностью и безопасностью исследования для больного при достаточно высокой информативности по сравнению с традиционными рентген-ангиографическими методиками. Последние модели ультразвуковых сканеров фирмы MEDISON позволяют провести высококачественное обследование сосудов, с успехом диагностировать уровень и протяженность окклюзирующих поражений, выявлять аневризмы, деформации, гипо- и аплазии, шунты, клапанную недостаточность вен и другую патологию сосудов.
Для проведения сосудистых исследований необходим УЗ-сканер, работающий в дуплексном и триплексном режимах, набор датчиков (таблица 1) и пакет программ для сосудистых исследований.
Исследования, приведенные в данном материале, проведены на ультразвуковом сканере SA-8800 «Digital GAIA» (фирма «Medison» Ю. Корея) во время скрининга среди пациентов, направленных на УЗ-обследование других органов.
Технология УЗИ сосудов
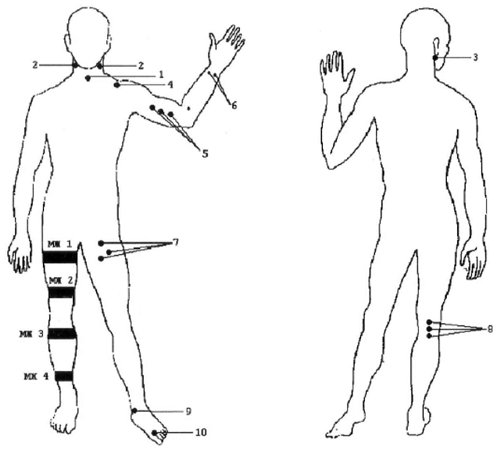
Датчик устанавливают в типичной области прохождения исследуемого сосуда (рис. 1).
Рис. 1. Стандартные доступы при допплеросонографии периферических сосудов. Уровни наложения компрессионных манжет при измерении регионального САД.
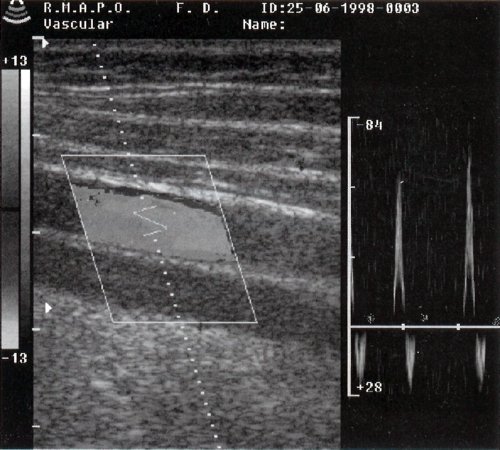
Для уточнения топографии сосудов проводят сканирование в плоскости, перпендикулярной анатомическому ходу сосуда. При поперечном сканировании определяют взаиморасположение сосудов, их диаметр, толщину и плотность стенок, состояние периваскулярных тканей. Воспользовавшись функцией и обведя внутренний контур сосуда, получают площадь его эффективного поперечного сечения. Далее производят поперечное сканирование вдоль исследуемого сегмента сосуда для поиска участков стенозирования. При выявлении стенозов используют программу для получения расчетного показателя стеноза. Затем проводят продольное сканирование сосуда, оценивая его ход, диаметр, внутренний контур и плотность стенок, их эластичность, активность пульсации (с использованием М-режима), состояние просвета сосуда. Измеряют толщину комплекса интима-медиа (по дальней стенке). Проводят допплеровское исследование в нескольких участках, перемещая датчик вдоль плоскости сканирования и осматривая возможно больший участок сосуда.
Оптимальной является следующая схема допплеровского исследования сосудов:
Расчет скоростных характеристик потоков в режиме импульсной допплерографии возможен при скорости потока не более 1-1,5 м/сек (Nyquist limit). Для получения более точного представления о распределении скоростей необходимо установить контрольный объем не менее 2/3 просвета исследуемого сосуда. Используются программы при исследовании сосудов конечностей и при исследовании сосудов шеи. Работая в программе, отмечают название соответствующего сосуда, фиксируют значения максимальной систолической и минимальной диастолической скоростей, после чего производят обводку одного комплекса. После проведения всех этих измерений можно получить отчет, включающий значения V max, V min, V mean, PI, RI для всех обследованных сосудов.
Количественные допплеросонографические параметры артериального кровотока
PI, RI важно использовать вместе, т.к. они отражают разные свойства кровотока в артерии. Использование лишь одного из них без учета другого может быть причиной диагностических ошибок.
Качественная оценка допплеровского спектра
Выделяют ламинарный, турбулентный и смешанный типы потока.
Турбулентный тип кровотока характерен для мест стеноза или неполных окклюзий сосуда и характеризуется отсутствием «спектрального окна» на допплерограмме. При ЦДК выявляется мозаичность окрашивания, в связи с движением частиц в разных направлениях.
Смешанный тип кровотока может в норме определяться в местах физиологических сужений сосуда, бифуркациях артерий. Характеризуется наличием небольших зон турбулентности при ламинарном потоке. При ЦДК выявляется точечная мозаичность потока в области бифуркации или сужения.
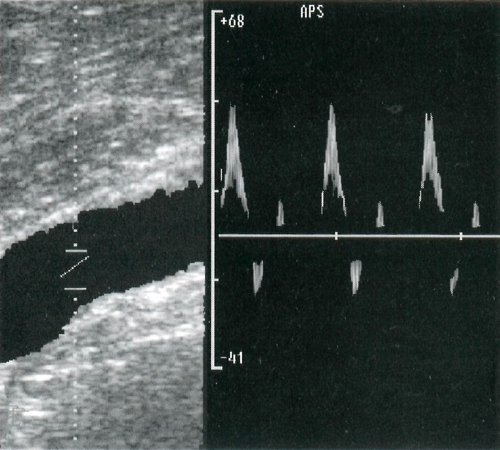
В периферических артериях конечностей выделяют также следующие типы кровотока на основании анализа огибающей кривой допплеровского спектра.
Коллатеральный тип кровотока также регистрируется ниже места окклюзии. Он проявляется близкой к монофазной кривой со значительным изменением систолического и отсутствием ретроградного и второго антеградного пиков (рис. 2в).
Рис. 3. Отличие огибающих допплерограмм НСА (а) и ВСА (б).
Рис. 4. Варианты магистрального типа кровотока в артерии. Продольное сканирование. ЦДК. Допплерография в импульсном режиме.
Исследование сосудов шеи
Датчик устанавливают поочередно на каждой стороне шеи в области грудино-ключично-сосцевидной мышцы в проекции общей сонной артерии. При этом визуализируются общие сонные артерии, их бифуркации, внутренние яремные вены. Оценивают контур артерий, их внутренний просвет, измеряют и сравнивают диаметр с обеих сторон на одном уровне. Чтобы отличить внутреннюю сонную артерию (ВСА) от наружной (НСА), используют следующие признаки:
При исследовании позвоночных артерий датчик ставят под углом 90° к горизонтальной оси, либо непосредственно над поперечными отростками в горизонтальной плоскости.
По программе Carotid рассчитывают Vmax (Vpeak), Vmin (Ved), Vmean (TAV), PI, RI. Сравнивают показатели, полученные с противоположных сторон.
Исследование сосудов верхних конечностей
Исследование вен нижних конечностей. Проводится одновременно с исследованием одноименных артерий либо как самостоятельное исследование.
Исследование бедренной вены проводится в положении больного на спине с несколько разведенными и ротированными кнаружи ногами. Датчик устанавливается в области паховой складки параллельно ей. Получают поперечный срез бедренного пучка, находят бедренную вену, которая располагается медиальнее одноименной артерии. Оценивают контур стенок вены, просвет ее, записывают допплерограмму. Развернув датчик, получают продольный срез вены. Проводят сканирование вдоль вены, оценивают контур стенок, просвет сосуда, наличие клапанов. Записывают допплерограмму. Оценивают форму кривой, ее синхронизацию с дыханием. Проводят дыхательную пробу: глубокий вдох, на задержке дыхания с натуживанием в течение 5 секунд. Определяют функцию клапанного аппарата: наличие расширения вены во время выполнения пробы ниже уровня клапана и ретроградной волны. При выявлении ретроградной волны измеряют ее продолжительность и максимальную скорость. Проводят исследование глубокой вены бедра по аналогичной методике, установив при допплерографии контрольный объем за клапан вены.
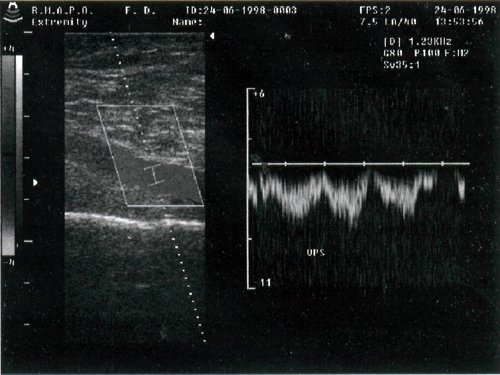
Исследование подколенных вен проводится в положении больного на животе. Для усиления самостоятельного кровотока по вене и облегчения получения допплерограммы пациенту предлагают опереться выпрямленными большими пальцами стоп в кушетку. Датчик устанавливают в области подколенной ямки. Проводят поперечное сканирование для определения топографических взаимоотношений сосудов. Записывают допплерограмму и оценивают форму кривой. Если кровоток в вене слабый, проводят компрессию голени, при этом выявляется усиление кровотока по вене. При продольном сканировании сосуда обращают внимание на контур стенок, просвет сосуда, наличие клапанов (обычно можно выявить 1-2 клапана) (рис. 5).
Рис. 5. Исследование кровотока в вене с использованием ЦДК и допплерографии в импульсном режиме.
Проводят пробу с проксимальной компрессией для выявления ретроградной волны. После получения устойчивого спектра сдавливают нижнюю треть бедра на 5 секунд для выявления ретроградного тока. Исследование подкожных вен проводится высокочастотным (7,5-10,0 МГц) датчиком по вышеописанной схеме, предварительно установив датчик в проекции этих вен. Важно проводить сканирование через «гелевую подушку», удерживая датчик над кожей, так как даже небольшого давления на эти вены достаточно для того, чтобы редуцировать в них кровоток.
Магнитно-резонансная томография (МРТ) в Санкт-Петербурге
Запишитесь на МРТ по телефону (812) 493-39-22 или заполните форму
Расписание приема МРТ:
ЦМРТ «Нарвский»
(812) 493-39-22
в четверг прием с 8-00 до 23-00
и воскресенье прием с 8-00 до 23-00
ул. Ивана Черных,29
МРТ аппарат 1,5 Тл
суббота :
ЦМРТ «Старая деревня»
(812) 493-39-22
прием 8-00 до 23-00
ул. Дибуновская,45
МРТ аппарат 1,5 Тл
Прием в “РНХИ им. проф. А.Л. Поленова” прекращен по техническим причинам и
перенесен в ЦМРТ
Ультразвуковая диагностика в онкогинекологии
Современные возможности УЗ диагностики в онкоурологии можно читать на нашем другом сайте. Далее мы продолжим тему УЗ диагностики в онкогинекологии.
Ультразвуковая диагностика рака тела матки
Согласно мировой статистике, рак тела матки занимает 7-е место среди злокачественных заболеваний, составляя 1-2% от всех причин смерти от злокачественных новообразований. Заболеваемость раком эндометрия в возрастном интервале от 40 до 54 лет резко увеличивается. Пик заболеваемости приходится на возраст 60-64 года. Частота распространения рака и ее динамика в разных странах, с учетом влияния миграционных процессов и возраста указывают на специфические особенности заболевания и на зависимость его возникновения от комплекса причин эндогенной и экзогенной природы. В странах Северной Америки и Европы данное заболевание встречается значительно чаще, являясь наиболее распространенной злокачественной опухолью женской половой системы, и занимает 4-е место среди всех злокачественных новообразований после рака молочной железы, легких и толстой кишки. В развивающихся странах риск возникновения рака тела матки в целом ниже, но уровень смертности при этом остается высоким. Анализ онкологической ситуации последнего десятилетия в России свидетельствует о неуклонном росте заболеваемости раком эндометрия, которая к 2007 году заняла второе место среди всех злокачественных опухолей у женщин. Доля рака тела матки в структуре заболеваемости злокачественными новообразованиями на 100000 женского населения России в различных регионах колеблется от 4,5 до 22,5. Прослеживается неуклонное возрастание частоты заболеваемости с 9,8 в 1990г. до 13,9 в 2005г., что соответствует третьему месту по величине показателей прироста злокачественными новообразованиями. На сегодняшний день, увеличение числа впервые выявленных случаев рака тела матки не уступает таковому при опухоли молочной железы.
Среди факторов риска, развития рака тела матки обращают на себя внимание малое число родов или бесплодие, ожирение, поздняя менопауза, сахарный диабет. В большинстве случаев риск развития рака ассоциируется с различными формами гиперплазий эндометрия – 75%, дисфункцией на фоне поликистоза яичников – 15%, полипозом эндометрия – 7%; миомой матки – в 3%. В последнее время отмечается существенное увеличение местно-распространенных форм рака эндометрия, что связано с неэффективными мероприятиями первичной диагностики.
В патогенезе заболевания ведущее значение имеет теория избыточной эстрогенной стимуляции эндометрия, сочетающейся с недостаточностью прогестерона. Повышенное количество эстрогенов может приводить к гиперплазии эндометрия, которая, способна прогрессировать в атипический вариант и в 20-25% случаев к переходу в аденокарциному. В то же время, существующая зависимость между степенью пролиферации эндометрия и концентрацией эстрогенов в крови отмечается до определенного, порогового значения и даже интенсивная пролиферация не во всех случаях сопровождается злокачественной его трансформацией. Обнаруженная корреляция между содержанием эстрогенов и повреждением ДНК в нормальном и малигнизированном эндометрии, заставляет обращать больше внимания на роль молекулярно-генетических и морфологических факторов при формировании различных типов рака тела матки. Основное значение в диагностике придается морфологической верификации патологического процесса. Рак эндометрия характеризуется гетерогенной природой, что проявляется как на уровне факторов риска, так и его патогенеза, чем определяются особенности формирования групп риска для данного заболевания. В профилактике и лечении рака эндометрия важнейшее значение имеет своевременное выявление предраковых заболеваний и точное стадирование патологического процесса. Расширенная экстирпация матки является основным методом лечения рака эндометрия. В тех случаях, когда проведение радикального хирургического лечения не представляется возможным, применяют паллиативную комплексную химиолучевую терапию, используя различные комбинации и схемы лечения. До сих пор отсутствует единство мнений в оценке возможных патологических изменений эндометрия, их прогностической значимости и тактике лечения. Проблема адекватного и эффективного лечения рака эндометрия определяется знанием основных параметров опухолевого процесса.
Одним из основных принципов, используемых в диагностике раннего инвазивного рака эндометрия, является существующая концепция о возможных трех типах роста опухоли.
III тип – развитие одного опухолевого очага на фоне атрофичной слизистой оболочки.
При первом и втором типе, как правило, определяется высокодифференцированная, а при третьем типе низко- или умеренно-дифференцированная аденокарцинома. Макроморфологические различия в типах роста рака эндометрия по мере прогрессирования местного распространения опухоли стираются.
Внедрение УЗИ в программы по ранней диагностике гинекологических заболеваний принципиально изменило ситуацию в выявлении рака эндометрия, так как практически исключило необходимость тотального диагностического выскабливания при появлении маточных кровотечений у женщин в пери- и особенно постменопаузе. Высокая информативность, неинвазивность, простота выполнения и возможность применения в массовых скрининговых осмотрах сделали УЗИ универсальным для диагностики заболеваний тела матки и патологии эндометрия. Вариабельность получаемого ультразвукового изображения злокачественной опухоли эндометрия обусловлена ее размерами и степенью дифференцировки. Многочисленными исследованиями установлено, что при размере М-ЭХО до 15мм структура эндометрия определяется, как и в норме гиперэхогенной, а с увеличением его размера до 20мм и более она становится гетерогенной, при этом визуализируются беспорядочные отражения как повышенной, так средне и пониженной интенсивности ультразвукового сигнала. При размерах более 30мм преобладает изоэхогенная и смешанная структура опухоли. Прослеживается определенная зависимость характера ультразвукового изображения злокачественной опухоли эндометрия от ее морфологического типа. Для высоко- умереннодифференцированной аденокарциномы характерна гиперэхогенная структура опухоли, в то время как для низкодифференцированного рака специфичны отражения средней и пониженной интенсивности и неоднородная или смешанная его структура. Основными эхографическими признаками инвазивного роста опухоли считаются нарушение целостности гипоэхогенного ободка по периферии слизистой, резкое истончение и исчезновение нормального изображения ткани миометрия. Точное определение степени злокачественной инвазии опухоли при использовании УЗИ, представляет достаточно сложную задачу, так как отсутствуют четкие ультразвуковые признаки инвазивного роста рака эндометрия в миометрий. Большое значение при этом имеет детальная характеристика структуры первичной опухоли и прилежащей к ней слизистой оболочки, а также линейные и объемные параметры новообразования. Характерно, что в случаях микроинвазивной карциномы эндометрия процесс ограничивается хорошо визуализируемой демаркационной линией. Однако, существенные трудности УЗИ, как и других лучевых методов исследования, связаны ограниченными их возможностями в определении начальных этапов прогрессирования заболевания. Решение этой задачи требует сравнительной оценки толщины маточной стенки, как в зоне опухоли, так и вне зоны локализации первичного очага, для этого необходимо использовать оптимальный угол томографического среза. Дополнительно в диагностических целях выполняют допплерометрию сосудов малого таза, при котором могут быть получены характерные кривые скоростей кровотока наружной, внутренней подвздошной и маточных артерий. Установлено, что при раке тела матки регистрируется низкорезистентный в сравнении с нормой или другой патологией эндометрия опухолевый кровоток. Для проведения допплерометрии в сосудах малого таза трансвагинальный доступ имеет ряд преимуществ по сравнению с трансабдоминальным за счет более близкого расположения датчика. В последние годы выделен целый ряд новых важных диагностических критериев, которые используются в оценке характеристики опухолевого роста, коррелируют с течением и прогнозом заболевания и уже активно используются на всех этапах выбора лечебных мероприятий.
Ультразвуковая диагностика рака шейки матки
Рак шейки матки занимает у женщин 3-е место по частоте возникновения после рака яичников и молочной железы. В России в последние годы заболеваемость составляет 10,8 на 100000 женского населения. Ежегодно в Санкт-Петербурге регистрируется около 350 новых случаев. На долю впервые выявленного рака I-II стадии приходится 56,4% случаев, а III стадии 29,3% новообразований этой локализации. Изучение материалов последних лет о заболеваемости и смертности позволяет констатировать возросшую частоту гинекологического рака у женщин молодого возраста. Отмечается связь между частотой рака шейки матки и такими факторами, как ранее начало менструаций и половой жизни, неустойчивый брак, беременности и роды, разрывы шейки матки, предшествующие воспаления. Разный уровень заболеваемости в странах с различным экономическим развитием, связь с миграцией населения отражают непосредственное воздействие основных факторов риска. В этиологии рака шейки матки значительная роль отводится папилломавирусной инфекции передаваемой половым путем. Известно, что около 95% случаев рак шейки матки вызывается онкогенными типами Т-пилломавирусов (НРV) 16, 18, 31, 33, 35 и др. серотипов, то есть генотипами вирусов папилломы человека, часто в синергизме с вирусом простого герпеса. Международное агентство по исследованию рака официально объявило HPV 16-го и 18-го типов канцерогенными факторами, а 31-го, 33-го и 35-го типов возможными канцерогенами. Длительная персистенция папилломавирусов в цервикальном эпителии сопровождается его интеграцией в геном и появлением мутаций. При таких условиях полный процесс малигнизации может пройти за 5-6 лет и таким образом наблюдаться у женщин молодого возраста. Достижения в изучении этиологии рака шейки матки, улучшение стратегии и тактики цитологического скрининга, усовершенствование хирургического, лучевого и комбинированного лечения позволили добиться стабильных и достаточно высоких показателей пятилетней выживаемости у этой категории больных. Однако статистические данные свидетельствуют, что более 40% женщин с инвазивным раком этой локализации умирают от прогрессирования заболевания в течение первых пяти лет с момента установления диагноза.
Первостепенное значение в диагностике рака шейки матки имеют: инструментальный осмотр шейки матки в зеркалах, влагалищное исследование, а также цитологические и гистологические методы исследования. При обследовании внутренних половых органов у женщин широко используется метод УЗД. Повсеместно применяемые методики трансабдоминального и трансвагинального УЗИ обладают малой чувствительностью в выявлении опухолей шейки матки с экзофитной и смешанной формой роста. В ряде случаев это связано с небольшой разницей в акустическом импедансе между опухолью, тканью шейки матки и окружающими органами. В последние годы возможности УЗИ расширились благодаря внедрению ультразвуковых аппаратов, основанных на дигитальной технике и новых допплерографических методик с трехмерной реконструкцией изображения. Возможность получать изображения с высокой тканевой специфичностью обеспечили приоритет УЗИ среди других методов визуализации у больных раком шейки матки, в том числе, при мониторинге в процессе проводимого лечения. Внедрение новейших методик УЗИ дает возможность определять истинные размеры и объем шейки матки, оценивать её внутреннюю эхоструктуру, что повышает точность исследования, особенно при изоэхогенных и инфильтративных формах рака или опухолях смешанной эхогенности. Наиболее перспективной методикой визуализации сосудистой системы органов малого таза является УЗ-ангиография, которая обеспечивает точное определение степени васкуляризации шейки матки и патологически измененных тканей.
Наиболее ранними ультрасонографическими признаками злокачественного перерождения ткани шейки матки, являются очаговые или диффузные изменения ее эхоструктуры. В большинстве случаев наблюдается увеличение объема, снижение акустической плотности или появление гипоэхогенных участков, расположенных преимущественно в центральной части шейки матки. При УЗИ характерным является отсутствие четких границ между различными по форме и размерам участками с измененной эхоструктурой, которые чаще имеют пониженную акустическую сопротивляемость и её стромой. При этом в целом ряде случаев при II-III стадиях заболевания опухоли шейки матки обладают изоэхогенными свойствами и при УЗИ по эхоструктуре практически неотличимы от нормальной ткани. При отсутствии изменений акустической сопротивляемости опухоли сонографическими критериями рака шейки матки могут служить ассиметричная деформация шейки и изменения стенок влагалища. Диагноз заболевания может быть подтвержден по увеличению объема шейки матки или косвенным признакам ракового её поражения. При III-IV стадиях заболевания, как правило, отчетливо не дифференцируется капсула, которая в начальных стадиях характеризуется утолщением и нечеткостью контура. Для оценки структуры шейки матки и выявления повреждения её капсулы предпочтительней использовать трансректальный доступ. Выполненное исследование в этих случаях также обеспечивает и детальное изображение нижних отделов мочевого пузыря, стенка которого также может быть деформирована за счет опухолевого процесса. При значительных размерах опухоли и распространении при УЗИ определяются инфильтраты в параметральной клетчатке и нижних отделах полости малого таза, визуализируемые как гипоэхогенные патологические образования без четких контуров. При прогрессировании заболевания и прорастании рака шейки матки в окружающие органы, могут не дифференцироваться стенки влагалища или прямой кишки. Распространение опухоли на стенки матки на первом этапе характеризуется изменениями эхоструктуры миометрия. В дальнейшем присоединяется неравномерное утолщение стенок матки с понижением их эхогенности. В случаях прогрессирования заболевания УЗ-методом определяют метастатические изменения в увеличенных региональных лимфатических узлах.
Ультразвуковая диагностика рака яичников
Рак яичника является 9-й по частоте злокачественной опухолью среди женского населения и занимает 5-е место как причина смерти женщин. В Европе рак яичника находится на первом месте среди опухолей женских гениталий, а ежегодное число новых случаев превышает 42700. Наиболее высока заболеваемость в северных регионах Канады (19,9), Австрии (15,1), Дании (14,1). В США ежегодно выявляются около 21550 первичных случаев рака яичника и 14600 летальных исходов от этого заболевания. Заболеваемость раком яичника в России составляет 9,9. В Санкт-Петербурге с 1980 г. заболеваемость раком яичника находится на уровне 10,8 — 12,2 на 100 000. женского населения. Средний возраст больных раком яичника — 63 года. Частота случаев увеличивается с возрастом и достигает максимума на восьмом десятке жизни. К особенностям течения рака яичника относится: скрытое течение заболевания, агрессивное течение, короткий период удвоения опухоли, универсальный характер метастазирования и многообразие гистологических форм опухолей. До 2/3 случаев рака яичника выявляются на поздних стадиях заболевания по причине трудности диагностики. Пятилетняя выживаемость больных раком яичника не превышает 30-35%. Рак яичника отличается от вышеописанных гинекологических локализаций более высокими показателями смертности. Показатель смертности в Европе составляет 12 случаев на 100000.
К факторам риска развития рака яичника относятся: ожирение, использование пудры из талька и некоторых препаратов для лечения бесплодия, раннее наступление менархе и позднее наступление менопаузы. Среди злокачественных новообразований женских половых органов РЯ считается одним из самых фатальных заболеваний, ввиду отсутствия клинической манифестации на ранних стадиях и высокого риска рецидивов и метастазов на фоне проводимого лечения. Своевременная диагностика и терапия РЯ и его рецидивов способствует увеличению продолжительности жизни больных, существенно улучшает ее качество. В этиологии РЯ доминирующую роль занимают генные повреждения: активация онкогена K-ras, выявление мутаций в котором может служить для дифференциальной диагностики муцинозного рака, супрессорный ген р53 может служить прогностическим фактором рака яичника, гены BRCA1 и BRCA2, MSH2 и MLH1 встречаются в 10% случаев эпителиальных опухолей яичника. Для РЯ риска развития заболевания при наличии мутации гена BRCA1 от 26% до 54%, и от 10% до 23% при мутации BRCA2. Перспективным является применение методик молекулярной онкологии с целью ранней диагностики или выявления риска развития заболевания. Современная диагностика РЯ и рецидивов основывается на клинической картине, бимануальном, ректовагинальном исследованиях, ультразвуковом, рентгенологических исследованиях, определении опухолевоассоциированного маркера СА-125.
УЗИ повсеместно используется как важный дополнительный метод исследования в онкогинекологии. Преимуществом сонографии является возможность обнаружения непальпируемых образований, которые обычно не определяются при клиническом осмотре и при использовании других методов диагностики. Внедрение внутриполостной эхографии с применением современных допплеровских методик, широко используются в первичной диагностике, диагностике рецидивов и метастазов. Следует отметить, что своевременная и качественная диагностическая интерпретация данных при дифференциальной диагностике РЯ способствует улучшению результатов лечения и прогнозу течения заболевания.
При первичном обследовании, только на основании ультразвуковой картины выявленного новообразования яичника уже с большой вероятностью можно предсказать доброкачественную или злокачественную его природу. В настоящее время наиболее распространенным и достаточно точным методом обнаружения злокачественных опухолей яичников на ранних стадиях является ТВУЗИ. В процессе исследования определяют локализацию, размеры яичников и выявленного новообразования, оценивают их эхогенность. Объем нормального яичника у женщин в предменопаузе составляет от 5 до 15 см 3 и уменьшается с возрастом. Наличие злокачественной опухоли более вероятно, когда её диаметр превышает 5,0см. Увеличенный яичник обычно принято считать патологически измененным и в этих случаях проводят его дальнейшую диагностическую оценку. Общепринято, что каждой пациентке, с выявленным при первичном скрининговом УЗИ увеличении объема яичника, следует назначать повторное исследование через 4—6 недель.
Важнейшим моментом ультразвуковой оценки новообразований яичников является анализ их сонографических характеристик. Для типичной доброкачественной морфологии новобразования яичников характерно наличие простой гипоэхогенной кисты с тонкими стенками и единичными перегородками, толщина которых не превышает 3,0мм. Простая одиночная киста диаметром менее 6,0см у женщин в предменопаузе, как правило, не является злокачественной. У женщин в постменопаузе в этих случаях, необходим ультразвуковой мониторинг. При кистозных новообразованиях в процессе УЗИ определяют толщину стенки кисты, число и толщину перегородок, наличие внутреннего детрита. Подозрение на опухоль должно вызывать любое кистозное образование яичника с очаговым или диффузным утолщением стенки более 3,0мм или наличием мягкотканного утолщения стенки выступающего в просвет кисты более чем на 3,0мм. При наличии в кистозном образовании высокоэхогенного очага, дающего акустическую тень, можно предположить наличие обизвествления, характерного для дермоидной опухоли. Доброкачественные тератомы или дермоидные опухоли яичников представляют собой исключение из правила корреляции между внутренней эхогенностью выявляемого новообразования и риском возможной его злокачественности. Большинство первичных злокачественных опухолей яичников по гистологическому строению являются эпителиальными и в большей или меньшей степени также содержат кистозную структуру. Кистозный компонент опухолей продуцирующих муцин часто содержит внутренние гипоэхогенные очаги характерные для жидкости. Значительное содержание эхогенного детрита в жидкостном кистозном компоненте указывает на злокачественный характер выявленных образований яичников. В дифференциальной диагностике наиболее важным является наличие и количество перегородок. При оценке перегородок внутри образований яичников обращают внимание на их количество, толщину и характер распределения. Повышенной вероятностью злокачественности, как и при оценке стенки кисты, характеризуются образования с толстыми перегородками, превышающими 3,0мм. Положительную предсказательную ценность в отношении злокачественности равную приблизительно 50% имеют образования яичников с множественными перегородками и наличием выраженного тканевого компонента. Сложные кисты с гомогенным внутренним эхо-сигналом, а также типичные дермоидные опухоли имеют очень высокую отрицательную предсказательную ценность. Общая суммарная оценка указанных показателей отражает большую или меньшую вероятность злокачественности новообразования. В прогностическом плане менее благоприятны по сравнению с кистозным формами, опухоли с большей пропорциональной долей тканевого компонента. Однако, в целом для дифференциальной диагностики между доброкачественным и злокачественным новообразованием яичника не могут быть использованы ни значение числа перегородок, ни отношение числа перегородок к объему опухоли, являющимися важными, но не единственными признаками злокачественности. Наличие высокого содержания тканевого компонента отмечается и при других первичных и вторичных неопластических образованиях яичника. Помимо рака яичника картину солидного образования или его увеличение преимущественно за счет тканевого компонента могут давать: эндометриоидная киста, герминоклеточные опухоли, лимфома, а также некоторые метастатические опухоли, в том числе из молочной железы, легкого или желудочно-кишечного тракта, которые известны под общим названием «опухоли Крукенберга». При УЗИ эти опухоли имеют характерные признаки отличающие их от эпителиального рака яичника. Тератомы обычно визуализируются как кистозные образования с наличием узлов Рокитанского или дермоидной пробки, характеризующиеся большим количеством высокоэхогенной ткани, которая представлена волосами и жиром с уровнями жидкости. Можно утверждать, что жир или волосы в дермоиде имеют более высокую эхогенность, чем муцин в эпителиальной злокачественной опухоли.
Спектральный анализ кровотока по допплеровскому сдвигу в доброкачественных опухолях показывает небольшой пассивный диастолический кровоток характерный для высокорезистентных сосудов с высокими показателями ИС и ИП. Многочисленными исследованиями подтверждено предположение о том, что злокачественные опухоли яичника в сравнении с доброкачественными образованиями, имеют более высокий кровоток с низким сосудистым сопротивлением, интенсивным пассивным диастолическим кровотоком, и как следствие низкие значения ИС (