Кто сказал что нервные клетки не восстанавливаются
НЕРВНЫЕ КЛЕТКИ ВОССТАНАВЛИВАЮТСЯ
Доктор медицинских наук В. ГРИНЕВИЧ.
Природа закладывает в развивающийся мозг очень высокий запас прочности: при эмбриогенезе образуется большой избыток нейронов. Почти 70% из них гибнут еще до рождения ребенка. Человеческий мозг продолжает терять нейроны и после рождения, на протяжении всей жизни. Такая гибель клеток генетически запрограммирована. Конечно же погибают не только нейроны, но и другие клетки организма. Только все остальные ткани обладают высокой регенерационной способностью, то есть их клетки делятся, замещая погибшие. Наиболее активно процесс регенерации идет в клетках эпителия и кроветворных органах (красный костный мозг). Но есть клетки, в которых гены, отвечающие за размножение делением, заблокированы. Помимо нейронов к таким клеткам относятся клетки сердечной мышцы. Как же люди умудряются сохранить интеллект до весьма преклонных лет, если нервные клетки погибают и не обновляются?
Смысл пластичности в том, что функции погибших нервных клеток берут на себя их оставшиеся в живых «коллеги», которые увеличиваются в размерах и формируют новые связи, компенсируя утраченные функции. Высокую, но не беспредельную эффективность подобной компенсации можно проиллюстрировать на примере болезни Паркинсона, при которой происходит постепенное отмирание нейронов. Оказывается, пока в головном мозге не погибнет около 90% нейронов, клинические симптомы заболевания (дрожание конечностей, ограничение подвижности, неустойчивая походка, слабоумие) не проявляются, то есть человек выглядит практически здоровым. Значит, одна живая нервная клетка может заменить девять погибших.
Первое сообщение о нейрогенезе появилось в 1962 году в престижном научном журнале «Science». Статья называлась «Формируются ли новые нейроны в мозге взрослых млекопитающих?». Ее автор, профессор Жозеф Олтман из Университета Пердью (США) с помощью электрического тока разрушил одну из структур мозга крысы (латеральное коленчатое тело) и ввел туда радиоактивное вещество, проникающее во вновь возникающие клетки. Через несколько месяцев ученый обнаружил новые радиоактивные нейроны в таламусе (участок переднего мозга) и коре головного мозга. В течение последующих семи лет Олтман опубликовал еще несколько работ, доказывающих существование нейрогенеза в мозге взрослых млекопитающих. Однако тогда, в 1960-е годы, его работы вызывали у нейробиологов лишь скепсис, их развития не последовало.
В конце 1980-х годов нейрогенез был также обнаружен у взрослых амфибий в лаборатории ленинградского ученого профессора А. Л. Поленова.
Как было показано, новые нейроны появляются из стволовых клеток взрослого организма и у низших позвоночных. Однако потребовалось почти пятнадцать лет, чтобы доказать, что аналогичный процесс происходит и в нервной системе млекопитающих.
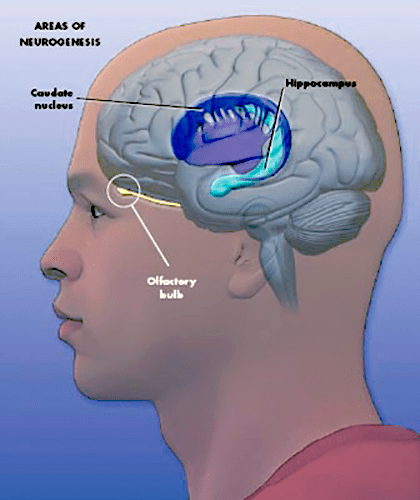
Развитие нейробиологии в начале 1990-х годов привело к обнаружению «новорожденных» нейронов в головном мозге взрослых крыс и мышей. Их находили большей частью в эволюционно древних отделах головного мозга: обонятельных луковицах и коре гиппокампа, которые отвечают главным образом за эмоциональное поведение, реакцию на стресс и регуляцию половых функций млекопитающих.
Для того чтобы понять, какие условия влияют на нейрогенез в гиппокампе и обонятельной луковице, профессор Гейдж из Университета Салка (США) построил миниатюрный город. Мыши там играли, занимались физкультурой, отыскивали выходы из лабиринтов. Оказалось, что у «городских» мышей новые нейроны возникали в гораздо большем количестве, чем у их пассивных сородичей, погрязших в рутинной жизни в виварии.
В некоторых лечебных учреждениях в США уже сформированы «библиотеки» нейрональных стволовых клеток, полученных из зародышевой ткани, и проводятся их пересадки пациентам. Первые попытки трансплантации дают положительные результаты, хотя на сегодняшний день врачи не могут разрешить основную проблему подобных пересадок: безудержное размножение стволовых клеток в 30-40% случаев приводит к образованию злокачественных опухолей. Пока не найдено подхода к предотвращению подобного побочного эффекта. Но, несмотря на это, трансплантация стволовых клеток, несомненно, будет одним из главных подходов в терапии таких нейродегенеративных заболеваний, как болезни Альцгеймера и Паркинсона, ставших бичом развитых стран.
«Наука и жизнь» о стволовых клетках:
Защита нейронов от повреждения
С.Н. Иллаpиошкин
профессор, доктор медицинских наук
ГУ НИИ неврологии РАМН
В большинстве ситуаций врач-невролог при заболевании головного мозга вынужден бороться с последствиями уже свершившейся катастрофы, в результате которой часть нервных клеток (нейронов) в определенной зоне мозга погибла. Другими словами, речь может идти о восстановительном лечении и компенсации утраченных функций – реабилитации, возможности которой в неврологии, к сожалению, достаточно ограничены. Между тем наиболее благоприятные результаты лечения возможны только в случае непосредственного воздействия на процессы, приводящие к гибели нервных клеток. Это направление в неврологии обозначается специальным термином – нейропротекция.
Развитие современных представлений о нейропротекции стало возможным в последнее десятилетие благодаря поистине революционным открытиям ряда фундаментальных наук. Были детально изучены основные цепи биохимических реакций (так называемые “биохимические каскады”), приводящие к гибели нейронов в результате острых или хронических стрессов. Установлены закономерности функционирования клеточных и митохондриальных мембран нейронов в норме и при патологии. Раскрыты основные типы рецепторов мозга и их взаимосвязь с процессами передачи клеточных сигналов. Изучены особенности образования и потребления энергии в нейронах. Наконец, большой вклад в изучение жизнедеятельности нейронов внесли успехи молекулярной биологии и генетики, а также моделирование разных заболеваний нервной системы у лабораторных животных.
Результатом проведенных исследований стало установление универсальных механизмов гибели нейронов при разных видах патологии. К ним относятся: 1) повышение уровня свободных радикалов и окислительное повреждение мембран нервных клеток; 2) нарушение деятельности митохондрий – своеобразных «энергетических станций” клетки, что приводит к запуску генетически запрограммированной гибели нейронов (апоптозу); 3) неблагоприятное действие избытка возбуждающих нейропередатчиков аминокислот (в первую очередь, глутамата), приводящее к перевозбуждению глутаматных рецепторов, входу кальция внутрь нейрона и его гибели. Этот механизм носит специальное название – эксайтотоксичность (от англ. “excite” – возбуждать).
В различных странах неоднократно предпринимались попытки лечения заболеваний нервной системы с помощью препаратов, связывающих свободные радикалы и предотвращающих окислительный стресс. Эти препараты получили название “антиоксиданты”, а наиболее известными из них являются витамины Е (токоферол) и С (аскорбиновая кислота). Однако результаты остаются далекими от идеала, и главная проблема – плохое проникновение этих соединений к внутриклеточным мембранам, особенно в центральной нервной системе.
Другая группа нейропротекторов имеет целью нормализацию функций митохондрий, улучшение усвоения кислорода и обеспечение клетки энергией. Нередко эти препараты называют “корректорами тканевого дыхания”. К ним относятся: коэнзим Q10, янтарная кислота, рибофлавин и др. На практике при необходимости улучшения функции митохондрий применяют комбинацию нескольких препаратов из данной группы.
Недавно в практику сталивнедряться принципиально новые нейропротекторы. Их действие основано на предотвращении эксайтотоксичности глутамата, выделяемого в межклеточное пространство. Такой эффект достигается за счет фармакологической блокады рецепторов глутамата, то есть специальных образований на поверхности клетки, воспринимающих глутаматные сигналы.
Новым этапом в данной области неврологии стало внедрение впрактику антагониста глутаматных рецепторов мемантина. Мемантин обладает определенными преимуществами перед другимиизвестными “антиглутаматными” препаратами, поскольку блокирует не абсолютную, а лишь избыточную активацию рецептора глутамата и поэтому обычно хорошо переносится. Действие мемантина на рецептор в физиологических условиях сходно с действием магния (данный препарат иногда образно называют “улучшенным магнием”).
В большинстве стран мемантин зарегистрирован как препарат для лечения различных видов деменций (болезнь Альцгеймера, сосудистая деменция и др.). Показано, что применение мемантина сопровождается достоверным улучшением памяти и других интеллектуальных функций, а также снижением зависимости от посторонней помощи у больных с легкой, умеренной и тяжелой деменцией. Однако знание механизма действия мемантина позволяет ставить вопрос о более широком спектре его применения – не только с целью лечения слабоумия, но и для защиты нейронов при различных патологических состояниях. Так, в недавней работе американских исследователей было показано, что мемантин при непрерывном 2-летнем применении значительно замедляет и даже приостанавливает течение болезни Гентингтона (тяжелого наследственного заболевания, сопровождающегося насильственными движениями и изменениями психики). Нами в нейрогенетическом отделении Института неврологии РАМН был также показан нейропротективный эффект мемантина у пациентов с болезнью Гентингтона. Более того, полученный нами опыт позволяет рекомендовать препарат для защиты мозга у “асимптомных” носителей мутантного гена, которые являются близкими родственниками больных и имеют высокий риск заболевания. Вся эта работа выполняется совместно с Российской ассоциацией помощи семьям с болезнью Гентингтона, которая входит во всемирную ассоциацию аналогичного профиля и осуществляет важнейший комплекс юридических, моральноэтических, психологических и иных мероприятий, направленных на обучение и поддержку семей, родственников больных и самих пациентов с этим тяжелым и пока еще неизлечимым заболеванием.
С учетом универсального значения эксайтотоксичности в механизмах гибели нейронов сегодня обсуждается возможность использования мемантина (как и других аналогичных антагонистов глутаматных рецепторов) в симптоматической и превентивной терапии ряда других неврологических заболеваний – таких как болезнь Паркинсона, сосудистые заболевания мозга и др. Разумеется, решение о назначении препарата, длительности его приема и оптимальной дозировке должно приниматься лечащим врачом с учетом характера болезни, особенностей конкретного пациента и принципов доказательной медицины применительно к данной группе лекарственных средств.
По всем прогнозам, нейропротекция как важнейшее и самостоятельное направление в клинической неврологии будет в ближайшие годы одной из наиболее актуальных и интенсивно развивающихся областей медицинской науки.
Всё, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить
Всё, что вы всегда хотели знать о взрослом нейрогенезе, но боялись спросить
Картина художника и дипломированного нейрофизиолога Грега Данна, изображающая одну из главных зон взрослого нейрогенеза — гиппокамп.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Выражение «нервные клетки не восстанавливаются» является одним из лидеров среди расхожих в быту утверждений о человеческом мозге. При этом уже 20 лет как доказана его ложность, а количество рассматривающих это самое восстановление статей до сих пор увеличивается чуть ли не по экспоненте. Уже установлены зоны, где оно проходит, его функциональное значение, а также огромное количество влияющих на него факторов. А сколько еще предстоит открыть.
Конкурс «био/мол/текст»-2015
Эта работа опубликована в номинации «Лучшая обзорная статья» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: лаборатория биотехнологических исследований 3D Bioprinting Solutions и студия научной графики, анимации и моделирования Visual Science.
Пошатнуть стереотип оказалось непросто.
Еще в начале прошлого века потеря нейронов в результате травмы или старения считалась фатальной — ведь даже лучшие умы настаивали на невозможности новообразования нейронов (или нейрогенез) у взрослых особей высших позвоночных. Впервые это постулировал гениальный С. Рамон-и-Кахаль [1], у которого на тот момент просто не могло быть инструментов исследования мозга, способных фиксировать малоинтенсивные постнатальные процессы. Авторитет Рамон-и-Кахаля был огромен, к тому же было известно, что с возрастом масса мозга снижается. О наличии малого пула стволовых клеток поводов задуматься не было, а отсутствие знаний о пластичности мозга не позволяло решить проблему интеграции новых нейронов в сложнейшую систему старых.
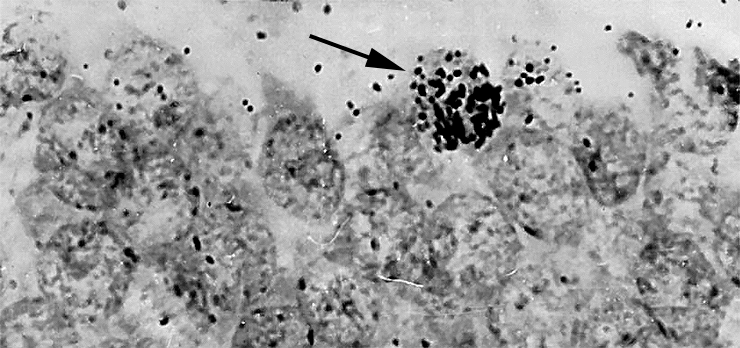
В результате убежденность в невозможности образования нервных клеток во взрослом состоянии была настолько твердой, что стала причиной ряда драматических историй в науке. Одним из первых, кто говорил о существовании взрослого нейрогенеза, был Джозеф Альтман. Используя новый для того времени метод авторадиографии с меченым тимидином (рис. 1), он и его сотрудники выпустили в 60-х целый ряд работ, утверждавших протекание нейрогенеза в зубчатой фасции гиппокампа, обонятельных луковицах и коре головного мозга у взрослых крыс, морских свинок, а также в новой коре у кошек [2].
Рисунок 1. Первые признаки взрослого нейрогенеза. Животным вводили 3 Н-тимидин — радиоактивный аналог обычного нуклеотида тимидина, — который тоже встраивается в ДНК делящейся клетки, но который потом можно регистрировать методом авторадиографии.
Альтман также предположил, что «взрослорождённые» нейроны имеют ключевое значение в процессах обучения и формирования памяти. Несмотря на то, что работы были выпущены в ведущих научных журналах, ученое сообщество проигнорировало их выводы, противоречившие установившемуся стереотипу. В результате Альтман прекратил работы по этому направлению. В начале 80-х его утверждения дополнились ультраструктурными доказательствами того, что возникающие в мозге взрослых крыс клетки похожи на нейроны. Кроме того, процессы деления были зафиксированы уже в мозге взрослых приматов — макак. Эти результаты получил Майкл Каплан, известный биолог и врач, позднее работавший в Университете Джонса Хопкинса и Национальном институте по проблемам старения (США). В ответ на его статьи некоторые именитые ученые говорили, что подобные результаты, полученные на крысах, не могут быть показательными, так как крысы не прекращают расти в течение жизни, следовательно, не могут когда-либо считаться «взрослыми». А обнаруженные деления в мозге макак сочли недостаточными для доказательства существования у них значительного нейрогенеза. Такие реакции не вдохновляли Каплана на продолжение исследований этой проблемы, и он занялся реабилитационной медициной [3].
. и всё же это удалось!
Одним из поворотных моментов в изучении нейрогенеза стала серия статей Фернандо Ноттебома, вышедшая в 80-х и 90-х годах. Сейчас Ноттебом — глава отдела экологии и этологии Рокфеллеровского университета, а тогда он занимался мозгом птиц, в частности — вокальным центром канареек. В ходе его работы выяснилось, что в отделах их мозга, гомологичных коре и гиппокампу приматов, помимо гибели происходит образование огромного количества новых клеток! При этом многие новые клетки являются нейронами и образуют синапсы, а активность всего этого процесса коррелирует со сложностью окружающей птицу среды. Несмотря на то, что многими эти результаты списывались на некую специфику птиц, они сильно сдвинули общественное мнение [3].
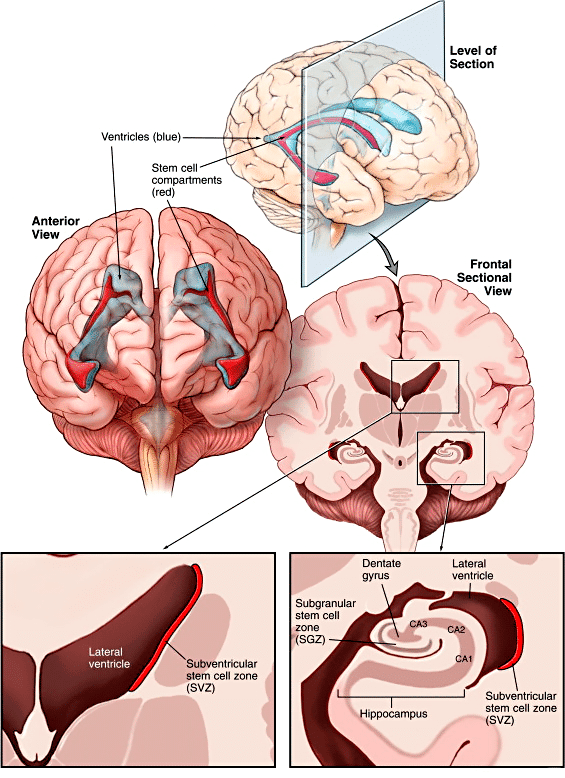
Исследование нейрогенеза продолжилось с новыми силами после введения в научную практику синтетических аналогов тимидина. Такие аналоги куда легче потом обнаружить в тканях, чем радиоактивные, которые использовал Альтман. Кроме того, были открыты маркеры клеток разных типов: нейронов различной степени зрелости, клеток глии, а также любых клеток, находящихся в фазе митоза, то есть делящихся. Это позволило еще увереннее говорить об активном нейрогенезе в зубчатой фасции гиппокампа и в стенках желудочков мозга с проекциями в обонятельные луковицы (рис. 2) [4]. Последние работы демонстрируют нейрогенез и в ряде других структур мозга: в хвостатом ядре, фронтальной коре, первичной и вторичной моторной и соматосенсорной коре (рис. 3) [5], [6]. Но недостаточно высокая активность процесса всё же не позволяет называть эти зоны нейрогенными, в отличие от двух вышеназванных.
Рисунок 2. Зоны мозга, в которых происходит нейрогенез: субвентрикулярная зона мозга (SVZ) в боковых стенках первых двух желудочков и субгранулярная зона зубчатой фасции гиппокампа (SGZ). У грызунов образующиеся в SVZ клетки потом мигрируют по ростральному миграционному тракту в обонятельные луковицы.
Рисунок 3. Зоны мозга человека, в которых происходит нейрогенез. У приматов клетки, образующиеся в субвентрикулярной области, мигрируют еще и в полосатое тело, которое представляет собой анатомическую структуру мозга, отвечающую за мышечный тонус, формирование условных рефлексов, а также регулирующую некоторые поведенческие реакции.
Нейрогенез в желудочках мозга значительно усиливается при каком-либо обонятельном опыте, а также при беременности у грызунов, так как узнавание детенышей у них сильно связано с обонянием [7], [8]. Результаты работ по исследованию нейрогенеза в этой зоне у человека пока не приводят к окончательным выводам: часть из них свидетельствует о его протекании у человека, другая ставит под сомнение миграцию нейронов в обонятельные луковицы. Недавно было показано, что у приматов новообразованные нейроны из субвентрикулярной зоны могут мигрировать в полосатое тело (или стриатум), отвечающее за сложные двигательные реакции и формирование условных рефлексов [9]. С повреждениями стриатума связан синдром Туретта, а также более серьезные проблемы, такие как болезни Паркинсона и Хантингтона. Поэтому в будущем можно рассчитывать на появление ряда работ по связанному с этой областью нейрогенезу.
Нейрогенез оказался важным инструментом в нашем организме.
Пожалуй, для человека самой важной нейрогенной зоной всё же можно назвать зубчатую фасцию гиппокампа. Гиппокамповая формация является частью лимбической системы и участвует в исполнении таких функций мозга, как интеграция и распределение по мозгу сенсорной информации, ответ на новизну, регуляция настроения и активности организма. Будучи частью круга Пейпеца, гиппокамп удерживает информацию при бодрствовании и участвует в ее переводе в кору больших полушарий во время сна, то есть из кратковременной памяти в долговременную. Нейрогенез вовлечен в осуществление некоторых из этих функций, выполнение которых становится возможным благодаря специфическим характеристикам образующихся клеток — в частности, молодые гранулярные клетки зубчатой фасции имеют более низкий порог долговременной потенциации, чем старшие [10]. Считается, что подобная пластичность играет роль в процессах обучения и памяти [11].
Скорость образования новых нейронов гиппокампа для взрослой крысы оценивается в 9000 клеток в сутки, однако большинство новообразованных клеток погибает между первой и второй неделями после своего рождения, из-за чего число окончательно интегрировавшихся в гиппокамп новых нейронов в месяц равно примерно 25000, что составляет около 3,3% их популяции [12]. Скорость нейрогенеза у человека оценивается в 700 нейронов ежедневно, а в год обновляется около 1,75% всего гиппокампа или же 0,004% нейронов его зубчатой фасции [13]. Половая специфика в этих показателях отсутствует, а с возрастом активность процесса снижается, при этом «качество» предшественников остается прежним, так как in vitro они культивируются так же хорошо, как и в молодом возрасте. Это позволяет предположить, что с возрастом происходит удлинение продолжительности клеточного цикла предшественников нервных клеток in vivo [14].
Стадии нейрогенеза в зубчатой фасции подробно описаны по морфологии клеток и набору специфических клеточных маркеров (рис. 4) [15].
Рисунок 4. Схема дифференцировки нервных стволовых клеток зубчатой фасции со специфическими маркерами разных стадий. Покоящиеся нервные предшественники (quiescent neural progenitors, в ранней классификации называемые радиальной глией) после активации цитокинами, ростовыми или иными факторами начинают делиться асимметричным митозом с образованием в базальной части делящегося нервного предшественника (amplifying neural progenitor, в ранней классификации — нерадиальный предшественник). Он, в свою очередь дважды поделившись, выходит из клеточного цикла и становится постмитотическим нейробластом (neuroblast 1, ранее — промежуточный прогенитор). Именно на этой стадии погибает большинство клеток. Оставшиеся превращаются в нейробласты второго порядка (neuroblasts 2, ранее — нейробласты) и затем в незрелые нейроны, мигрирующие в гранулярный слой, где завершается их созревание. Полное превращение нервной (нейральной) стволовой клетки в функциональный нейрон занимает около месяца.
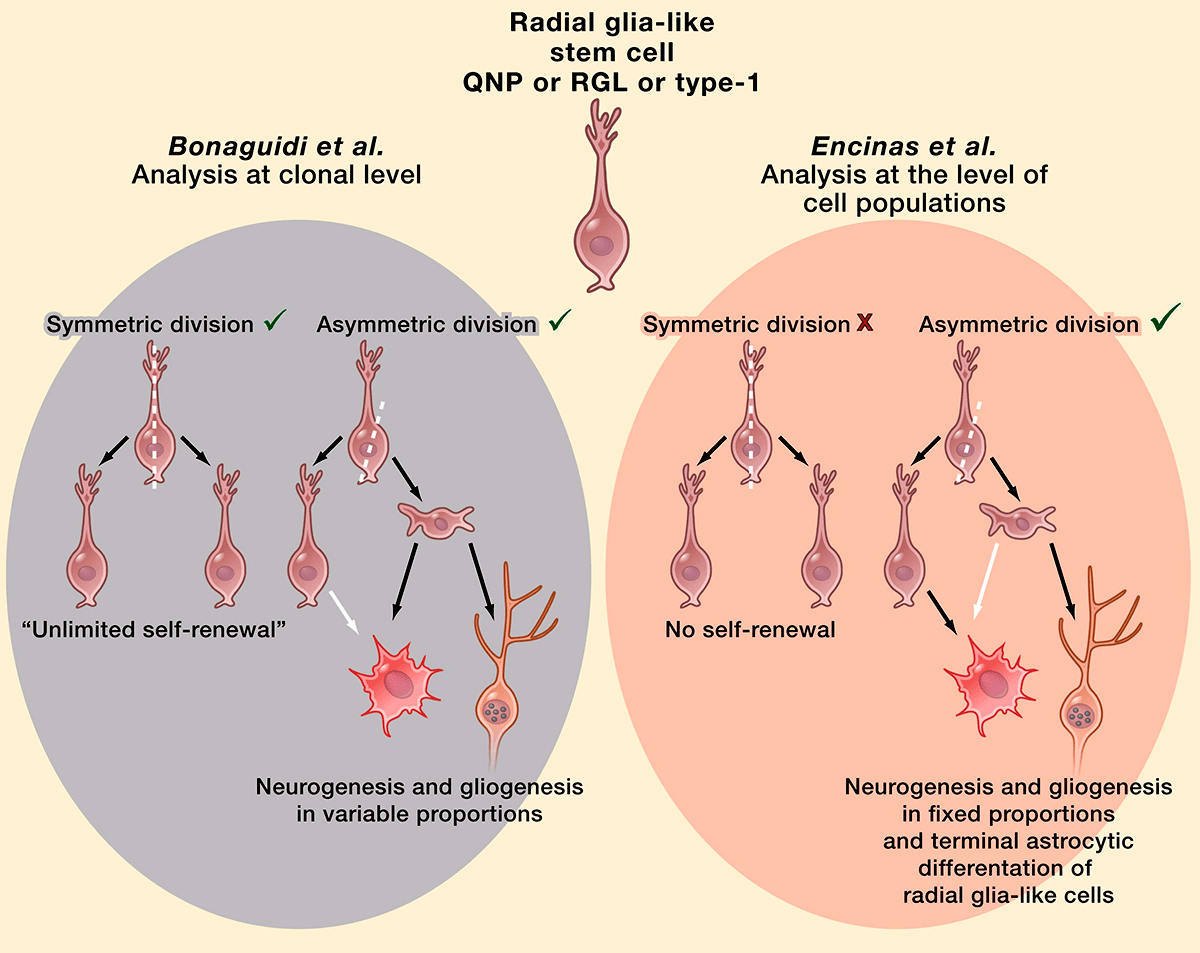
В настоящее время ведутся споры относительно судьбы QNP (quiescent neural progenitors, покоящихся нервных предшественников) после деления. Согласно «оптимистической» модели, стволовые клетки мозга — по аналогии с гемопоэтическими стволовыми клетками — являются самовозобновляемыми: в результате асимметричного деления они дают клетку, дифференцирующуюся потом в нейрон, а затем возвращаются в покоящееся состояние и могут быть заново активированы. В противоположность этому, согласно «пессимистической» модели, стволовые клетки зубчатой фасции не способны к самовоспроизведению, и их активация в конечном итоге приводит к превращению в астроциты. Предполагают, что сами стволовые клетки используются только единожды в течение взрослой жизни, выходя из этого пула после серии быстрых делений, в результате которых образуются прогениторы. Это объясняет и связывает между собой снижение темпов нейрогенеза и рост количества астроцитов в течение жизни (рис. 5) [16].
Рисунок 5. «Оптимистическая» (слева) и «пессимистическая» (справа) модели деления стволовых клеток.
В то же время вторая модель не исключает возможности нахождения в зубчатой фасции или малых популяций самовоспроизводящихся стволовых клеток, или клеток с удлиненными G2/M-фазами, или же каких-то специфических клеток, не экспрессирующих нестин. В последнем случае их просто не удалось бы обнаружить при использованном дизайне эксперимента.
. на работу которого многое может повлиять
Уровень новообразования нервных клеток — в частности, в зубчатой фасции — может меняться под воздействием множества факторов. Если принять во внимание «пессимистическую» модель и роль нейрогенеза в осуществлении некоторых функций гиппокампа, а также патогенез ряда нейродегенеративных заболеваний, станет очевидной важность определения мишеней для этих факторов — влияют ли они на молчащие стволовые клетки, расходуя их пул, или же способствуют выживаемости их потомков, или увеличивают количество их делений. Все влияния на нейрогенез в конечном итоге можно подразделить по результату их действия на положительные и отрицательные. К первым относятся как банальные (содержание в обогащенной среде, физическая нагрузка, прием антидепрессантов или мелатонина, социальные взаимодействия), так и специфические — вроде одноночной бессонницы или приема каннабиноидов. Ко вторым — радиация, стресс, хроническое недосыпание, злоупотребление опиатами, алкоголем и множество прочих общенегативных для мозга вещей.
Хотя в целом результат воздействия многих перечисленных факторов можно предугадать, механизм их воздействия, а также влияние их комбинаций требуют изучения — как для выстраивания правильной общей профилактики, так и для лечения конкретных заболеваний. Среди так называемых позитивных факторов особенно эффективным является обогащенная среда, включающая в себя физические упражнения. По различным данным, нахождение в течение небольшого количества времени (примерно от недели до месяца) в такой среде стабильно и значимо повышает уровень нейрогенеза, причем увеличение может быть даже пятикратным — в зависимости от возраста, состояния здоровья и других параметров [17]. Несмотря на активное изучение эффектов обогащенной среды на нейрогенез, на современном этапе исследований остается открытым вопрос о том, какие именно из ее компонентов (физическая или исследовательская активность) оказывают влияние на процесс формирования новых нейронов в мозге, а также на какие этапы нейрогенеза эти эффекты распространяются. Разрешение этих вопросов важно для поиска новых терапевтических и нейропротекторных воздействий и для нахождения эффективных путей регуляции нейрогенеза во взрослом мозге. Именно поэтому интерес к этой теме лишь усиливается, и количество статей по ней будет расти еще долгое время.