Кураризация в анестезиологии что это
| Послеоперационная резидуальная кураризация | |
|---|---|
 | |
| Электромиографический мониторинг приводящей мышцы. | |
| Специальность | Анестезия |
СОДЕРЖАНИЕ
Заболеваемость
Многочисленные исследования показали, что неполное обращение NMBD является важным фактором риска послеоперационной заболеваемости и смертности. Многочисленные исследования показали, что послеоперационная остаточная кураризация в отделении постанестезиологической помощи (PACU) является частым осложнением, при этом у 40% пациентов наблюдаются признаки остаточного паралича. Частота этого осложнения остается высокой и, похоже, не снижается с течением времени.
Типы нервно-мышечных блокаторов
Классифицируется на две основные группы:
• Деполяризующие NMBD: вызывают расслабление скелетных мышц за счет прямого связывания с nAChR, вызывая длительную деполяризацию.
• Недеполяризующие NMBD: конкурентные антагонисты (конкурирующие с ацетилхолином [ACh] за сайты связывания в nAChR), предотвращающие инициацию потенциала действия.
Недеполяризующие нервно-мышечные блокаторы
Деполяризующие нервно-мышечные блокаторы
Побочные эффекты от неадекватного снятия нервно-мышечной блокады
Мониторинг нервно-мышечной блокады
Модели и определения стимуляции периферических нервов
Поезд из четырех человек (TOF)
TOF-стимуляция состоит из четырех последовательных супрамаксимальных стимулов, подаваемых с частотой 2 Гц. После введения недеполяризующего NMBD ответы на этой частоте постепенно уменьшаются по амплитуде (так называемое «затухание» или уменьшение отношения TOF по сравнению с нормальным отношением 1).
Соотношение поездов четырех (TOFR)
Отношение TOF (TOFR) рассчитывается путем деления амплитуды четвертого ответа на амплитуду первого ответа (требуется количественная оценка ответа на стимуляцию).
Последовательность четырех (TOFC)
Подсчет TOF (TOFC) определяется как «количество обнаруживаемых вызванных ответов, и он коррелирует со степенью нервно-мышечной блокады следующим образом:
Соотношение поездов из четырех
Данные показывают, что отношение TOF, измеренное качественно с помощью ЭМГ, MMG или AMG, должно достигать порогового значения> 0,9, чтобы гарантировать восстановление нервно-мышечной функции. Отношения TOF Субъективный мониторинг
Субъективный мониторинг относится к клинической оценке оценки TOFC или степени затухания с использованием таких методов, как физическое прикосновение к пациенту и ощущение движения или визуальное наблюдение подергивания в ответ на нейростимуляцию, обеспечиваемую стимулятором периферических нервов. Если используется субъективный мониторинг, следует признать его ограничения: «клиницисты склонны переоценивать TOFC при использовании субъективной оценки, особенно при умеренных уровнях блокады. Аналогичным образом, уровень затухания трудно определить субъективно, и большинство клиницистов не могут обнаружить затухание. когда отношение TOF> 0,4. «
Объективный / количественный мониторинг
Из-за сложности субъективного определения затухания (отношения TOF от 0,4 до 0,9) при использовании стимуляторов периферических нервов клиницисты не могут надежно исключить остаточную нервно-мышечную блокаду. Отношения TOF> 0,4 можно точно измерить и отобразить численно с помощью количественного нервно-мышечного мониторинга. Однако отношения TOF> 4 можно точно измерить с помощью методов количественного мониторинга, таких как электромиография (ЭМГ), кинемиография (KMG), фономиография (PMG) и акселеромиография (AMG).
Отмена NMBD и методы предотвращения остаточной нервно-мышечной блокады
• Использование NBMD короткого или промежуточного действия, когда это возможно, может снизить риск остаточной нервно-мышечной блокады по сравнению с NMBD длительного действия.
• По возможности используйте объективный нервно-мышечный мониторинг (акселеромиографию, электромиографию, кинемиографию). Стимуляторы периферических нервов могут быть более доступными, и их также можно использовать. Однако стимуляторы периферических нервов могут только субъективно определять глубину блока (последовательность четырех счетчиков) и не могут предоставить точную информацию, необходимую для выбора времени и дозирования реверсивных агентов, а также для обеспечения полного восстановления (исчезновение TOF).
• Если самопроизвольное выздоровление не достигло TOFC = 4, используйте сугаммадекс вместо неостигмина для отмены стероидных NMBD.
• Если сугаммадекс недоступен, дождитесь спонтанного выздоровления, чтобы достичь TOFC = 4, прежде чем вводить неостигмин.
• Экстубируйте трахею только после достижения TOFR ≥0,9 (если доступны количественные мониторы)
Чурсин В.В. Внутривенная анестезия (методические рекомендации)
Информация
Чурсин В.В.
Внутривенная анестезия
Рецензенты:
Методические рекомендации содержат информацию о современных препаратах для внутривенной анестезии. Описаны различные методы многокомпонентной внутривенной анестезии и тактика инфузионной терапии во время операции.
Протокол № 2 от « 04 » апреля 2008 г.
Введение
Основные компоненты внутривенной анестезии
Сбалансированность и есть результат грамотного творчества, определяемая по стабильности гомеостаза – нормального функционирования всех систем организма.
Не может быть сбалансированности, если больного привозят в палату холодного или мокрого, хоть и со «стабильной, по линейке, гемодинамикой». Такое допустимо, если возникла нештатная ситуация или больной экстренный и анестезиолог просто не успел во время операции устранить все возникшие нарушения.
Анальгетики
ПРОМЕДОЛ – синтетический наркотический анальгетик, в основном используется для премедикации, послеоперационного обезболивания, но может быть применён и для поддержания общей анестезии, особенно предпочтителен при объёмных и длительных операциях. Применяются 1-2% р-ры в дозе 40-80 мг для введения в анестезию (до разреза), далее по 0,3-0,4 мг/кг массы тела каждые 30-50 минут, т.е. на 70 кг – примерно 20-30 мг. При в/в введении достаточное анальгетическое действие развивается через 15-20 минут. Об этом необходимо помнить если промедол используется как основной анальгетик – начинать операцию можно только по истечении этого времени. Пока промедол не развил своё действие, операцию можно начать после введения калипсола.
СТАДОЛ (Бефорал, Буторфанол, Буторфанола тартрат, Морадол) – синтетический наркотический анальгетик (агонист/антагонист), в основном используется для послеоперационного обезболивания, но может использоваться и для поддержания общей анестезии. Применяется в дозе 4-8 мг для введения в анестезию (до разреза), далее по 0,02-0,04 мг/кг массы тела каждые 30-50 минут, т.е. на 70 кг – примерно 2-3 мг. При в/в введении достаточное анальгетическое действие развивается через 15-20 минут. Об этом необходимо помнить, если стадол используется как основной анальгетик – начинать операцию можно только по истечении этого времени.
Седативные средства
Противопоказания относительные: сердечная недостаточность, перикардит, обструктивные заболевания легких, выраженные нарушения функции легких (бронхиальная астма), гиповолемия, выраженная гипотония, ишемия миокарда, шок, артериальная гипертензия, болезнь Аддисона, ацидоз, дисфункция печени. Не применяют при кесаревом сечении, т.к. проходит через плацентарный барьер и может вызвать апноэ у плода. При угнетении дыхания и нарушении сердечной деятельности как антагонист используется бемегрид.
Фармакология: Хорошо растворим в липидах, мало ионизирован, полностью метаболизируется в печени. Может вызвать освобождение гистамина.
Схемы общего обезболивания с использованием препаратов для внутривенной анестезии
Интубация трахеи.
Показанием для использования именно Пропофола для индукции можно считать кратковременные операции или манипуляции, требующие интубации трахеи, например бронхоскопию. Рекофол показан для вводного наркоза больным с исходно высоким артериальным давлением, когда весь наркоз будет вестись с использованием этого гипнотика.
Обезболивание малых хирургических вмешательств с использованием Пропофола.
Обезболивание объёмных хирургических операций с использованием Пропофола.
Тактика анестезии
Инфузионная терапия во время операции
Базовая инфузия во время операции должна составлять не менее 5 мл/кг в час (на 70 кг это 350 мл в час). Этот объём компенсирует потери жидкости на перспирацию (особенно это важно при использовании аппаратов ИВЛ без увлажнителя) и «потение» брюшины или плевры.
Объём инфузии свыше базовой увеличивается в следующих случаях:
Быстрая последовательная индукция и интубация
Быстрая последовательная индукция (БПИ, англ. «rapid sequential induction» — RSI) и интубация — анестезиологическая техника, которая применяется у пациентов с высоким риском аспирации желудочного содержимого. Цель данной техники — снижение риска аспирации путем максимального уменьшения времени манипуляции, когда дыхательные пути не защищены (от начала индукции до постановки эндотрахеальной трубки (ЭТТ)). Сама концепция БПИ родилась после введения в клиническую практику сукцинилхолина в 1951 году и приема Селлика в 1961 году. Первая публикация, включающая все основные приемы техники БПИ, появилась в 1970 году.
Традиционные компоненты БПИ:
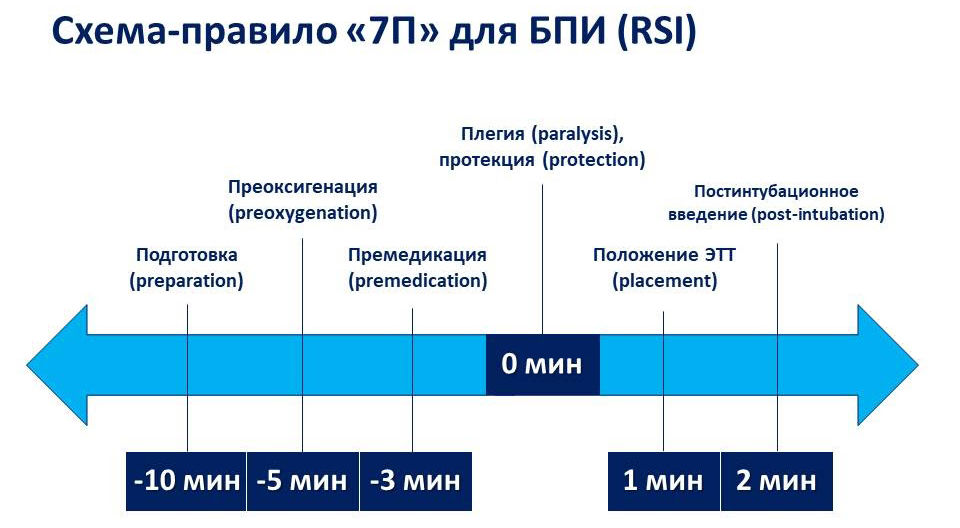
После появления новых лекарственных средств и улучшения технического обеспечения современная техника БПИ в анестезиологии претерпела некоторые изменения. Стоит отметить, что у новорожденных данная техника не применяется, т. к. для подготовки к оперативному вмешательству данного контингента пациентов используется совершенно иной подход (концепция мультимодальной анальгезии). Современная БПИ проводится по схеме-правилу «7П»: подготовка, преоксигенация, премедикация, плегия, протекция, положение трубки, постинтубационное ведение (рис. 1).
Рисунок 1 | Правило «7П»
Преоксигенация
Первым этапом БПИ является преоксигенация пациента. Целью данного этапа является удаление азота из функционально мертвого пространства и замещение его кислородом, что увеличивает кислородный резерв пациента на период апноэ. Беременные, тучные пациенты, дети, а также пациенты с заболеваниями, вызывающими растяжение кишечника, имеют меньший кислородный резерв, в результате чего снижение SpO2 протекает быстрее.
Варианты преоксигенации:
А. 3–5 минут дыхания 100 % кислородом;
Б. 4 максимально глубоких вдоха в течение 30 секунд;
В. 8 максимально глубоких вдоха в течение 60 секунд.
По возможности должен использоваться вариант А, но при необходимости сокращения времени до интубации возможно использование вариантов Б и В (данные режимы менее эффективны у пожилых пациентов).
Стоит отметить, что в последние годы появилось несколько новых способов преоксигенации, которые проводятся с помощью носовых или носоглоточных канюль, один из них — трансназальная быстрая инсуфляция увлажненным кислородом (THRIVE).
Давление на перстневидный хрящ
Барри Селлик в 1961 году предложил применять давление на перстневидный хрящ для уменьшения риска аспирации желудочного содержимого. Данная техника сразу же была принята, т. к. другой альтернативы на тот момент не было. Селлик предлагал использовать давление силой около 44 Ньютонов (Н), или 4,45 кг. Однако оказалось, что правильное анатомическое использование перстневидного давления выполнить намного сложнее, чем ожидалось. После проведения ряда исследований данные об эффективности и целесообразности данного маневра остаются противоречивыми.
На данный момент рекомендуется давление 10 Н/1 кг для пациентов в сознании и 30 Н/3 кг для пациентов без сознания. Но такое действие указано не как способ защиты от аспирации, а в качестве внешнего воздействия на гортань при трудной интубации трахеи для облегчения визуализации — «BURP»-прием (англ. «back, upward, right lateral, pressure» — назад, вверх, вправо, надавите).
В период апноэ желательно использование мягкой масочной вентиляции: данная манипуляция вряд ли повысит риск аспирации, именно поэтому она была рекомендована в недавних гайдлайнах Общества трудных дыхательных путей (DAS). При адекватном давлении на перстневидный хрящ и использовании низких значений положительного давления на вдохе (PIP) раздувания желудка не произойдет. По сравнению с описанной выше техникой, использование масочной вентиляции только после снижения сатурации увеличивает риск раздувания желудка и предикторов срыгивания. Некоторое количество исследований продемонстрировало успешное использование разных типов ларингеальных масок, таких как LMA Classic. Также по результатам исследований рекомендуется вентиляция маской с ограничением по давлению на вдохе Pmax 20 см вод. ст.; интубация должна проводится оротрахеально (ЭТТ № 7,0–8,0). Однако не упоминалось, что желательно использовать ларингеальные маски второго поколения, с портом для желудочного зонда.
Премедикация
Премедикация проводится с целью предотвращения рефлекторной симпатической реакции на ларингоскопию (RSRL), проявляющейся повышением внутричерепного давления (ВЧД), внутриглазного давления (ВГД), развитием кашля и ларингоспазма, тахикардии и артериальной гипертензии. Ларингоскопия и интубация трахеи вызывают рефлекторную симпатическую стимуляцию и связаны с повышенным уровнем катехоламинов.
Есть некоторые анатомо-физиологические особенности, о которых хотелось бы напомнить. Учитывая сложную иннервацию гортани, рефлекторная вегетативная реакция на интубацию у взрослых и детей может различаться. Подробно процесс интубации трахеи будет описан ниже. У взрослых интубация трахеи изогнутым клинком Макинтоша часто сопровождается активацией симпатической ВНС. Связано это с тем, что фарингеальная часть надгортанника, включая грушевидную ямку, иннервируется ветвями языкоглоточного нерва. У детей интубация трахеи прямым клинком Миллера чаще всего сопровождается активацией парасимпатического отдела ВНС, что связано с непосредственным соприкосновением клинка с надгортанником, иннервирующимся ветвями блуждающего нерва. Поэтому в педиатрической практике частым осложнением интубации трахеи является рефлекторная остановка сердца или бронхоспазм. Во избежание RSRL возможно применение следующих лекарственных средств (общепринятый акроним LOAD претерпел некоторые изменения, лидокаин уступил лидирующее место фентанилу):
У новорожденных детей премедикация может не выполняться, т. к. часто такие пациенты уже находятся на ИВЛ (возможно с рождения) и медикаментозно седатированы. В случае необходимости премедикация может включать в себя в/в введение опиоидов (1–5 мкг/кг), атропина (0,01 мг/кг) для снижения длительности и количества попыток интубации трахеи.
Внутривенные анестетики для БПИ
Следующим этапом является введение внутривенных анестетиков. После введения индукционного агента необходимо осуществлять непрерывное давление на перстневидный хрящ до постановки эндотрахеальной трубки.
На сегодняшний момент для БПИ применяются следующие внутривенные анестетики:
Индукция с помощью ингаляционных анестетиков
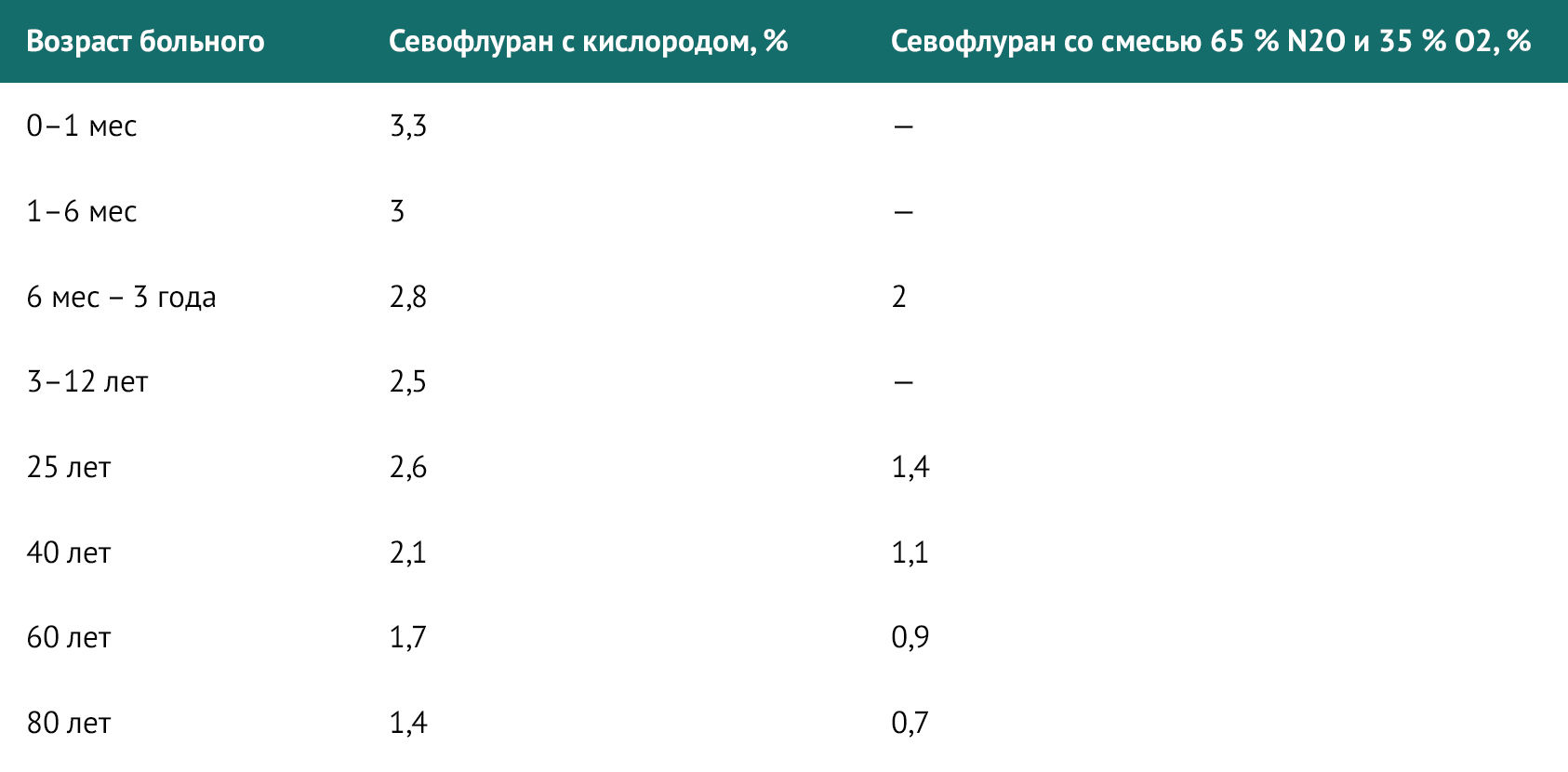
Индукция ингаляционными препаратами чаще всего проводится у детей. Одним из наилучших средств является севофлуран. Также существуют показания для проведения последовательной индукции ингаляционными анестетиками и во взрослой практике:
Одним из основных параметров при проведении индукции ингаляционными препаратами является минимальная альвеолярная концентрация (МАК) — концентрация анестетика, при которой 50 % пациентов не реагируют на разрез кожи.
У новорожденных для индукции, как правило, используется диазепам 0,5 мг/кг в/в; фентанил 5 мкг/кг; атракурия безилат 0,6 мг/кг.
Нейромышечная блокада
Наиболее часто для нейромышечной блокады используется деполяризующий миорелаксант короткого действия суксаметоний, однако при наличии противопоказаний к нему могут использоваться недеполяризующие миорелаксанты. В последнее время в качестве альтернативы рассматривается недеполяризующий миорелаксант — рокуроний, который в высоких дозах показал такое же время до начала действия и условия интубации, как и суксаметоний.
Суксаметония хлорид (Листенон®) или суксаметония йодид (Дитилин®)
Стандартная доза суксаметония для интубации — 1 мг/кг в/в, при проведении прекураризации доза суксаметония увеличивается до 1,5 мг/кг в/в.
Суксаметоний имеет ряд побочных эффектов, вот некоторые из них:
Ввиду вышеперечисленных побочных реакций суксаметоний противопоказан при:
Частота некоторых побочных эффектов может быть снижена проведением премедикации и прекураризации. У детей применение суксаметония ограничено ввиду быстрого развития гиперкалиемии, ацидоза, возможности наличия нераспознанного нейромышечного заболевания и, крайне редко, рабдомиолиза.
Проблемы, наиболее часто ассоциированные с применением лекарственных средств данной группы:
Рокурония бромид (Эсмерон®)
Доза для интубации — 0,6 мг/кг в/в, при применении для БПИ — 1,2 мг/кг в/в. Начало действия 60–90 секунд, длительность 30–40 минут.
Атракурия безилат (Тракриум®)
Доза для интубации — 0,5–0,6 мг/кг в/в. Начало действия 60–90 секунд, длительность 15–35 минут.
У новорожденных детей используются: пипекурония бромид 10–20 мкг/кг/час; атракурия безилат 0,3–0,6 мг/кг/час; рокурония бромид 0,3–0,6 мг/кг/час.
Интубация трахеи
Стандартной техникой, рекомендованной для интубации, является прямая ларингоскопия. Во взрослой практике для интубации чаще всего используется ларингоскопы с клинками Макинтоша (изогнутые), в неонатальной практике пользуются клинками Миллера (прямые), в педиатрической практике используют и те, и другие в зависимости от возраста и предпочтений врача. У взрослых и новорожденных практически всегда используется оротрахеальная интубация. В педиатрической практике предпочитают назотрахеальную интубацию, для которой дополнительно необходимо использование щипцов Мейнджила.
ЭТТ тоже различаются по своей форме и структуре. Существуют армированные ЭТТ (не изменяет внутреннего просвета при любом сгибании), с заранее сформированным полярным изгибом (так называемые «северные» и «южные»), двухпросветные интубационные трубки (Карленса для левого бронха, Уайта для правого бронха) и т. п. Взрослые и педиатрические ЭТТ имеют на дистальном конце манжету для раздувания, для новорожденных следует применять ЭТТ без манжеты (т. к. при раздувании манжеты чрезвычайно большой риск повреждения трахеи).
Размеры эндотрахеальной трубки для взрослых пациентов варьируют от 6,5 до 9,5; для детей рассчитывается по формуле:
Глубина постановки ЭТТ у мужчин — 22–24 см, у женщин — 20–22 см, для детей рассчитывается по формуле: глубина (см) = 12 + возраст (в годах)/2. Для назотрахеальной интубации глубина постановки ЭТТ (см) = 15 + возраст (в годах)/2.
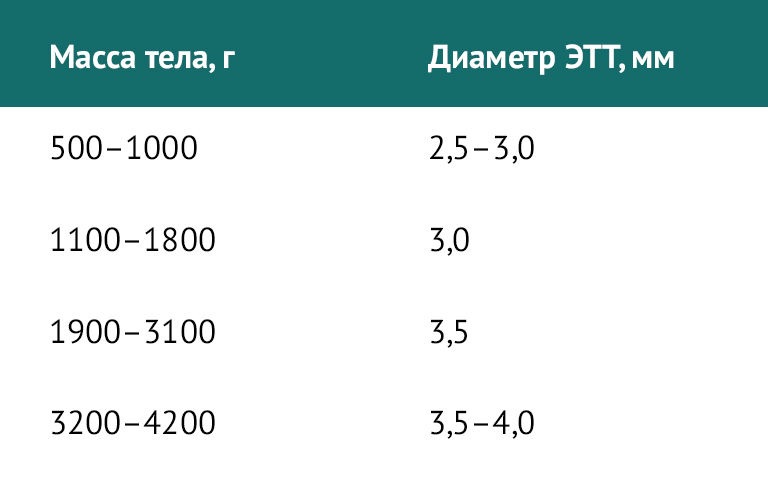
Для новорожденных детей существуют отдельные требования. Диаметр ЭТТ в зависимости от массы тела при рождении представлен в таблице 2.
Таблица 2 | Диаметр ЭТТ у новорожденных детей в зависимости от массы тела
Глубина постановки ЭТТ у новорожденных вычисляется по формуле: масса тела (кг) + 6 см.
Перед интубацией рекомендуется привести пациента в положение «принюхивания» (кроме того существуют классическое джексоновское положение, улучшенное положение Джексона и т. п. при отсутствии признаков повреждения шейного отдела позвоночника). Интубация должна быть проведена максимально быстро.
Верификация положения ЭТТ
Важно убедиться, что ЭТТ не находится в пищеводе и не опустилась в один из главных бронхов. С этой целью возможно использования правила DOPE:
Существует множество методов, которыми необходимо пользоваться для верификации положения ЭТТ.
Надежные:
Практически надежные:
Ненадежные:
Источники:
Кураризация в анестезиологии что это
НОВЫЕ ВОЗМОЖНОСТИ В АНЕСТЕЗИОЛОГИЧЕСКОМ ОБЕСПЕЧЕНИИ ОПЕРАЦИЙ У БОЛЬНЫХ МИАСТЕНИЕЙ
К.М. Лебединский, А.Ф. Романчишен, А.Е. Карелов, Д.С. Бедняков, В.А. Мазурок
Доклад на 486 заседании Общества анестезиологов и реаниматологов СПб 29.12.2004 г.
Глубокоуважаемый Анатолий Ильич, глубокоуважаемые коллеги!
История изучения и лечения миастении оказалась тесно связана не только с прогрессом хирургии, но, самым неожиданным образом, с рождением и развитием современной анестезиологии. Начало клинического применения миорелаксантов вскрыло целый ряд фактов, проливших свет на глубинное родство между эффектом этих препаратов, с одной стороны, и механизмами патогенеза миастении, с другой. Выяснилось, что недеполяризующий нейромышечный блок, вызываемый в клинике конкурентной блокадой чувствительных к никотину холинорецепторов концевой пластинки, по электро- и механомиографической картине практически идентичен проявлениям миастении. В обоих случаях отмечаются чрезвычайно характерные феномены последовательного угасания мышечных ответов на одиночные электрические импульсы и облегчения нейромышечной передачи в ответ на введение антихолинэстеразных средств. Таким образом, привычная анестезиологам декураризация является прямой параллелью прозеринового теста при миастении.
С другой стороны, пациенты с этим заболеваниям демонстрируют резко повышенную чувствительность к действию недеполяризующих миорелаксантов, развивая уже в ответ на малые дозы препаратов глубокий нейромышечный блок. Наконец, чувствительность миастеников по отношению к деполяризующим миорелаксантам всегда представлялась крайне непостоянной: одни авторы расценивали ее как повышенную, другие, напротив, отмечали устойчивость, требующую для достижения эквивалентной степени блока существенно бoльших доз сукцинилхолина или декаметония по сравнению со здоровыми людьми.
Это кажущееся противоречие нашло объяснение позднее, когда у миастеников была подтверждена доказанная ранее для здоровых лиц прямая зависимость между продолжительностью деполяризующего блока и активностью плазменной псевдохолинэстеразы. А поскольку уровень активности фермента существенно меняется под влиянием антихолинэстеразных препаратов, резкая индивидуальная вариабельность эффектов становится вполне понятной.
Именно эти факты и послужили основой первой, исходной концепции анестезиологической тактики у больных миастенией. Она постулировала прежде всего полный или частичный отказ от использования миорелаксантов, особенно недеполяризующего типа действия, и готовность к продленной искусственной вентиляции легких в послеоперационном периоде c заблаговременной плановой трахеостомией. При этом необходимость продленной ИВЛ у миастеников рассматривалась скорее как стихийное, неконтролируемое явление, подлежащее лишь возможному прогнозированию, но не управлению со стороны врача.
В русле этих классических представлений следовали вышедшие из кафедры анестезиологии и реаниматологии Ленинградского ГИДУВа работы ее основателя – профессора Владимира Львовича Ваневского. Среди них прежде всего следует сослаться на капитальную монографию Гаджиева, Догель и Ваневского «Диагностика и хирургическое лечение миастении», изданную в Ленинграде в 1971 году. Опыт, изложенный в этой книге, включает и первую в нашем городе тимэктомию, выполненную в ГИДУВе Александром Сергеевичем Чечулиным в 1958 году.
Внедрение в практику анестезии едва ли не каждого нового препарата вызывало волну надежд на решение проблемы оптимального выбора. В частности, так было с пропофолом, казавшимся «идеальным средством для безрелаксантной анестезии у больных миастенией» прежде всего благодаря своему уникальному фармакокинетическому профилю. Пропофол применялся и применяется с успехом у этой категории больных как в составе «традиционных» схем, не предусматривающих использования миорелаксантов, так и в комбинации с последними.
Важным направлением, также сформировавшимся в этот период, стало применение в роли альтернативного «релаксанта для миастеников» галогенсодержащих ингаляционных препаратов. Отмечено, однако, что чувствительность пациентов–миастеников по отношению к галотану отличается значительной вариабельностью, плохо коррелирующей с исходной истощаемостью мышечных ответов и титром антител к н-холинорецепторам. Лишь наличие антигена HLA–B8 (главного комплекса гистосовместимости) продемонстрировало достоверную связь с чувствительностью нейромышечной передачи к действию галотана. Особенной популярностью в этом качестве пользуется изофлюран, оказавшийся при миастении примерно в два раза более сильным депрессантом нейромышечной проводимости, чем галотан. При этом быстрое клиническое восстановление, позволяющее экстубировать пациентов уже в течение первого часа после операции, контрастирует с замедленным восстановлением электромиографической картины.
Некоторые анестезиологи предпочитают использовать у больных миастенией эпидуральную анестезию. Применительно к тимэктомии речь идет о высоком блоке: уровни пункции эпидурального пространства у разных авторов варьируют от С7–Th1, Th1–Th2 или Th2–Th3 до Th4–Th5. Впрочем, многим авторам эпидуральная анестезия представляется при миастении оптимальным решением не только для тимэктомии, но и для других, непосредственно не связанных с основным заболеванием, оперативных вмешательств. Избирая метод регионарной анестезии, нельзя лишь забывать о том, что системное действие местных анестетиков – блокаторов потенциал-завивисимых натриевых каналов – само по себе предполагает нарушение функции всех возбудимых тканей, включая, разумеется, и мышечное сокращение.
Осознание ограниченной пригодности при миастении большинства традиционных методик анестезии и тенденцию к поиску радикальных альтернатив демонстрируют попытки обезболивания тимэктомии методом иглорефлекторной анестезии.
Однако радикально положение изменилось лишь после появления недеполяризующих миорелаксантов относительно кратковременного действия. Хронологически первый препарат этого класса – атракуриум, бензилизохинолиновое производное, подвергающееся в организме так называемой элиминации Хоффманна (спонтанному, т.е. неферментативному, гидролизу при естественных значениях рН и температуры плазмы крови). Поворотным пунктом стал 1984 год, когда первые успешные опыты применения атракуриума у больных миастенией вызвали поток восторженных отзывов. Позже наступил черед еще более короткодействующего мивакуриума.
Применение короткодействующих недеполяризующих миорелаксантов послужило толчком, запустившим более широкие исследования эффективности и безопасности искусственного нейромышечного блока у больных миастенией. Оказалось, что у этой группы пациентов могут быть успешно применены такие препараты, как векуроний, рокуроний, алкуроний и даже пипекуроний (хорошо знакомый нам как ардуан). Более того, стандартная последовательность «сукцинилхолин–векуроний» оказалась при тимэктомии вполне приемлемой!
Подчеркнем, что авторы всех цитированных работ выдвигают одно чрезвычайно существенное условие, без которого использование мышечных релаксантов любого типа у больных миастенией не может быть безопасным. Это условие – мониторинг нейромышечной передачи, осуществляемый с контролем ответа по принципу механо- или электромиограммы (впрочем, результаты обоих методов превосходно коррелируют между собой).
Говоря о тактике анестезиолога применительно к тимэктомии, нельзя, конечно, ограничиться лишь вопросами техники анестезии. Сегодня, как и много лет назад, в начале пути, успех и безопасность лечения в значительной мере зависят от исходного состояния пациента, а потому нельзя пренебрегать возможностями патогенетической предоперационной подготовки.
Учитывая патогенез заболевания, связанный у части больных с наличием циркулирующего пула антител к aльфа-субъединице н-холинорецептора концевой пластинки, удаление этих антител из плазмы больного с помощью тех или иных эфферентных методов представляется как отечественным, так и зарубежным авторам важной составляющей подготовки к операции. Наиболее часто используется плазмаферез, однако некоторые авторы сообщают об успешном применении гемосорбции и ксеноспленоперфузии.
Что касается применения при миастении глюкокортикоидов, то с точки зрения анестезиолога это – лишь повод для того, чтобы не забывать о возможной функциональной недостаточности коры надпочечников.
Основываясь на собственном опыте анестезиологического обеспечения различных операций у больных миастенией – как тимэктомии, так и различных вмешательств, не связанных с основным заболеванием, – мы могли бы рекомендовать две различные схемы проведения анестезии у этой по-прежнему непростой группы пациентов. Общими требованиями к анестезиологическому обеспечению в обоих случаях являются тщательный мониторинг, в особенности нейромышечной передачи, желательно наличие центрального венозного катетера, наркозного аппарата, обладающего возможностью интерактивной респираторной поддержки, а также настороженность в плане необходимости использования глюкокортикоидов.
Первая, более традиционная, схема предполагает отказ от применения миорелаксантов. При этом возможность поддержания нормальной нейромышечной передачи до момента доставки больного в операционную обеспечивается интубацией трахеи с помощью фибробронхоскопа под внутривенной анестезией. Далее необходимая для технического удобства действий хирурга миорелаксация достигается ингаляцией паров галогенсодержащего препарата, например, галотана или изофлурана под контролем мониторинга нейромышечной передачи. Что касается тимэктомии, использование торакального ранорасширителя для стернотомической раны позволяет хирургам работать без технических затруднений уже при уровне индекса TOF около 15–20%, т.е. в условиях, далеких от так называемого полного или “хирургического” блока. Этот необходимый для беспрепятственного выполнения операции уровень релаксации и является необходимым и достаточным.
В конце анестезии, сразу вслед за выключением подачи анестетика, после начальной болюсной дозы начинается введение антихолинэстеразного препарата с помощью постоянной объемно-дозированной инфузии. Такая техника анестезии обеспечивает возможность безопасной экстубации пациентов практически тотчас после восстановления сознания, активных глоточных и гортанных рефлексов.
Постоянная объемно-дозированная инфузия антихолинэстеразных препаратов использовалась у больных миастенией и ранее – для лечения миастенических кризов. Однако в качестве планового мероприятия, обеспечивающего раннюю экстубацию пациентов, инфузия прозерина нам в литературе не встретилась. Необходимо отметить, что введение таким способом весьма высоких доз препарата (до 12 мг/сут внутривенно, что с учетом невысокой биодоступности прозерина соответствует примерно 360 мг/сут per os ), не вызывало ни у одного из наших больных проявлений парасимпатической гиперактивности (брадикардия, бронхоспазм, боли в животе), не говоря уже о развитии холинергического криза. Введения м-холинолитиков также не потребовалось ни в одном из наших наблюдений.
Вторая схема, предпочтительная, на наш взгляд, при операциях большого объема и продолжительности, предполагает использование недеполяризующих миорелаксантов произвольной длительности действия. Безусловно, как и во всяком другом случае, применение препаратов с более предсказуемой фармакокинетикой, каковыми на сегодня являются новые аминостероиды – рокуроний и векуроний – выглядит здесь предпочтительным. В целом техника анестезии ничем не отличается от стандартной, и только на заключительном этапе использование «бескомпромиссной» декураризации прозерином в дозе до 0,07 мг/кг с последующей постоянной инфузией препарата под контролем мониторинга нейромышечной передачи позволяет экстубировать больного по общим для «обычной» анестезиологии правилам.
И хотя никаких особенностей использования наркотических анальгетиков у этих больных не отмечают, нелишне напомнить об их побочных эффектах, в частности, об угнетении дыхательного центра, которое на фоне нарушенной нейромышечной передачи может серьезно затянуть восстановление самостоятельного дыхания. В связи с этим замена опиоидов на альтернативные анальгетики, лишенные этого недостатка, по нашему мнению, является вполне обоснованной. В качестве такой альтернативы мы у 8 пациентов с успехом использовали пуриновую анальгезию. При этом инфузия анальгетика – аденозинтрифосфата натрия – на заключительном этапе анестезии продолжалась параллельно с введением прозерина до достижения приемлемого уровня нейромышечной проводимости, т.е. до момента транспортировки пациента из операционной.
По описанным двум методикам нами без каких-либо осложнений проведено суммарно более 20 анестезий при различных операциях, включая тимэктомию и тимомэктомию. Одной пациентке было выполнено 2 операции – тимомэктомия и экстирпация матки, пораженной тяжелым миоматозным процессом с гнойным расплавлением узла. Преимуществом описанных методик мы считаем прежде всего возможность ранней экстубации больных, что повышает безопасность и комфорт пациента, не доставляя в то же время неудобств хирургу.
В двух случаях, однако, методика не имела успеха: больным потребовалась продленная ИВЛ различной продолжительности. Анализируя причины этих неудач, необходимо выделить два важнейших условия успеха новых методик анестезии у миастеников. Первое из них – хороший уровень нейромышечного проведения на фоне медикаментозной терапии до операции. Следует избегать применения методики в тех случаях, когда принимаемая перед операцией доза антихолинэстеразных средств не обеспечивает хорошей функциональной компенсации. Второе условие – строгое соблюдение преемственности лечебной тактики в послеоперационном периоде и, в частности, непрерывность инфузии прозерина под осмысленным контролем мониторинга нейромышечной проводимости.
Две неудачи, с которыми нам пришлось столкнуться, подчеркивают важность непременного выполнения обоих этих требований. В одном случае дежурный персонал отделения реанимации не справился с управлением дозатором, что привело больного к реинтубации, а затем и трахеостомии. В другом случае у пациентки до операции на фоне приема каллимина имелись выраженная мышечная слабость и диплопия, а в послеоперационном периоде пересмотр стратегии ведения больной осуществлялся каждой вновь приходящей дежурной сменой. В итоге дело и здесь едва не закончилось трахеостомией.
Подчеркнем в заключение мысль, часто акцентируемую нашими зарубежными коллегами: для успешного лечения больного миастенией чрезвычайно важно повседневное и взаимно-доброжелательное взаимодействие между невропатологом, хирургом и анестезиологом.