Лактобактерии реутери что это
Уменьшение количества Helicobacter pylori с помощью Lactobacillus reuteri DSMZ17648
Lactobacillus reuteri DSMZ17648 специфически коагрегирует с Helicobacter pylori in vitro и сохраняет активность даже после лиофилизации. Оценена потенциальная возможность снижения уровня обсемененности H. pylori у здоровых, но инфицированных взрослых люде
Lactobacillus reuteri (L. reuteri) DSMZ17648 specifically co-aggregates H. pylori in vitro and was shown to reduce 13C urea breath test in vivo. In this pilot study, we tried to replicate previous findings in an independent sample and to evaluate effects of spraydrying vs. freeze-drying of cultures. A single-blinded, placebo-controlled study was done in 22 H. pylori positive, asymptomatic adults.
Несмотря на то, что в течение длительного времени считалось, что микроорганизмы не выживают в желудке, Helicobacter pylori (H. pylori) регулярно обнаруживают у пациентов с язвенной болезнью. Она выделяет фермент уреазу, с помощью которого разрушает (гидролизует) мочевину, в результате чего образуется аммиак. Этот механизм в сочетании с подвижностью бактерии и способностью прикрепляться к слизистой оболочке позволяет ей выживать в кислой среде желудка. Присутствие и воздействие H. pylori связывают с несколькими заболеваниями желудочно-кишечного тракта, включая язвы и рак желудка [1]. У инфицированных людей концентрация H. pylori составляет приблизительно от 10 4 до 10 7 колониеобразующих единиц (КОЕ) на грамм слизистой оболочки желудка [2]. Инфицирование H. pylori может привести к воспалительной реакции, увеличению объема вырабатываемой желудочной кислоты и гастритам типа B. Очевидна зависимость между уровнем колонизации желудка H. pylori и вероятностью появления симптомов/обострения заболевания [3]. При нормальной барьерной функции слизистой оболочки желудка инфицирование H. pylori часто приводит только к небольшому сопутствующему воспалению. В случае хронического проявления могут образовываться хронические опухоли, о чем свидетельствует лимфома MALT-типа [4]. Лечение первичной инфекции оказывает терапевтический эффект на вторичные заболевания.
Генетические факторы риска также влияют на патологические процессы при инфицировании H. pylori [5–7]. Исследования семей и близнецов позволяют предположить наличие взаимосвязи между вероятностью инфицирования и генотипом. Более того, реакция на инфекцию частично передается по наследству, это второй важный фактор риска для здоровья. Способность справляться со стрессом как поведенческий фактор риска развития рака желудка также передается по наследству [8]. Так как инфекция очень часто передается от родителей к детям в детстве [9], должна приниматься во внимание комплексная взаимосвязь с генотипом и окружающей средой: дети родителей с генетическими факторами риска могут унаследовать эти генетические факторы риска и в то же время имеют более высокую вероятность инфицирования в связи с повышенным воздействием факторов окружающей среды. Этот замкнутый круг может быть разорван лечением родителей на ранней стадии.
Чтобы уменьшить влияние генетических факторов, настоящее исследование по проверке концепции частично проводилось на близнецах, так как в этом случае генетическая среда контролируется, но основной целью исследования было изучение воздействия Lactobacillus reuteri DSMZ17648 на инфицированных взрослых людей. В настоящее время единственным методом терапевтического лечения инфекции является эрадикационная терапия патогенных микроорганизмов с использованием комбинации блокаторов протонного насоса с несколькими антибиотиками. Этот комплексный подход имеет высокий риск нежелательных лекарственных реакций. Более того, такая терапия рекомендуется при острых гастритах или сильно выраженных симптомах, таких как язва желудка. Поэтому для пациентов, инфицированных H. pylori, но еще не имеющих патологий с клинической точки зрения, на данный момент не найдены средства терапевтического лечения [10]. Рост устойчивости H. pylori к антибактериальным препаратам и увеличивающиеся сроки эрадикационной терапии наглядно свидетельствуют о необходимости разработки альтернативного метода лечения или способов профилактики. Были предприняты попытки повысить эффективность терапии путем добавления приема Lactobacillus acidophilus к стандартной трехкомпонентной эрадикационной терапии, но они не дали каких-либо значимых результатов [11].
Мы выбрали штамм Lactobacillus reuteri DSMZ17648 путем скрининга сотен штаммов Lactobacilli в большой коллекции культур (ORGANOBALANCE GmbH, Берлин, Германия). Этот специфический штамм первоначально был классифицирован как активный фармакологический ингредиент (АФИ), так как он принадлежит к группе L. fermentum. Но так как классификация по АФИ не позволяла дифференцировать L. fermentum и L. reuteri [12], было выполнено секвенирование 16S-rRNA, в соответствии с этим методом штамм DSMZ17648 был классифицирован как L. reuteri. DSMZ17648 специфически коагрегирует с H. pylori in vitro и в искусственном желудочном соке и не оказывает негативного влияния на другие бактерии симбиотической кишечной флоры (Lang и соавт., в препарате). Эти специфические связи закрывают поверхностные структуры H. pylori и снижают подвижность Helicobacter. Предполагается, что связанные патогенные организмы не могут присоединяться к слизистой оболочке желудка и выводятся из него.
Целью разработки специфических лактобакцилл является устранение пробела в средствах терапевтического лечения инфекций, протекающих бессимптомно, а также создание для пациентов нового профилактического средства, понижающего риск развития рака желудка, таким образом можно предотвратить серьезные негативные последствия для здоровья и сократить расходы на лечение.
L. reuteri были обнаружены как в грудном молоке человека, так и в микрофлоре желудочно-кишечного тракта. Было доказано, что штаммы L. reuteri в ряде случаев благоприятно влияют на здоровье, в том числе при коликах у младенцев, желудочных расстройствах у детей и пищевой непереносимости у недоношенных детей [13].
Нами было проведено плацебо-контролируемое исследование для проверки концепции, задачей исследования было определение, может ли лечение препаратом L. reuteri DSMZ17648 (Pylopass™/Lonza)* в течение двух недель понизить уровень обсемененности желудка H. pylori у пациентов, не имеющих симптомов каких-либо заболеваний.
Материалы и методы исследования
Исследуемая популяция
В соответствии с исходными условиями настоящее исследование должно было представлять собой плацебо-контролируемое исследование однояйцевых близнецов, при котором один из близнецов получает активное лечение, в то время как его однояйцевый близнец принимает плацебо-препарат. По имеющимся данным степень соответствия реакции на инфекцию H. pylori у однояйцевых близнецов составляет 80% [7], а у двуяйцевых близнецов — 60%. Наследуемость количественных уровней колонизации H. pylori согласно имеющейся оценке составляет 0,8. Историческая распространенность инфекции H. pylori для основной популяции по имеющимся данным составляет 45%, однако по результатам последних исследований этот параметр уменьшился примерно до 25% в западном мире [14, 15]. Распространенность инфекции в Германии по данным за 1996 г. составляла 39% [16]. В менее развитых регионах распространенность инфекции гораздо выше. На основании этих данных на первом этапе исследования планировалось включить в анализ 64 пары близнецов, ожидалось, что в 29 парах будет хотя бы один зараженный близнец, а в 23 парах близнецы будут иметь одинаковое состояние, то есть оба близнеца в паре будут иметь положительные результаты теста. Так как коэффициент заболеваемости на этапе скрининга оказался ниже ожидаемого в соответствии с данными для всей популяции, в исходный проект были внесены изменения, и в исследование были включены пациенты, не являющиеся близнецами. Во втором этапе скрининга участвовали как близнецы, так и единственные дети.
Пациенты включались в исследуемую группу, если они достигли 18-летнего возраста, подписали документированное информированное согласие, а также имели положительные результаты 13 C-уреазного дыхательного теста на наличие H. pylori (Helicobacter Test INFAI®, Δδ ≥ 4‰). Критерием исключения был прием любых медицинских препаратов, которые могли повлиять на эффективность лактобацилл, имевшие место ранее хирургические вмешательства, влияющие на желудок или тонкую кишку, которые могли повлиять на результаты исследований, например гастрэктомия или обходной желудочный анастомоз, диабеты первого или второго типа, наличие случаев нарушения липидного обмена в семье, любые другие серьезные заболевания, изменение веса на > 3 кг за последние три месяца, беременность или кормление грудью, злоупотребление алкоголем или наркотиками, психиатрические расстройства.
Протокол исследования
Исследуемый продукт (активное вещество) состоял из лиофилизированных мертвых клеток штамма DSMZ17648 в форме твердых таблеток для перорального приема. Каждая таблетка содержала 5 × 10 9 клеток, суточная доза 4 таблетки составляет 2 × 10 10 клеток. Таблетки с пищевой добавкой и плацебо-таблетки имели одинаковый вес (250 мг), размер, цвет и запах.
Среди пар, где оба близнеца инфицированы, лечение было рандомизировано параллельно в течение периода, составлявшего 14 дней. Среди единственных детей активное лечение и лечение плацебо-препаратом распределялось по методу одностороннего слепого нерандомизированного перекрестного исследования. На первом этапе в течение 14 дней принимались плацебо-таблетки; после второго дыхательного теста в течение 14 дней осуществлялось активное лечение, затем снова проводился дыхательный тест. В течение четырех-шести недель после этапа лечения проводился еще один дыхательный тест.
Пациентам были даны инструкции принимать по две таблетки после завтрака и ужина. Пациенты также были проинструктированы о том, что в течение периода лечения не следует изменять образ жизни и диету и что они не должны употреблять пищевые продукты с пробиотиками и клюкву.
Пациентов попросили заполнить анкету по вопросам, связанным с исследованием, чтобы документировать самочувствие, наличие каких-либо потенциальных нежелательных лекарственных реакций, курение, употребление алкоголя, принимаемую пищу и медикаменты.
Измерения
Выявление инфекции H. pylori на этапе скрининга и количественное определение степени колонизации для проверки эффективности DSMZ17648 выполнялись путем проведения дыхательного теста, так как этот метод диагностики лучше всего подходит для определения интраиндивидуальных изменений [17]. Исследование Helicobacter Test INFAI® — это дыхательный тест для прямого неинвазивного количественного обнаружения бактерии H. pylori [14]. В основе теста лежит уреазная активность H. pylori. Специфичность (98,5%) и чувствительность (97,9%) теста Helicobacter Test INFAI® сравнимы с традиционными неинвазивными методами диагностики (эндоскопия или биопсия). Так как дыхательный тест отражает текущую степень колонизации H. pylori, он хорошо подходит для определения уменьшения концентрации или уничтожения бактерий.
Тест основан на гидролизе мочевины, меченной изотопом 13 C, с образованием аммиака и диоксида углерода, меченного изотопом 13 C, который обнаруживают в выдыхаемом воздухе. Пациент проглатывает 75 мг мочевины, обогащенной изотопом 13 С. Диоксид углерода, образующийся при распаде мочевины, содержащей изотоп, может быть обнаружен методом массспектроскопии. Так как даже в отсутствии уреазной активности в выдыхаемом воздухе присутствует небольшое количество 13 C, образующихся естественным путем, пробы выдыхаемого воздуха берутся до и через 30 минут после проглатывания мочевины, меченной изотопом 13 C. Если значения одинаковые, результаты теста считаются отрицательными, что свидетельствует о том, что человек не инфицирован H. pylori. Установлено количественное соотношение между уреазной активностью и содержанием 13 C в выдыхаемом воздухе, которое косвенно отражает уровень колонизации H. pylori.
Статистика
Все исторические и клинические данные были введены в специальную экспериментальную базу данных, анализ выполнялся с помощью SPSS (версия 16.0.2). Мы рассчитали отличие значения результатов 13 C-уреазного дыхательного теста (УДТ) от результатов исходных измерений: ΔАктивный = 13 C УДТ активный — 13 C УДТ исходный, Δ Плацебо = 13 C УДТ плацебо — 13 C Статистический УДТ исходный, ΔВымывание = 13 C УДТ вымывание — 13 C УДТ исходный. Дополнительно сравнивались абсолютные значения результатов теста на различных этапах исследования: 13 C УДТ исходный, 13C УДТ активный (через 14 дней активного лечения), 13 C УДТ плацебо (через 14 дней принятия плацебо-таблеток), 13 C УДТ вымывание (через 4–6 недель после активного лечения). Данные для пар близнецов были скомбинированы и проанализированы как для единственных детей. Метод контроля при работе с однояйцевыми близнецами сравним с перекрестным методом, но без каких-либо потенциальных эффектов переноса. Не использовался рандомизированный порядок активного лечения/плацебо, так как никакого долгосрочного плацебо-эффекта не ожидалось.
Для всех данных было проверено отклонение от нормального распределения с помощью критерия Колмогорова–Смирнова. Стандартные отклонения были проверены парным t-критерием. Потенциальные взаимосвязи между реакцией на лечение и исходным уровнем колонизации были исследованы с использованием линейной регрессии. В качестве порога значимости был задан уровень погрешности 5%. Результаты приведены в виде среднего значения ± стандартное отклонение (СО); значения соответствуют стандартной ошибке среднего значения (СОС).
Результаты
В скрининге принимали участие 364 пациента, из них 47 пар близнецов; 27 пациентов имели положительные результаты дыхательного теста, что является признаком инфицирования H. pylori. Более подробные данные о скрининге популяции приведены в табл.
На начальной стадии было начато всего 14 независимых курсов лечения без пропусков во время начальной стадии испытаний. Все 6 пар близнецов с одинаковым состоянием здоровья согласились участвовать в начальной стадии испытания, также участие приняли 4 близнеца из пар, где был инфицирован только один близнец, и 4 пациента, являющиеся единственными детьми. Так как наблюдалась высокая межиндивидуальная вариабельность количественных показателей колонизации ( 13 С УДТ Исходное), анализ снижения содержания H. pylori при приеме DSMZ17648 выполнялся на основании внутрииндивидуальных изменений после активного лечения или плацебо-лечения (сравнение ΔАктивный с ΔПлацебо). Прием плацебо-препарата не привел к значимому снижению 13 С УДТ (ΔПлацебо — 0,6 ± 5,3), в то время как после активного лечения значения 13 С УДТ уменьшились (ΔЛекарственный препарат — 4,9 ± 7,8, p = 0,026 по сравнению с плацебо), что свидетельствует об уменьшении обсемененности H. pylori. Абсолютные значения 13 C УДТ при измерении на исходном этапе, после плацебо-лечения и после активного лечения составили 14,1 ± 9,9, 12 ± 7,2 (незначимые по сравнению с исходным этапом) и 11,9 ± 5,9 (p относительно исходного значения 0,01, p относительно плацебо 0,03) соответственно.
Чтобы более подробно изучить реакцию на прием DSMZ17648, индивидуальные значения 13 C УДТ были нанесены на график, показанный на рис. 1. После активного лечения у большинства пациентов было зафиксировано снижение степени колонизации H. pylori. Реакции на прием препарата имели некоторую вариабельность: от отсутствия снижения до разницы значений более 20. Для сравнения, после 2 недель плацебо-лечения у некоторых пациентов результаты теста снизились, в то время как у других увеличились на такое же значение, что свидетельствует об отсутствии систематического эффекта.
Значения 13 C УДТ после вымывания (х ± y) незначительно отличаются от значений для активного лечения. Эффект снижения уровня колонизации сохраняется после активного лечения. Повышенная вариабильность значений на этапе вымывания по сравнению со значениями после активного лечения, скорее всего, отражает биологическую вариабельность процесса роста бактерий.
Наблюдается некоторая зависимость реакции на лечение от исходных значений (r 2 = 0,66, p = 0,01, рис. 2). Чем выше уровень колонизации, тем более ярко выражен эффект снижения уровня колонизации при приеме L. reuteri DSMZ17648. При очень низких исходных значениях эффект отсутствует или выражен в очень слабой форме, в отличие от пациентов с очень высоким уровнем колонизации инфекции, поэтому наиболее вероятно, что лечение окажется для них эффективным. При плацебо-лечении была выявлена эта же зависимость, но в меньшей степени (r 2 = 0,35, p = 0,02), возможно, это отражает эффект регрессии к среднему значению. Не исключен прямой плацебо-эффект на иммунную реакцию. Этот потенциальный эффект значительно ниже, чем специфическое действие DSMZ17648.
В соответствии с данными анкет в течение времени проведения исследования не было изменений образа жизни, например, физической активности или диеты, и общего состояния здоровья. Ни в одной из исследуемых групп не было сообщений о каких-либо нежелательных лекарственных реакциях.
Обсуждение
Настоящее исследование in vivo показало существенное снижение уровня колонизации желудка H. pylori после приема Lactobacillus reuteri DSMZ17648 здоровыми пациентами из основной популяции, у которых было выявлено инфицирование H. pylori. Основным критерием оценки было снижение количества H. pylori, измеренного с помощью 13 C-уреазного дыхательного теста (Helicobacter Test INFAI®) через 14 дней приема пищевой добавки, содержащей L. reuteri DSMZ17648, ежедневная доза составляла 2 × 10 10 нежизнеспособных лиофилизированных клеток.
Эти результаты являются серьезным основанием для предположения, что употребление DSMZ17648 может использоваться для профилактики развития вторичных заболеваний и соответствующих симптомов при инфицировании H. pylori. В будущем для подтверждения полученных результатов должны быть проведены более масштабные клинические исследования. В качестве первого этапа этих исследований будут изучены временные сроки снижения количества бактерий и восстановления бактерий после завершения лечения. Учитывая взаимосвязь между инфекцией H. pylori и нервно-психическим напряжением, кратковременное снижение количества бактерий может использоваться в периоды высокого эмоционального стресса, например, во время экзаменов, в периоды повышенной нагрузки на работе или при других психологических переживаниях.
В ходе настоящего исследования снижение количества бактерий было наиболее ярко выражено у пациентов с высоким уровнем инфицирования, в то время как у пациентов с более низкими результатами дыхательного теста (близкими к порогу обнаружения) статистически значимое снижение количества H. pylori не было зафиксировано. Однако при таких низких уровнях инфицирования длительный прием L. reuteri DSMZ17648 может также быть эффективным. Мы предполагаем, что уничтожение или замедление роста количественных показателей инфицирования может использоваться в качестве средства профилактики, что должно быть проверено в ходе более длительных наблюдений.
В предыдущих исследованиях, посвященных оценке эффективности применения широкого ряда культур пробиотиков для лечения H. pylori, были получены различные результаты. Исследование с применением L. casei показало незначительный подавляющий эффект [19]. При использовании живых клеток штамма L. brevis было зафиксировано снижение и было выдвинуто предположение о корреляции с уменьшением синтеза полиамина [20]. В случае с L. acidophilus (johnsonii) La1 было выявлено, что использование супернатанта на основе молочной сыворотки приводит к значительному снижению результатов дыхательных тестов на H. pylori, как в сочетании с омепразолом, так и без него [21].
Были выдвинуты предположения о нескольких потенциальных возможных механизмах влияния пробиотиков на H. pylori. Неиммунологический барьер является первой линией защиты от патогенных бактерий. Прием пробиотиков может усилить этот барьер за счет генерации противомикробных веществ, конкурентной борьбы с H. pylori за адгезивные рецепторы, стимуляции производства слизистого секрета и стабилизации барьера слизистой пищеварительного тракта. Противомикробное действие может объясняться не только прямым воздействием на H. pylori, но и снижением ее уреазной активности [22].
Для проявления всех этих противомикробных свойств требуются живые микроорганизмы, в то время как препарат DSMZ17648 содержит нежизнеспособные клетки, что значительно снижает вероятность потенциальных нежелательных лекарственных реакций и, следовательно, обеспечивает стабильную активность в потенциальных потребительских товарах и в составе фармацевтических и медицинских препаратов. L. reuteri DSMZ17648 имеет много потенциальных областей применения. Так как они снижают бактериальную обсемененность, они могут использоваться как для смягчения проявления острых симптомов, так и для кратковременной профилактики в периоды высокой эмоциональной нагрузки. L. reuteri DSMZ17648 также может использоваться для долговременной профилактики при хронических заболеваниях. Несмотря на то, что снижение уровня обсемененности H. pylori все еще наблюдалось через 4–6 недель после лечения, более подробный анализ эффективного периода, а также зависимости эффекта от дозы не входил в задачи настоящего исследования и должен быть изучен отдельно.
Литература
* HealthTwiST GmbH, Берлин, Германия
** Экспериментально-исследовательский клинический центр, Charité Campus Berlin-Buch (CCB), Берлин, Германия
*** ORGANOBALANCE GmbH, Берлин, Германия
# Institut für Klinische Pharmakologie, Medizinische Hochschule Hannover, Ганновер, Германия
* В РФ продукт, содержащий субстанцию Pylopass™/Lonza, зарегистрирован как Хелинорм®.
Эффективность применения Lactobacillus reuteri в клинической практике
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
В статье представлены основные сведения, касающиеся становления кишечной микробиоты, особенностей формирования иммунной системы и роли микробиоценоза кишечника в этом процессе. Отмечено, что оптимальная колонизация кишечника, а также формирование адекватного иммунного ответа являются одними из ключевых факторов развития толерантности к комменсальным микроорганизмам и противоинфекционной защиты. Особое внимание уделено различным пренатальным, неонатальным и постнатальным факторам, которые нарушают нормальную колонизацию слизистой желудочно-кишечного тракта. Одним из способов восстановления качественного и/или количественного состава кишечной микробиоты является использование пробиотиков, которые обладают антагонистической активностью в отношении патогенов, конкурируя с ними за места адгезии к эпителию слизистой оболочки и за питательные вещества, подавляя продукцию бактериальных токсинов, модулируя работу иммунной системы, улучшая микробиоценоз кишечника, поддерживая целостность слизистого барьера желудочно-кишечного тракта, контролируя прогрессирование воспаления в кишечнике. Особо отмечено, что пробиотики относятся к гетерогенной группе живых бактерий с видоспецифическими и штаммоспецифическими свойствами. Представлены данные, подтверждающие эффективность применения Lactobacillus reuteri, наиболее часто назначаемого пробиотика, у недоношенных детей, детей с острым гастроэнтеритом, младенческими коликами.
Ключевые слова: кишечная микробиота, микробиоценоз, недоношенность, кесарево сечение, пробиотики, бактерии, иммунная система, младенческие колики, Lactobacillus reuteri.
Для цитирования: Комарова О.Н. Эффективность применения Lactobacillus reuteri в клинической практике. РМЖ. Мать и дитя. 2021;4(3):277-283. DOI: 10.32364/2618-8430-2021-4-3-277-283.
Yu.E. Vel’tishchev Institute of Pediatrics of the Pirogov Russian National Research Medical University, Moscow, Russian Federation
This paper addresses the primary aspects of developing gut microbiota and the immune system and the role of gut microbiocenosis in this process. Optimal gut colonization and adequate immune response are critical factors in developing tolerance to commensal microbes and anti-infectious protection. The authors highlight various prenatal, neonatal, and postnatal factors which prevent normal colonization of gastrointestinal mucosa. One of the methods to restore the qualitative and quantitative composition of gut microbiota are probiotics. Probiotics demonstrating antagonistic activity for pathogens compete with these pathogens for the adhesion to mucosal epithelium and nutrients, thereby inhibiting the production of bacterial toxins, modulating the functions of the immune system, improving gut microbiocenosis, maintaining the integrity of the gastrointestinal mucosal barrier, and controlling gut inflammation. Probiotics are a heterogeneous group of living bacteria with species— and strain-specific properties. For example, Lactobacillus reuteri is an effective probiotic commonly prescribed in premature babies, children with acute gastroenteritis, and infantile colic.
Keywords: gut microbiota, microbiocenosis, premature, C-section, probiotics, bacteria, immune system, infantile colic, Lactobacillus reuteri.
For citation: Komarova O.N. Efficacy of Lactobacillus reuteri in clinical practice. Russian Journal of Woman and Child Health. 2021;4(3):277–283 (in Russ.). DOI: 10.32364/2618-8430-2021-4-3-277-283.
Введение
Применение пробиотиков в педиатрической практике представляет научный и практический интерес. В ходе исследований было показано, что назначение пробиотиков улучшает состав микробиоты кишечника, поддерживает целостность слизистого барьера желудочно-кишечного тракта (ЖКТ), прямо или косвенно регулирует различные функции иммунной системы, контролирует прогрессирование воспаления в кишечнике [1]. Продемонстрировано положительное влияние пробиотиков на процессы пищеварения, течение пищевой аллергии [2]. Известно также о положительном влиянии пробиотиков на течение кандидозов [3], при профилактике и лечении диареи, в том числе антибиотик-ассоциированной [4], кариеса зубов [5]. В последние годы активно изучаются свойства пробиотических микроорганизмов, способных модулировать иммунную систему и уменьшать влияние негативных факторов на бактериальный состав кишечника ребенка, в частности в период становления кишечного микробиоценоза.
Становление кишечного микробиоценоза и иммунной системы
Как известно, самым большим иммунным органом человека является кишечник. В лимфоидной ткани, ассоциированной с кишечником (GALT — gut associated lymphoid tissue), локализовано около 70–80% иммунокомпетентных клеток организма [6]. Основная роль GALT — поддержание иммунного гомеостаза, которое заключается, с одной стороны, в подавлении реакции на пищевые белки и комменсальные бактерии, с другой — в обеспечении защиты от патогенов.
Формирование адаптивной иммунной системы начинается с рождения и тесно связано с микробной колонизацией организма новорожденного ребенка. Естественная колонизация кишечника совпадает по времени с началом энтерального поступления пищевых антигенов и запускает финальные стадии созревания иммунной системы. Кишечная микробиота (КМ) участвует в запуске и последующей активации как синтеза неспецифических гуморальных факторов защиты — лизоцима, пропердина, комплемента, так и клеточных механизмов, в частности фагоцитоза. КМ стимулирует созревание лимфоидного аппарата кишечника, синтез секреторного IgA (sIgA), продукцию цитокинов и интерферонов колоноцитами [7]. Заселение кишечника именно здоровой микробиотой поддерживает адекватное состояние врожденного иммунитета и способствует формированию адаптивного иммунитета [8].
Таким образом, нарушение микробиоценоза кишечника приводит к изменению баланса Th1/Th2 в сторону преобладания Тh2-клеток, что способствует ослаблению антиинфекционной защиты и повышению риска развития аллергических реакций [10].
Факторы, влияющие на состав КМ
На бактериальный состав кишечника у младенцев влияет множество пренатальных, неонатальных и постнатальных факторов. Состав и свойства КМ во многом определяются той средой, в которой растет и развивается ребенок. Следовательно, особенности течения беременности, состояние микробиоценоза матери, характер ее питания во время беременности, образ жизни, наличие у нее соматических и инфекционных заболеваний, способ родоразрешения, а также вид вскармливания ребенка в первые часы и дни жизни могут определять здоровье ребенка в будущем [10].
Недоношенность — важный фактор нарушения колонизации кишечника ребенка. У недоношенных детей по сравнению с доношенными детьми ЖКТ незрелый, а бактериальная флора менее разнообразна. Большинство бактерий кишечника, включая Klebsiella, Enterobacteriaceae и Clostridium, являются потенциально патогенными и могут вызвать повреждение пищеварительного тракта, которое в сочетании с недостаточным функционированием врожденной иммунной системы увеличивает вероятность распространения патогенов по всему организму и развитие системной инфекции [11]. В неонатальном периоде риск распространения инфекций выше по сравнению с другими возрастными периодами, что является основным фактором риска неонатальной смертности [12].
На состав КМ влияет способ родоразрешения. Необходимо подчеркнуть, что первые микроорганизмы, заселяющие кишечник ребенка в родах, в дальнейшем в значительной мере определяют формирование его иммунитета. Известно, что КМ у младенцев, рожденных естественным путем, близка к вагинальной микробиоте матери с доминированием Bifidobacterium longum, infantis, Bacteroidetes, Lactobacillus species, Prevotella, Atopobium [13]. У детей, рожденных путем кесарева сечения, состав бактерий отличается от материнского. Преобладают бактериальные сообщества, обитающие на поверхности кожи матери, большинство которых составляют Staphylococcus, Corynebacterium и Propionibacterium spp., а колонизация кишечника видами Lactobacillus, Bifidobacterium и Bacteroides запаздывает. Помимо микрофлоры кожи матери, в 64–82% случаев КМ ребенка представлена микрофлорой родильного зала — это метициллинрезистентные штаммы S. aureus, Corynebacterium, Propionibacterium spp. [13]. Важным последствием кесарева сечения является также менее разнообразный состав КМ у детей, что может служить фактором риска развития атопии [10]. Таким образом, одним из факторов нарушения КМ выступает кесарево сечение. Детей, рожденных путем кесарева сечения, следует относить к группе высокого риска по микробиологической дезадаптации с первых дней жизни. Нарушение состава КМ у них сохраняется вплоть до года жизни.
После рождения процесс заселения кишечника микроорганизмами продолжается и модулируется многими факторами. Окружающая среда и рацион питания в течение первых 3 лет жизни — это ключевые факторы формирования КМ, близкой к КМ взрослого человека, и установления симбиоза между микробами и хозяином, что влияет на развитие его иммунной и нервной системы. Несмотря на способность КМ к адаптации, распространение генов резистентности к антибиотикам в настоящее время представляет собой серьезную угрозу здоровью людей, и основной причиной этого, по-видимому, является чрезмерное применение антибиотиков. Антибактериальная терапия обусловливает уменьшение популяции основных бактерий в кишечнике, способствуя разрастанию условно-патогенных, патогенных бактерий и грибов. Например, показано, что после 7-дневного курса амоксициллина у новорожденных происходит полная эрадикация бифидо- и лактобактерий, замещение антибиотикорезистентными штаммами, повышается активность тучных клеток и увеличивается риск развития атопии [14]. Антибиотики — нужные и жизненно необходимые средства, значительно снижающие заболеваемость и смертность. Однако их применение отрицательно сказывается на составе КМ, что требует разумного их назначения.
Факторами, определяющими становление кишечного микробиоценоза, служат особенности вскармливания: время первого кормления и вид вскармливания. Отсроченное первое прикладывание к груди матери, докорм молочными формулами в первые часы и дни жизни, а также ранний перевод на искусственное вскармливание нарушают адекватную колонизацию кишечника и способствуют развитию пищевой аллергии. Напротив, у детей, получающих грудное вскармливание, формируется здоровая КМ благодаря содержанию в грудном молоке пребиотических компонентов и пробиотических микроорганизмов. Функцию пребиотиков в грудном молоке выполняют лактоза и олигосахариды грудного молока (ОГМ). Негидролизованная лактоза и ОГМ поступают в неизмененном виде в толстую кишку, где становятся субстратом для ферментации собственными бифидобактериями, способствуя их росту. У детей, получающих исключительно грудное молоко, количество представителей Bifidobacterium в составе КМ может достигать 70% [15].
В недавно проведенном исследовании [16] оценивалась эпигенетическая траектория развития CD4 + Т-клеток у детей, матери которых получали пробиотическую терапию во время беременности, и детей, получавших пробиотики в постнатальном периоде. Было показано, что пробиотики влияют на метилирование ДНК, активируя CD4 + Т-клетки у детей, особенно при рождении. Эти изменения позволяют предположить, что пробиотики оказывают иммуностимулирующее воздействие на развивающийся плод [16].
Таким образом, созревание иммунной системы ребенка находится в тесной связи с микробиомом кишечника, и при грудном вскармливании поддерживается метаболитами, образующимися в процессе брожения пребиотических соединений, что обеспечивает формирование толерантности к комменсальным микроорганизмам и специфических реакций на патогены [17].
Пробиотики и их свойства
При нарушении качественного или количественного состава КМ развивается дисбиоз (дисбактериоз) кишечника. Дисбиоз кишечника не относится к собственно заболеваниям, но может быть причиной нарушения функций иммунной системы и ослабления противоинфекционной защиты, а также нарушения липидного обмена и многих других метаболических изменений в организме. Для эффективного восстановления КМ применяются пробиотики. Главное их преимущество заключается в способности влиять на развитие микроорганизмов, населяющих кишечник, таким образом, чтобы обеспечить правильный баланс между патогенами и собственной микробиотой, который необходим для правильного развития иммунной системы [18].
Пробиотики могут эффективно подавлять рост патогенных бактерий, таких как Clostridium perfringens, Campylobacter jejuni, Salmonella еnteritidis, Escherichia coli, различные виды Shigella, Staphylococcus, Yersinia, предотвращая развитие инфекционного процесса в организме [19]. Пробиотические бактерии (например, Lactobacillus и Bifidobacterium) могут производить деконъюгированные желчные кислоты, имеющие более выраженный антибактериальный эффект, чем соли желчи, продуцируемые в организме человека [18].
Доказано, что современные пробиотические средства не только способствуют восстановлению качественного и количественного состава КМ, но и положительно влияют на иммунный статус пациента [20, 21]. Иммуномодулирующее действие пробиотических бактерий, как и КМ, основано, с одной стороны, на формировании и поддержании состояния иммунологической толерантности к антигенам окружающей среды, с другой — на индукции и контроле иммунологических реакций против возбудителей бактериального и вирусного происхождения [22]. Пробиотики могут воздействовать на врожденный и адаптивный иммунный ответ через метаболиты, компоненты клеточной стенки и ДНК, распознаваемые клетками эпителия и иммунными клетками кишечника [18]. Ответ иммунной системы на пробиотики неоднозначный и варьирует в зависимости от вида применяемых бактерий. Некоторые штаммы модулируют продукцию цитокинов дендритными клетками in vitro и индуцируют регуляторный ответ, другие, напротив, стимулируют провоспалительный ответ. Зависимый от штамма эффект связывают со специфическим взаимодействием поверхностных структур бактерий и распознающими их рецепторами [23].
Суммируя вышесказанное, можно выделить основные механизмы действия пробиотиков: подавление роста патогенов; конкуренция с патогенами за места адгезии к эпителию слизистой оболочки и за питательные вещества; подавление продукции бактериальных токсинов; модуляция иммунной системы (местного, врожденного и адаптивного иммунитета) [24].
Важно отметить, что пробиотики относятся к гетерогенной группе живых бактерий с видоспецифическими и штаммоспецифическими свойствами, а значит, общие утверждения об их эффективности в лечении не могут быть применены к каждому пробиотическому микроорганизму. В настоящее время проводится много исследований, направленных на определение конкретных видов и штаммов пробиотиков, которые могут быть наиболее эффективными в разных ситуациях.
Свойства Lactobacillus reuteri
Наиболее изученными из пробиотических микроорганизмов являются различные штаммы лактобактерий. Один из представителей семейства Lactobacillaceae — Lactobacillus reuteri имеет штаммы с разными механизмами действия, наиболее изученным из которых является L. reuteri DSM 17938.
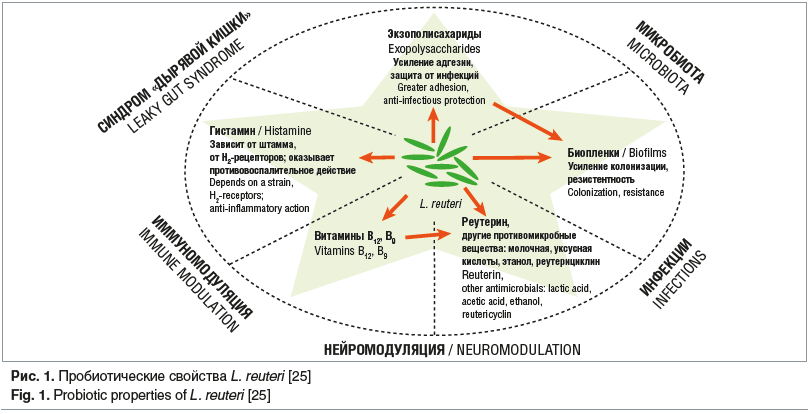
Показано, что L. reuteri активирует CD4 + T-клетки и координирует другие иммунные клетки для регуляции иммунного ответа. L. reuteri стимулирует синтез IgА, подавляет адгезию бактерий и вирусов к эпителиальным клеткам и нейтрализует токсины (рис. 1) [25]. Продуктами микробного метаболизма L. reuteri являются уксусная кислота и реутерин. Уксусная кислота снижает рН in vivo и оказывает выраженное антибактериальное действие на многие патогены; реутерин способен вызывать окислительный стресс у патогенов и эффективно предупреждает развитие воспалительной реакции [26].
Многолетнее применение L. reuteri в клинической практике не выявило каких-либо побочных эффектов, в том числе у недоношенных детей [27, 28].
Применение L. reuteri у недоношенных детей
Как уже было отмечено выше, в неонатальном периоде инфекции встречаются часто и являются основным фактором смертности детей на первом году жизни [12].
Учитывая антибактериальные и детоксицирующие свойства L. reuteri, M.Y. Oncel et al. [29] показали, что L. reuteri может значительно снижать частоту септицемии у детей с экстремально низкой массой тела при рождении с гестационным возрастом менее 32 нед. Напротив, в исследовании X. Cui et al. [30] не было получено статистически значимых различий в частоте сепсиса или локализованной инфекции между двумя группами, получавшими и не получавшими L. reuteri. Авторы предполагают, что результаты могут отличаться из-за различий в гестационном возрасте, массе тела ребенка при рождении или из-за особенностей питания. Необходимо проведение исследований с большой выборкой для того, чтобы определить способность L. reuteri предотвращать развитие инфекций у недоношенных детей [30].
Y. Liu et al. [31] установили, что L. reuteri может значительно снижать уровень TNF-α, регулируя сигнальные пути TLR2, TLR4 и NF-kB в кишечнике, и уменьшать частоту и тяжесть экспериментального некротического энтероколита (НЭК) у крыс. C. Hunter et al. [32] в ходе ретроспективного анализа данных 311 младенцев, 79 из которых получали L. reuteri, обнаружили, что частота НЭК была значительно снижена у недоношенных детей, которым назначался L. reuteri. Таким образом, в исследованиях было показано, что пробиотики могут эффективно предотвращать и снижать частоту НЭК у недоношенных детей [33].
Влияние L. reuteri на течение острого гастроэнтерита
Во всем мире диарея является одной из ведущих причин смерти в педиатрической популяции, особенно у детей в возрасте до 5 лет, несмотря на успехи, достигнутые в лечении этого заболевания [34, 35]. Поиск эффективных способов терапии актуален и продолжается в настоящее время.
Пробиотики показали свою эффективность в снижении как продолжительности диареи, так и выраженности ее симптомов. Так, по данным A. Shornikova et al. [36], прием L. reuteri с адекватной регидратацией уменьшал длительность диареи вдвое по сравнению с регидратацией без пробиотика. В работе R. Francavilla et al. [37] показано, что рецидивы диареи после перенесенного инфекционного гастроэнтерита в группе, получившей пробиотик, отмечены только в 15% наблюдений, тогда как в группе без пробиотика — в 42% (р 8 КОЕ живых L. reuteri LR92 DSM 26866, контрольную группу — 88 беременных, которые получали плацебо (9% раствор глюкозы) в течение последних 4 нед. беременности. Младенцы, рожденные от матерей обеих групп, наблюдались в течение 5 мес. по признакам и симптомам колик с повторным осмотром педиатра для регистрации возникновения колик и оценки их степени тяжести. У детей, рожденных от матерей, получавших плацебо, вероятность возникновения младенческих колик была в 2,36 раза выше, чем у детей, рожденных от матерей из группы приема L. reuteri LR92 DSM 26866 (95% доверительный интерал 1,18–4,73). Степень тяжести колик была значительно ниже в группе детей, чьи матери получали L. reuteri LR92 (p=0,01). На рисунке 2 показана частота различных степеней колик у младенцев, родившихся у женщин в сравниваемых группах. Тяжесть колик оценивали путем градации на основе Римских критериев IV по 4 степеням (0–3) [49]:
степень 0: отсутствие значительного безутешного плача;
степень 1: рецидивирующий безутешный плач с коликообразной болью по неизвестной причине менее 3 ч в день и менее 3 дней в неделю;
степень 2: рецидивирующий безутешный плач с коликообразной болью по неизвестной причине более 3 ч в день, но менее 3 дней в неделю;
степень 3: повторяющийся безутешный плач с коликообразной болью по неизвестной причине более 3 ч в день и более 3 дней в неделю.
Частота возникновения у детей колик различной степени в зависимости от способа родоразрешения и режима кормления матери не различалась между двумя группами (p>0,05) [48].
Данные, представленные выше, указывают на целесообразность назначения L. reuteri новорожденным, относящимся к группам риска: детям после проведенной антибактериальной терапии в раннем неонатальном периоде, недоношенным, рожденным путем кесарева сечения, находящимся на искусственном или парентеральном питании, а также для предупреждения развития заболеваний неонатального периода: НЭК, сепсиса, различных форм внутрибольничных инфекций. Одним из доступных способов применения L. reuteri является введение капель Максилак® Бэби (LABOMAR S.P.A., Италия). В 8 каплях (однократная суточная доза) содержится 10 9 КОЕ L. reuteri LR92. Флакон с каплями может храниться при комнатной температуре (не выше 25 °С), после вскрытия флакона — 60 дней при температуре 2–4 °C (в холодильнике). К преимуществам Максилак® Бэби можно отнести возможность применения у детей с рождения, а также отсутствие в составе лактозы и казеина.
Заключение
Колонизация кишечника ребенка естественной микрофлорой после рождения запускает финальные стадии созревания иммунной системы. Оптимальная колонизация кишечника, а также формирование адекватного иммунного ответа являются одним из решающих факторов развития толерантности и противоинфекционной защиты. Многие пренатальные, неонатальные и постнатальные факторы могут оказывать влияние на бактериальный состав кишечника младенцев, нарушая его нормальную колонизацию. Среди таких факторов наиболее важными являются: течение беременности, состояние микробиоценоза матери, характер ее питания во время беременности, образ жизни, наличие соматических и инфекционных заболеваний, способ родоразрешения, а также вид вскармливания ребенка. Дисбиоз кишечника, развивающийся при нарушении качественного и/или количественного состава КМ, может быть причиной нарушения функций иммунной системы и снижения ее противоинфекционной защиты.
Пробиотики эффективно нормализуют нарушенную КМ, восстанавливая баланс между патогенной и нормальной микрофлорой, необходимый для правильного формирования иммунной системы.
Одним из хорошо изученных пробиотических микроорганизмов является L. reuteri, доказавшая свою эффективность в многочисленных исследованиях, что позволяет с успехом использовать ее, в частности, у недоношенных детей, детей, рожденных путем кесарева сечения, детей с младенческими коликами, а также находящихся на искусственном вскармливании.
Редакция благодарит сотрудников медицинского отдела компании
«Биннофарм Групп» за предоставленный научный материал.
Editorial Board is grateful to medical department of Binnopharm group for providing scientific material required to write the review.
Сведения об авторе:
Комарова Оксана Николаевна — к.м.н., врач-гастроэнтеролог, диетолог Научно-исследовательского клинического института педиатрии имени академика Ю.Е. Вельтищева ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 125412, Россия, г. Москва, ул. Талдомская, д. 2; ORCID iD 0000-0002-3741-8545.
Контактная информация: Комарова Оксана Николаевна, e-mail: komarovadoc@yandex.ru.
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 19.06.2021.
Поступила после рецензирования 13.07.2021.
Принята в печать 05.08.2021.
Oksana N. Komarova — C. Sc. (Med.), gastroenterologist, dietologist, Yu.E. Vel’tishchev Institute of Pediatrics of the Pirogov Russian National Research Medical University; 2, Taldomskaya str., Moscow, 125412, Russian Federation; ORCID iD 0000-0002-3741-8545.
Contact information: Oksana N. Komarova, e-mail: komarovadoc@yandex.ru.
Financial Disclosure: the author has no financial or property interest in any material or method mentioned.
There is no conflict of interests.
Только для зарегистрированных пользователей
.gif)
_575.gif)