Лечение абт что такое
Антибактериальная терапия инфекционных заболеваний в отделениях реанимации и интенсивной терапии
В.Б. Белобородов
Российская медицинская академия последипломного образования, Москва
Антибактериальная терапия (АБТ) является одним из важнейших компонентов лечения пациентов отделений интенсивной терапии и реанимации (ОИТР). Применение АБТ в условиях ОИТР преследует, как правило, две цели: лечение ведущего патологического процесса и/или нозокомиальной инфекции. В обоих случаях эффективность АБТ может существенно влиять на течение и исход заболевания.
Появление в 70-е годы специализированных ОИТР для больных инфекционными заболеваниями было объективной необходимостью, связанной с появлением новых возможностей лечения. Роль АБТ бактериальных инфекций существенно возрастала в связи с тем, что основной причиной развития жизнеугрожающих состояний был именно инфекционный процесс. Развитие жизнеугрожающего состояния было тесно связано с этиологией возбудителя, его вирулентностью и способностью макроорганизма адекватно реагировать на агрессию. Поэтому эффективное подавление патогенной бактериальной флоры являлось одним из важнейших условий лечения. Естественно, что определенные особенности физиологии ответа макроорганизма на инфекцию, например, закономерные иммунологические нарушения, связанные с возрастом (маленькие дети и пожилые пациенты), также играли важную роль и являлись независимым прогностическим фактором исхода заболевания.
Особенности применения АБТ в инфекционной патологии
Огромный опыт применения АБТ у инфекционных больных был накоплен в процессе развития инфекционной патологии как клинической дисциплины. Сопоставление клинических и бактериологических данных привело к формированию феномена этиологической диагностики. Она подразумевает систему клинико-этиологических сопоставлений и выявление клинических признаков, тесно связанных с этиологией возбудителя. Применение этого подхода в дальнейшем позволило на основании клинических признаков с высокой вероятностью предполагать этиологию возбудителя. Необходимо отметить, что внедрение современных технологий микробиологических исследований в неинфекционной клинике на современном этапе может способствовать развитию аналогичного подхода в общемедицинской практике.
С другой стороны, большой опыт проведения этиотропной терапии ряда инфекционных заболеваний указал на невысокую эффективность или опасность развития неблагоприятного течения заболевания. Это касается, в первую очередь, пациентов c острыми кишечными инфекциями. Были доказаны два основополагающих положения: тяжесть состояния пациентов напрямую связана со степенью выраженности водно-электролитных расстройств, и применение АБТ может приводить к хронизации процесса и формированию носительства патогенных бактерий. Проведение этих исследований совпало по времени с внедрением в клиническую практику антибактериальных препаратов нитрофуранового ряда и левомицетина.
Эффективность АБТ в лечении анаэробной клостридиальной инфекции оценивается противоречиво. Убедительно показана первостепенная важность проведения хирургической обработки и полноценного удаления пораженных тканей в плане прогноза исхода заболевания и купирования клинических признаков (например, столбняка и газовой гангрены). Несмотря на доказанную чувствительность возбудителей этих заболеваний in vitro к ряду антибактериальных препаратов и обязательность их применения, в большинстве случаев эта мера не позволяет контролировать распространение инфекции на окружающие ткани. Развитие инфекции преимущественно в нежизнеспособных тканях, которые не перфузируются кровью, а стало быть, лишены главного пути доставки антибактериальных препаратов, ставит под сомнение эффективность АБТ. Тем более, учитывая, что важнейшим патогенетическим звеном этих инфекций является действие экзотоксинов, а не самих бактерий.
В некоторых случаях локализация возбудителей также может оказывать влияние на эффективность АБТ. Так, известна высокая эффективность пенициллинов и макролидов в отношении Corinebacterium diphtheriae. Однако локализация микроорганизмов в толще многослойных фибриновых пленок на поверхности слизистой оболочки верхних дыхательных путей, в условиях гибели подлежащего эпителия, также является важным фактором ограничения доставки антибактериальных препаратов, вероятности создания ингибирующих рост микроорганизмов концентраций антибиотиков. Применение специфических антитоксической сыворотки или иммуноглобулина для связывания экзотоксина и профилактика цитотоксических эффектов, местное применение антисептиков оказываются намного более эффективными средствами лечения по сравнению с системным применением антибиотиков.
Таким образом, в ряде инфекционных заболеваний недостаточная эффективность АБТ связана с особенностями патогенеза, локализаций возбудителя или ограниченной возможностью создания бактерицидных концентраций в области персистенции патогена.
Особенности применения АБТ при генерализованных инфекциях
Некоторые инфекционные заболевания при определенных условиях могут протекать в виде генерализованных форм. К таким заболеваниям относятся сепсис, брюшной тиф, менингококковая инфекция, лептоспироз и др. Отличительной особенностью этих инфекций является наличие бактеремической фазы, когда возбудители способны размножаться в кровотоке, вызывать генерализованную воспалительную реакцию, поражение сосудистого эндотелия и органную патологию.
Еще одной особенностью является применение АБТ у пациентов с острой печеночно-почечной недостаточностью, например, при иктерогеморрагическом лептоспирозе. В этой ситуации АБТ проводится на фоне органозаместительной терапии (продленная ультрафильтрация, гемодиализ). Характерная клиническая картина и известная чувствительность лептоспир к антибиотикам позволяют проводить эффективную эмпирическую АБТ (пенициллин, ампициллин). При этом дозировка и кратность введения антибиотиков тесно связаны со степенью выраженности почечной недостаточности и характером проведения органозаместительной терапии. В ряде случаев (например, при проведении непрерывной гемофильтрации в течение нескольких суток) выбор дозировки препарата представляет определенную проблему из-за отсутствия информации о реальной концентрации препарата в крови из-за его выделения через мембрану гемофильтра в экстракорпоральный контур.
Отсутствие характерных клинических данных, указывающих на этиологию возбудителя, резко снижает эффективность эмпирической терапии и требует применения комбинации препаратов для максимального расширения спектра антимикробной активности.
В случае развития сепсиса выбор АБТ является достаточно сложным. Это связано с многообразием клинической картины сепсиса и крайней ограниченностью клинических симптомов, позволяющих с высокой степенью вероятности предположить этиологию заболевания. Тяжесть состояния пациентов, высокая вероятность развития органной недостаточности и септического шока диктуют необходимость применения АБТ. Важными факторами, облегчающими выбор антибиотиков, являются данные микробиологического мониторинга этиологии сепсиса в конкретном регионе или стационаре. Основной тенденцией эмпирического выбора препаратов является применение комбинированной терапии (цефалоспорины III-IV поколения + аминогликозиды) или монотерапии препаратом с ультрашироким антибактериальным спектром (карбапенемы). Важным фактором выбора именно этих препаратов является их спектр антибактериальной активности и наличие достоверных данных об их эффективности именно у пациентов ОИТР.
В отсутствие бактериологических данных о возбудителе сепсиса эффективность и длительность комбинированной терапии оцениваются по клиническим данным, важнейшими из которых являются снижение интенсивности генерализованной воспалительной реакции (температуры, лейкоцитоза, палочкоядерного сдвига, тахикардии, одышки, уровня белков острой фазы). В случае проведения комбинированной терапии развитие в процессе лечения резистентности возбудителя сепсиса маловероятно, поэтому при получении позитивного клинического эффекта переход к применению других антибактериальных препаратов нецелесообразен.
После выделения возбудителя сепсиса и определения его антибиотикорезистентности АБТ может претерпеть существенные изменения. Основными принципами выбора целенаправленной АБТ являются высокая эффективность, возможность монотерапии, применение препаратов с низкой токсичностью, применение менее дорогостоящих препаратов. При подтверждении высокой эффективности одного из препаратов, выбранных для проведения комбинированной эмпирической терапии, возможен также переход на монотерапию. Последующий переход на другой препарат в процессе АБТ нецелесообразен. Принципиальное изменение АБТ у больных сепсисом может потребоваться при развитии нозокомиальной инфекции.
Особенности применения АБТ у больных гнойными менингитами
Пациенты с гнойными менингитами являются одной из наиболее тяжелых категорий пациентов инфекционных ОИТР. Это связано с несколькими проблемами: быстрым развитием патологического процесса, значительной продолжительностью догоспитального периода, крайней тяжестью при поступлении, необходимостью поддержания ингибирующей концентрации препарата в субарахноидальном пространстве. Необходимо отметить, что все пациенты ОИТР с гнойными менингитами имеют различную степень нарушения сознания, высокую внутричерепную гипертензию, симптомы дислокации структур мозга. Высокая внутричерепная гипертензия связана с несколькими факторами: развитием местной воспалительной реакции, поражением капилляров с формированием интерстициального (вазогенного) отека головного мозга. В последующем это приводит к нарушению капиллярного кровотока с развитием метаболических (гипоксических) нарушений в клетках головного мозга, снижением доставки и пенетрации антибиотиков
В случае вторичных менингитов у нейрохирургических и ЛОР-пациентов эмпирическая антибактериальная терапия должна учитывать актуальность резистентных пневмококков, метициллинрезистентного S.aureus и коагулазонегативных стафилококков. Поэтому эмпирической терапией является комбинация ванкомицина и цефалоспорина III поколения. Применение ванкомицина для лечения менингита требует дополнительного обсуждения. Это связано с очень низкой проницаемостью препарата через гематоэнцефалический барьер. Идеальным является исследование концентрации ванкомицина в ликворе в процессе проведения терапии с возможной коррекцией уровня с помощью интратекального введения препарата. Доказанная эффективность применения кортикостероидов в комплексе лечения гнойных менингитов также способствует снижению пенетрации ванкомицина.
Особенности применения АБТ при нозокомиальных инфекциях
Нозокомиальные инфекции являются неизбежным злом длительного лечения пациентов в ОИТР. Первым этапом этого процесса является колонизация кожи и слизистой госпитальными штаммами микроорганизмов. Особенностью этих штаммов является приобретение непредсказуемой антибиотикорезистентности в соответствии с практикой применения антимикробных препаратов в данном отделении или учреждении.
Факторами, способствующими переходу колонизации в нозокомиальную инфекцию, являются повреждение слизистых оболочек и кожи, длительная катетеризация сосудов и мочевых путей, имплантация инородных тел и протезов, недостаточное кормление, снижение резистентности организма и др.
Многочисленными исследованиями, проведенными в различных стационарах, показана возможность снижения количества нозокомиальных инфекций только на одну треть даже при оптимальной организации лечебного процесса. Применение антибиотиков с целью профилактики нозокомиальных инфекций оказалось неэффективным.
Особенностью нозокомиальных инфекций в инфекционных ОИТР является то, что они развиваются у пациентов, уже страдающих тяжелым или осложненным инфекционным заболеванием. В этих случаях наличие клинических признаков тяжелой инфекции приводит к стиранию остроты появления клинических симптомов присоединения нозокомиальной инфекции. Поэтому диагностика нозокомиальной инфекции является ответственным и непростым делом. Наличие клинических данных позволяет диагностировать нозокомиальную инфекцию, однако данные микробиологического исследования и антибиотикограммы играют принципиальную роль для выбора АБТ. Необходимо помнить о высокой вероятности выделения штаммов микроорганизмов, не играющих этиологической роли в отношении данного вида нозокомиальной инфекции (контаминация). Даже в том случае, когда по результатам исследования антибиотикорезистентности они могут быть расценены как нозокомиальные. Поэтому от правильности проведения забора материала, проведения микробиологического исследования и адекватной клинической интерпретации полученных результатов зависит в целом эффективность лечения нозокомиальной инфекции. Необходимо напомнить, что только повторные высевы коагулазонегативных стафилококков во всех или подавляющем количестве образцов крови, взятых, по крайней мере, из двух периферических вен (не из катетеров), могут с высокой достоверностью указывать на этиологическую роль данного возбудителя. Применение бронхоальвеолярного лаважа или взятие образца для посева из трахеи под визуальным контролем с использованием специальных защищенных щеточек являются обязательным условием в определении этиологической значимости выделения возбудителя нозокомиальной пневмонии. Получение возбудителя из стерильного, только что введенного катетера из мочевых путей является подтверждением роли данного микроорганизма в этиологии инфекции. Эти методические приемы должны стать рутинными для проведения забора материала на микробиологическое исследование. Обсуждение роли отдельных микроорганизмов в этиологической структуре нозокомиальных инфекций, их антибиотикорезистентность и рекомендации по использованию антибактериальных препаратов могут проводиться только с использованием достоверных данных.
Таблица. Наиболее частые возбудители нозокомиальных инфекций в США
| Возбудитель | Количество случаев | % |
|---|---|---|
| Инфекции кровотока | ||
| Коагулазонегативные стафилококки | 8432 | 33,5 |
| S.aureus | 3381 | 13,4 |
| Энтерококки | 3161 | 12,8 |
| Пневмония | ||
| P.aeruginosa | 8307 | 17,4 |
| S.aureus | 8292 | 17,4 |
| Enterobacter | 5466 | 11,4 |
| Инфекции мочевых путей | ||
| E.coli | 8119 | 19,2 |
| Candida albicans | 6092 | 14,4 |
| Энтерококки | 5975 | 14,1 |
| P.aeruginosa | 4757 | 11,2 |
В заключение необходимо отметить, что электрофизиологический и лабораторный мониторинг пациентов ОИТР играет важную роль для контроля состояния пациентов, планирования объема необходимого лечения и прогноза заболевания. Важность микробиологического мониторинга пациентов ОИТР с применением современных методик неизмеримо возрастает при лечении инфекций, вызванных микроорганизмами с неизвестной антибиотикорезистентностью. Недостаточное внимание к этой серьезнейшей проблеме специалистов, проводящих комплексное лечение наиболее тяжелых пациентов, может сводить на нет огромные затраты, связанные с оказанием разнообразной специализированной помощи. С другой стороны, внедрение мер по профилактике и оптимизации этиотропной терапии инфекционных заболеваний и осложнений может существенно расширить возможности и повысить эффективность оказания помощи пациентам ОИТР. Нерациональная АБТ является экономически невыгодной и снижает эффективность как интенсивной терапии, так и всего комплекса лечения тяжелых больных.
Внебольничная пневмония у взрослых (рекомендации по лечению амбулаторных пациентов)
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Диагностический минимум обследования
Помимо сбора анамнеза и физического обследования диагностический минимум должен включать исследования, позволяющие установить диагноз «внебольничная пневмония» (ВП) и решить вопрос о тяжести течения и необходимости госпитализации пациента. К ним относятся: рентгенография органов грудной клетки в 2-х проекциях, общий анализ крови.
Диагноз ВП может быть установлен только на основании клинической картины заболевания и данных физического обследования без проведения рентгенологического исследования. Однако рентгенография грудной клетки целесообразна в плане оценки тяжести заболевания и для решения вопроса о госпитализации.
Рутинная микробиологическая диагностика ВП в амбулаторной практике недостаточно информативна и не оказывает существенного влияния на выбор антибактериального препарата (категория доказательств В).
Выбор стартовой антибактериальной терапии
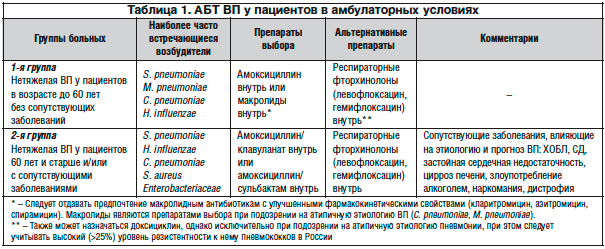
Рекомендации по эмпирической терапии ВП у амбулаторных больных представлены в таблице 1. Среди пациентов, которые могут получать лечение в амбулаторных условиях, выделяют 2 группы, различающиеся между собой по этиологической структуре и тактике антибактериальной терапии (АБТ).
В 1-ю группу включены пациенты в возрасте до 60 лет без сопутствующей патологии. У этих пациентов адекватный клинический эффект может быть получен при применении пероральных препаратов (категория доказательств С). В качестве препаратов выбора рекомендуются амоксициллин (категория доказательств D) или макролидные антибиотики. Несмотря на то, что in vitro аминопенициллины не перекрывают весь спектр потенциальных возбудителей, в ходе клинических исследований не выявлено различий в эффективности этих антибиотиков, а также отдельных представителей класса макролидов или респираторных фторхинолонов (категория доказательств А).
Макролидам следует отдавать предпочтение в первую очередь при непереносимости β-лактамов или при подозрении на атипичную этиологию заболевания (микоплазма, хламидии). В качестве альтернативных препаратов у этой группы пациентов рекомендуются респираторные фторхинолоны.
Во 2-ю группу включены лица пожилого возраста (60 лет и старше) и/или пациенты с сопутствующими заболеваниями, которые влияют на этиологию и являются факторами риска неблагоприятного прогноза при ВП:
У пациентов этой группы адекватный клинический эффект также может быть получен при назначении пероральных антибиотиков. Поскольку вероятность этиологической роли грамотрицательных микроорганизмов (в т. ч. обладающих некоторыми механизмами резистентности) у этих больных возрастает, в качестве препарата выбора рекомендуется амоксициллин/клавуланат. У пациентов данной категории возможно проведение комбинированной терапии β-лактамами и макролидами в связи с возможной хламидийной этиологией ВП. Альтернативой комбинированной терапии β–лактамами и макролидами может быть применение респираторных фторхинолонов (левофлоксацин, моксифлоксацин). Распространенную в некоторых регионах практику широкого использования аминогликозидов (гентамицин и др.) при лечении ВП следует признать ошибочной, т. к. они не активны в отношении пневмококка и атипичных возбудителей.
Парентеральное введение антибиотиков в амбулаторных условиях
Парентеральные антибиотики при лечении ВП в амбулаторных условиях не имеют доказанных преимуществ перед пероральными. Они могут применяться лишь в единичных случаях. У пациентов
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Только для зарегистрированных пользователей
Диагностика острого бронхита и внебольничной пневмонии и тактика антибактериальной терапии с применением амоксициллина

Наиболее частыми формами инфекций нижних дыхательных путей в практике врача являются острый бронхит и внебольничная пневмония. Врачу приходится принимать решение о тактике ведения таких пациентов с учетом клинической картины и результатов обследования. Вн
Abstract. The most frequent forms of lower respiratory tract infections in practice of the doctor are the acute bronchitis and community-acquired pneumonia. The doctor should make the decision on tactics of maintaining such patients taking into account a clinical picture and results of inspection. Community-acquired pneumonia is a common and potentially life-threatening respiratory disease. The severity of the problem is that during periods of influenza epidemics or other respiratory viral infections, when Streptococcus pneumoniae is activated, there is an increase in the incidence of community-acquired pneumonia. However, recent years have shown that the etiology of pneumonia has expanded significantly, and among the causes of community-acquired pneumonia, in addition to bacteria, pneumotropic viruses began to occupy an important place (new coronavirus SARS-CoV-2, MERS, influenza A viruses, including pandemic H1N1, avian influenza, bocaviruses, metapneumoviruses, etc.). The association of bacteria and viruses makes the disease worse. In the world, 5-8 people per 1,000 adults suffer from pneumonia annually, in Europe – 2-15. In Russia, cases of community-acquired pneumonia in adults exceed 1,5 million per year. In 2020, Russia registered a significant increase in the incidence of community-acquired pneumonia – 3,6 times (1856,18 per 100 thousand population), including viral pneumonia – 109 times (783,08 per 100 thousand population) due to the spread of the new coronavirus SARS-CoV-2. Approaches to diagnostics and medicamentous therapy of bronchitis and community-acquired pneumonia are considered. Clinical performance of the treatment including intake of amoxicillin is estimated, results allow to recommend amoxicillin for use in out-patient practice. For citation: Krasnova E. I., Provorova V. V., Khokhlova N. I., Kolpakova T. A., Petrenko T. I. Diagnostics of an acute bronchitis and community-acquired pneumonia and tactics of antibacterial therapy using amoxicillin// Lechaschi Vrach. 2021; 11 (24): 30-36. DOI: 10.51793/OS.2021.24.11.005
Резюме. Наиболее частыми формами инфекций нижних дыхательных путей в практике врача являются острый бронхит и внебольничная пневмония. Врачу приходится принимать решение о тактике ведения таких пациентов с учетом клинической картины и результатов обследования. Внебольничная пневмония является распространенным и потенциально угрожающим жизни заболеванием органов дыхания. Острота проблемы состоит в том, что в периоды эпидемий гриппа или других респираторных вирусных инфекций, когда активируется Streptococcus рneumoniae, отмечается рост заболеваемости внебольничной пневмонией. Однако последние годы показали, что этиология пневмонии значительно расширилась и среди причин внебольничной пневмонии важное место помимо бактерий стали занимать пневмотропные вирусы (новый коронавирус SARS-CoV-2, MERS, вирусы гриппа А, в т. ч. пандемичесий H1N1, птичьего гриппа, бокавирусы, метапневмовирусы и др.). Ассоциация бактерий и вирусов утяжеляет течение болезни. В мире пневмонией ежегодно болеют 5-8 человек на 1 тыс. взрослого населения, в Европе – 2-15. В России случаи внебольничной пневмонии у взрослых превышают 1,5 млн в год. В 2020 г. в России зарегистрирован значительный рост заболеваемости по внебольничной пневмонии – в 3,6 раза (1856,18 на 100 тыс. населения), в том числе по вирусной пневмонии – в 109 раз (783,08 на 100 тыс. населения), что обусловлено распространением нового коронавируса SARS-CoV-2. Рассмотрены подходы к диагностике и медикаментозной терапии бронхита и внебольничной пневмонии. Оценена клиническая эффективность лечения, включающего прием амоксициллина, результаты позволяют рекомендовать амоксициллин для использования в амбулаторной практике.
Формами инфекции нижних дыхательных путей, обусловливающими обращение за врачебной помощью, главным образом являются острый бронхит (ОБ) и внебольничная пневмония (ВП). В амбулаторной практике развитых европейских стран доля больных ОБ и ВП составляет 70% и 10% соответственно [1]. Поликлиническому врачу приходится принимать решение о тактике ведения данной категории пациентов на основании клинической картины и результатов дополнительного обследования. При этом эффективность лечения во многом определяется уровнем компетенции курирующего врача [2].
ОБ имеет клинические особенности в разных детских возрастных категориях. У детей раннего возраста, по нашим наблюдениям, бронхиту, как правило, предшествует воспалительный процесс в верхних дыхательных путях, который часто сопровождается лихорадкой. Кашель за счет поражения гортани и трахеи поначалу носит малопродуктивный характер, но с вовлечением в процесс крупных бронхов становится влажным. У детей старше 3 лет при возникновении ларинготрахеита сухой, грубый, даже лающий кашель, иногда чрезвычайно болезненный, сохраняется продолжительное время. Далее воспалительный процесс также может спускаться в бронхи, формируя клиническую картину ОБ. Его особенностью в детском возрасте является нередкое течение на фоне измененной иммунологической реактивности: преобладание гуморального звена иммунного ответа у детей раннего возраста препятствует адекватной противовирусной защите, почему нередки рецидивы и повторные эпизоды (реинфекции) острых респираторных вирусных инфекций. Достаточно часто возникает респираторный аллергоз за счет сенсибилизации дыхательных путей, поэтому кашель при бронхите может принимать судорожный характер, учащаться в ночное время и напоминать коклюшный, может развиться синдром длительного кашля, что требует дифференциальной диагностики с коклюшем, паракоклюшем, микоплазменной и хламидийной инфекциями. Рентгенологически в боковой проекции удается выявить увеличение лимфатических узлов, достигающее иногда значительной степени (неспецифический бронхоаденит), чем объясняется иногда астматический характер кашля при бронхите у детей этой группы [3].
Кашель – защитный механизм, направленный на восстановление проходимости дыхательных путей. Однако защитную функцию он может выполнять только при определенных реологических свойствах мокроты. Образование секрета трахеобронхиального дерева бронхиальными железами, бокаловидными клетками, секреторными клетками Кларка, эпителием бронхиол и альвеол и его продвижение в проксимальном направлении от альвеол к крупным бронхам – один из важнейших физиологических процессов в организме человека. Бронхиальный секрет состоит из поверхностного, более плотного и вязкого слоя — геля (образуется при смешивании секрета бокаловидных и серомукоидных клеток с золем), касающегося только верхушек ресничек, и лежащего под ним более жидкого слоя — золя (продуцируется клетками бронхиол и альвеол), в котором движутся реснички мерцательного эпителия. Структура геля и вязкоэластические свойства мокроты в значительной степени зависят от внутри- и межмолекулярных дисульфидных мостиков, разрушение которых приводит к уменьшению вязкости (на этом основан механизм действия истинных муколитических препаратов) [3].
Возбудители острых респираторных инфекций, размножаясь в цилиндрическом эпителии трахеи и бронхов, приводят к возникновению трахеобронхита, вызывают цитолиз и некроз эпителиоцитов, нарушают реологические свойства мокроты, вызывают гиперпродукцию вязкого секрета и снижение мукоцилиарного транспорта (клиренса). Вязкий бронхиальный секрет становится хорошей питательной средой для размножения микроорганизмов (в т. ч. вирусов, бактерий, грибов). Заболевание прогрессирует, нарастает бронхиальная обструкция, развивается оксидативный стресс.
Кашель является одним из значимых симптомов бронхита, характеристика которого позволяет сформировать суждение о вероятной природе заболевания. В частности, для вирусного бронхита типичен малопродуктивный кашель, доставляющий больному дискомфорт в связи с его навязчивостью. Бронхит бактериальной природы, встречающийся реже, чем вирусный, отличается преимущественно продуктивным кашлем с выделением слизистой или слизисто-гнойной мокроты. При наличии бактериального агента более выражены симптомы интоксикации, связанные с выделением микроорганизмами токсических продуктов, стимулирующих пирогенные реакции.
При развитии бронхообструктивного синдрома с практической точки зрения целесообразно выделять клинический тип бронхиальной обструкции – бронхоспастический или гиперкринический [4]. Симптоматика бронхоспастического типа характеризуется наличием малопродуктивного навязчивого кашля, отчетливой экспираторной одышкой с участием вспомогательной мускулатуры, вздутием (эмфизематозностью) легких, сухими, свистящими и немногочисленными влажными хрипами. Бронхиту гиперкринического типа, который чаще развивается при бактериальном инфицировании, присуще шумное дыхание, длительный влажный кашель с трудно отходящей мокротой, одышка смешанного характера с превалированием экспираторного компонента, диффузные влажные разнокалиберные хрипы.
Лечебные мероприятия больным с ОБ включают раннее начало терапии с учетом предполагаемой или известной этиологии, формы, тяжести патологического процесса. Общепринятые показания к антибактериальной терапии (АБТ) ОБ: доказанный бактериальный генез заболевания, гипертермия более 3 дней, выраженные симптомы интоксикации, лейкоцитоз более 12 × 109/л и др. ВП является распространенным и потенциально угрожающим жизни заболеванием органов дыхания. В мире пневмонией ежегодно болеют 5-8 человек на 1 тыс. взрослого населения, в Европе – 2-15. В России случаи ВП у взрослых превышают 1,5 млн в год [5]. В 2020 г. в России зарегистрирован значительный рост заболеваемости ВП – в 3,6 раза (1856,18 на 100 тыс. населения), в том числе по вирусной пневмонии – в 109 раз (783,08 на 100 тыс. населения), что обусловлено распространением нового коронавируса SARS-CoV-2 [6].
Острота проблемы состоит в том, что в периоды эпидемий гриппа или других респираторных вирусных инфекций, когда активируется Streptococcus рneumoniae, отмечается рост заболеваемости ВП. Однако последние годы показали, что этиология пневмонии значительно расширилась и среди причин ВП важное место помимо бактерий стали занимать пневмотропные вирусы (новый коронавирус SARS-CoV-2, MERS, вирусы гриппа А, в т. ч. пандемичесий H1N1, птичьего гриппа, бокавирусы, метапневмовирусы и др.). Ассоциация бактерий и вирусов утяжеляет течение болезни.
Под ВП следует понимать острое заболевание, возникшее вне стационара, или диагностированное в первые 48 часов от момента госпитализации, или развившееся у пациента, не находившегося в домах сестринского ухода/отделениях длительного медицинского наблюдения более 14 суток, проявляющееся симптомами системного воспаления (лихорадка, одышка, тахикардия, лейкоцитоз), нарушением самочувствия (отказ от еды, сонливость, неадекватность поведения), признаками инфекционного поражения нижних отделов дыхательных путей (кашель, выделение мокроты, боль в грудной клетке на высоте вдоха) и рентгенологическими признаками свежих очагово-инфильтративных изменений в легких при отсутствии очевидной диагностической альтернативы [7].
Пневмония является инфекционным заболеванием, связанным с проникновением микроорганизмов в респираторную систему. Возникающая при этом воспалительная реакция в паренхиме легких зависит от количества и вирулентности микроорганизма, состояния защитных механизмов дыхательных путей и организма в целом. Основной путь проникновения микроорганизма в легочную ткань – аэрогенный. Микроорганизм, преодолев защитные барьеры дыхательных путей, может попасть непосредственно в альвеолы и там интенсивно размножаться. Под действием токсинов микроба нарушается проницаемость капилляров, развивается серозный отек. Отечная жидкость, содержащая большое количество бактерий, быстро распространяется через альвеолярные поры на всю долю легкого, нередко вовлекая в воспалительный процесс плевру. Экссудат из серозного быстро превращается в фибринозный, пораженная часть легкого становится плотной. Нарушения проходимости бронхов, расстройства микроциркуляции, воспалительная инфильтрация, интерстициальный отек легочной паренхимы и снижение ее воздушности приводят к нарушению перфузии газов и гипоксемии; последняя сопровождается респираторным ацидозом, гиперкапнией, компенсаторной одышкой и появлением клинических признаков дыхательной недостаточности (ДН) [8].
В соответствии с МКБ-10 и Классификацией клинических форм бронхолегочных заболеваний у детей по этиологии выделяют следующие формы пневмонии: бактериальная, вирусная, грибковая, паразитарная, хламидийная, микоплазменная, смешанная [9].
По морфологическим формам выделяют очаговую, очагово-сливную, сегментарную, полисегментарную, лобарную и интерстициальную пневмонию. При очаговой форме возникает один или несколько очагов пневмонической инфильтрации размером 1-2 см.
По течению выделяют ВП острую (до 6 недель) или затяжную (более 6 недель). Хронический вариант течения пневмонии в настоящее время не рассматривается и не включен в Классификацию клинических форм бронхолегочных заболеваний у детей [9].
По тяжести различают ВП средней тяжести и тяжелую. Тяжесть ВП определяется выраженностью клинических проявлений и наличием осложнений. Выделяют следующие осложнения ВП: плевральные (плеврит), легочные (полостные образования, абсцесс), легочно-плевральные (пневмоторакс, пиопневмоторакс), инфекционно-токсический шок [9].
ВП – острое заболевание, относящееся к управляемой патологии, однако по летальности она занимает 6-е место в структуре всех причин смерти, достигая 15-30% при тяжелом течении [10]. Основными факторами, определяющими риск развития и прогноз ВП, являются детский и пожилой возраст, курение, прием некоторых лекарственных препаратов (глюкокортикостероиды, атипичные нейролептики, ингибиторы протонной помпы и др.), а также сопутствующие заболевания, такие как сахарный диабет (СД), цирроз печени, хроническая обструктивная болезнь легких (ХОБЛ), алкоголизм, острое нарушение мозгового кровообращения, почечная недостаточность, ишемическая болезнь сердца, острая и хроническая сердечная недостаточность (ХСН), фибрилляция предсердий [11, 12]. Ожирение как фактор риска тяжелого течения пневмонии связано с иммуносупрессией Т- и В-лимфоцитов, поэтому и предполагается повышенная восприимчивость пациентов к вирусным респираторным заболеваниям; у этой категории пациентов чаще применяется искусственная вентиляция легких (ИВЛ) [3].
Смертность от пневмонии в России особенно высока среди детей первого года жизни (37 случаев на 100 тыс. населения), а также среди лиц старше 55 лет (48,2 на 100 тыс.) и пожилых людей (≤ 78,5 на 100 тыс.) [13]. Основными группами риска по заболеваемости ВП являются дети до 2 лет и лица в возрасте 50 лет и старше, при этом с возрастом риск развития летального исхода при ВП увеличивается в несколько раз [14].
К числу наиболее актуальных типичных бактериальных возбудителей пневмонии относятся Streptococcus pneumoniae, Klebsiella pneumoniae, Staphylococcus aureus, Haemoplilus influenzae. У некоторых категорий пациентов существенно возросла актуальность Pseudomonas aeruginosa. С появлением в 2009 г. и распространением в популяции пандемического вируса гриппа H1N1 участились случаи возникновения тяжелой вторичной бактериальной пневмонии, возбудителями которой являются S. aureus, S. pneumoniae. Кроме того, при ВП возможна коинфекция более чем двумя возбудителями, которая может быть вызвана как ассоциацией различных бактериальных возбудителей, так и их сочетанием с респираторными вирусами, при этом отмечаются более тяжелое течение и худший прогноз [13]. Рост числа полирезистентных к воздействию антибактериальных препаратов штаммов микроорганизмов диктует необходимость поиска новых подходов к терапии и реабилитации пациентов с различными воспалительными заболеваниями системы органов дыхания.
Важна адекватность первичного осмотра пациентов, от которого во многом зависят корректная диагностическая концепция, оптимальный алгоритм лабораторно-инструментального обследования и рациональная программа лечения, в первую очередь инициальной терапии, имеющей первостепенное значение для последующего прогноза течения и исходов пневмонии.
Диагностика ВП на основании клинических симптомов сопряжена с существенными трудностями. Диагноз пневмонии необходимо выставить у постели больного, но он считается достоверным только при выявлении на рентгенограмме грудной клетки инфильтрации легочной ткани и наличии не менее двух из нижеследующих критериев [10]:
1) лихорадка выше 38 °C в течение трех и более суток;
2) кашель с мокротой;
3) физикальные симптомы пневмонии (локальное ослабление дыхания и мелкопузырчатые влажные хрипы);
4) лейкоцитоз > 10 × 10 9 /л и/или число палочкоядерных нейтрофилов > 10%.
У всех пациентов с подозрением на ВП необходима оценка сатурации уже в условиях приемного покоя. Наряду с более адекватной оценкой выраженности ДН это позволит объективизировать показания к кислородотерапии, подключению ИВЛ (запоздалое подключение малоэффективно) и отлучению от аппарата, а вместе с адекватной оценкой тяжести состояния – к своевременному переводу в отделение реанимации и интенсивной терапии [15].
Одним из самых точных методов верификации ВП является рентгенологическое исследование органов грудной клетки (РИ ОГК). РИ ОГК в прямой и боковой проекциях должно выполняться всем лицам с подозрением на ВП независимо от возраста, клинической картины, физического статуса и результатов лабораторной диагностики [11, 12]. M. Kanwar и соавт. показали, что удельный вес диагностических ошибок у больных старше 20 лет, госпитализированных в отделение интенсивной терапии с предположительным клиническим диагнозом ВП, после проведения рентгенологического исследования составлял 20,6-28,5%, тогда как на снимках несомненная пневмоническая инфильтрация выявлялась лишь у 40,8-55,3% пациентов, включенных в исследование. В течение пребывания в стационаре (на момент выписки) ВП была окончательно установлена в 58,9-75,9% случаев [16].
С целью повышения качества рентгенологической верификации ВП предлагается как дополнительный критерий компьютерная томография (КТ) ОГК и определение в сыворотке крови биомаркеров воспаления [11]. КТ ОГК рекомендуется пациентам с подозрением/верифицированным диагнозом ВП при наличии следующих показаний [17]:
Биологические маркеры как индикаторы патологических процессов внедрены в алгоритмы обследования с начала 1990-х гг. В качестве биологических маркеров при пневмонии используются прокальцитонин, пресепсин (ПСП), интерлейкин-6 (ИЛ-6), C-реактивный белок (СРБ), уровень лейкоцитов в крови [18].
Одним из лабораторных критериев синдрома системного воспалительного ответа является лейкоцитоз периферической крови более 10-12 × 10 9 /л или выявление в лейкоцитарной формуле более 10% незрелых форм, нейтрофильно-лимфоцитарное соотношение более 20, что указывает на высокую вероятность бактериальной инфекции. Лейкопения менее 4 × 10 9 /л, тромбоцитопения менее 100 × 10 9 /л и гематокрит менее 30% являются неблагоприятными прогностическими признаками при ВП [17, 19]. Однако типичный для ВП у лиц молодого возраста лейкоцитоз не всегда регистрируется у пожилых пациентов. Учитывая низкую информативность общего анализа крови для верификации ВП у пациентов пожилого и старческого возраста, особую актуальность в последнее время приобретает использование в диагностическом алгоритме количественного определения сывороточных маркеров воспаления – СРБ и прокальцитонина. Показано также достоверное повышение концентрации этих биомаркеров в крови при бактериальной инфекции, в т. ч. при ВП 21. У большинства больных при развитии ВП СРБ возрастает выше 10 мг/л (13,6-242), прокальцитонин – выше 0,05 нг/мл (0,05-3,55) 22. Наиболее ценным с практической точки зрения является исследование уровня СРБ у лиц с неопределенным диагнозом ВП (отсутствие воспалительной инфильтрации у пациентов с характерным анамнезом, жалобами и локальными симптомами, свидетельствующими в пользу легочной консолидации); при уровне СРБ более 100 мг/л его специфичность в подтверждении диагноза превышает 90%. Напротив, при значениях СРБ менее 20 мг/л диагноз пневмонии является маловероятным. Отсутствие значимого снижения уровня СРБ на фоне АБТ у госпитализированных пациентов с ВП является предиктором более высокой летальности [17]. Прокальцитонин является высокоинформативным биомаркером воспаления, концентрация которого в крови при развитии бактериальных инфекций, в т. ч. ВП, повышается. При этом уровень прокальцитонина сыворотки крови не только коррелирует с тяжестью течения заболевания, но и может использоваться в качестве предиктора неблагоприятного прогноза ВП [21, 23]. Одним из основных аспектов практической значимости прокальцитонина как биомаркера воспаления является определение его концентрации в сыворотке крови с целью оценки показаний к назначению системной АБТ и оптимизации сроков ее проведения. При использовании прокальцитонинового алгоритма ведения пациентов данной категории, основанного на регистрации уровня сывороточного прокальцитонина (первично, в динамике течения заболевания и после выздоровления), ограничивается необоснованное назначение антибактериальных препаратов (АБП), сокращается продолжительность необходимых курсов системной АБТ и, соответственно, уменьшаются медицинские затраты на лечение ВП [23]. ПСП – новый биомаркер бактериальных и грибковых системных инфекций [18]. Чем выше уровень ПСП, тем тяжелее пневмония. По данным Е. А. Титовой и соавт. (2017) ПСП у больных тяжелой пневмонией составил 642,00 ± 140,59 пг/мл, у больных нетяжелой пневмонией – 231,30 ± 54,26 пг/мл (р 7 ммоль/л;
3) тахипноэ ≥ 30/мин;
4) снижение систолического артериального давления (АД) 7 дней) курсом АБТ, не выявил существенных различий между группами [26].
При решении вопроса об отмене АБП при ВП рекомендуется руководствоваться критериями достаточности АБТ (должны присутствовать все нижеперечисленные) [17]:
Е. И. Краснова, ORCID: 0000-0003-2625-5442, krasnova-inf@rambler.ru
В. В. Проворова, ORCID: 0000-0002-3475-9934, provorova.ydif@mail.ru
Н. И. Хохлова, ORCID: 0000-0003-4497-3173, talitas@bk.ru
Т. А. Колпакова, ORCID: 0000-0001-9718-2020, t.a.Kolpakova@yandex.ru
Т. И. Петренко, ORCID: 0000-0002-9624-5234, tipetrenko@gmail.com
ФГБОУ ВО НГМУ Минздрава России; 630099, Россия, Новосибирск, Красный пр-т, 52
Сведения об авторах:
Краснова Елена Игоревна, д. м. н., профессор, заведующая кафедрой инфекционных болезней ФГБОУ ВО НГМУ Минздрава России; 630099, Россия, Новосибирск, Красный пр-т, 52; krasnova-inf@rambler.ru
Проворова Вероника Валерьевна, к. м. н., доцент кафедры инфекционных болезней ФГБОУ ВО НГМУ Минздрава России; 630099, Россия, Новосибирск, Красный пр-т, 52; provorova.ydif@mail.ru
Хохлова Наталья Игоревна, к. м. н., доцент кафедры инфекционных болезней ФГБОУ ВО НГМУ Минздрава России; 630099, Россия, Новосибирск, Красный пр-т, 52; talitas@bk.ru
Колпакова Татьяна Анатольевна, д. м. н., профессор кафедры туберкулеза ФПК и ППВ ФГБОУ ВО НГМУ Минздрава России; 630099, Россия, Новосибирск, Красный пр-т, 52; t.a.Kolpakova@yandex.ru
Петренко Татьяна Игоревна, д. м. н., профессор кафедры фтизиопульмонологии лечебного факультета ФГБОУ ВО НГМУ Минздрава России; 630099, Россия, Новосибирск, Красный пр-т, 52; tipetrenko@gmail.com
Information about the authors:
Elena I. Krasnova, Dr. of Sci. (Med.), Professor, Head of the Department of Infectious Diseases at FSBEI HE Novosibirsk State Medical University of the Ministry of Health of the Russian Federation; 52 Krasny Prospekt, Novosibirsk, 630099, Russia; krasnova-inf@rambler.ru
Veronika V. Provorova, MD, Associate Professor of the Department of Infectious Diseases at FSBEI HE Novosibirsk State Medical University of the Ministry of Health of the Russian Federation; 52 Krasny Prospekt, Novosibirsk, 630099, Russia; provorova.ydif@mail.ru
Nataliya I. Khokhlova, MD, Associate Professor of the Department of Infectious Diseases at FSBEI HE Novosibirsk State Medical University of the Ministry of Health of the Russian Federation; 52 Krasny Prospekt, Novosibirsk, 630099, Russia; talitas@bk.ru
Tatiana A. Kolpakova, Dr. of Sci. (Med.), Professor of the Department of Tuberculosis of the Faculty of Advanced Training and Professional Retraining of Physicians at FSBEI HE Novosibirsk State Medical University of the Ministry of Health of the Russian Federation; 52 Krasny Prospekt, Novosibirsk, 630099, Russia; t.a.Kolpakova@yandex.ru
Tatiana I. Petrenko, Dr. of Sci. (Med.), Professor of the Department of Phthisiopulmonology of the Faculty of Medicine at FSBEI HE Novosibirsk State Medical University of the Ministry of Health of the Russian Federation; 52 Krasny Prospekt, Novosibirsk, 630099, Russia; tipetrenko@gmail.com
Диагностика острого бронхита и внебольничной пневмонии и тактика антибактериальной терапии с применением амоксициллина/ Е. И. Краснова, В. В. Проворова, Н. И. Хохлова, Т. А. Колпакова, Т. И. Петренко
Для цитирования: Краснова Е. И., Проворова В. В., Хохлова Н. И., Колпакова Т. А., Петренко Т. И. Диагностика острого брон¬хита и внебольничной пневмоии и тактика антибактериальной терапии с применением амоксициллина // Лечащий Врач. 2021; 11 (24): 30-36. DOI:10.51793/OS.2021.24.11.005
Теги: инфекции нижних дыхательных путей, пневмотропные вирусы, Streptococcus рneumoniae