Ледяная кислота что это
Важно знать в каких пропорциях разводить уксусную кислоту.
Уксус – это продукт брожения вина, который известен человеку с очень давних времен. Впервые данное вещество применяли в третьем веке до нашей эры. Известный грецкий ученый Теофраст первым описал воздействие уксуса на металлы, приводящее к появлению некоторых пигментов, используемых в искусстве.
Еще в Древнем Риме готовили специально вино в свинцовых горшках. Такое вино было очень прокисшее, что и являлось его отличительной особенностью. В результате получался напиток повышенной сладости, который имел название «сапа». «Сапа» в своем составе содержала очень много ацетата свинца – того самого сладкого вещества. Из-за этого напитка в римской аристократии было очень распространено свинцовое отравление. В начале VIII века Джабирибн Хайян – арабский алхимик, впервые смог получить уксусную кислоту посредством перегонки.
Уксусная кислота – это бесцветная жидкость с характерным для нее кислым вкусом и резким запахом. Она гигроскопична. В воде растворяется в неограниченных пределах, поэтому следует наперед знать в каких пропорциях разводить уксусную кислоту. Она способна смешиваться с большинством растворителей, но лучше всего с HCl, HF, HBr, HI. Существует в виде линейных и циклических димеров.
Как получают уксусную кислоту?
Одним из наиболее распространенных промышленных способов получения уксусной кислоты является окисление ацетальдегида кислородом воздуха. Процесс выполняется в присутствии специального катализатора – ацетата марганца при температуре от 50 до 60 °С.
2CH3CHO + O2 → 2 CH3COOH
Ранее использовались другие методы получения уксусной кислоты, такие как окисление бутана и ацетальдегида. Окисление ацетальдегида происходило в присутствии марганца при повышенном давлении и температуре. На выходе можно было получить 95% уксусной кислоты.
Но все же натуральная кислота – это та, которая получается путем брожения. Это может быть виноградное или яблочное вино.
Свойства данного вещества могут изменяться в зависимости от процентного содержания в ней воды. Из-за этого много веков химики считали, что кислота из ацетатов, и кислота из вина – это два разных вещества. Естественно это мнение было ошибочным. Все зависит от концентрации воды.
Виды уксусной кислоты.
Ледяную уксусную кислоту получают путем синтеза, либо брожением нескольких органических веществ. Также ледяная кислота всегда содержится в продуктах сухой перегонки определенных сортов дерева.
70-80% раствор уксусной кислоты называется уксусной эссенцией. Уксусная эссенция – это торговое название водного раствора пищевой уксусной кислоты, которую получают брожением уксуснокислых спиртовых жидкостей. Как правило, уксусная эссенция используется в процессе приготовления маринадов, столового уксуса и консервирования продуктов. Бывают случаи, когда в рецепте для закрутки нужна уксусная эссенция, а на кухне есть только обычный столовый 9% уксус, или наоборот. Большинство хозяек не знают, как выйти из этого положения. Поэтому следует знать, что данные жидкости взаимозаменяемые. Главное знать, как правильно разбавить уксусную кислоту, а именно в каких пропорциях.
Например, из столового уксуса необходимо получить 70% раствор уксусной эссенции. При этом нужно уменьшать количество воды на столько, сколько предусматривается добавлять укуса. Формула расчета очень простая:
1 столовая ложка уксусной эссенции = 8 столовым ложкам уксуса 9% на 7 столовых ложек воды; 1 столовая ложка уксусной эссенции = 12 столовым ложкам уксуса 6% на 11 столовых ложек воды; 1 столовая ложка уксусной эссенции = 21 столовая ложка уксуса 3% на 20 столовых ложек воды.
Если кто-то выпил уксусную кислоту в чистом виде, то его ждут тяжелые ожоги слизистых оболочек глотки и полости рта, а также поражается желудок и пищевод. К наиболее распространенным последствиям всасывания уксусной кислоты относятся гемолиз, гемоглобинурия, ацидоз, а также нарушение свертываемости крови.
Уксус (3-15% водный раствор уксусной кислоты) – продукт с определенным содержанием уксусной кислоты. Зачастую данное вещество получают в результате микробиологического синтеза при помощи уксуснокислых бактерий из специального спиртосодержащего сырья. Также столовый уксус можно получить из ледяной уксусной кислоты или укосной эссенции, нужно только знать, как разводится уксусная кислота.
Это слабо окрашенная или бесцветная прозрачная жидкость с резким кислым вкусом и специфическим неприятным ароматом. Уксус подразделяют на синтетический и натуральный. Он широко используется в кулинарии.
Пищевой уксус натурального типа вырабатывается в таком ассортименте: Фруктовый и яблочный (из плодового сырья). Спиртовой (из этилового спирта для пищевого производства). Винный (из винограда и виноматериалов). Бальзамический (из винограда и виноматериалов путем длительного выдерживания в бочках из различных пород дерева). Ароматизированный спиртовой с натуральными ароматизаторами (экстрактами растений, специями). Солодовый. Сывороточный (из очищенной молочной сыворотки).
Что касается синтетического уксуса, то для пищевых целей его выпускают в чистом виде и с добавлением различных ароматизаторов (синтетических, идентичных натуральным и натуральных). Следует отметить, что в некоторых странах запрещено производство уксуса для пищевых целей (Болгария, США и Франция).
Разбавляем уксусную эссенцию правильно.
Уксус является незаменимым помощником в быту, а именно на кухне. Существует уксус различной концентрации, но наиболее часто хозяйки используют укус 6% и 9% концентрации. Уксусную эссенцию не используют по причине незнания или неумения того, как приготовить 3 раствор уксусной кислоты, имея при этом 70% эссенцию.
На сегодняшний день на бутылках с этикетками уксусной эссенции производители пишут, что ее нужно разбавить с водой в соотношении 1:20, но это не совсем верно. Также существуют бутылки, где такой надписи вовсе нет. Поэтому нужно знать, как использовать уксусную эссенцию, чтобы получить столовый укус различной концентрации.
Для разведения эссенции нужно взять холодную воду, отфильтрованную или кипяченую. За условную единицу (1 часть) можно считать 1 столовую ложку. Расчет на калькуляторе для уксуса покажет обратное соотношение уксусной эссенции к столовому уксусу.
Чтобы приготовить 3% уксус, нужно взять 1 часть уксусной эссенции и разбавить ее в 22 или 22,5 частях воды, то есть получается соотношения 1:22 или 1:22,5. Если рассчитывать на специальном калькуляторе для уксуса, то вместо 1 столовой ложки, которая содержит 15 мл жидкости, 70%-ного уксуса необходимо взять 24,9 столовых ложки 3% уксуса.
Для приготовления 4%-ного уксуса следует взять 1 часть эссенции и разбавить ее в 17 частях воды. Получается соотношение 1:17. Из расчета на специальном калькуляторе для уксуса показатели следующие: вместо 1 столовой ложки 70%-ного уксуса следует взять 18,6 столовых ложек 4%-ного столового уксуса.
Если нужно приготовить 5%-ный уксус, тогда соотношение будет 1:13, то есть одну часть уксусной эссенции необходимо разбавить в 13 частях воды. Рассмотрев расчет на калькуляторе для укуса покажет, что вместо одной столовой ложки 70%-ного уксуса следует взять 14,9 столовых ложки столового уксуса с концентрацией 5%.
Если вы не знаете, как развести уксусную кислоту до 6 уксуса, тогда нужно взять одну часть уксусной эссенции и разбавить ее в 11 частях воды, то есть в соотношении 1:11. Расчет на калькуляторе для уксуса покажет, что вместо одной столовой ложки уксусной эссенции необходимо взять 12,4 столовых ложки уксуса 6%.
Для приготовления 7%-ного столового уксуса из уксусной эссенции следует взять одну часть эссенции и разбавить ее в 9 частях воды (соотношение 1:9). Обратный расчет на калькуляторе покажет, что вместо одной столовой ложки 70%-ной уксусной кислоты необходимо взять 10,6 столовых ложек уксуса с концентраций 7%.
Чтобы приготовить столовый уксус с концентрацией 8% нужно взять одну часть уксусной эссенции и разбавить ее в соотношении 1:8, то есть в 8 частях воды. Расчет на калькуляторе для уксуса покажет, что вместо одной столовой ложки 70%-ного уксуса следует взять 9,3 столовых ложки уксуса 8%-ного.
Перед тем как развести уксусную кислоту до 9 процентного уксуса, нужно удостовериться, что эссенция имеет концентрацию 70%. После этого одну часть уксусной эссенции следует разбавить в 7 частях воды (соотношение 1:7). Расчет на калькуляторе покажет, что вместо одной столовой ложки эссенции с концентраций 70% необходимо взять 8,2 столовых ложек 9%-ного столового уксуса.
Чтобы приготовить 10%-ный столовый уксус, берется одна часть уксусной эссенции и разбавляется в соотношении 1:6, то есть в 6 частях воды. Из расчета на «уксусном» калькуляторе будет видно, что вместо одной столовой ложки 70%-ного уксуса следует взять 7,4 столовых ложки уксуса с концентрацией 10%.
Для приготовления 30%-ного уксуса, что бывает очень необходимо в случае консервирования различных овощей, нужно одну часть эссенции разбавить в 1,5 частях воды, то есть в соотношении 1:1,5. Расчет на калькуляторе для уксуса покажет, что вместо одной столовой ложки 70%-ного уксуса следует взять 2,4 столовых ложки уксуса с концентрацией 30%.
Бывают случаи, когда вместо 70%-ного уксуса люди по ошибке покупают 30%-ный. Но это не проблема, поскольку его также можно легко разбавить, только нужно знать, как правильно развести укосную кислоту с концентраций 30%, поскольку пропорции уже будут другими.
Для того, чтобы из уксусной эссенции, которая имеет концентрацию 30% получить обычный 3%-ный столовый уксус нужно ее разбавить в соотношении 1:10. То есть одна часть уксусной эссенции разбавляется в 10 частях воды. Обратный расчет на калькуляторе для укуса покажет, что вместо одной столовой ложки 30%-ного уксуса следует взять 1,4 столовых ложки столового уксуса с концентраций 3%.
Для приготовления 4%-ного столового укуса из уксусной эссенции с концентрацией 30% нужно одну ее часть разбавить в 7 частях воды, то есть в соотношении 1:7. Если произвести расчет на специальном калькуляторе для укуса, то он покажет, что вместо одной столовой ложки 30%-ного уксуса следует взять 7,8 столовых ложек обычного 4%-ного уксуса.
Чтобы приготовить столовый уксус с концентрацией 5% следует разбавить одну часть 30%-ной уксусной эссенции в 6 частях воды (соотношение 1:6). Выполнив расчет на калькуляторе для уксуса можно удостовериться, что вместо одной столовой ложки 30%-ного укуса необходимо взять 6,2 столовых ложки укуса с концентрацией 5%.
Если вы не знаете, как сделать из уксусной кислоты 6 уксус, тогда вам нужно взять одну часть уксусной эссенции с концентраций 30% и разбавить ее в 5 частях холодной, инфильтрированной воды, то есть в соотношении 1:5. Обратный расчет на специальном калькуляторе для укуса покажет, что вместо одной части эссенции необходимо взять 5,2 столовых ложки обычного столового уксуса с концентрацией 6%.
В ходе приготовления столового уксуса с концентрацией 7%, по сути ничего не меняется кроме пропорции. Следует взять одну часть 30%-ной уксусной эссенции и разбавить ее в 4 частях воды. Расчет на «уксусном» калькуляторе покажет, что вместо 1 столовой ложки 30%-ного уксуса следует взять 4,4 столовых ложки 7%-ного столового уксуса.
Чтобы приготовить из уксусной эссенции с концентрацией 30% обычный 8%-ный столовый уксус нужно взять одну часть эссенции и разбавить ее в 3,5 частях воды. Соотношение будет 1:3,5. Из расчета на специальном калькуляторе для укуса покажет, что вместо одной столовой ложки укуса с концентрацией 30% следует взять 3,9 столовых ложки обычного 8%-ного столового уксуса.
Перед тем как перевести уксусною кислоту в уксус 9 следует заранее подготовить холодную отфильтрованную воду и проверить имеет ли уксусная эссенция концентрацию 30%, поскольку ниже будет представлено соотношение именно для этой концентрации. Одну 30%-ной уксусной кислоты нужно разбавить в 3 частях воды. Если рассмотреть расчет на калькуляторе для уксуса, то вместо одной столовой ложки уксуса с концентрацией 30% следует взять 3,4 ложки обычного 9%-ного уксуса.
Для приготовления 10%-ного уксуса из уксусной эссенции с концентрацией 30% нужно взять одну ее часть и разбавить в 2,5 частях воды (соотношение 1:2,5). Расчет на калькуляторе для уксуса покажет, что вместо одной столовой ложки 30%-ного уксуса необходимо взять 3,1 столовых ложки обычного столового уксуса с концентрацией 10%.
Итак, выше были рассмотрены наиболее распространенные соотношения получения уксуса определенной концентрации. Но вы всегда можете сами добиться нужной концентрации, для этого следует знать одну небольшую формулу: K = Сисх/Стр. В этой формуле К – это коэффициент, Сисх – исходная концентрация, Стр – требуемая концентрация. Чтобы эту формулу было проще понять рассмотрим небольшой пример.
Нам нужно разбавить 70%-ную уксусную эссенцию, так, чтобы получить столовый уксус с концентраций 2%. Подставляем значения в формулу: К = 70/2 = 35. Таким образом, чтобы получить 2%-ный уксус, нужно 1 часть эссенции развести 35 частями воды.
Техника безопасности при работе с уксусной эссенцией.
Уксусная эссенция или в разбавленный пищевой уксус очень часто являются виновниками ожогов и отравления. Наиболее часто вызывает отравление и ожоги именно уксусная эссенция с концентрацией 70%. Это происходит по причине того, что большинство людей не знают, как перевести уксусную кислоту в укус 9 и делают это «на глаз». Не только 70%-ная уксусная кислота может вызвать ожоги и отравление, этого можно добиться и 30%-ной кислотой. Даже укус с концентрацией 2% является опасным, для глаз особенно.
Если уксусная эссенция была принята внутрь, то сразу же во рту, глоте и по ходе всего пищеварительного тракта образуется ожог, вызывающий резкую боль. Боль будет продолжаться при глотании и продолжается около 10 дней. Ожог желудка, кроме боли, сопровождается рвотой с кровью. Попадая в гортань, уксусная эссенция вызывает осиплость голоса и оттек, который может привести к затруднению дыхания, свистящему дыханию, посинению кожи и удушью.
Поэтому следует запомнить такие правила:
Первая помощь при отравлении уксусом или уксусной эссенцией.
Если вы неправильно выполнили разбавление уксусной кислоты, или каким-либо другим способом отравились уксусной кислотой, тогда нужно неотложно прибегать к первой помощи. В случае попадания в глаза, их нужно немедленно, обильно и длительно промывать их холодной водой, после этого закапать 1-2 капли новокаина. После этого нужно капать специальные антибиотики, например, 0,25%-ный раствор левомицетина.
Раздражение верхних дыхательных путей устраняется полосканием горла и носа холодной водой, ингаляцией раствором соды. Также рекомендуется пить теплую воду боржоми или молоко с содой.
В случае попадания на кожу, ее нужно тщательно промыть водой из-под крана. Можно использовать мыло или 0,5-1%-ный раствор щелочи. Место ожога следует обработать дезинфицирующим раствором, лучше всего фурацилином. Обработать место ожога дезинфицирующими растворами, например, фурацилином.
Если же человек выпил уксусную кислоту, тогда необходимо немедленное промывание желудка при помощи толстого зонда, который смазывается растительным маслом. В холодную воду рекомендуется добавить яичный белок или молоко. Применять слабительные средства и соду категорически запрещено. Если выполнить промывание желудка не удается, тогда пострадавшему следует выпить 3-5 стаканов холодной воды и вызвать искусственную рвоту. Такую процедуру нужно повторить 3-4 раза. Применять рвотные средства противопоказано. Принимать внутрь можно крахмал, взбитые яичные желтки, молоко и слизистые отвары. На живот можно положить что-то холодное. Рекомендуется глотать небольшие кусочки льда. Во избежание болевого шока пострадавшему следует ввести сильные анальгетики (морфин, промедол). В условиях стационара проводится интенсивная терапия и симптоматическое лечение.
Характеристика и свойства уксусной кислоты
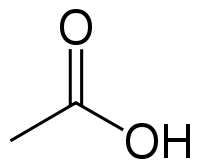
Уксусная кислота (или этановая) – органическое химическое соединение, относящееся к карбоновым кислотам (в состав их формулы входит карбоксильная группа – COOH). Это вещество известно человечеству с древних времен. Без нее невозможно производство многих пищевых продуктов и получение органических веществ.
Общая характеристика, формула
Химическая формула вещества СН3СООН. При нормальных условиях это бесцветная жидкость, обладающая резким характерным запахом и кислым вкусом. Попадание концентрированного вещества на слизистые оболочки вызывает химический ожог. «Ледяная» уксусная кислота 99 процентов обладает высокой гигроскопичностью, т.е. она способна поглощать водяной пар из атмосферного воздуха.
В уксусе могут растворяться не только жидкости, но и газы. Например, в нем растворяются фтороводород HF, хлористый водород HCl и бромистый водород HBr.
Соли рассматриваемого химического вещества называются ацетатами. Такое же наименование имеют и сложные эфиры. В качестве пищевой добавки применяется раствор уксусной кислоты с концентрацией 3 – 9%. В составе уксусной кислоты не может быть никаких примесей.
История открытия уксусной кислоты
Рассматриваемое вещество известно человеку с первобытных времен. СН3СООН образуется при скисании вина (отсюда и другое название – винный уксус). Впервые химические свойства уксуса описано в Древней Греции в 3 веке до н.э. В то время это вещество применялось для получения красителей. В Древнем Риме большой популярностью пользовался так называемый свинцовый сахар – ацетат свинца. Эта соль была причиной хронических отравлений и болезней римской аристократии.
Химическое строение уксуса впервые начал исследовать французский химик Дюма: он опубликовал труд о замещении атома водорода в органических соединениях атомом хлора. Так он получил хлоруксусную кислоту.
В середине 19 века немецкий химик А. Кольбе синтезировал уксус путем хлорирования сероуглерода CS2 до тетрахлометана CCl4, который путем пиролиза превращался в тетрахлорэтилен C2Cl4. Дальнейшее воздействие хлором водного раствора тетрахлорэтилена дало возможность получить трихлоруксусную кислоту. После электролитического восстановления ученый получил СН3СООН.
Еще в начале ХХ века значительное количество уксуса проводилось путем перегонки древесины.
Получение и производство
На ранних этапах развития индустрии вещество уксусная кислота получали путем окисления бутана и ацетатальдегида. Этот альдегид окислялся в присутствии катализатора ацетата марганца при высоком давлении и температуре. Реакция имела такой вид: 2СН3СНО + О2→2СН3СООН.
Окисление же бутана проходило при высоком давлении и в присутствии катализатора ацетата кобальта. Реакция имела такой вид: 2С4Н10 + 5О2→ 2СН3СООН.
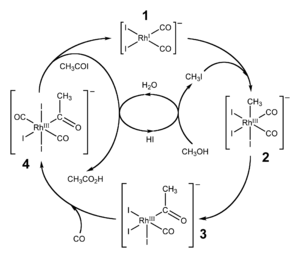
В результате подорожания нефти (а рассмотренные способы базировались на окислении продуктов ее крекинга) сделали такие химические реакции экономически невыгодными. Более совершенный способ получения уксусной кислоты – это каталитическое карбонилирование метанола (древесного спирта) путем воздействия на него окисью углерода. Реакция имеет такой вид: СН3СОН + СО → СН3СООН. Катализатором служит йодистая соль кобальта.
С 1970 г. компания Монсанто предложила использовать в качестве катализатора родиевые соли. В результате производство уксусной кислоты заметно возросло.
В процессе биохимического производства применяется окисление этилового спирта микроорганизмами. Реакция проходит при участии фермента алькогольдегидрогеназы.
Также пищевую добавку уксусную кислоту можно получить путем окисления этилового спирта: С2Н5ОН + О2→ СН3СООН + Н2О.
Химические и физические свойства
Физические свойства уксусной кислоты следующие:
В следующих примерах показаны кислотные свойства уксусной кислоты.
Качественной реакцией на наличие ацетатов является их взаимодействие с сильными кислотами. Уксус вытесняется из водных растворов солей. При этом появляется характерный запах.
Хранение и транспортировка
Промышленная уксусная кислота наливается в транспортную тару (оцинкованные металлические бочки или канистры из полимерных материалов). В магазины раствор поступает в стеклянных или пластиковых бутылках с навинчивающимися крышками или пробками.
Хранить это вещество нужно в плотно закрытой таре в помещениях, которые специально приспособленные для хранения воспламеняющихся веществ. Места хранения уксусной кислоты должны быть защищенными от попадания прямых солнечных лучей и осадков.
Класс опасности уксусной кислоты – 8: едкие и коррозийные вещества.
Перевозку нужно осуществлять в цистернах из нержавеющей стали. Они не должны иметь нижнего слива. Наливные отверстия, люки оборудуются герметичными резиновыми, полиэтиленовыми прокладками, которые предотвращают расплескивание жидкости в процессе перевозки.
ООО «Эверест» осуществляет оптовые поставки уксусной ледяной (этановой) кислоты по выгодным ценам. Подробнее по телефону: +7 (812) 448-47-55.
Уксусная кислота
| Уксусная кислота | |
 | |
 | |
| Общие | |
|---|---|
| Химическая формула | CH3COOH |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветная жидкость |
| Молярная масса | 60,05 г/моль |
| Плотность | 1,0492 г/см³ |
| Термические свойства | |
| Температура плавления | 16,75 °C |
| Температура кипения | 118,1 °C |
| Критическая точка | 321,6 °C, 5,79 МПа |
| Молярная теплоёмкость (ст. усл.) | 123,4 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | −487 кДж/моль |
| Химические свойства | |
| pKa | 4,76 (Ka=1,75*10-5) |
| Оптические свойства | |
| Показатель преломления | 1,372 |
| Структура | |
| Дипольный момент | 1,74 Д |
| Классификация | |
| Рег. номер CAS | 64-19-7 |
У́ксусная кислота (эта́новая кислота) — органическое вещество с формулой CH3COOH. Слабая, предельная одноосно́вная карбоновая кислота. Производные уксусной кислоты носят название «ацетаты».
Содержание
История
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к третьему веку до н. э. Греческий ученый Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения «свинцовых белил», а также ярь-медянки (зелёной смеси солей меди, содержащей помимо всего ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». «Сапа» содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют «свинцовым сахаром» или «сахаром Сатурна». Высокая популярность «сапы» была причиной хронического отравления свинцом, распространенного среди римской аристократии. [1]
В VIII веке арабский алхимик Джабир ибн Хайян впервые получил концентрированную уксусную кислоту путем перегонки.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается ацетон, вполне промышленный способ до середины 20 века).
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту. [2]
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тыс. тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго. [1] [3]
Физические свойства
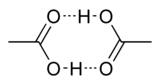
Абсолютная уксусная кислота называется ледяной, ибо при замерзании образует льдовидную массу (см. изображение справа).
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
Получение
В промышленности
Окислительные методы
Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 %.
Окисление н-бутана проводилось при температуре 150—200 °C и давлении 150 атм. Катализатором этого процесса являлся ацетат кобальта.
Каталитическое карбонилирование метанола
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом. [7] Катализатором превращения служил йодид кобальта.
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году. [8] [9] Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO). [5]
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты. [10]
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
Биохимический способ производства
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольоксидазы. Это сложный многоступенчатый процесс, который описывается формальным уравнением [12] :
Химические свойства
Уксусная кислота обладает всеми свойствами карбоновых кислот. Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.
Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями. [13]
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты.
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота.
Этим путем могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты.
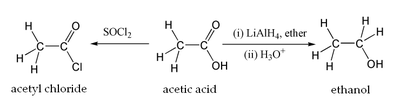
Уксусная кислота вступает во все реакции, характерные для карбоновых кислот. Она может быть восстановлена до этанола действием алюмогидрида лития. Уксусная кислота также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусный кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана.
Применение
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
Безопасность
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Порог восприятия запаха уксусной кислоты в воздухе находится в районе 0,4 мг/л. ПДК в атмосферном воздухе составляет 0,06 мг/м³, в воздухе рабочих помещений — 5 мг/м³. [4]
Последствиями приёма концентрированной уксусной кислоты являются тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка; последствия всасывания уксусной эссенции — ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлыми желудочно-кишечными кровотечениями. Характерно значительное сгущение крови из-за потери плазмы через обожжённую слизистую оболочку, что может вызвать шок. К опасным осложнениям отравления уксусной эссенцией относятся острая почечная недостаточность и токсическая дистрофия печени.
При приёме уксусной кислоты внутрь следует выпить большое количество жидкости. Вызов рвоты является крайне опасным, так как вторичное прохождение кислоты по пищеводу усугубит ожог. Показано промывание желудка через зонд. Необходима немедленная госпитализация.