Летучее водородное соединение что это
Гидриды
Водородные соединения – это сложные вещества, состоящие из двух элементов, один из которых водород. Водородные соединения разделяют на солеобразные гидриды и летучие водородные соединения.
Летучие водородные соединения НЭ – это соединения неметаллов с водородом. Степень окисления водорода равна +1.
| Летучие водородные соединения НЭ – это соединения неметаллов с водородом | Солеобразные гидриды ЭН – это соединения металлов IA, IIA групп и алюминия с водородом |
| Степень окисления водорода равна +1. Для солеобразных гидридов характерны некоторые свойства солей: гидролиз, обменные реакции и т.д. | |
| Элементы IVА гр.: ЭН4 (SiH4 – силан, CH4 – метан) Элементы VА гр.: ЭН3 (NH3 — аммиак, PH3 — фосфин, AsH3 – арсин, SbH3 – стибин) Элементы VIА гр.: Н2Э (Н2S – сероводород, H2Se – селеноводород, Н2Те – теллуроводород и т.д.) Элементы VIIА гр.: НЭ (НF – фтороводород, хлороводород и т.д.) | NaH – гидрид натрия, CaH2 – гидрид кальция и т.д. |
Стибин SbH3 (сурьмянистый водород) — неорганическое бинарное химическое соединение сурьмы с водородом, имеющее чесночный запах.
Арсин AsH3 (мышьяковистый водород, гидрид мышьяка) — гидрид мышьяка, химическое соединение мышьяка и водорода. При нормальных условиях — ядовитый бесцветный газ. Абсолютно чистый химически арсин запаха не имеет, но ввиду неустойчивости продукты его окисления придают арсину чесночный запах. Сильный восстановитель.
Летучие водородные соединения
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды) при нормальных условиях.
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
Соли фосфония неустойчивые, легко гидролизуются.
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Водородные соединения: гидриды и их свойства
Способы завершения энергетического уровня
Помимо способов завершения энергетического уровня, существует классификация гидридов, в соответствии с их характером связи. Они подразделяются на 3 большие группы.
Типы гидридов
Стоит рассмотреть основные группы, поскольку побочные группы (полимерные, интерметаллические и комплексные) являются подвидами основных, а также имеют схожие с ними физические и химические свойства.
Ионные гидриды
Ионные (солеобразные) — соединения H2 с металлами IA и IIA (кроме магния), а также с алюминием. Их главное отличие от двух других видов в том, что они активно реагируют с H2O с образованием щёлочи и выделением H2 в виде газа. Самым ярким представителем ионных гидридов является гидрид натрия.
Физические свойства: белые твёрдые вещества с кристаллической решёткой, содержащей катион (плюс) металла и гидрид-анион (минус) Н–. Проводят электрический ток. Устойчивы при нормальных условиях (н.у.).
Как и любое вещество (химический элемент, простое вещество или химическое соединение), ионные гидриды обладают свойствами. Они проявляются в процессе реакции и влияют на неё. Химические свойства:
Применение: для получения металлов из их оксидов, удаления окалины с поверхности металлических изделий, как ракетное топливо.
Получение: при взаимодействии металлов с водородом при t 200-600°С:
Ковалентные соединения
Ковалентные — гидриды, образованные неметаллами IV, V, VI и VII групп, а также бором. Например, гидрид углерода/метан CH4, силан SiH4, гидрид серы/сероводород H2S.
Физические свойства: газообразные, легко воспламеняются на воздухе.
Ковалентные гидриды во многом отличаются от ионных и металлических. Если последние обладают химическими свойствами, схожими с металлами, то свойства ковалентных следует рассмотреть подробнее. Химические свойства:
Применение: для получения полупроводниковых пленочных покрытий, защитных покрытий на поверхности металлов.
Получение: термическое разложение, восстановление галогенидов.
Существуют многочисленные производные ковалентных гидридов, в которых часть атомов H2 замещена атомами галогенов или металлов.
Магний по своим свойствам и химической связи располагается между ионными и ковалентными гидридами. С водой и водными растворами MgH2 реагирует с выделением H2, но не так энергично, как ионные гидриды.
Соединения железа с водородом крайней неустойчивы и в чистом виде не обнаружены. Формула неустойчивого гидрида железа выглядит так: C5H5Fe.
Металлические соединения
Металлические — соединения переходных металлов. Фактически они являются твёрдым раствором H2 в металле, атомы водорода помещаются в кристаллическую решётку металла. Их образованию всегда способствует адсорбция водорода на поверхности металла.
Физические свойства: представляют собой кристаллические вещества с металлическим блеском. Обладают интенсивной окраской, проявляют металлические или полупроводниковые свойства. Устойчивы на воздухе. С кислородом и водой реагируют медленно. Магнитными, механическими, тепло- и электропроводными свойствами схожи с металлами.
Химическая связь очень прочная.
Применение: применяются в качестве источников водорода особой чистоты (который используется в топливных элементах), также для удаления водорода из газовых смесей.
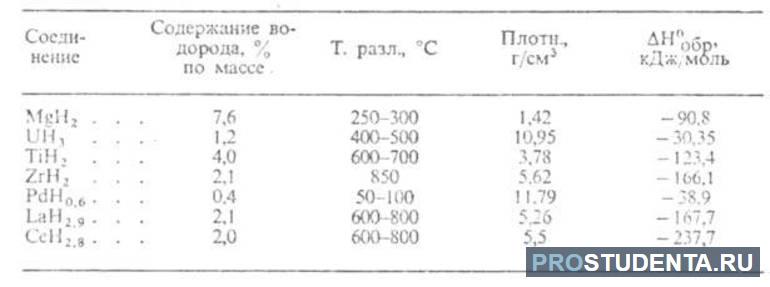
Получение: реакция металла с водородом при обычной температуре или при нагревании: Ti + H2 = (150-200°С) TiH2.
При взаимодействии H2 с интерметаллическими соединениями, такими как TiFe, LaNi5, можно получить гидриды интерметаллидов TiFeH2, LaNi5H6, которые с высокой скоростью обратимо поглощают водород при атмосферном давлении.
В прикрепленных таблицах указано содержание водорода, температура разложения, плотность и пр., что поможет в более глубоком понимании физических свойств водорода разных типов гидридов.
Особенности водородных соединений
Как и в любом разделе химии, водородные соединения имеют свои исключения. В их числе He, Ne, Ar, Kr, Pm, Os, Ir, Rn, Fr и Ra. Они не образуют бинарные соединения с водородом.
Информация, изложенная выше доказывает то, что химия интереснейший и увлекательный предмет, который стоит потраченного внимания и времени.
Водородные соединения. Оксиды
Урок 19. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Водородные соединения. Оксиды»
Само название «водородные соединения» говорит о том, что в состав данных соединений входит водород. К таким соединениям относятся гидриды и летучие водородные соединения. Давайте разберемся, в чем их отличие.
Гидриды – это бинарные соединения металлов I и II A групп с водородом. Например: CaH2, NaH, BaH2, LiH. Все эти гидриды твердые, нелетучие, тугоплавкие вещества с ионным типом связи.
Летучие водородные соединения – это бинарные соединения неметаллов с водородом. Эти соединения могут быть как жидкостями (например, Н2О), так и газами (HCl, NH3).
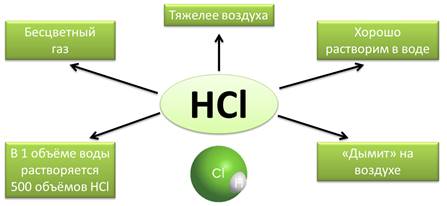
Рассмотрим свойства хлороводорода – HCl. Это бесцветный газ, тяжелее воздуха, хорошо растворим в воде. В 1 объёме воды растворяется 500 объёмов хлороводорода. Хлороводород «дымит» на воздухе, т.е. он поглощает пары воды из воздуха, образуя при этом туманное облако.
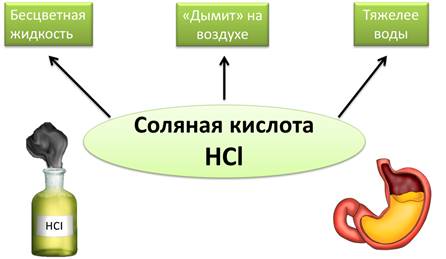
Раствор хлороводорода в воде называют соляной кислотой. Это бесцветная жидкость, «дымит» на воздухе, тяжелее воды. Соляная кислота содержится в желудочном соке человека и некоторых животных.
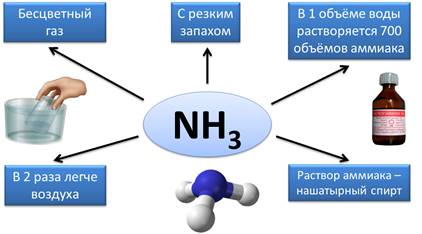
Известным и распространенным водородным соединением является аммиак – NH3. Аммиак является бесцветным газом, имеет резкий запах, в 1 объёме воды растворяется 700 объёмов аммиака, он почти в 2 раза легче воздуха. Раствор аммиака в воде называют нашатырным спиртом, который широко используют в медицине.
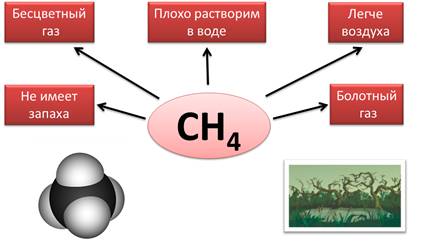
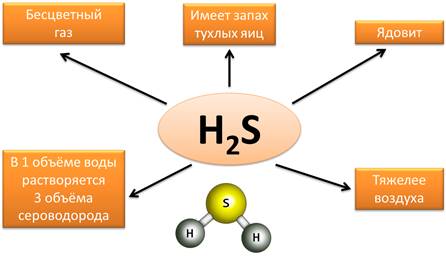
Сероводород – H2S – тоже известное летучее водородное соединение. Он является бесцветным газом, имеет запах тухлых яиц, ядовит, в 1 объеме воды растворяется 3 объёма сероводорода, он тяжелее воздуха.
В названии оксидов сначала указывают слово оксид в именительном падеже (от лат. названия кислорода – «оксигениум»), а затем название элемента в родительном падеже.
Например: CaO – оксид кальция, K2O – оксид калия, Al2O3 – оксид алюминия. А если элемент имеет несколько степеней окисления или переменную валентность, то после названия оксида в скобках римскими цифрами указывают численное значение степени окисления. Например: Fe2O3 – оксид железа (III) (читается: «оксид железа три»), CuO – оксид меди (II) (читается: «оксид меди два»), CrO3 – оксид хрома (VI) (читается: «оксид хрома шесть»).
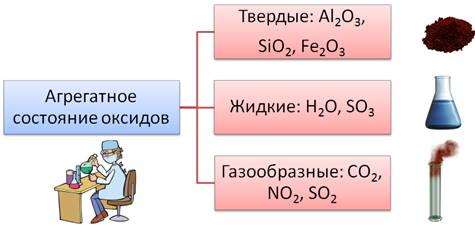
По агрегатному состоянию оксиды делят на твёрдые: к ним относятся такие оксиды, как Al2O3, SiO2, Fe2O3 и др., жидкие оксиды – это H2O, SO3, газообразными являются такие оксиды, как СО2, NO2, SO2 и др.
Познакомимся с вами с наиболее важными оксидами.
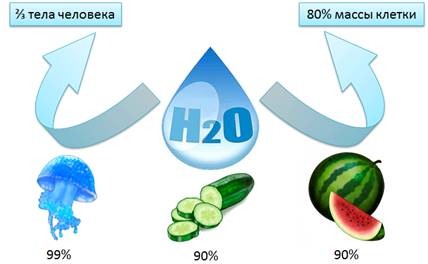
Вода – Н2О – самое распространенное и самое необходимое вещество на планете. Почти ¾ поверхности земного шара занято водой. Однако, это вода морей и океанов, которая является солёной. Она непригодна для питья, для сельского хозяйства, для промышленности. Кроме того, тело человека на 2/3 состоит из воды. Вода составляет до 80% массы клетки и выполняет важные функции: защитную, транспортную и др. У некоторых медуз вода занимает почти 99% от массы тела. Содержание воды в огурцах и арбузах превышает 90%. Большинство реакций и процессов в различных отраслях промышленности тоже протекают в растворах. Однако запасы пресной воды малы, всего 3% от общего объёма, поэтому нужно беречь и экономить воду. Без воды невозможно представить жизнь человека, который потребляет ее для бытовых нужд.
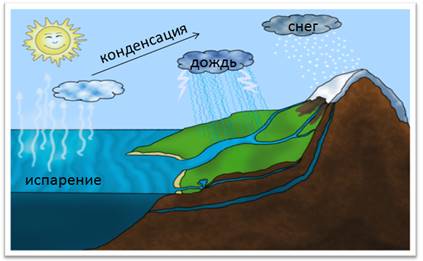
В природе постоянно происходит круговорот воды. Под влиянием солнечного тепла часть воды испаряется в атмосферу. При охлаждении воздуха образуются водяные капельки, из которых состоят облака. Эти мелкие капельки сливаются в более крупные и выпадают на землю в виде осадков: снега, дождя, града.
Круговорот воды в природе
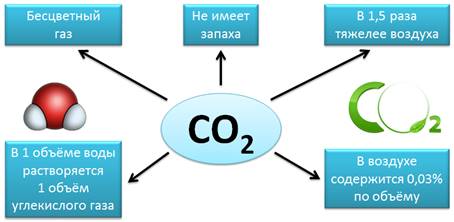
Еще одним известным оксидом является диоксид углерода, углекислый газ, или оксид углерода (IV) – CO2. Это бесцветный газ, не имеет запаха, в 1,5 раза тяжелее воздуха. В 1 объёме воды растворяется 1 объем углекислого газа. В воздухе содержится 0,03% (по объему) диоксида углерода.
Большое количество углекислого газа вызывает удушье. Например, в «Собачьей пещере» вблизи Неаполя, известной еще из древности, заходившие сюда собаки постоянно погибали из-за скопившегося газа, который стелется по дну пещеры слоем до полуметра. Углекислый газ образуется при дыхании, сгорании топлива, тлении и гниении различных организмов. Большое содержание углекислого газа в минеральной воде «Нарзан», находящейся в Кисловодске. Углекислый газ используют для получения газированных вод, а твердый диоксид углерода, или «сухой лед» используют для хранения продуктов питания, в частности мороженого. Т.к. углекислый газ не поддерживает горение, его используют для тушения пожаров. В медицине углекислый газ используют для углекислотных ванн.
Негашеная известь, или СаО, является белым, тугоплавким веществом, которое энергично реагирует с водой, при этом образуется гашеная известь. Негашеная известь применяется для получения вяжущих строительных материалов.
Основная часть литосферы – это оксид кремния (IV) – SiO2. Он входит в состав минералов и горных пород. Этот оксид образует кварц, кварцевый песок, кремнезем, горный хрусталь и др. соединения.
Еще одно соединение, которое является основой литосферы – это оксид алюминия – Al2O3. Он также входит в состав минералов и горных пород. Этот оксид образует корунд, рубин, сапфир, каолин и др. соединения.
Летучие водородные соединения.



Бинарные соединения.
«Би»- означает два. Бинарные соединения состоят из атомов двух ХЭ.
Оксиды.
Оксиды —очень распространённый тип соединений, содержащихся в земной коре и во Вселенной.
Названия оксидов образуются по схеме:
Примеры оксидов. У некоторых есть тривиальное (историческое)название.
CO –оксид углерода(II) угарный газ (монооксид углерода)
Na2O — оксид натрия
Al2O3 — оксид алюминия глинозём
FeO — оксид железа(II)
Fe2О3 — оксид железа(III) гематит (красный железняк)
SO2 — оксид серы (IV) сернистый газ
CaO — оксид кальция негашёная известь
SiO2 — оксид кремния песок (кремнезём)
MnO — оксид марганца(II)
N2O— оксид азота (I) «веселящий газ»
N2O3— оксид азота (III)
NO2— оксид азота (IV) «лисий хвост»
N2O5— оксид азота (V)
Индексы в формуле расставляем с учётом степени окисления ХЭ:
Записать оксиды, расставить степени окисления ХЭ. Уметь по названию составлять формулу оксида.
Другие бинарные соединения.
Летучие водородные соединения.
В ПС внизу есть горизонтальная строка «Летучие водородные соединения».
Там перечислены формулы: RH4 RH3 RH2 RH
Каждая формула относится к своей группе.
Например, написать формулу летучего водородного соединения N(азот).
Находим его в ПС и смотрим, какая формула записана под V группой.
Там RH3. Вместо R подставляем элемент азот, получается аммиак NH3.
SiH4 – силан бесцветный газ с неприятным запахом
PH3 – фосфин ядовитый газ с запахом гнилой рыбы
NH3 аммиак газ с резким раздражающим запахом.
Его раствор в воде называется нашатырным спиртом.
Гидриды металлов.