Левилимаб что это за лекарство
ЛЕВИЛИМАБ (LEVILIMAB) ОПИСАНИЕ
Фармакологическое действие
Специфическая противовоспалительная активность левилимаба продемонстрирована в тестах in vitro и in vivo. Левилимаб оказывает антипролиферативное действие на культуру клеток DS-1, вызывая дозозависимое ингибирование роста клеток.
На модели коллаген-индуцированного артрита у яванских макак (Macaca fascicularis) многократное (1 раз в неделю в течение 7 недель) п/к введение левилимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (значимое снижение выраженности воспалительных и дегенеративных изменений хрящевой ткани). Кроме того, ИЛ-6 является ключевым цитокином в развитии массивного высвобождения цитокинов («цитокинового шторма») у пациентов, получающих иммуносупрессивную терапию, включая деплецирующие агенты (в частности моноклональные антитела к рецепторам Т- и В-лимфоцитов), а также в формировании острого респираторного дистресс-синдрома при тяжелых инфекционных заболеваниях, в т.ч. у пациентов с COVID-19.
Динамика фармакодинамических маркеров (нарастание концентрации рИЛ6Р, насыщение мИЛ6Р, нарастание ИЛ-6 и снижение концентрации СРБ) свидетельствует о высокоэффективной нейтрализации рецепторов ИЛ-6 препаратом левилимаб, что в свою очередь проявляется быстрым и выраженным снижением сывороточной концентрации СРБ, отражающим эффективное подавление воспалительного процесса у пациентов с активным ревматоидным артритом.
Фармакокинетика
При однократном п/к введении левилимаба пациентам с ревматоидным артритом активное вещество обнаруживается в сыворотке крови в течение 2-24 ч, и его концентрация нарастает, достигая C max через 96 ч, с последующим снижением. C max левилимаба в сыворотке крови после первого введения при еженедельном ведении и введении 1 раз в 2 недели значимо не различалась и составляла 17543 [10975; 28323] нг/мл и 21168.5 [11248; 28338] нг/мл.
После первого введения левилимаба пациентам значения AUC (0-168 ч) составляли 1866231 2168200 (нг/мл)×ч для группы пациентов с еженедельным введением и 2152996.5 1324529 (нг/мл)×ч для группы с введением 1 раз в 2 недели. При многократном введении левилимаба значения AUC (0-2016 ч) составили 189580779 [134794695; 230680771] (нг/мл)×ч при введении 1 раз в неделю и 50763951 [34465213,5; 65810194,5] (нг/мл)×ч при введении 1 раз в 2 недели.
При повторных введениях левилимаба пациентам с ревматоидным артритом, показатель максимальной концентрации (C max-mult) нарастал и достигал значений 201024 158075 нг/мл при еженедельном введении и 51570 62387 нг/мл при введении 1 раз в 2 недели. При этом Т max ) составляло 1848 [1512; 2016] ч и 1848 [1512; 1848] ч при еженедельном введении и введении 1 раз в 2 недели соответственно.
V d в равновесном состоянии составлял 7871.029 [4226.795; 13363.547] мл при введении 1 раз в неделю и 7130.453 [5532.978; 11387.959] мл при введении 1 раз в 2 недели.
О накоплении левилимаба при многократном введении свидетельствовал коэффициент кумуляции (AR), который составлял 10.932 [6.446; 14.178] для еженедельного введения, 2.593 [1.902; 4.164] для введения 1 раз в 2 недели.
При повторных введениях отмечается накопление левилимаба, с ростом C max в 6.5-14.2 раза при еженедельном введении и в 1.9-4.2 раза при введении 1 раз в 2 недели. Таким образом, п/к введение левилимаба 1 раз в неделю обеспечивает более высокую сывороточную концентрацию и экспозицию у пациентов с активным ревматоидным артритом.
Значения показателей, характеризующих период элиминации, зависели от дозы левилимаба, что говорит о нелинейной фармакокинетике препарата, обусловленной мишень-опосредованными распределением и элиминацией. Общий клиренс левилимаба после однократного введения в дозе 2.2 мг/кг составлял 35.288 мл/ч.
Данный лекарственный препарат зарегистрирован по процедуре регистрации препаратов, предназначенных для применения в условиях угрозы возникновения, возникновения и ликвидации чрезвычайных ситуаций. Инструкция подготовлена на основании ограниченного объема клинических данных по применению препарата и будет дополняться по мере поступления новых данных. Применение препарата возможно только в условиях стационарной медицинской помощи.
Регистрационный номер:
Торговое наименование:
Международное непатентованное или группировочное наименование:
Лекарственная форма:
раствор для подкожного введения
Состав
| Ингредиент: | В 1,0 мл | В предварительно наполненном шприце 0,9 мл |
| Действующее вещество: | ||
| Левилимаб | 180,0 мг | 162,0 мг |
| Вспомогательные вещества: | ||
| Натрия ацетата тригидрат | 0,436 мг | 0,392 мг |
| Глицин | 7,5 мг | 6,8 мг |
| Маннитол | 23,0 мг | 20,7 мг |
| Уксусная кислота ледяная | до pH 5,0 | до pH 5,0 |
| Вода для инъекций | до 1,0 мл | до 0,9 мл |
Описание
Прозрачный, желто-коричневого цвета раствор. Возможно наличие лёгкой опалесценции.
Фармакотерапевтическая группа
Иммунодепрессанты, ингибиторы интерлейкина.
Код по ATX:
Фармакологические свойства
Фармакодинамика
Левилимаб – рекомбинантное человеческое моноклональное антитело к рецептору интерлейкина-6 (ИЛ-6). Левилимаб связывается и блокирует как растворимые (рИЛР), так и мембранные рецепторы ИЛ-6 (мИЛ6Р). Блокада обеих форм рецептора позволяет предотвратить развитие ИЛ-6-ассоциированного провоспалительного каскада, в том числе препятствует активации антигенпрезентирующих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, и избыточной продукции других провоспалительных цитокинов. ИЛ-6 участвует в активации и поддержании местных воспалительных реакций (образование паннуса в синовии, стимуляция остеокластогенеза – эрозии хрящевой ткани, остеопороз), кроме того ИЛ-6 – единственный цитокин, непосредственно индуцирующий синтез острофазовых белков в гепатоцитах: СРБ, фибриногена, сывороточного амилоидного белка А – SAA, гипсидина, лептина.
Специфическая противовоспалительная активность левилимаба продемонстрирована в тестах in vitro и in vivo. Левилимаб оказывает антипролиферативное действие на культуру клеток DS-1, вызывая дозозависимое ингибирование роста клеток. На модели коллаген-индуцированного артрита у яванских макак (Масаса fascicularis) многократное (один раз в неделю в течение 7-ми недель) подкожное введение левилимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (значимое снижение выраженности воспалительных и дегенеративных изменений хрящевой ткани). Кроме того ИЛ-6 является ключевым цитокином в развитии массивного высвобождения цитокинов («цитокинового шторма») у пациентов, получающих иммуносупрессивную терапию включая деплецирующие агенты (в частности моноклональные антитела к рецепторам Т- и В-лимфоцитов), а также в формировании острого респираторного дистресс-синдрома при тяжелых инфекционных заболеваниях, в том числе у пациентов с COVID-19.
Динамика фармакодинамических маркеров (нарастание концентрации рИЛ6Р, насыщение мИЛ6Р, нарастание ИЛ-6 и снижение концентрации СРБ) свидетельствует о высокоэффективной нейтрализации рецепторов ИЛ-6 препаратом левилимаб, что в свою очередь проявляется быстрым и выраженным снижением сывороточной концентрации СРБ, отражающим эффективное подавление воспалительного процесса у пациентов с активным ревматоидным артритом.
Фармакокинетика
При однократном подкожном введении левилимаба пациентам с ревматоидным артритом, препарат обнаруживается в сыворотке крови пациентов в течение 2-24 часов, и его концентрация нарастает, достигая максимальных значений через 96 часов, с последующим снижением. Максимальная концентрация левилимаба в сыворотке крови (Сmax) после первого введения при еженедельном ведении и введении 1 раз в 2 недели значимо не различалась и составляла 17543 [10975; 28323] нг/мл и 21168,5 [11248; 28338] нг/мл.
После первого введения левилимаба пациентам значения AUC(0-168) составляли 1866231 2848225 (нг/мл)·ч, для группы пациентов с еженедельным введением препарата и 2152996,5 2561388 (нг/мл)·ч, для группы с введением препарата 1 раз в 2 недели. При многократном введении левилимаба значения суммарной площади под кривой концентрация – время рассчитанной в период 0-2016 ч после введения (AUC (0-2016)) составили 189580779 [134794695; 230680771] (нг/мл)·ч при введении 1 раз в неделю и 50763951 [34465213,5; 65810194,5] (нг/мл)·ч при введении 1 раз в 2 недели.
При повторных введениях левилимаба пациентам с ревматоидным артритом, показатель максимальной концентрации (Cmax-mult) нарастал и достигал значений 201024 221863 нг/мл при еженедельном введении препарата и 51570 40013 нг/мл при введении 1 раз в 2 недели. При этом время достижения максимальной концентрации (Тmax) составляло 1848 [1512; 2016] часов и 1848 [1512; 1848] часов при еженедельном введении препарата и введении 1 раз в 2 недели соответственно.
Стационарный объем распределения составляя 7871,029 [4226,795; 13363,547] мл при введении препарата 1 раз в неделю и 7130,453 [5532,978; 11387,959] мл при введении 1 раз в 2 недели.
О накоплении препарата при многократном введении свидетельствовал коэффициент кумуляции (AR), который составлял 10,932 [6,446; 14,178] для еженедельного введения препарата, 2,593 [1,902; 4,164] для введения 1 раз в 2 недели.
При повторных введениях отмечается накопление препарата, с ростом максимальной концентрации в 6,5-14,2 раза при еженедельном введении и в 1,9-4,2 раза при выведении препарат 1 раз в 2 недели. Таким образом, подкожное введение левилимаба 1 раз в неделю обеспечивает более высокую сывороточную концентрацию и экспозицию у пациентов с активным ревматоидным артритом.
Значения показателей, характеризующих период элиминации (Kel, С1 и период полувыведения препарата), зависели от дозы левилимаба, что говорит о нелинейной фармакокинетике препарата, обусловленной мишень-опосредованными распределением и элиминацией. Общий клиренс левилимаба после однократного введения в дозе 2,2 мг/кг составлял 35,288 мл/час.
Пациенты с почечной и печеночной недостаточностью: фармакокинетические данные у больных с почечной и печеночной недостаточностью отсутствуют.
Пациенты в возрасте старше 65 лет: фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют.
Показания к применению
Угрожающий жизни острый респираторный дистресс-синдром, сопровождающийся повышенным высвобождением цитокинов.
Противопоказания
Применение в период грудного вскармливания
Неизвестно, проникает ли левилимаб в грудное молоко. Учитывая то, что иммуноглобулины класса G, к которым относится левилимаб, могут выделяться с грудным молоком, препарат ИЛСИРА ® противопоказан к применению в период грудного вскармливания.
Влияние на фертильность
Данные о влиянии препарата на фертильность у людей отсутствуют.
Способ применения и дозы
Применение препарата ИЛСИРА ® должно осуществляться под наблюдением врачей. Рекомендуемая доза препарат ИЛСИРА ® составляет 324 мг однократно в виде двух подкожных инъекций по 162 мг каждая.
Указания по применению
Подготовка к проведению подкожной инъекции
На данном этапе не следует снимать колпачок шприца
Техника выполнения подкожной инъекции препарата ИЛСИРА ® в преднаполненном шприце
Утилизация расходного материала
Неиспользованный раствор препарата, использованные шприцы, салфетки/ватные тампоны и другие расходные материалы подлежат утилизации с применением закрывающегося, устойчивого к проколам контейнера для острых предметов из пластика или стекла. Не допускайте хранения использованных шприцев в местах, доступных для детей.
Побочное действие
В данной инструкции нежелательные реакции представлены в соответствии с международным словарем нежелательных реакций MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших левилимаб в рамках клинических исследований, и имеющих определенную, вероятную или возможную степень связи с приемом препарата. Частота указана с учетом следующих критериев: очень часто (≥1/10), часто (от ≥1/100 до ® необходимо предоставить письменную информацию пациенту об эффективности препарата и рисках, связанных с его применением (в том числе о риске влияния на эмбрион и плод) и получить письменное согласие на применение препарата.
Серьезные инфекции
Наличие таких потенциально тяжелых инфекций как ВИЧ, активный гепатит В и (или) С, сифилис, туберкулез, относится к противопоказаниям для назначения левилимаба. Левилимаб не следует применять у пациентов с активным течением инфекционных заболеваний, включая локализованные инфекции. Учитывая иммуносупрессивное действие левилимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования.
При реактивации гепатита В терапия левилимабом должна быть прекращена и назначена соответствующая противовирусная терапия.
Туберкулез
Лабораторные показатели
В клинических исследованиях препарата ИЛСИРА ® отмечалось снижении числа нейтрофилов. Снижение абсолютного числа нейтрофилов (АЧН) не сопровождалось более высокой частотой развития инфекций, в том числе серьезных. Следует соблюдать осторожность при лечении препаратом ИЛСИРА ® пациентов с АЧН 9 /л. При снижении АЧН 9 /л терапию препаратом ИЛСИРА ® следует отменить. Следует оценивать число нейтрофилов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
В клинических исследованиях препарата ИЛСИРА ® отмечалось снижении числа тромбоцитов. Снижение числа тромбоцитов не сопровождалось развитием кровотечений. Следует соблюдать осторожность при назначении терапии препаратом ИЛСИРА ® при числе тромбоцитов ниже 100×10 3 /мкл. Лечение не рекомендуется при числе тромбоцитов 3 /мкл. Следует оценивать число тромбоцитов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
В клинических исследованиях препарата ИЛСИРА ® отмечалось повышение активности «печеночных» трансаминаз без признаков печеночной недостаточности. Частота возникновения подобных изменений может возрастать при совместном использовании с препаратами, обладающими потенциальным гепатотоксическим действием (например, метотрексатом). Следует соблюдать осторожность при назначении терапии препаратом ИЛСИРА ® у пациентов с показателями аланинаминотрансферазы (АЛТ) или аспартатаминотрансферазы (ACT), превышающими верхнюю границу нормы (ВГН) более чем в 1,5 раза. Следует оценивать показатели активности печеночных трансаминаз (АЛТ и ACT) через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Изменение показателей липидного обмена
В клинических исследованиях препарата ИЛСИРА ® отмечалось повышение концентрации липидов (холестерин и(или) триглицериды). Следует оценивать показатели липидного обмена через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой. При ведении пациентов с гиперлипидемией следует руководствоваться национальными рекомендациями по лечению гиперлипидемии.
Реакции гиперчувствительности
При использовании левилимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований препарата ИЛСИРА ® анафилактических реакций и реакций гиперчувствительности не зарегистрировано. Однако при использовании других ингибиторов ИЛ6Р регистрировались крапивница и другие реакции гиперчувствительности, в том числе анафилаксия. При возникновении анафилактических или других серьёзных аллергических реакций применение препарата ИЛСИРА ® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Наличие алкогольной или наркотической зависимости
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения левилимабом, что, в свою очередь может привести к снижению эффективности терапии. Необходим более тщательное наблюдение за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований у данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность
В ходе клинических исследований препарата ИЛСИРА ® при лечении ревматоидного артрита выработки связывающих антител к левилимабу выявлено не было.
Пациенты в возрасте старше 65 лет
Данные об эффективности и безопасности препарата у пациентов в возрасте старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Пациенты с нарушениями функции почек и печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Пациенты моложе 18 лет, дети
Исследование эффективности и безопасности препарата у детей и лиц моложе 18 лет не проводилось.
Вакцинация
Влияние на способность управлять транспортными средствами и механизмами
Форма выпуска
Раствор для подкожного введения 180 мг/мл.
По 0,9 мл в трехкомпонентные стерильные шприцы из бесцветного нейтрального стекла I гидролитического класса. Шприц, с одной стороны, имеет впаянную иглу для инъекций из нержавеющей стали, которая защищена пластмассовым колпачком с бутил каучуковым уплотнителем. Шприц укупорен эластичным уплотнителем на поршень и поршнем.
На каждый шприц наклеивают самоклеящуюся этикетку.
По 1 шприцу помещают в контурную ячейковую упаковку из пленки ПВХ.
По 2 и 4 контурных ячейковых упаковок вместе с инструкцией по применению помещают в пачку из картона.
Пачку дополнительно комплектуют спиртовыми салфетками в количестве 2 или 4 шт.
Условия хранения
При температуре от 2 до 8 °С в защищенном от света месте. Не замораживать!
Хранить в недоступном для детей месте.
Срок годности
Не применять по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Владелец регистрационного удостоверения
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, Петродворцовый р-н, п. Стрельна, ул. Связи, д. 34, лит. А.
Производитель
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, п. Стрельна, ул. Связи, д. 38, стр. 1.
Организация, принимающая претензии потребителей
ЗАО «БИОКАД», Россия, 198515, г. Санкт-Петербург, Петродворцовый р-н, п. Стрельна, ул. Связи, д. 34, лит. А.
Левилимаб в лечении COVID-19
Левилимаб – это новый ингибитор интерлейкина (ИЛ)-6, разработанный фармацевтической компанией ЗАО “БИОКАД” и недавно зарегистрированный для патогенетической терапии синдрома высвобождения цитокинов при тяжелом течении COVID-19. Препарат представляет собой моноклональное антитело, блокирующее как растворимые, так и мембранные рецепторы ИЛ-6. Эффективность и безопасность левилимаба были установлены в рандомизированном, двойном слепом исследовании CORONA, в которое были включены 206 пациентов с COVID-19 ассоциированной пневмонией, у которых имелся по крайней мере один критерий тяжести заболевания, такой как увеличение частоты дыханий более 30 в минуту, снижение SpO2≤93% или PaO2/FiO2≤300 мм рт. ст., увеличение распространенности поражения легких более чем на 50% в течение 24-48 ч и др. Первичным критерием эффективности в этом исследовании была доля пациентов, состояние которых стабильно улучшилось по шкале ВОЗ (без дополнительных инъекций левилимаба открытым методом) на 14-й день после введения исследуемого препарата. По этому показателю левилимаб достоверно превосходил плацебо (63,1% и 42,7%, соответственно; р=0,0017), а разница между группами сохранялась до конца 30-дневного наблюдения. Эффективность левилимаба подтверждалась и результатами анализа ряда вторичных показателей эффективности, таких как потребность в дополнительном введении ингибитора ИЛ-6 открытым методом и частота перевода в отделение реанимации и интенсивной терапии. Увеличения риска развития оппортунистических инфекций при введении левилимаба отмечено не было. В статье на основании случая успешного применения левилимаба у пациента с COVID-19 разбираются практические аспекты использования ингибиторов ИЛ-6 при этом заболевании.
С.В. Моисеев. Несмотря на ограничительные меры, которые принимаются по всему миру, и продолжающуюся вакцинацию число больных с COVID-19 продолжает увеличиваться, а во многих странах, включая Россию, периодически регистрируются подъемы заболеваемости, которые связывают с появлением мутировавших штаммов вируса и/или недостаточным охватом населения вакцинацией. Очевидно, что последняя не позволяет исключить возможность COVID-19, хотя значительно снижает риск развития инфекции и тяжесть ее течения [1]. В клинических исследованиях изучаются многочисленные лекарственные средства, которые обладают потенциальной активностью в отношении SARS-CoV-2, однако противовирусные препараты, характеризующиеся доказанной эффективностью в профилактике неблагоприятных исходов COVID-19, по-прежнему отсутствуют. В нашей стране для лечения SARS-CoV-2 инфекции широко используется фавипиравир, который в рандомизированном клиническом исследовании вызывал более быстрое улучшение состояния пациентов по сравнению со стандартной терапией [2], однако остается неясным, снижает ли этот препарат риск прогрессирования COVID-19 и, соответственно, частоту перевода на искусственную вентиляцию легких и смерти больных. При оценке перспектив лечения SARS-CoV2 инфекции необходимо учитывать, что эффекта от противовирусной терапии следует ждать только в случае раннего ее назначения (например, в первые 1-3 дня), когда у пациента продолжается репликация вируса и еще нет признаков чрезмерного воспалительного ответа, который определяет тяжесть течения заболевания. Следует отметить, что распространенная в нашей стране практика назначения антибиотиков пациентам с COVID-19 с первых дней инфекции не имеет какого-либо обоснования и смысла, так как антибактериальные средства не обладают противовирусной активностью, а риск вторичных бактериальных инфекций при COVID-19 не так велик, особенно при легком течении заболевания. При этом широкое применение антибиотиков сопровождается распространением резистентности среди бактериальных возбудителей, может привести к различным побочным эффектам, включая диарею и псевдомембранозный колит, и вынуждает чаще использовать резервные антибиотики на госпитальном этапе в случае присоединения бактериальной инфекции. Для подавления гипериммунного воспалительного ответа, вызванного SARS-CoV-2, в настоящее время применяют глюкокортикостероиды, прежде всего дексаметазон, и “антицитокиновые» препараты, в частности ингибиторы интерлейкина (ИЛ)-6, первые сообщения об эффективности которых при COVID-19 были опубликованы уже вскоре после начала пандемии в Китае и Италии, а затем и в других странах. Препараты этой группы представляют собой моноклональные антитела, которые взаимодействуют с рецепторами ИЛ-6 (тоцилизумаб и сарилумаб) или непосредственно с цитокином (олокизумаб). Российской компанией ЗАО “БИОКАД» разработан еще один ингибитор ИЛ-6 – левилимаб (Илсира), который блокирует как растворимые, так и мембранные рецепторы ИЛ-6. Эффективность и безопасность левилимаба изучаются у пациентов с ревматоидном артритом, а в Российской Федерации он был недавно одобрен для патогенетической терапии синдрома высвобождения цитокинов при тяжелом течении COVID-19. Что послужило основанием для регистрации левилимаба по этому показанию?
С апреля по август 2020 г. были рандомизированы 206 пациентов с COVID-19 ассоциированной пневмонией. Группы левилимаба и плацебо были сопоставимы по среднему возрасту (58,5 и 58,2 года, соответственно), хотя доля пациентов в возрасте ≥75 лет была достоверно выше в группе левилимаба (11,7% и 3,9%). Доля мужчин в двух группах составляла 56,3% и 49,5%, соответственно. В обеих группах практически все пациенты относились к категории 4 (58,3% и 61,2%, соответственно) или 3 (38,8% и 37,9%), т.е. получали увлажненный кислород или не нуждались в какой-либо респираторной поддержке. Доля пациентов, принимавших глюкокортикостероиды в обеих группах была очень низкой (4,9% и 8,7%, соответственно), так как исследование проводилось в начале пандемии, когда польза назначения препаратов этой группы вызывала сомнение. Увеличение содержания С-реактивного белка (СРБ), которое в настоящее время является одним из основных показаний к назначению ингибиторов ИЛ-6, не учитывалось при отборе пациентов в исследование CORONA, однако медиана этого показателя была высокой как в группе левилимаба, так и плацебо (39,8 и 46,0 мг/л, соответственно). При интерпретации результатов исследования необходимо учитывать тот факт, что 13 (12,6%) и 42 (40,8%) больным двух групп, соответственно, вводился левилимаб открытым методом в связи с ухудшением состояния в качестве “терапии спасения». Пациентов, получивших повторное введение левилимаба, считали не ответившими на терапию, а для оценки эффективности проводили анализ “non-responder imputation». Таким образом, значительная часть пациентов группы плацебо также получили инъекцию ингибитора ИЛ-6, что могло способствовать улучшению результатов терапии в контрольной группе и несколько нивелировать эффективность исследуемого препарата.
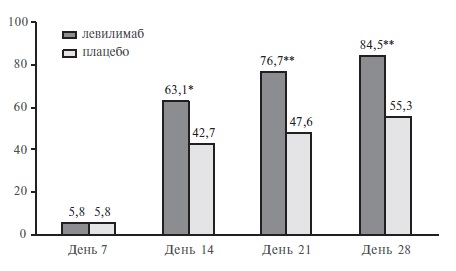
На 14-й день доля пациентов, состояние которых стабильно улучшилось (без дополнительных инъекций левилимаба открытым методом), в группе левилимаба достоверно превосходила таковую в группе плацебо (63,1% и 42,7%, соответственно; р=0,0017). Таким образом, исследование CORONA подтвердило преимущество ингибитора ИЛ-6 перед контролем по первичному критерию эффективности. Выявленные различия между группами сохранялись на 21-й и 28-й дни наблюдения (рис. 1). Эффективность левилимаба подтверждалась и трехкратным снижением потребности в дополнительном введении исследуемого препарата открытым методом, а также результатами анализа ряда вторичных показателей эффективности. Например, на 5-й день доля пациентов, не нуждавшихся в оксигенотерапии, в основной группе была значительно выше, чем в группе плацебо (41,8% и 26,2%, соответственно; р=0,0186), а на 30-й день в группе левилимаба было выявлено значительное увеличение доли выписанных пациентов (84,5% и 55,3%, p 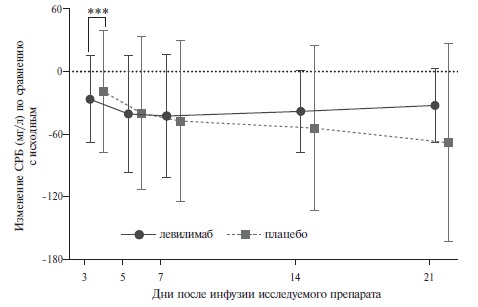
С.В. Моисеев. Таким образом, клиническое исследование CORONA подтвердило, что введение левилимаба в дополнение к стандартной терапии по эффективности превосходит плацебо и вызывает улучшение клинического состояния у части больных COVID-19 ассоциированной пневмонией. Благоприятный эффект препарата проявлялся в течение первой недели после его введения и сохранялся до конца 30-дневного периода наблюдения. Примером успешного применения левилимуба у пациента с тяжелым течением COVID-19 может служить следующее наблюдение.
В.Б. Надточеева. Пациентка С., 56 лет, страдающая сахарным диабетом 2 типа, госпитализирована в отделение для лечения больных коронавирусной инфекцией клиники им. Е.М. Тареева 2 июля 2021 г. на седьмой день болезни с подтвержденной SARS-CoV-2 инфекцией (в мазке из носа и ротоглотки выявлена РНК вируса методом полимеразной цепной реакции). Заболела остро: повышение температуры тела до 39,1 о С, резкая слабость, аносмия, малопродуктивный кашель. Амбу латорно получала фавипиравир, апиксабан (в дозе 2,5 мг два раза в сутки) и парацетамол, однако лихорадка и другие симптомы заболевания сохранялись. На 6-й день болезни появилась нарастающая одышка, в связи с чем пациентка была доставлена в клинику машиной скорой помощи.
При поступлении состояние средней тяжести. Тем пе ратура тела 38,8 о С. SpO2 в покое 91%. После незначительной физической нагрузки SpO2 снижалась до 86-88%. При компьютерной томографии в обоих легких определялись множественные участки уплотнения легочной ткани от степени “матового стекла» до консолидации, ретикулярные изменения, утолщение междолькового интерстиция по типу “булыжной мостовой» (высокая вероятность COVID-19; КТ-3 степени). В отделении проводилось введение увлажненного кислорода через носовые канюли (10-12 л/мин). Начата терапия дексаметазоном в дозе 20 мг/сут внутривенно капельно, продолжен прием апиксабана. На второй день госпитализации температура тела 38,5 о С. В общем анализе крови лейкоцитоз (12100 в мл), снижение количества лимфоцитов (450 в мл) и повышение СОЭ (37 мм/ч). Кроме того, выявлено увеличение содержания СРБ (337 мг/л) и ферритина (949 мкг/л) и активности ЛДГ (707 ед/л).
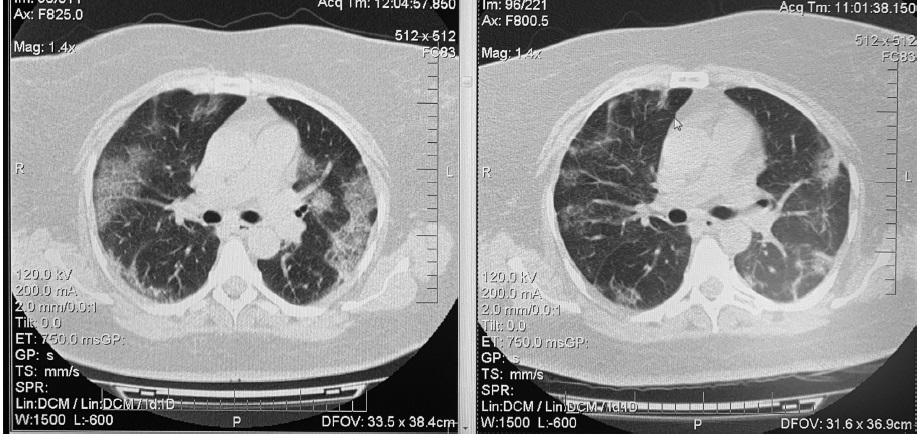
Учитывая нарастание дыхательной недостаточности, наличие высокой воспалительной активности и неэффективность глюкокортикостероидов в высокой дозе, пациентке однократно введен левилимаб в дозе 324 мг подкожно. В течение суток температура тела нормализовалась, а содержание СРБ снизилось до 260 мг/л, ферритина до 846 мкг/л. В течение последующих 3-5 дней отмечено нарастание SpO2 до 96% на воздухе, увеличение толерантности к физическим нагрузкам, а также нормализация содержания СРБ (1,6 мг/л), снижение активности ЛДГ (365 ед/л), концентрации ферритина (336 мкг/л), числа лейкоцитов (9600 в мл) и увеличение количества лимфоцитов (1400 в мл). Через неделю выявлена положительная динамика при компьютерной томографии органов грудной клетки в виде уменьшения зон “матового стекла» (до КТ-2 степени) (рис. 3). Пациентка выписана через 10 дней.
С.В. Моисеев. У пациентов, включенных в исследование CORONA, летальность в группах сравнения оказалась низкой. Это не позволило изучить эффективность препарата в профилактике смерти пациентов с COVID-19 от прогрессирующего поражения легких. Что известно о влиянии других ингибиторов ИЛ-6 на риск неблагоприятных исходов SARS-CoV-2 инфекции?
М.Ю. Бровко. Первые случаи успешного применения тоцилизумаба у пациентов с тяжелым течением COVID-19 были описаны в начале пандемии и послужили основанием для проведения большого числа неконтролируемых и контролируемых исследований препаратов этой группы. Хотя польза назначения ингибиторов ИЛ-6 представлялась очевидной, тем не менее, результаты клинических исследований оказались противоречивыми. Нерандомизированные исследования в основном демонстрировали эффективность тоцилизумаба [4,5]. Например, в ретроспективном американском исследовании STOP-COVID эффективность тоцилизумаба изучали у 3924 пациентов с COVID-19, поступивших в ОРИТ (62,8% мужчин, медиана возраста 62 года) [6]. 433 (11,0%) из них получили тоцилизумаб в течение первых 2 дней после госпитализации в ОРИТ. Лечение ингибитором ИЛ-6 ассоциировалось с достоверным снижением риска смерти на 29% по сравнению с контролем (отношение рисков 0,71, 95% ДИ 0,56-0,92). В то же время эффективность тоцилизумаба в профилактике неблагоприятных исходов COVID-19 ассоциированной пневмонии не была подтверждена в нескольких рандомизированных контролируемых исследованиях 7. Так, в двойном слепом, рандомизированном, плацебоконтролируемом исследовании, проводившемся в США, эффективность тоцилизумаба изучали у 243 больных средне-тяжелой COVID-19 пневмонией (медиана возраста 59,8 лет) [9]. 84% из них получали оксигенотерапию. В течение 28 дней частота перевода на ИВЛ или смерти достоверно не отличалась между группами тоцилизумаба и плацебо (10,6% и 12,5%, соответственно). Лечение тоцилизумабом не привело также к уменьшению риска ухудшения состояния больных или сокращению длительности оксигенотерапии.
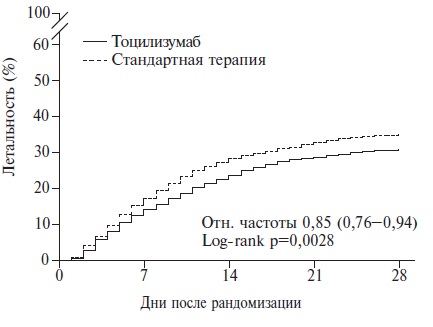
Тем не менее, опубликованы результаты нескольких крупных рандомизированных исследований, которые показали эффективность ингибиторов ИЛ-6 у пациентов с COVID-19 на основании анализа “твердых» конечных точек, таких как необходимость в ИВЛ и летальность. В исследовании EMPACTA у 389 рандомизированных госпитализированных больных с COVID-19 лечение тоцилизумабом привело к достоверному снижению риска интубации или смерти на 44% по сравнению с плацебо (отношение рисков 0,56; 95% ДИ 0,330,97) [10]. В исследовании REMAP-CAP у 803 больных с COVID-19, находившихся в ОРИТ в критическом состоянии, лечение тоцилизумабом или сарилумабом сопровождалось достоверным увеличением выживаемости в течение 90 дней по сравнению со стандартной терапией [11]. И, наконец, в самое крупное рандомизированное исследование RECOVERY, проводившееся в Великобритании, были включены 4116 пациентов с COVID-19 ассоциированной пневмонией, сопровождавшейся гипоксией и увеличением содержания СРБ ≥75 мг/л, которые получали тоцилизумаб (n=2022) или только стандартную терапию (n=2094) [12]. Частота применения глюкокортикостероидов составила в целом 82%, т.е. протокол стандартной терапии в этом исследовании соответствовал сложившейся к настоящему времени практике лечения госпитализированных пациентов с COVID-19. На момент рандомизации у 14% больных проводилась ИВЛ, у 41% – неинвазивная респираторная поддержка, включая высокопоточную оксигенотерапию и НИВЛ, а 45% пациентов нуждались только во введении кислорода. Во всей выборке лечение тоцилизумабом привело к достоверному снижению летальности пациентов на 15% (р=0,0028; рис. 4). Среди больных, которые исходно не нуждались в ИВЛ, в группе тоцилизумаба было выявлено достоверное снижение риска интубации или смерти на 16% по сравнению с контролем (p 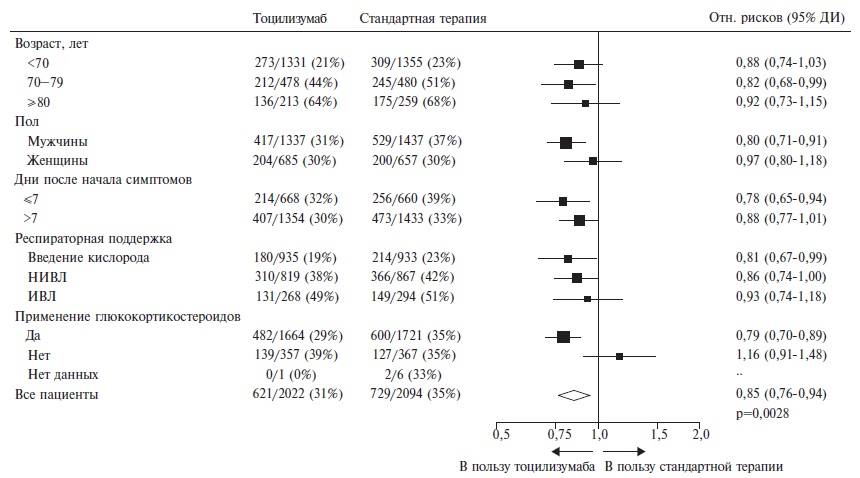
С.В. Моисеев. Применение ингибиторов ИЛ-6, включая левилимаб, предусмотрено во временных методических рекомендациях по профилактике, диагностике и лечению новой коронаровирусной инфекции, которые постоянно обновляются Минздравом Российской Федерации на протяжении пандемии. В июне 2021 г. назначение тоцилизумаба для лечения COVID-19 было одобрено Американской администрацией по контролю за пищевыми продуктами и лекарствами (FDA) у взрослых пациентов и детей, получающих системные глюкокортикостероиды и нуждающихся в оксигенотерапии, НИВЛ, ИВЛ или ЭКМО. В каких случаях и когда следует применять левилимаб или другие ингибиторы ИЛ-6 у пациентов с COVID-19?
Л.А. Акулкина. В последнее время увеличилось количество пациентов с COVID-19, которые самостоятельно или по рекомендации врача начинают прием иммуносупрессивных препаратов, прежде всего глюкокортикостероидов, уже с первых дней инфекции. Подобная практика опасна, так как подавление иммунного ответа при продолжающейся репликации вируса может привести к прогрессированию заболевания. Данную гипотезу подтверждают результаты исследования RECOVERY, в котором изучались различные препараты, в том числе дексаметазон, у пациентов с COVID-19. В этом исследовании лечение дексаметазоном привело к достоверному снижению 28-дневной летальности (р В.Б. Надточеева. Показания к введению ингибиторов ИЛ-6 иллюстрирует приведенное выше наблюдение. У 56-летней пациентки в конце первой недели болезни выявлена COVID-19 ассоциированная пневмония (КТ3), сопровождавшаяся гипоксией (снижением SpO2 до 91% на воздухе), выраженной лимфопенией и высокой воспалительной активностью, в частности содержание СРБ увеличилось до 337 мг/л. Сохранение лихорадки после введения дексаметазона в дозе 20 мг/сут указывало на недостаточную эффективность глюкокортикостероида. На повышенный риск дальнейшего прогрессирования поражения легких при COVID-19 указывало наличие сахарного диабета 2 типа. Однократное подкожное введение левилимаба в дозе 324 мг уже в течение суток привело к нормализации температуры тела и улучшению состояния пациентки, а в течение последующих нескольких дней увеличилось SpO2, восстановилось количество лимфоцитов в крови и снизились лабораторные признаки воспаления. Умеренный лейкоцитоз мы расценивали как признак не бактериальной инфекции, а воспаления, поэтому лечение антибиотиками не проводилось. Снижение количества лейкоцитов на фоне противовоспалительной терапии подтверждало правильность выбранной тактики лечения.
В.И. Шоломова. В рандомизированных клинических исследованиях возможные варианты стратегии применения противовоспалительных препаратов у пациентов с COVID-19 не сравнивали. Данных о сравнительной эффективности глюкокортикостероидов и ингибиторов ИЛ-6 в профилактике неблагоприятных исходов заболевания также нет. Тем не менее, не вызывает сомнения, что глюкокортикостероиды обладают широким спектром противовоспалительной активности и дают необходимый эффект у значительной части пациентов с признаками синдрома выделения цитокинов. Глюкокортикостероиды подавляют экспрессию различных провоспалительных цитокинов и повышают выделение цитокинов, обладающих противовоспалительной активностью [24], поэтому их также можно считать антицитокиновыми препаратами, как и генно-инженерные биологические препараты или ингибиторы янускиназ. Основным недостатком глюкокортикостероидов являются различные побочные эффекты, однако они чаще встречаются при длительном лечении препаратами этой группы и не представляют особой проблемы при кратковременном применении глюкокортикостероидов, особенно в небольших дозах, у пациентов с COVID-19. Лечение дексаметазоном или другими глюкокортикостероидами может привести к декомпенсации сахарного диабета, однако гликемический профиль обычно улучшается после снижения дозы или отмены этих препаратов. Соответственно, с этих препаратов обычно и начинают лечение. Кстати, в исследовании RECOVERY, в котором изучался тоцилизумаб, практически все пациенты на момент рандомизации уже получали дексаметазон или другие глюкокортикостероиды. Введение ингибитора ИЛ-6 необходимо при отсутствии быстрого ответа на введение глюкокортикостероида и, тем более, при продолжающемся нарастании воспалительного ответа и/или появлении признаков гипоксии. У пациентов со сниженной SpO2, а также у больных, относящихся к группе риска, как в нашем наблюдении, лучше не ждать ответа на глюкокортикостероиды, а одновременно с ними сразу вводить ингибитор ИЛ-6.
М.Ю. Бровко. Если исходить из концепции “цитокинового шторма» как основы прогрессирования COVID19, то блокада действия различных цитокинов выглядит оправданной, хотя эффективность такого подхода в контролируемых исследованиях не изучалась и, соответственно, не доказана. При ревматических заболеваниях, таких как ревматоидный артрит, опыта комбинированной терапии различными генно-инженерными биологическими препаратами и/или ингибиторами янус-киназ также нет. Речь, конечно, не идет о глюкокортикостероидах, которые, как указано выше, сегодня являются компонентом терапии у большинства госпитализированных пациентов со средне-тяжелым и тяжелым течением COVID-19. Иногда комбинированная терапия является вынужденной мерой, например, в случае ухудшения состояния пациента, не ответившего на пероральный прием ингибитора янус-киназ, необходимо вводить ингибитор ИЛ-6. Различия механизмов действия ингибиторов ИЛ-6, по-видимому, не имеют большого значения, поэтому комбинированное применение разных препаратов этой группы, вряд ли, приведет к усилению эффекта по сравнению с таковым при введении одного и того же препарата. В исследовании CORONA, как и в других исследованиях ингибиторов ИЛ-6, допускалось повторное введение левилимаба открытым методом в случае отсутствия ответа на первую инъекцию исследуемого препарата двойным слепым методом. Как указано выше, доля пациентов, которым потребовалось повторное введение левилимаба, в основной группе составила около 12% и была в 3 раза меньше, чем в группе плацебо. Таким образом, почти в 90% случаев исследователи были удовлетворены результатами однократного введения ингибитора ИЛ-6. Конечно, этот показатель в достаточной мере условный и может существенно отличаться в разных выборках, так как результаты лечения любыми противовоспалительными препаратами в значительной степени зависят от тяжести течения COVID-19.
С.В. Моисеев. Необходимо ли измерять содержание ИЛ-6 при оценке показаний к введению ингибиторов этого цитокина?
С.В. Моисеев. Тоцилизумаб выпускается в виде двух лекарственных форм – для внутривенного и подкожного введения, в то время как все остальные ингибиторы ИЛ-6 предназначены только для подкожного применения. Имеет ли значение путь введения этих препаратов при COVID-19?
П.И. Новиков. Однозначно ответить на этот вопрос сложно. С одной стороны, среди ингибиторов ИЛ-6 у пациентов с COVID-19 лучше всего изучен тоцилизумаб внутривенно, который применялся в большинстве рандомизированных и нерандомизированных клинических исследований. С другой стороны, всем больным с COVID-19, нуждающимся в ингибиторах ИЛ-6, вводить тоцилизумаб внутривенно нереально, учитывая дефицит этого препарата, который неизбежно усиливается во время подъемов заболеваемости, когда число госпитализированных пациентов быстро увеличивается. К настоящему времени накоплен опыт внутривенного введения подкожных форм ингибиторов ИЛ-6, хотя мы в своей практике чаще вводили их в соответствии с инструкцией по применению. В рандомизированных контролируемых исследованиях эффективность внутривенного и подкожного введения тоцилизумаба не сравнивали, а результаты нерандомизированных исследований оказались противоречивыми [4,28]. С.С. Боб кова и соавт. сопоставили результаты внутривенного (n=114) и подкожного (n=86) введения тоцилизумаба и подкожного применения левилимаба (n=100) и олокизумаба (n=100) у 400 пациентов с COVID-19 [29]. Все изученные ингибиторы ИЛ-6 вызывали сопоставимое снижение содержания СРБ через 24 ч после введения, а достоверных различий летальности между группами не выявили. Таким образом, в этом исследовании тоцилизумаб не имел преимуществ перед ингибиторами ИЛ-6 для подкожного применения. Доводом в пользу возможности подкожного введения левилимаба служат и результаты рандомизированного исследования CORONA, которое подтвердило преимущество препарата перед плацебо у пациентов с COVID-19. При выборе пути введения необходимо учитывать состояние больного. В более тяжелых случаях, особенно при быстром нарастании гипоксии, вероятно, имеет смысл отдать предпочтение внутривенному введению.
С.В. Моисеев. Тактика медикаментозного лечения средне-тяжелых и тяжелых форм COVID-19 по-прежнему вызывает много вопросов, однако все же в этом направлении удалось достичь существенного прогресса, который прежде всего связан с применением глюкокортикостероидов и ингибиторов ИЛ-6. Потребность в последних в российских лечебных учреждениях остается высокой, поэтому расширение арсенала ингибиторов ИЛ-6 благодаря появлению левилимаба, разработанного российской фармацевтической компанией, имеет очень важное значение. Необходимо подчеркнуть, что эффективность левилимаба в лечении COVID-19 была установлена в рандомизированном, плацебо-контролируемом исследовании, в то время как многие лекарственные средства, которые в свое время использовали или пытались использовать при SARS-CoV-2 инфекции (гидроксихлорохин, лопинавир/ритонавир и др.), не выдержали этого испытания.