Левофлоксацин и амоксициллин что лучше
Антибиотики при коронавирусе
Принципы лечения
Человек заражается вирусной инфекцией через слизистые оболочки глаз и носоглотки. Инкубационный период длится около недели. В это время могут наблюдаться симптомы в виде ломоты и недомогания. В период острой фазы повышается температура, появляются головные боли, кашель, насморк, озноб, тошнота. Тяжелая фаза заболевания вызывает сильную одышку, боли в животе и грудной клетке. Чтобы не допустить серьезных осложнений, важно быстро и правильно подобрать лечение.
В настоящее время вакцины от коронавируса не существует. Курс лечения выстроен на применении противовирусных медикаментов и антибиотиков. Пациенту назначают сильнодействующий препарат. Противовирусное вещество не сможет самостоятельно справиться с вирусом, поэтому дополнительно принимаются обезболивающие, жаропонижающие и сорбирующие медикаменты.
Антибиотики назначают при осложненной форме заболевания, когда происходит размножение условно-патогенной микрофлоры.
Как выбрать антибиотик
При остром вирусном заболевании антибиотик назначает врач, ссылаясь на результаты лабораторных анализов. Для правильного подбора препарата нужно:
определить свойство и вид возбудителя инфекции;
выбрать курс лечения и рассчитать дозу препарата;
подобрать комплекс медикаментов для микроорганизмов, которые тяжело поддаются лечению;
когда возбудитель не выявлен, стоит применять антибиотик широкого воздействия, после проведенных бактериологических анализов использовать препарат с узким спектром влияния.
Чтобы исключить негативные побочные эффекты, при назначении медикаментозного лечения учитывается возраст пациента, общее состояние, выраженные симптомы.
Прием препаратов
Не все понимают, можно ли при коронавирусе принимать антибиотики и какие симптомы должны стать тому причиной. Категорически запрещено самостоятельно пить препараты без назначения лечащего врача, так как неправильно подобранные антибиотики не только ослабят организм, но и могут спровоцировать летальный исход.
Показания для приема антибиотиков:
на протяжении нескольких дней температура тела превышает 38 градусов;
в респираторном тракте развивается бактериальная микрофлора, в качестве подтверждения инфекции часто наблюдаются выделения зеленой и желтой мокроты при кашле;
при продолжительном лечении противовирусными веществами сохраняется общее недомогание;
кал содержит гнойную слизь.
Если у пациента имеются все симптомы, врач не сможет назначить прием антибиотиков без бактериологического посева. Для проведения исследований из трахеи и носоглотки берется мазок, из кала извлекается слизистая часть. Он засевается на питательную среду с целью выявления вида инфекции. После получения результатов определяется дополнительный вид антибиотика, способного уничтожить вирус.
Если пациенту прописывается курс приема антибиотиков, то это не означает, что противовирусные медикаменты принимать не нужно. Назначается комплексный прием препаратов для достижения оптимального эффекта в целях устранения бактериальной среды из ЖКТ либо респираторного тракта. После завершения терапии у пациента берутся все анализы, если коронавирусная инфекция не подтверждается, пациент выписывается.
Виды антибиотиков
Все виды препаратов имеют сильное воздействие и включают в себя широкий спектр влияния на патогенные микроорганизмы.
Амоксиклав
Комплексный препарат, в состав которого входит амоксициллин, активно борется с вирусной инфекцией. Второй компонент, клавулановая кислота, подавляет синтез бактерий. Антибиотик показан при таких симптомах как:
Если вирус проник в кровоточную систему, медикамент быстро поможет справиться с сепсисом.
Побочные эффекты могут наблюдаться в виде:
желтухи, гепатита, нарушенного формирования стула;
Флуимуцил
В состав препарата входит триамфеникол. Применяется в качестве ингаляций и инъекций. Антибиотик обладает отхаркивающими, муколитическими и бактерицидными свойствами. Когда у пациента состояние средней тяжести, ему прописывают ингаляции с препаратом. Вещество в малых количествах всасывается в кровоточную систему, поэтому риск возникновения побочных эффектов минимальный. Однако они все же существуют и могут выражаться в виде аллергической сыпи, стоматита, панцитопении.
Азитромицин
Антибиотик относится к числу сильнодействующих препаратов. Производится в ампулах и таблетках, может применяться как внутривенно, так и внутримышечно. Активно воздействует на бактериальные клетки за счет подавления синтеза белка, размножения, ферментов. Эффективно борется с отитом, синуситом, тонзиллитом, бронхитом.
Препарат показан при выявлении инфекционных патологий, вызванных воспалительным процессом дыхательных путей, поэтому может использоваться для лечения коронавируса. Побочных эффектов достаточно много, тем не менее их можно избежать, если придерживаться рекомендаций приема.
Цефтриаксон
Препарату присуще сильное воздействие на патогенные микроорганизмы. При его попадании в организм происходит бактерицидное влияние, все бактерии уничтожаются, что исключает риск появления хронических заболеваний. Средство обычно назначают во время осложненной вирусной фазы. Среди побочных эффектов может наблюдаться:
Левофлоксацин
Антибиотику под силу справляться с грамотрицательными и грамположительными бактериями, которые выявлены у взрослых людей. При коронавирусе медикамент применяется для лечения патогенных микробов. Пациенту прописывается прием препарата, когда имеются ярковыраженные симптомы пневмонии и бронхита.
Токсичность антибиотика имеет средний показатель, он распространяется по всему организму и может вызывать побочные эффекты в следующих системах:
Все виды препаратов должны применяться не больше 10 дней, в противном случае может развиться резистентность суперинфекции и бактериальной микрофлоры.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Ошибки в антибактериальной терапии инфекций дыхательных путей в амбулаторной практике
Опубликовано в журнале:
Лечащий врач, 2003, №8 Л. И. Дворецкий, доктор медицинских наук, профессор
С. В. Яковлев, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
При выборе способа антибактериальной терапии в амбулаторной практике необходимо учитывать и решать как тактические, так и стратегические задачи. К тактическим задачам антибиотикотерапии относится рациональный выбор антибактериального препарата, обладающего наибольшим терапевтическим и наименьшим токсическим воздействием.
Стратегическая задача антибиотикотерапии в амбулаторной практике может быть сформулирована как уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции.
В соответствии с этими положениями следует выделять тактические и стратегические ошибки при проведении антибактериальной терапии инфекций дыхательных путей в амбулаторной практике (см. таблицу 1).
Таблица 1. Ошибки антибактериальной терапии в амбулаторной практике.
Тактические ошибки антибактериальной терапии
1. Необоснованное назначение антибактериальных средств
Особую категорию ошибок представляет неоправданное применение антибактериальных препаратов (АП) в тех ситуациях, когда их назначение не показано.
Показанием для назначения антибактериального препарата является диагностированная или предполагаемая бактериальная инфекция.
При всех трудностях принятия решения в подобных ситуациях необходимо отдавать себе отчет в том, что антибактериальные препараты не оказывают влияния на течение вирусной инфекции и, следовательно, их назначение при ОРВИ не оправдано (см. таблицу 2). В то же время предполагаемая возможность предотвращения бактериальных осложнений вирусных инфекций с помощью назначения антибактериальных препаратов не находит себе подтверждения в клинической практике. Кроме того, очевидно, что широкое неоправданное применение антибактериальных препаратов при ОРВИ чревато формированием лекарственной устойчивости и повышением риска возникновения нежелательных реакций у пациента.
Таблица 2. Инфекционные заболевания дыхательных путей преимущественно вирусной этиологии
и не требующие антибактериальной терапии.
Часто врач назначает нистатин или другой антимикотик в случае обнаружения в полости рта или в моче грибов рода Candida. При этом он ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза, а также факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.).
Выделение грибов рода Candida из полости рта или мочевых путей пациентов в большинстве случаев служит свидетельством бессимптомной колонизации, не требующей коррегирующей противогрибковой терапии.
II. Ошибки в выборе антибактериального препарата
Пожалуй, наибольшее число ошибок, возникающих в амбулаторной практике, связано с выбором антибактериального средства. Выбор антибиотика должен производиться с учетом следующих основных критериев:
НОВЫЕ ФТОРХИНОЛОНЫ: новые возможности лечения внебольничной пневмонии
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетлив
Инфекции дыхательных путей по частоте возникновения занимают первое место среди инфекционных заболеваний человека. Несмотря на наличие в арсенале врача большого количества антибактериальных препаратов разных классов, в последние годы наблюдается отчетливая тенденция к увеличению смертности от пневмонии во всех развитых странах мира. Причина может быть связана прежде всего с ростом резистентности основных возбудителей внебольничных инфекций дыхательных путей ко многим антибактериальным препаратам. Этим объясняется интерес клиницистов к новым антибактериальным средствам, к которым отмечается меньший уровень резистентности бактерий.
Этиология внебольничной пневмонии непосредственно связана с нормальной микрофлорой «нестерильных» верхних отделов дыхательных путей (полости рта, носа, рото- и носоглотки). Из множества видов микроорганизмов, колонизующих верхние отделы дыхательных путей, лишь некоторые, обладающие повышенной вирулентностью, проникая в нижние дыхательные пути, способны вызывать воспалительную реакцию даже при минимальных нарушениях защитных механизмов. Такими типичными бактериальными возбудителями внебольничной пневмонии являются следующие перечисленные ниже микроорганизмы.
Streptococcus pneumoniae — самый частый возбудитель внебольничной пневмонии у лиц всех возрастных групп (30-50%). Наиболее остро в настоящее время стоит проблема распространения среди пневмококков пенициллинрезистентных штаммов. В некоторых странах частота устойчивости пневмококков к пенициллину может достигать 60%. Масштабных исследований распространения резистентности пневмококков к пенициллину в нашей стране не проводилось. По данным локальных исследований в Москве, частота устойчивых штаммов составляет 2%, штаммов с промежуточной чувствительностью — около 20%. Устойчивость пневмококков к пенициллину связана не с продукцией β-лактамаз, а с модификацией мишени действия антибиотика в микробной клетке — пенициллинсвязывающих белков, поэтому ингибитор-защищенные пенициллины в отношении этих пневмококков также неактивны. Устойчивость пневмококков к пенициллину обычно ассоциируется с устойчивостью к цефалоспоринам I-II поколений, макролидам, тетрациклинам, ко-тримоксазолу.
Haemophilus influenzae — второй по частоте возбудитель (10-20%), особенно у лиц, страдающих хроническими обструктивными болезнями легких, а также у курильщиков; высокой природной активностью в отношении гемофильной палочки обладают аминопенициллины, амоксициллин/клавуланат, цефалоспорины II-IV поколений, карбапенемы, фторхинолоны. Основной механизм резистентности H. influenzae связан с продукцией β-лактамаз.
Staphylococcus aureus — нечастый возбудитель пневмонии (около 5%), наиболее опасен для пожилых людей, наркоманов, алкоголиков, после перенесенного гриппа. Препаратами выбора при стафилококковых пневмониях являются оксациллин, также активны амоксициллин/клавуланат, цефалоспорины, фторхинолоны.
Klebsiella pneumoniae — редкий возбудитель внебольничной пневмонии (менее 5%), встречается, как правило, у больных с тяжелыми сопутствующими заболеваниями (сахарный диабет, застойная сердечная недостаточность, цирроз печени и др.). Наиболее высокой природной активностью в отношении этого возбудителя обладают цефалоспорины III-IV поколений, карбапенемы, фторхинолоны.
Определенное значение в этиологии пневмонии имеют также два других микроорганизма, характеризующихся особыми биологическими свойствами и внутриклеточной локализацией в макроорганизме — Micoplasma pneumoniae и Chlamidia pneumoniae. В отношении этих микроорганизмов клинически неэффективны все β-лактамные антибиотики. Наибольшей природной активностью обладают макролиды и тетрациклины, несколько менее активны ранние фторхинолоны.
В настоящее время в качестве основных средств стартовой терапии внебольничной пневмонии в амбулаторной практике обычно рекомендуются аминопенициллины (ампициллин, амоксициллин), защищенные аминопенициллины (амоксициллин/клавуланат), пероральные цефалоспорины II поколения (цефуроксим аксетил), макролиды (эритромицин, кларитромицин, рокситромицин, азитромицин, спирамицин, мидекамицин). При тяжелом течении пневмонии у госпитализированных больных целесообразно применение парентеральных цефалоспоринов III поколения или фторхинолонов. Клиническая эффективность всех указанных препаратов примерно одинакова, однако при лечении внебольничной пневмонии ни один из этих антибиотиков не может считаться идеальным.
Аминопенициллины характеризуются высокой природной активностью в отношении S. pneumoniae (амоксициллин более высокой, чем ампициллин), однако о проблемах, связанных с возрастающим распространением пенициллинрезистентных пневмококков, упоминалось выше. Имеются данные, что амоксициллин пока сохраняет клиническую эффективность в отношении штаммов пневмококка с промежуточной чувствительностью, а также в отношении устойчивых штаммов. Однако можно предположить снижение клинической эффективности амоксициллина при выделении штаммов пневмококка с высоким уровнем резистентности. Аминопенициллины неэффективны при пневмонии, вызванной S. aureus и K. pneumoniae.
Назначение амоксициллина/клавуланата и цефуроксима аксетила предусмотрено большинством международных и отечественных стандартов лечения внебольничной пневмонии ввиду высокой активности против пневмококков, гемофильной палочки, стафилококков. Однако в отношении пенициллинрезистентных пневмококков мы сталкиваемся с теми же проблемами, что и у аминопенициллинов.
Следует подчеркнуть, что все пенициллины и цефалоспорины неактивны в отношении микоплазм, а также хламидий, и поэтому клинически неэффективны при атипичных пневмониях.
Макролидные антибиотики проявляют высокую природную активность в отношении пневмококков, стафилококков, микоплазм, хламидий и низкую — в отношении гемофильной палочки. Однако в последние годы во всех регионах мира, в том числе и в нашей стране, отмечается неуклонная тенденция повышения устойчивости пневмококков к макролидам. Резистентность пневмококков обычно ассоциируется с неуспехом терапии макролидами. Следует отметить, что новые полусинтетические макролиды не имеют преимуществ перед эритромицином, когда речь идет об устойчивых штаммах пневмококков. В последние годы значение макролидов при внебольничной пневмонии пересматривается. По всей видимости, эти препараты могут быть рекомендованы только в случае нетяжелой пневмонии при подозрении на атипичную этиологию.
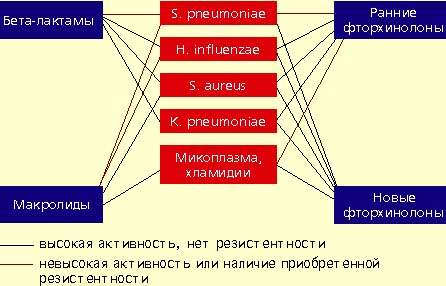 |
| Антимикробная активность бета-лактамов, макролидов и фторхинолонов в отношении наиболее значимых возбудителей внебольничной пневмонии |
Фторхинолоны обладают широким спектром антимикробной активности. Эти препараты проявляют природную активность в отношении практически всех потенциальных возбудителей внебольничной пневмонии. Однако применение ранних фторхинолонов (ципрофлоксацин, офлоксацин, пефлоксацин) при внебольничной пневмонии было ограничено из-за их слабой природной активности в отношении основного возбудителя пневмонии — S. pneumoniae. Значения минимальных подавляющих концентраций (МПК) ранних фторхинолонов в отношении пневмококков составляют от 4 до 8 мкг/мл, а их концентрация в бронхолегочной ткани значительно ниже, что недостаточно для успешной терапии. Описаны случаи, когда терапия фторхинолонами при пневмококковой пневмонии не приносила успеха.
Определенные перспективы лечения внебольничной пневмонии связаны с появлением в последние годы препаратов нового поколения фторхинолонов, которые характеризуются более высокой активностью в отношении S. pneumoniae. Современная классификация фторхинолонов представлена в таблице.
Первым препаратом нового поколения фторхинолонов является левофлоксацин, представляющий собой левовращающий изомер офлоксацина. Левофлоксацин характеризуется более высокой активностью против пневмококков (МПК = 2 мкг/мл) по сравнению с офлоксацином и ципрофлоксацином, причем препарат сохраняет активность и в отношении пенициллинрезистентных штаммов S. pneumoniae. Левофлоксацин — это первый и пока единственный антибактериальный препарат, который официально рекомендован в США для лечения пневмонии, вызванной пенициллинрезистентными пневмококками. Среди новых фторхинолонов только левофлоксацин выпускается в двух лекарственных формах — для приема внутрь и для внутривенного введения. Поэтому левофлоксацин может применяться не только в амбулаторной практике, но и при тяжелых пневмониях у госпитализированных больных. В большом количестве клинических исследований показана высокая эффективность левофлоксацина при внебольничной пневмонии в дозе 500 мг, вводимой однократно в сутки. К несомненным достоинствам левофлоксацина можно отнести его хорошую переносимость.
Вторым препаратом нового поколения фторхинолонов, внедренным в клиническую практику, был спарфлоксацин. Он зарегистрирован в нашей стране и выпускается только в пероральной форме. Однако наряду с доказанной высокой клинической эффективностью следует отметить ряд нежелательных эффектов, отмеченных при его применении. Прежде всего речь идет о существенной фототоксичности спарфлоксацина (т. е. повышенной чувствительности кожи к ультрафиолету); по некоторым данным, частота возникновения этого нежелательного явления составляет более 10%. Фототоксичность характерна для всех препаратов класса фторхинолонов, однако при использовании других препаратов этой группы (например, левофлоксацина, офлоксацина, ципрофлоксацина) это побочное явление возникает гораздо реже. К другим достаточно серьезным нежелательным явлениям, связанным с приемом спарфлоксацина, относится удлинение интервала QT на ЭКГ, что может сопровождаться появлением желудочковых аритмий, иногда опасных для жизни. Клиническое значение этого феномена до конца не ясно, однако известен факт отзыва с рынка препарата этого класса (грепафлоксацина) именно по данной причине. Таким образом, спарфлоксацин, по всей видимости, не может быть рекомендован для рутинного применения в амбулаторной практике при пневмонии, учитывая наличие других, более безопасных препаратов этой группы.
Последним зарегистрированным в нашей стране новым фторхинолоном является моксифлоксацин. Пока он существует только для перорального приема, однако в следующем году ожидается появление в клинической практике парентеральной лекарственной формы. Моксифлоксацин характеризуется очень высокой природной активностью в отношении пневмококков (МПК = 0,25 мкг/мл), в том числе пенициллинрезистентных штаммов, а также более высокой активностью (по сравнению с ранними фторхинолонами) в отношении микоплазм и хламидий. Моксифлоксацин в суточной дозе 400 мг (однократно) показал высокую клиническую эффективность и хорошую переносимость при внебольничной пневмонии. В контролируемых исследованиях не отмечено клинически значимого удлинения интервала QT и существенной фототоксичности.
Ряд перспективных препаратов нового поколения фторхинолонов в настоящее время проходят стадию клинического изучения. В 2001 году ожидается разрешение клинического применения в России еще двух препаратов этой группы — гемифлоксацина и гатифлоксацина.
Левофлоксацин и амоксициллин что лучше
В.Т.Пальчун1, Л.И.Кафарская2, Н.Л.Кунельская3, А.В.Гуров2, Г.Н.Изотова3, А.Н.Закариева1
1Кафедра ЛОР-болезней Лечебного факультета РГМУ, Москва
2Кафедра клинической микробиологии и вирусологии РГМУ, Москва
3Московский научно-практический центр оториноларингологии
В настоящее время острый гаймороэтмоидит занимает ведущее место в структуре ЛОР-заболеваемости взрослых и детей, требующей стационарного лечения. Так, по данным различных исследований, воспалительные заболевания околоносовых пазух составляют от 15 до 36% в структуре неотложных состояний ЛОР-органов. Актуальной задачей оториноларингологии является выбор оптимальных лекарственных средств для лечения этого заболевания. Часто неправильно подобранная, неэффективная терапия острой гнойно-воспалительной патологии околоносовых пазух ведет к увеличению сроков лечения, к хронизации процесса и тяжелым осложнениям. Выявление этиологического фактора, вызывающего то или иное инфекционное заболевание имеет решающее значение в их лечении. Одними из основных возбудителей острой воспалительной патологии ЛОР-органов являются бактерии, поэтому антибактериальные препараты относятся к основным при терапии этих заболеваний. Так как препараты для стартовой антибактериальной терапии назначаются эмпирически, этот выбор должен основываться на современных данных о наиболее частых возбудителях гаймороэтмоидита, их чувствительности к антибактериальным препаратам в данном конкретном регионе, а также данных анамнеза. Однако антибиотики назначаются без учета представлений о возможных возбудителях той или иной патологии, без их идентификации, а также без учета современных сведений об их чувствительности к антибактериальным препаратам. В настоящее время наиболее часто при инфекционной патологии околоносовых пазух используются лекарственные средства (самостоятельно и/или при назначении врачом), обладающие либо крайне низкой активностью, либо имеющие высокий процент резистентности в отношении основных возбудителей гнойно-воспалительных заболеваний в оториноларингологии.
Увеличение количества микроорганизмов, резистентных к антибиотикам за счет выработки b-лактамаз, уже многие годы стало существенной проблемой в лечении инфекций, вызываемых респираторными патогенами, которые до этого были наиболее чувствительны к пенициллинам и цефалоспоринам. Известно, что синтез b-лактамаз является одним из самых важных механизмов развития резистентности бактерий к бета-лактамным антибиотикам, в первую очередь к пенициллинам и цефалоспоринам I и II поколения. b-лактамаза играет важную роль в резистентности и в том случае, если она продуцируется присутствующими в участке инфекции бактериями, которые не являются основными возбудителями гнойного воспаления. Синтез b-лактамазы такими непрямыми патогенами может приводить к инактивации пенициллинов и отсутствию эффекта лечения, даже если основной патоген не продуцирует b-лактамазу.
Амоксициллин/клавуланат – это комбинированный антибактериальный препарат, состоящий из амоксициллина и клавулановой кислоты. Благодаря подавлению активности b-лактамазы клавулановой кислотой амоксициллин/клавуланат обладает активностью в отношении как синтезирующих, так и несинтезирующих b-лактамазу возбудителей риносинусита. Однако бета-лактамные антибиотики часто вызывают аллергические реакции и дисбактериозы желудочно-кишечного тракта.
Фторхинолоны III-IV поколения, сохраняя активность в отношении грамотрицательных возбудителей, более активны в отношении грамположительных кокков и атипичных возбудителей. In vitro они проявляют активность против метициллинорезистентных стафилококков. В связи с высокой активностью в отношении возбудителей респираторной инфекции они получили название «респираторные» фторхинолоны. Однако, к сожалению, респираторные фторхинолоны в настоящее время необоснованно редко назначаются в оториноларингологической практике.
Один из наиболее широко применяемых препаратов в респираторной патологии левофлоксацин – левовращающий изомер офлоксацина. Левофлоксацин блокирует ДНК-гиразу, нарушает суперспирализацию и сшивку разрывов ДНК, вызывает глубокие морфологические изменения в цитоплазме, клеточной стенке и мембране бактерий. Флорацид® (левофлоксацин) обладает широким спектром действия в отношении грамположительных (включая MRSA) и грамотрицательных микроорганизмов (включая синегнойную палочку) возбудителей острого и хронического риносинусита, активностью в отношении спорообразующих и неспорообразующих анаэробов, а также облигатных внутриклеточных патогенов. По своему действию на хламидии и микоплазмы левофлоксацин значительно превосходит макролиды и тетрациклины. Он также обладает активностью против микроорганизмов, резистентных к другим классам антибактериальных препаратов, включая макролидо- и пенициллинорезистентные пневмококки и b-лактамазопродуцирующие штаммы H. influenzae. Левофлоксацин обладает выраженным постантибиотическим эффектом против грамположительных и грамотрицательных микроорганизмов, который в среднем равен 2 ч. После приема внутрь препарат имеет большой объем распределения и достигает высоких концентраций в тканях и жидкостях организма, в частности в тканях околоносовых пазух, среднем ухе, слизистой оболочке трахеи и бронхов, а также в макрофагах. Помимо этого, левофлоксацин обладает также иммуномодулирующим действием, стимулируя синтез интерлейкинов, интерферона, гранулоцитов и макрофагов, благодаря чему обладает и опосредованным антимикотическим действием как в отношении дрожжевых, так и в отношении филаментозных грибов.
В связи с вышеизложенным, целью нашего исследования было сравнить эффективность различных антибактериальных препаратов при лечении острого гаймороэтмоидита на основании клинического и микробиологического исследований.
Материалы и методы
Было обследовано и проведено лечение 60 пациентам с острым гаймороэтмоидитом (мужчины и женщины в возрасте от 18 до 65 лет). Все пациенты предъявляли жалобы на головную боль, болезненность в области верхнечелюстных пазух, заложенность носа, выделения из носа. С целью верификации диагноза, мы проводили эндоскопический осмотр полости носа и околоносовых пазух с помощью жестких эндоскопов с углом зрения 0°, 30°, 70° и 120°.
Всем больным было проведено рентгенологическое исследование (рентгенография и компьютерная томография околоносовых пазух). Клинический диагноз ставился на основании всех методов исследования. Кроме того, всем больным в соответствии с целью работы проводили микробиологические исследования, при этом изучали патологическое содержимое на наличие аэробной, факультативно- и облигатно-анаэробной флоры. Исследования проводились в бактериологической лаборатории 1 ГКБ имени Н.И.Пирогова и на базе лабораторий Кафедры фундаментальной и клинической микробиологии РГМУ. После взятия биоматериала тампоны помещали в полужидкие транспортные среды Amies с углем или Stuart без угля производства фирмы
COPAN (Италия), после чего материал сразу же отправляли на исследование. Для выделения факультативно-анаэробных микроорганизмов посевы производили на сердечно-мозговой агар (BBL, USA) с 5% бараньей кровью; на среды Левина и Плоскирева (НПО «Питательные среды», Махачкала, Россия) Посевы инкубировали в термостате при 37°С в течение 18-20 ч. Для выделения чистой культуры выросшие колонии пересевали на 5% кровяной агар. Идентификацию выросших культур осуществляли на полуавтоматических микробиологических анализаторах «Sceptor» и «Crystal», производства компании Becton Dickinson, USA. В работе использовали диагностические системы № 431 Gram Positive Breakpoint ID Panel (Becton Diskinson, USA) для идентификации грамположительных штаммов и № 430 Gram Negative Breakpoint ID Panel (Becton Diskinson, USA) для идентификации грамотрицательных штаммов. Одновременно с идентификацией культур определяли чувствительность выделенных штаммов к антибиотикам и способность к b-лактамазообразованию выявленной флоры методом серийных микроразведений в лунках. Полученные результаты оценивали с помощью экспертной компьютерной программы «DMC», основанной на принципах NCCLS (версия 1997 г.).
Результаты исследования
В исследование были включены 60 пациентов (мужчины и женщины), из которых 30 человек принимали амоксициллин/клавуланат (0,5 г 3 раза в сутки per os) и 30 пациентов – левофлоксацин (Флорацид®) (0,5 г 1 раз в сутки per os), отобранных на основании принципов рандомизации слепым методом. У 28 пациентов был диагностирован двусторонний гаймороэтмоидит, у 23 – односторонний гаймороэтмоидит, у 6 – гемисинусит и у 3 пациентов – пансинусит. Длительность заболевания до обращения к врачу составила в среднем 3 дня. В настоящее исследование включались пациенты, не получавшие антибактериальную терапию на догоспитальном этапе.
По результатам проведенных исследований, у больных с острым гнойным гайморитом в обеих исследовательских группах наиболее частыми возбудителями явились следующие микроорганизмы: Streptococcus pneumoniae – в 39,8% случаев, Haemophilus influenzae – в 31,6% случаев. Среди других микроорганизмов выделялись: Moraxella catarrhalis (7,6%), Streptococcus pyogenes (6,8%), Staphylococcus aureus (4,8%), Staphylococcus spp. (4,3%), прочие микроорганизмы (среди них Neisseria spp., Klebsiella pneumoniae, K.ozaenae, Streptococcus spp., Candida spp., Aspergillus spp.) составили 5,1%.
Ассоциации микроорганизмов высевались в 9,4% случаев. При этом тяжесть клинического течения заболевания не зависела от наличия микробных ассоциаций. Наиболее часто встречались: S. pneumoniae в ассоциации с Candida spp., Streptococcus spp. и Neisseria spp.; H.influenzae в ассоциации с S.aureus, Staphylococcus spp., K.pneumoniae и грибами рода Aspergillus и др.
Данные, полученные при исследовании антибиотикоустойчивости выделенных штаммов микроорганизмов у больных с острым гнойным гайморитом, приведены в таблице.
Штаммы S. pneumoniae, выделенные у пациентов, проявляли максимальную чувствительность к амоксициллину/клавуланату, цефалоспоринам II и III поколения, левофлоксацину, характеризовались максимальной устойчивостью к ко-тримоксазолу, тетрациклину, эритромицину. Выделенные стафилококки характеризовались максимальной чувствительностью к амоксициллину/клавуланату и левофлоксацину, наибольшая устойчивость отмечалась к ко-тримоксазолу, бензилпенициллину, тетрациклину, оксациллину, эритромицину. Штаммы H.influenzae и M.catarrhalis характеризовались 100% чувствительностью к амоксициллину/клавуланату, цефалоспоринам II и III поколений, новым макролидам и фторхинолонам. Все выделенные у больных штаммы энтеробактерий в 100% случаев были чувствительны к левофлоксацину. Также высокую активность в отношении энтеробактерий проявляли цефалоспорины III поколения, фторхинолоны. Максимальная резистентность была отмечена к тетрациклину и ко-тримоксазолу.
По результатам проведенной антибактериальной терапии было отмечено выраженное клиническое и бактериологическое улучшение (эрадикация возбудителя или существенное уменьшение его количественного состава) во всех 60 случаях (см. рисунок). Однако в группе пациентов, принимавших Флорацид®, чистую промывную жидкость при пункции верхнечелюстной пазухи удалось получить в 21 (35%) случае на третьи и в 28 (46,7%) случаях – на четвертые сутки. При этом клинические данные полностью соответствовали результатам микробиологических методов исследования (полной эрадикации возбудителя удавалось достичь также на 3-4-е сутки). При этом к указанным срокам значительно улучшалось общее состояния больных, а окончательное разрешение клинической картины заболевания наступало на 5-6-е сутки.
В группе пациентов, принимавших амоксициллин/клавуланат, чистой промывной жидкости удавалось добиться у 17 (28,3%) пациентов на 5-е сутки терапии и в 29 (48,3%) случаях – на 6-е суткам терапии. Полной эрадикации возбудителей, по результатам микробиологического исследования, удалось добиться также на 5-е и 6-е сутки терапии у 25 исследованных больных.
В 3 (10,0%) случаях после применения амоксициллина/клавуланата, несмотря на выраженный положительный клинический результат, микробиологической эрадикации достигнуто не было. В двух случаях из пазухи продолжали выделяться штаммы
S. aureus в диагностическом титре, в другом случае – K. pneumoniae также в диагностическом титре. Во всех случаях для достижения клинического эффекта потребовалось дополнительное введение современного антисептика при выполнении очередной пункции верхнечелюстной пазухи, благодаря чему в конечном счете удалось достичь эрадикации возбудителя. Полное клиническое выздоровление данных больных наступало на 8-9-е сутки лечения.
Переносимость. При лечении Флорацидом® у 3 пациентов были отмечены побочные явления (тошнота), которые являлись легкими и имели транзиторный характер, при этом ни в одном случае не потребовалась отмена препарата. Подавляющее число пациентов отмечали удобную форму назначения препарата.
В группе больных, принимавших амоксициллин/клавуланат, нежелательные эффекты отмечались у 7 пациентов: диарейный синдром (3 случая), тошнота, диспепсические расстройства, а также выраженная крапивница. Необходимо отметить также тот факт, что пациенты, принимавшие амоксициллин/клавуланат, в подавляющем большинстве случаев отмечали неудобства, возникающие при необходимости приема препарата 3 раза в сутки.
Выводы
Таким образом, антибактериальный препарат Флорацид® является эффективным антибиотиком для терапии острого гнойного синусита – при этом клиническая и микробиологическая эффективность препарата составляет 100%.
На основании проведенных исследований, применение препарата Флорацид® оказалось более эффективным и приводило к более быстрым результатам как в отношении клинической картины заболевания, так и более быстрой эрадикации возбудителей, по сравнению с амоксициллином/клавуланатом. Эффективность терапии препаратом Флорацид® составила 100%. Все больные отмечали удобство применения препарата Флорацид® по сравнению с препаратом амоксициллин/клавуланатом. Флорацид® хорошо переносится больными: за время исследования не было отмечено нежелательных реакций, требующих отмены препарата. Препарат левофлоксацин может с успехом применяться при острых воспалительных заболеваниях в оториноларингологической практике как в амбулаторно-поликлинических, так и стационарных условиях.
