Лейкодистрофия что это за болезнь у детей
Лейкодистрофия. Причины, симптоматика, диагностика и лечение лейкодистрофии
1. Общие сведения
Термин «лейкодистрофия» объединяет группу редких (и очень редких) наследственных заболеваний, с развитием которых разрушаются миелиновые оболочки аксонов – связующих проводников между нейронами, функциональными клетками центральной нервной системы. Снижение концентрации миелина, выполняющего функции природного электроизолятора, приводит к «пробоям» и нарушениям в сложнейших электрохимических взаимосвязях, обеспечивающих высшую нервную деятельность, и вызывает ее постепенную общую деградацию вплоть до летального исхода. Название заболевания обусловлено цветом миелина (от греч. «лейкос» – белый). Эпидемиологические данные по лейкодистрофии неодинаковы для разных ее форм и, кроме того, обнаруживают значимую региональную зависимость, однако в среднем частота встречаемости составляет 1 случай на несколько десятков тысяч населения. Известно также, что лейкодистрофии наследуются по аутосомно-рецессивному типу и примерно с равной частотой встречаются у мужчин и женщин. В подавляющем большинстве случаев симптоматика манифестирует уже в раннем детском возрасте (в т.ч. на первом году жизни), причем более раннее начало связано статистической закономерностью с более быстрым и злокачественным течением.
2. Причины
В основе прогрессирующего миелинового дефицита лежит хроническая нехватка в организме лизосомных ферментов, что, в свою очередь, обусловлено наследуемой мутацией определенных генов. При наличии такого сбойного гена у обоих родителей вероятность того, что их ребенок заболеет лейкодистрофией (независимо от очередности и порядкового номера рождения) составляет 25%, или 1/4.
3. Симптоматика, диагностика
Различают несколько более или менее самостоятельных лейкодистрофических процессов, – метахроматическая, суданофильная, адренолейкодистрофия и т.д.; в некоторых из них выделяются, в свою очередь, отдельные возрастные формы. В целом же, симптоматика лейкодистрофий очень многообразна. Так, отмечаются тяжелые нарушения моторики (параличи, тремор, нистагмоидные движения глазных яблок, мышечный гипертонус) и координации движений, атрофия зрительного нерва, судорожные припадки эпилептического типа, при некоторых формах имеет место микроцефалия. Однако наиболее тяжелые нарушения и изменения касаются высшего продукта центральной нервной системы – психики. Если начало заболевания приходится на ранний детский возраст, обнаруживается выраженное отставание интеллектуального и эмоционального развития, некорригируемые поведенческие нарушения, практическое отсутствие обучаемости. Иногда элементарные навыки и автоматизмы не успевают выработаться вообще, и жизнедеятельность больного ребенка приходится поддерживать, фактически, искусственно. Если же заболевание манифестирует в более позднем или зрелом возрасте, начинается своего рода инволюция, т.е. «обратное развитие»: высшие психические функции распадаются и деградируют к предшествующим уровням развития, пока не наступает практически полная беспомощность, вегетативное существование и, в конечном счете, гибель больного.
В диагностике лейкодистрофий ключевое значение имеет изучение анамнеза, в т.ч. семейного; назначается неврологическое, медико-генетическое, биохимическое обследование. Необходим тщательный мониторинг динамики появившихся (и появляющихся) симптомов. В ряде случаев показана спинномозговая пункция с последующим микроскопическим анализом ликвора. Информативны, – и потому широко применяются, – современные визуализирующие методы: МРТ, МСКТ.
4. Лечение
Единственным эффективным, на данный момент, лечением лейкодистрофий является трансплантация костного мозга или пуповинной крови – как правило, от ближайших родственников (что, однако, также не гарантирует от возможных осложнений в виде отторжения донорского материала). Данная процедура позволяет в какой-то степени восполнить дефицит миелина и, по крайней мере, замедлить темпы прогрессирования болезни, но, к сожалению, положительный эффект наступает далеко не сразу (спустя несколько месяцев или даже 1,5-2 лет, в течение которых продолжается психический и неврологический распад) и, кроме того, пересадка не позволяет восстановить уже утраченный функциональный статус. Проводится также поддерживающая симптоматическая терапия, – в частности, для профилактики эпилептиформных приступов.
Исследования этиопатогенетических механизмов и, соответственно, разработка этиопатогенетических терапевтических стратегий (направленных на устранение первопричин) продолжаются. Однако на сегодняшний день лейкодистрофия остается тяжелым инвалидизирующим заболеванием с неблагоприятным прогнозом.
Лечение лейкодистрофии в Израиле — точная диагностика и передовые методы терапии
Лейкодистрофия является группой врожденных нейродегенеративных патологий, при котором недостаточный синтез определенных ферментов провоцирует накопление в мозговых тканях метаболитов, вызывающих распад миелина. Учитывая тяжелое протекание и редкость данной болезни, ее успешная диагностика и терапия требуют от специалистов высокой квалификации и огромного опыта. Лечение лейкодистрофии в Израиле проходит по программе, разработанной на основе данных, полученных при обследовании пациента, и в большинстве случаев позволяет ослабить болезненные симптомы, добиться продления жизни больного и повышения ее качества.
Методы лечения заболевания
При лейкодистрофии поражается белое вещество мозга, откуда и пошло название болезни. Насчитывается приблизительно 60 разновидностей патологии, различающихся типом генных нарушений и возрастом, в котором у пациента проявляются первые клинические симптомы. Основные, и наиболее известные, виды заболевания — метахроматическая, глобоидно-клеточная и суданофильная лейкодистрофии, при этом, в зависимости от возраста манифестации болезни, каждая разновидность делится на несколько форм.
Причины лейкодистрофии заключаются в генетически обусловленном нарушении синтеза определенных ферментов. Дефектная продукция фермента влечет за собой нарушения обмена липидов и отложение метаболитов в некоторых органах, прежде всего, в почках и печени. На клеточном уровне нарушения метаболизма ведут к разрушению миелина, входящего в состав проводящих нервных путей, и гибели нейронов, впоследствии замещающихся тканью глии.
Как правило, симптоматика заболевания проявляется в первые месяцы жизни ребенка. При рождении малыш кажется здоровым, у него отсутствуют характерные признаки и нарушения. После возникновения неврологические симптомы неуклонно прогрессируют, в первую очередь проявляясь в резком ухудшении зрения и слуха, атаксии, развитии эпилептиморфных приступов, спастических парезов, изменениях поведения, отставании в умственном развитии вплоть до олигофрении. При диагностике лейкодистрофии прогноз сомнительный, успех лечения, направленного на максимальное замедление развития заболевания и улучшение качества жизни пациента, зависит от стадии, на которой оно было начато.
Как и в случае других заболеваний, обусловленных генетическими нарушениями, на сегодняшний день не разработаны методы, дающие возможность полностью остановить развитие болезни и восстановить утраченные функции. Однако применяемые в Израиле прогрессивные способы лечения позволяют нормализовать состояние больного и максимально стабилизировать функционирование головного мозга.
Медикаментозное лечение
В курс лекарственной терапии входят препараты, направленные на купирование симптомов, нормализацию процесса обмена веществ, предупреждение развития эпилептиморфных приступов. Пациентам назначаются противосудорожные и дегидратационные препараты, гормональные средства, антагонисты фолиевой кислоты, цитостатические препараты, витаминно-минеральные комплексы. Для восполнения недостающих элементов проводится переливание эритроцитарной массы и плазмы крови, вводятся тканевые экстракты.
Трансплантация костного мозга
Является фактически единственным действенным способом лечения лейкодистрофии. При пересадке донорского костного мозга или пуповинной крови (аллогенная трансплантация) нормализуется уровень дефицитного белка, улучшается метаболизм, в результате чего заметно увеличивается качество и продолжительность жизни пациента. Однако следует учитывать, что процедура имеет ряд серьезных ограничений.
Трансплантация должна проводиться как можно раньше, до формирования у больного выраженных неврологических расстройств. Это связано с тем, что как бы успешно ни была выполнена пересадка, она не дает возможности исправления возникших нарушений, приводя только к замедлению их прогрессирования. Принимая во внимание высокую скорость развития некоторых форм лейкодистрофии, тяжелого состояния больного, приводящего к инвалидизации или к летальному исходу, не удается избежать даже после трансплантации. Это объясняется тем, что после процедуры должно пройти 1-2 года для восстановления за счет функционирования клеток донора уровня миелина. За это время заболевание успевает значительно развиться, поэтому максимальный эффект трансплантации получается в случаях проведения ее еще до возникновения клинической симптоматики.
В случае аллогенной пересадки всегда существует опасность отторжения пересаженного материала, вероятность развития реакции «трансплантат против хозяина», инфекционных осложнений.
Если пересадка костного мозга по каким-либо причинам противопоказана пациенту, назначается паллиативное лечение, целью которого является возможное ослабление симптомов.
Способы диагностики патологии
Постановка правильного диагноза требует мультидисциплинарного подхода — участия не только лечащего врача, но и ряда узкопрофильных специалистов (педиатра, невролога, офтальмолога и других). В Израиле всестороннее обследование пациента с использованием высокоточных инструментальных и лабораторных методик занимает около трех дней.
По прибытии в страну и поступления в клинику пациента направляют на первичную консультацию ведущего специалиста-невролога. На приеме врач внимательно изучает анамнез (первые признаки заболевания и время, когда они проявились, последовательность их возникновения, характер и выраженность), узнает о наличии подобных патологий у близких родственников. После проведения поверхностного осмотра составляется список необходимых обследований, выписываются направления к другим специалистам.
На следующие день пациенту выполняются назначенные диагностические процедуры:
— исследование спинномозговой жидкости (ликвора) — с помощью пункции получается нужное количество ликвора, после чего он направляется в лабораторию для проведения детального анализа. В ходе исследования проводится оценка прозрачности и цвета спинномозговой жидкости, которая в норме прозрачна и бесцветна, определяется количество и виды клеток, уровень солей хлора и глюкозы. Для лейкодистрофии характерно значительное возрастание содержания белка, что вызвано разрушением мозговых клеток.
— биохимические тесты — с помощью специфических методик определяется содержание ферментов и накопившихся метаболитов.
— нейросонография.
— эхо-энцефалография.
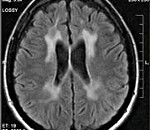
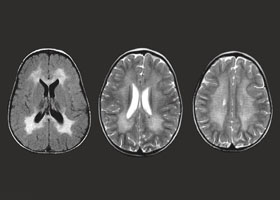
— компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) головного мозга — на снимках четко визуализируются участки демиелинизации, причем МРТ может показать их еще до появления клинических симптомов.
— молекулярно-генетическое тестирование.
— пренатальная диагностика.
Результаты передаются на рассмотрение врачебного консилиума, состоящего из невролога и узкопрофильных специалистов. Изучив полученные данные, врачи устанавливают диагноз и разрабатывают схему лечения.
Сколько стоит лечение заболевания
Цена лечения входит в число самых актуальных вопросов. Прохождение терапевтического курса в израильской клинике позволяет пациенту сэкономить примерно 30% суммы, необходимой в западноевропейских странах, и до 50% стоимости аналогичных услуг в США.
Преимущества лечения в Израиле
Обратившись в израильскую клинику, вы сможете значительно улучшить жизнь пациента даже с таким тяжелым заболеванием. Главное — не медлить и начинать лечение как можно раньше.
Метахроматическая лейкодистрофия
Метахроматическая лейкодистрофия — аутосомно-рецессивно наследуемая демиелинизирующая патология ЦНС, отличительной особенностью которой является метахроматическое окрашивание зон демиелинизации. В клинике преобладает задержка развития, парезы, судорожные приступы, экстрапирамидные и мозжечковые расстройства, нарушение зрения. В ходе диагностики проводится исследование цереброспинальной жидкости, уровня сульфатидов, активности арилсульфатазы А, КТ/МРТ головного мозга, генетические обследования. Возможна пренатальная диагностика. Лечение симптоматическое, в отдельных случаях проводится трансплантация пуповинной крови или стволовых клеток.
Общие сведения
Метахроматическая лейкодистрофия — один из основных видов лейкодистрофии, характеризующийся, как и другие ее типы, задержкой психомоторного развития, расстройством психики, спастическими парезами, мозжечковым синдромом, экстрапирамидными нарушениями, судорожным синдромом и атрофией зрительных нервов. Встречается в популяции с частотой 1 случай на 40 тыс. Наследуется аутосомно-рецессивно. Впервые выделена как нозологическая форма в 1910 г. Альцгеймером, подробно описана в 1925 г. Шольцем. Время манифестации заболевания существенно варьирует и обуславливает его клиническое течение. В соответствии с этими особенностями выделяют несколько вариантов патологии: врожденную (раннедетскую) форму, позднедетскую форму Гринфилда, ювенильную форму Шольца и взрослую форму. Наиболее часто наблюдается познедетская форма. В виду отсутствия эффективных способов лечения метахроматическая лейкодистрофия является проблемной патологией для современной педиатрии, неврологии и генетики.
Причины
Основным субстратом заболевания выступает дефект расположенного на 22-й хромосоме гена, ответственного за синтез арилсульфатазы А. Результатом дефицита указанного энзима является блокировка метаболизма сульфатида в галактоцереброзид. Сульфатиды откладываются в белом веществе головного и спинного мозга, коже, соматических органах (печени, легких, сердце, почках) и в костях. Однако при этом функция внутренних органов не страдает (исключением является желчный пузырь), а в мозговом веществе происходят прогрессирующие дегенеративные изменения, ведущие к гибели заболевшего.
Отложение сульфатидов в нервной ткани приводит к разрушению миелина и накоплению продуктов его распада. В процесс демиелинизации вовлекаются не только структуры ЦНС, но и периферические нервные стволы. В головном мозге формируются диффузные очаги демиелинизации, дающие при их гистохимическом исследовании метахроматическое окрашивание.
Симптомы метахроматической лейкодистрофии
Врожденная метахроматическая лейкодистрофия дебютирует до 3-месячного возраста задержкой развития и эписиндромом. Быстро присоединяется спастический парез, расстройства глотания. Дети погибают на 1-ом году жизни.
Позднедетская метахроматическая лейкодистрофия (поздняя инфантильная форма) обычно манифестирует на 2-ом году жизни ухудшением моторики и задержкой психического развития. Отмечается неустойчивая походка, понижение мышечного тонуса. В течении позднедетской формы различают 4 периода. Первый характеризуется мышечной гипотонией и слабостью, угасанием сухожильных рефлексов, затруднением ходьбы. Длится от 1-3 мес. до 1 года, иногда и дольше. Второй период знаменуется выраженным отставанием в интеллектуальной сфере, сменой гипотонии на гипертонию мышц. Ребенок утрачивает способность стоять. Наблюдается дизартрия, атрофия зрительных нервов. Период занимает несколько месяцев. В третьем периоде отмечается тетраплегия, тяжелая олигофрения, бульбарный и псевдобульбарный паралич. Четвертый период сопровождается утратой реакций на окружающие события. Ребенок не говорит, не может принимать пищу, развивается полная слепота. При хорошем уходе и кормлении через гастростому или желудочный зонд данный период может продолжаться 1-2 года.
Ювенильная метахроматическая лейкодистрофия начинается после 3-летнего возраста в периоде до 10 лет (чаще в возрасте около 6 лет). Дебютирует эмоциональной лабильностью, изменениями в поведении, снижением когнитивных функций (у школьников происходит резкое ухудшение успеваемости), атаксией, затруднениями при ходьбе. Зачастую отмечаются эпиприступы. Заболевание неуклонно прогрессирует и, в зависимости от начала симптоматики, к 10-15 годам жизни приводит к летальному исходу.
Взрослая метахроматическая лейкодистрофия манифестирует после пубертата, может возникать до 60-летнего возраста. Как правило, имеет начало с психических расстройств шизофреноподобного или психопатического характера, отчего заболевшие первоначально становятся пациентами психиатра. В отдельных случаях дебют происходит с симптомов полиневропатии. Развитие патологических изменений происходит медленнее, чем при других возрастных вариантах заболевания. В позднем периоде развиваются тетрапарез, бульбарные нарушения, деменция. Летальный исход наблюдается спустя 10-20 лет от начала симптоматики.
Диагностика метахроматической лейкодистрофии
Диагностические мероприятия имеют комплексный характер и позволяют отдифференцировать метахроматическую лейкодистрофию от других нейродегенеративных заболеваний и других форм лейкодистрофии. Проводится люмбальная пункция, при исследовании цереброспинальной жидкости определяется повышенная концентрация белка, дефицит арилсульфатазы, белково-клеточная диссоциация. Электромиография выявляет увеличение длительности проведения нервных импульсов. КТ головного мозга визуализирует расширенные желудочки и определяет пониженную плотность белого церебрального вещества. МРТ головного мозга выявляет очаги демиелинизации.
Важное диагностическое значение имеют биохимические исследования: определение сульфатидов в крови и моче, оценка активности арилсульфатазы А в лейкоцитах взятой на анализ крови. Пациентам показана консультация генетика с проведением генеалогического исследования; возможна ДНК-диагностика. Разработан также метод пренатальной диагностики патологии — определение активности арилсульфатазы А в клетках полученной при амниоцентезе амниотической жидкости. Исследования показали, что у носителей патогенного гена также отмечается сниженный уровень арилсульфатазы А. В связи с этим вместо пренатальной диагностики плода предлагается обследовать родителей будущего ребенка, чтобы избежать медаборта плода, являющегося лишь носителем дефектного гена.
Лечение метахроматической лейкодистрофии
Терапия, способная предотвратить летальный исход заболевания, пока не найдена. Осуществляется лечение, направленное на купирование его отдельных симптомов: противосудорожная терапия, борьба с контрактурами суставов; на поздних стадиях — профилактика пролежней, парентеральное питание. Проводится поиск более эффективных способов лечения, особенно в области генной терапии.
Предпринимаются попытки лечения путем трансплантации костного мозга и пуповинной крови. У ряда пациентов пересадка стволовых клеток позволяет добиться временной стабилизации состояния и замедления прогрессирования патологических изменений. Донором стволовых клеток обычно выступает родственник больного, не имеющий лейкодистрофии и тщательно обследованный. Однако следует помнить, что сама трансплантация может повлечь за собой целый ряд осложнений: отторжение, интеркурентные инфекции, реакцию «трансплантат против хозяина». Кроме того, при быстром прогрессировании симптомов летальный исход опережает наступление эффекта трансплантации.
Прогноз
Пока не найдена эффективная терапия лейкодистрофий, она имеет крайне неблагоприятный прогноз. При врожденной форме дети не доживают до 1 года. При позднедетском варианте продолжительность болезни, как правило, не превышает 4 года, при ювенильном — 6 лет. Среди пациентов со взрослой формой известны отдельные случаи, когда продолжительность жизни составила около 50 лет. Пока единственным способом предупреждения лейкодистрофии является недопущение рождения ребенка, имеющего соответствующую генную мутацию. В этом плане основное значение имеет генетическое консультирование пар, планирующих деторождение, а также обследование будущих родителей из группы риска на степень активности арилсульфатазы А.
Лейкодистрофия
Общие сведения
Лейкодистрофия головного мозга — врожденное заболевание нервной системы. Википедия дает следующее определение данной патологии: «это группа тяжелых наследственных заболеваний, которые характеризуются поражением белого вещества головного мозга спинного». Это нейродегенеративные, достаточно редкие заболевания, для которых характерно нарушение обмена веществ, связанного с врожденным дефектом того или иного фермента, что сопровождается накоплением метаболитов, которые вызывают разрушение миелина белого вещества мозга и прогрессирующую его дегенерацию.
Группа лейкодистрофий включает более 60 форм, которые отличаются видом мутации и возрастом проявления болезни, что влияет на прогноз заболевания. В зависимости от возраста формы могут подразделяться на варианты: инфантильный, ювенильный и взрослый. Все эти заболевания сопровождаются нарушением передачи нервных импульсов в ЦНС, в связи с чем у больных возникают сначала двигательные, а затем и интеллектуальные расстройства, задержка психомоторного развития. По мере разрушения миелина расстройства прогрессируют и за несколько лет у больных развивается тяжелая физическая и психическая деградация. Некоторые формы имеют отличительные симптомы, связанными с поражением и других органов кроме ЦНС. Многие формы настолько редко встречаются, что даже в мировой медицинской литературе описано несколько сотен случаев и наблюдений за больными.
Патогенез
Генетически обусловленный дефект приводит к нарушению обмена (чаще нарушается метаболизм липидов). Это влечет отложение того или иного вещества (метаболита) в тканях. Прежде всего поражается головной мозг и спинной, почки и печень. Токсические метаболиты вызывают разрушение миелина, гибель или атрофию нейронов (клетки нервной ткани), при этом погибшие нейроны замещаются глиальной тканью (соединительная ткань), которая разрастается. Любая лейкодистрофия характеризуется основными патогенетическими процессами: диффузная гибель миелина в полушариях, скопление продуктов, которые образуются после его распада и усиленное разрастание глии. При отдельных формах отмечается специфическая картина — метахроматическое (суданофильное) окрашивание распавшихся продуктов миелина или скопление в зонах распада характерных глобоидных клеток. При болезни Александера в результате мутации в нервной ткани накапливается генетически измененный (мутантный) белок GFAP.
Классификация
Наследственные лейкодистрофии по характеру являются гипомиелинизирующими — миелин изначально не образуется или образуется в недостаточном количестве. Большинство из этих заболеваний наследуется по аутосомно-рецессивному признаку — это значит, что вероятность заболевания у ребенка составляет 25%, если оба родителя-носители гена. В таких случаях с одинаковой частотой в семьях заболевают мальчики и девочки, рожденные от близкородственных браков.
Есть форма, которая характеризуется наследованием, сцепленным с Х хромосомой (адренолейкодистрофия) — она передается Х-хромосомой матери-носительницы болезни. Чаще всего встречаются метахроматическая лейкодистрофия, Пелицеуса-Мерцбахера (или суданофильная), адренолейкодистрофия, болезнь Краббе, Александера и Канавана. Кратко остановимся на этих формах.
Метахроматическая лейкодистрофия — одна из частых и изученных форм. Девочки и мальчики поражаются одинаково часто. При данной патологии отмечается дефицит лизосомного фермента арилсульфатазы. Этот дефект приводит к тому, что в белом веществе головного мозга, периферических нервов и органах (печень, легкие, почки, сердце) накапливаются специфические метаболиты сульфатиды, которые при гистохимическом исследовании дают специфическое метахроматическое окрашивание. Функция внутренних органов не страдает, а в мозговом веществе прогрессируют дегенеративные изменения. Метахроматическая лейкодистрофия по клинике делится на типы: врожденный, поздний инфантильный, ювенильный (ранний и поздний) и взрослый. Все типы протекают с ухудшением двигательной и психической функции, но эти нарушения возникают в разный возрастной период и степень прогрессирования тоже разная.
Врожденная метахроматическая форма развивается до 3-х месяцев и проявляется эпилептическим синдромом и задержкой развития. К ним присоединяется парез и прогрессирующие расстройства глотания. Малыши умирают на первом году жизни.
Поздняя детская форма — самая частая. Заболевание проявляется в 6 месяцев — 4 года. Дети, которые нормально развивались до 8-9 месяцев к году жизни теряют приобретенные навыки — у них нарушается походка, они перестают сидеть и ходить, появляется разболтанность суставов, снижаются сухожильные рефлексы и прогрессирует мышечная слабость, нарушается функция глотания и ухудшается зрение (атрофия зрительных нервов). Постепенно развивается нарушение функции ног, а затем и рук (спастический тетрапарез), нарушения глотания. При хорошем питании через желудочный период продолжается 1-2 года. Но потом двигательная и когнитивная функция быстро прогрессируют, и такие дети умирают в течение 5 лет с начала заболевания.
Ведущий симптом при ювенильной форме (6-10 лет) — нарушение координации движений (мозжечковая атаксия). Больные неустойчивы, ходят неуверенно с широко расставленными ногами, отмечается шаткость при походке. С поздней ювенильной формой больные доживают до взрослого возраста. Взрослая форма проявляется нарушением поведения, из-за чего пациентов часто принимают за психиатрических больных, и снижением когнитивной функции. Постепенно развиваются нарушения движений. Дети редко доживают до десяти лет.
Взрослая форма начинается после пубертата в период до 50-60-лет. Начинается с психических расстройств (психопатия, шизофреноподобный синдром). Также развиваются полинейропатии. Если сравнивать с другими возрастными вариантами, то изменения прогрессируют медленно и заканчивается заболевание тетрапарезом и возрастной деменцией.
Лейкодистрофия Пелицеуса-Мерцбахера связана с генетическим дефектом синтеза апопротеина — белка, который важен для функции клеток олигодендроцитов, участвующих в миелинизации аксонов. Передается по аутосомно-рецессивному признаку: если оба родителя носители мутантного гена в 25% рождается больной ребенок. Второй тип наследования — сцепленная с полом передача (только мальчикам в семье или девочкам).
Проявляется болезнь рано — с 5 до 10 месяцев и имеет медленное развитие. В течение болезни появляется «светлый» промежуток, очень долго длящийся. В связи с этим больные доживают до зрелого возраста и летальный исход возможен только в возрасте 20-30 лет. Болезнь Пелицеуса-Мерцбахера в младенчестве проявляется кивательными движениями головы, блуждающими движениями глаз нистагмом, задержкой развития. Когда малыш начинает ходить, у него появляется атаксия и спастичность конечностей, хореоатетоз (сочетание быстрых и порывистых движений с медленными судорожными). Постепенно развивается нарушение речи и атрофия зрительных нервов. Умственное развитие детей не страдает.
Адренолейкодистрофия связана с мутациями гена АВСD1 и изменением белка ALDP. При генетической диагностике обнаруживают мутации гена ABCD1 (это могут точечные мутации, делеции нуклеотидов и крупные делеции). При этом нарушается транспорт нормальных жирных кислот в миелиновую оболочку и образуются аномальные сверхдлинноцепочечные жирные кислоты в большом количестве, оказывающие токсическое действие на миелин. В результате токсического действия концентрация миелина резко снижается. Помимо поражения ЦНС и периферической нервной системы отмечается поражение надпочечников в виде их недостаточности. В зависимости от преобладания симптомов в клинике выделяют церебральную форму, периферическую и форму только с надпочечниковой недостаточностью.
Церебральная Х-сцепленная адренолейкодистрофия может проявляться в детском возрасте (пик 7-8 лет, детская форма), юношеском (манифестирует в 10-21 лет, юношеская форма) и во взрослом возрасте (30-50 лет, встречается редко). Детская и юношеская формы характеризуются быстрым прогрессированием двигательных нарушений, интеллектуальных и поведения. В детском возрасте наиболее часто встречаются гиперактивное поведение или противоположность ему — аутистическое поведение. У детей возникает агрессивность, снижается память и внимание, возникают проблемы с обучением, нарушается походка и прогрессирует слабоумие.
Значительно реже бывают нарушения зрения и слуха, а также надпочечниковая недостаточность (низкое давление, гиперпигментация кожи, слабость, рвота и тошнота, возникающие периодически). В юношестве прогрессирует умственная отсталость, прогрессивно ухудшается память, развивается спастический тетрапарез (нарушается двигательная функция рук и ног), снижается зрение и слух, появляются судороги. У взрослых заболевание проявляется деменцией и шизофренией. Также у больных нарушается функция глотания и зрения (выпадают поля зрения). Чаще всего прогноз неблагоприятный: несколько лет от начала первых симптомов заболевание прогрессирует и приводит к смерти.
Лейкодистрофия Краббе связана с дефицитом определенного лизосомного фермента, что обусловлено мутациями в гене GALC. При недостатке этого фермента в нервной ткани накапливается галактозилсфингозин — высокотоксичное вещество, вызывающее демиелиенизацию и гибель клеток с образованием в очагах больших глобоидных образований. Болезнь Краббе бывает нескольких подтипов: инфантильный, поздний инфантильный, взрослый и ювенильный. Самая частая из всех форм — инфантильная, она считается классической и составляет до 90% всех случаев.
Первые проявления заболевания наблюдаются в 3-6 месяцев. Сначала у малышей появляется гипервозбудимость, повышенный мышечный тонус, рвота, гастроэзофагеальный рефлюкс, плохая прибавка веса и задержка развития (до этого периода ребенок развивался нормально). На втором этапе заболевания отмечается регресс психомоторного развития (теряются все навыки), появляются судороги и опистотонус, наступает атрофия зрительных нервов (слепота) и прогрессирует гипотрофия (нарушение питания). На третьей стадии заболевания ребенок полностью теряет произвольные движения, и у него возникает децеребрационная поза, которая свидетельствует о тяжелом поражении головного мозга.
Лейкодистрофия Канавана обусловлена мутацией гена ASPA, ответственным за синтез фермента аспартоацилазы. Этот фермент расщепляет токсичный N-ацетиласпартат. Накопление токсичного вещества вызывает дегенерацию серого и белого вещества мозга. Тип наследования аутосомно-рецессивный с передачей гена от обоих родителей.
Болезнь Кэнэвэн-ван-Богарта-Бертрана развивается постепенно и сначала ребенок развивается нормально. Через несколько месяцев навыки начинают угнетаться, снижается мышечная активность, увеличивается спастичность мышц, взгляд становится нефиксированным, затрудняется вскармливание из-за нарушений глотания, а также постепенно увеличивается объем головы. Болезнь прогрессирует стремительно, но произвольные движения пока сохраняются. Потом ребенку становится трудно фиксировать голову, развиваются спастические парезы рук и ног. По мере прогрессирования глотательный рефлекс утрачивается и ребенка кормят через пищеводный зонд. Развиваются судорожные припадки, реакции на раздражители отсутствуют и утрачивается зрение — эти симптомы являются пиком заболевания. Развитие симптомов может быть быстрым (в течение нескольких месяцев) и длительным (до 10 лет). Бактериальные или вирусные инфекции — частые осложнения этого заболевания.
Причины
Как было указано выше, причиной этой группы заболеваний являются генные мутации и наследование патологии от родителей. Вид мутаций установлен для наиболее распространенных форм. Мутации выявляются в генах, кодирующих различные лизосомальные ферменты:
Симптомы
В зависимости от формы лейкодистрофия у ребенка проявляется или в грудном возрасте (первые месяцы) или раннем детстве. До этого времени ребенок развивается нормально и не отстает от сверстников. Постепенно развивающиеся изменения в ткани мозга (головного или спинного) проявляются неврологическими расстройствами.
Первыми появляются двигательные нарушения: ухудшается координация, ребенку трудно удерживать тело в равновесии, он перестает сидеть и ходить. Развивается мышечная слабость, изменяется тонус мышц (чаще всего он повышается, но может снижаться), появляются мышечные подергивания, а потом судорожные приступы. К двигательным расстройствам присоединяются психические нарушения (меняется поведение), ухудшается интеллект и память. Вышеперечисленные симптомы неуклонно прогрессируют. Постепенно ухудшаются слух и зрение. На поздних стадиях развиваются параличи, выраженная олигофрения, слепота, глухота, ребенок теряет возможность глотать. В терминальной стадии наблюдается децеребрационная ригидность. Больной лежит в позе разгибания. При этом шея и позвоночник напряжены, а голова запрокинута, ноги разогнуты и повернуты внутрь, могут быть скрещены. Стопы и руки разогнуты, а пальцы сжаты в кулак. Скорость прогрессирования симптомов заболевания больше, чем раньше проявились первые симптомы. Периферическая нейропатия у ребенка — важная черта метахроматической лейкодистрофии и болезни Краббе, при которых нарушается метаболизм липидов миелина.