Лейкодистрофия метахроматическая у ребенка что это такое
Лейкодистрофия метахроматическая у ребенка что это такое
Считается, что избыточное накопление сульфатида цереброзида вызывает распад миелина и деструкцию олигодендроглии. Разработана пренатальная диагностика метахроматической лейкодистрофии, основанная на определении арилсульфатазы А в ворсинах хориона или в культуре клеток амниотической жидкости. Окраска срезов тканей крезилом фиолетовым вызывает метахроматическое окрашивание сульфатидных гранул, этот феномен лежит в основе названия заболевания.
Группа метахроматических лейкодистрофии включает шесть заболеваний, которые классифицируется в соответствии с возрастом пациентов в дебюте болезни и ферментным дефицитом. Ниже представлены короткие описания трех из этих заболеваний: классическая, или поздняя, младенческая, ювенильная и взрослая лейкодистрофия.
Поздняя младенческая метахроматическая лейкодистрофия характеризуется постепенным малозаметным началом с нарушения походки в возрасте 1-2 лет. В начале ребенок выглядит неловким и часто падает, однако способность к передвижению постепенно значительно нарушается и пациент нуждается в поддержке при ходьбе. Выявляется гипотония мышц конечностей, глубокие сухожильные рефлексы отсутствуют или снижены. В последующие несколько месяцев ребенок теряет способность стоять, снижение интеллекта становится выраженным.
Характерна нечеткая речь, дизартрия, ребенок выглядит вялым и апатичным. Зрительная фиксация нарушена, выявляется нистагм, на глазном дне — атрофия диска зрительного нерва. В течение 1 года после дебюта заболевания ребенок теряет способность сидеть самостоятельно, отмечается прогрессирующая декортикационная ригидность. Прием пищи и глотание нарушены вследствие псевдобульбарного паралича, необходимо наложение гастростомы для кормления ребенка. На конечной стадии заболевания развивается ступор, пациенты умирают от аспирации или бронхопневмонии в возрасте 5-6 лет. Нейрофизиологические методы исследования выявляют прогрессирующее изменение ВП (ЗВП, слуховых ВП ствола, ССВП) и значительное снижение скорости проведения возбуждения по периферическим нервам.
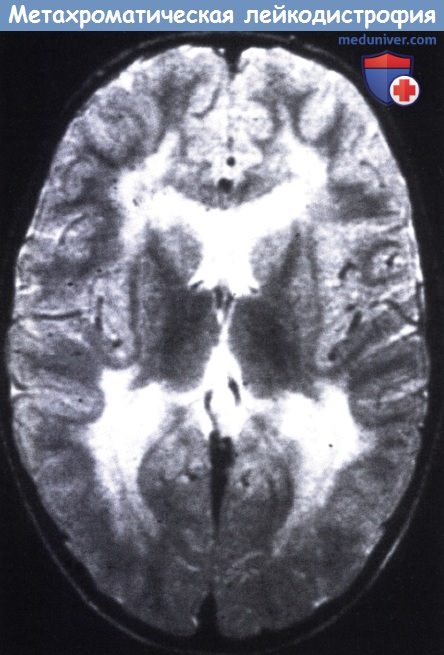
На КТ и МРТ головного мозга диффузное симметричное снижение плотности белого вещества в мозжечке и полушариях мозга, в СМЖ повышен уровень белка. Трансплантация костного мозга — перспективный метод лечения поздней младенческой метахроматической лейкодистрофии. Эффективность трансплантации отмечена только при ее проведении на ранней стадии заболевания. В настоящее время небольшое число пациентов и слишком короткий период катамнестического наблюдения не позволяют сделать заключение об эффективности трансплантации костного мозга в лечении этого заболевания.
Взрослая форма метахроматической лейкодистрофии дебютирует на 2-6-м десятилетии жизни. Основные клинические проявления — нарушение памяти, психические нарушения и личностные изменения. Медленно прогрессируют такие неврологические нарушения, как спастичность, дистония, атрофия зрительных нервов и генерализованные судороги; в терминальной стадии пациенты прикованы к постели, характерны декортикационная поза и отсутствие реакции на окружающую среду.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Метахроматическая лейкодистрофия
Об этом заболевании впервые сообщено немецким врачом Альцгеймером (A. Aizheimer) в 1910 г., детальное описание представлено в 1925 г. немецким невропатологом Шольцем (Scholz). Популяционная частота 1: 40 000.
Что провоцирует / Причины Метахроматической лейкодистрофии:
В основе всех клинических форм лежат аллельные мутации гена арилсульфатазы А, локализованного на 22-й хромосоме. Это приводит к дефициту фермента арилсульфатазы А и нарушению превращения сульфатида в галактоцереброзид.
Патогенез (что происходит?) во время Метахроматической лейкодистрофии:
Сульфатиды накапливаются в печени и почках, иногда в небольших количествах в сердце, легких, селезенке, коже, костях и желудочно-кишечном тракте, однако функция органов не страдает. Отложения в желчном пузыре приводят к его патологии. Накопления сульфатидов в белом веществе головного и спинного мозга вызывают значительные расстройства нервной системы. При этом олигодендриды в ЦНС и миелиновые оболочки периферических нервов подвергаются демиелинизации, в глиальных клетках и нейронах находят гранулярные и ламеллярные включения.
Симптомы Метахроматической лейкодистрофии:
Различают позднюю инфантильную, ювенильную и взрослую формы метахроматической лейкодистрофии.
Поздняя инфантильная форма проявляется между первым и вторым годами жизни задержкой речевого развития и ухудшением моторных функций (ходьбы). Затем дети начинают плохо стоять, появляются мышечная гипотония, сменяющаяся гипертонией, нистагм, дизартрия, расстройство глотания, угнетение рвотного рефлекса, гипомимия, атаксия. Выделяют 4 стадии этой формы заболевания.
I стадия характеризуется мышечной слабостью и гипотонией рук и ног, снижением или отсутствием глубоких сухожильных рефлексов, переразгибанием коленных суставов, затруднениями при ходьбе. Продолжительность стадии от нескольких месяцев до 1 года и более.
II стадия проявляется отставанием интеллектуального развития, дизартрией, афазией, нистагмом, ребенок не может стоять, мышечный тонус в нижних конечностях повышен, наблюдаются атаксия, интермиттирующие боли в руках и ногах. При исследовании глазного дна выявляют атрофию зрительного нерва, серое окрашивание желтого пятна. Продолжительность этой стадии несколько месяцев.
Для III стадии характерны тетраплегия, мышечная дистония, декортикация и децеребрация, симптомы бульбарного и псевдобульбарного паралича, тяжелый психический дефект.
При IV стадии отмечаются исчезновение реакции на окружающее, развитие слепоты, ребенок перестает говорить, есть (кормление осуществляется через зонд или гастростому). Продолжительность этой стадии от нескольких месяцев до нескольких лет (при хорошем уходе). Больные погибают в детском возрасте.
Ювенильная форма метахроматической лейкодистрофии проявляется между 3 и 10 годами снижением интеллекта, изменением поведения, нарушением походки, атаксией. Часты судороги. Вначале симптомы могут быть выражены нерезко. Причиной обращения к врачу в этих случаях служит плохая успеваемость в школе из-за эмоциональной лабильности, Прогрессирование процесса может быть медленным. Больные погибают в возрасте от 5 до 12 лет.
Диагностика Метахроматической лейкодистрофии:
Диагноз подтверждается при выявлении дефицита цереброзидсульфатазы (арилсульфатазы), увеличении содержания белка и наличии клеточно-белковой диссоциации в цереброспинальной жидкости, повышении уровня сульфатидов в крови и моче. Увеличивается время проведения импульса при электромиографии. На компьютерной томограмме головного мозга определяются симметричное диффузное снижение плотности белого вещества, умеренное расширение желудочков.
Дифференцировать метахроматическую лейкодистрофию необходимо с другими формами лейкодистрофии и дегенеративными изменениями проводящих путей нервной системы ненаследственной природы с помощью биохимического исследования.
Лечение Метахроматической лейкодистрофии:
Специфическое лечение, предотвращающее летальный исход, отсутствует. Показаны парентеральное питание, мероприятия по предотвращению контрактур суставов. Предпринимаются попытки снизить синтез сульфатидов путем назначения диеты с низким содержанием витамина А и серы. Заместительная терапия не эффективна.
К каким докторам следует обращаться если у Вас Метахроматическая лейкодистрофия:
Лейкодистрофия метахроматическая у ребенка что это такое
Метахроматическая лейкодистрофия (MLD) впервые была описана Scholz и Greenfield. Scholz выявил генетическое происхождение заболевания и выделил его из группы болезней, описываемых как диффузный склероз. Типичные признаки в виде метахромазии при окрашивании крезил-фиолетом или толуидиновым синим в кислом растворе отделяют заболевание от так называемых ортохроматических или суданофильных лейкодистрофий. Окрашивание специфично выявляет сульфатиды, присутствующие не только в тканях головного мозга, но и в нервах и множестве соматических тканей, таких как почки, печень и яичники, а также в моче. Кроме метахромазии в периферических нервах также отмечается сегментарная демиелинизация.
Выявление метахроматического материала в эпителиальных клетках в моче до сих пор является полезным диагностическим тестом.
Метахроматическая лейкодистрофия (MLD) является аутосомно-рецессивным заболеванием, по оценкам с частотой 1 на 40000. Причиной заболевания является дефицит арилсульфатазы A (ARSA). Дефицит ARSA приводит к накоплению цереброзид сульфата (сульфатида). Генетический дефект локализован на 22 хромосоме (Polten et al., 1991). Накопление сульфатидов приводит к повреждению центрального и периферического миелина. Концентрация сульфатидов в пораженных тканях повышается, а концентрация цереброзида снижается.
Кроме аллелей ARSA (частота 0,5%), являющихся причиной MLD, существуют другие ARSA-аллели (частота 7-15%), называемые псевдодефицитным ARSA-геном (ARSA-PD) (Gieselmann et al., 1991). У 10-20% гомозигот по данному аллелю отмечается сниженная активность ARSA, но клинические симптомы и сульфатидурия не развиваются. Гомозиготность по ARSA-PD часто встречается в общей популяции; пациентам, у которых причиной неврологических симптомов является не ARSA-PD, может быть ошибочно установлен диагноз MLD. Псевдодефицитный аллель может быть выявлен непосредственно при исследовании ДНК. Кроме того, в редких случаях MLD может быть вызван мутациями, затрагивающими активатор белка (сапонин В), кодируемый геном на участке 10q21—22. Активатор белка активирует не только гидролиз сульфатидов под действием ARSA, но и гидролиз GM1-ганглиозидов.
Дефицит сапонина В может приводить к ювенильной или (в редких случаях) поздней младенческой форме MLD, но гистологически также отмечается накопление ганглиозидов. Диагностика проводился в культуре фибробластов: патологический метаболизм может быть восстановлен активатором белка (Gieselmann, 2003).
Время появления симптомов при ювенильной форме варьирует, заболевание может начинаться в возрасте 4-6 лет. Наблюдается нарушение походки в сочетании с трудностями обучения и поведенческими проблемами. Двигательные симптомы включают мозжечковые и пирамидные нарушения, а также признаки периферической нейропатии. Припадки и деменция являются поздними проявлениями. В случае начала заболевания во взрослом возрасте в клинической картине преобладают нарушения походки, экстрапирамидные симптомы и психиатрические отклонения.
Метахроматическую лейкодистрофию (MLD) следует подозревать у всех детей с прогрессирующими спастическо-атаксическими симптомами и парадоксальным отсутствием ахиллова рефлекса при наличии рефлекса Бабинского. При осмотре глазного дна может выявляться атрофия зрительного нерва. Показатели ЭЭГ обычно не отличаются от нормы или позволяют выявить некоторую медленную активность и эпилептиформные разряды на поздних стадиях заболевания. Электроретинограмма сохраняется неизмененной. Скорость проводимости чувствительных и двигательных нервов снижена. Практически всегда выявляется повышенное содержание белка в спинномозговой жидкости.
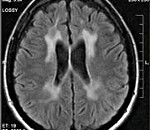
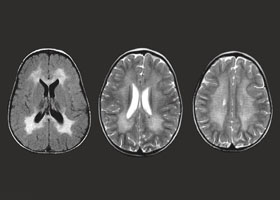
При всех трех типах заболевания на КТ и МРТ отмечаются изменения перивентрикулярного белого вещества с преобладанием поражения в лобной области. При ювенильной и взрослой формах заболевания U-волокна сохраняются, отмечается раннее поражение мозолистого тела, в пирамидном тракте могут выявляться признаки демиелинизации. Диагноз подтверждается на основании определения уровня ARSA и метахроматического материала в моче.
В настоящее время эффективные методы лечения отсутствуют. Предпринимались попытки трансплантации костного мозга или стволовых клеток гемопоэза, но полученные результаты имели противоречивый характер. В последнее время поднят вопрос о поддерживающей терапии арилсульфатазой-А (Matzner и Gieselmann, 2005).
Редактор: Искандер Милевски. Дата публикации: 16.12.2018
Метахроматическая лейкодистрофия
Метахроматическая лейкодистрофия — аутосомно-рецессивно наследуемая демиелинизирующая патология ЦНС, отличительной особенностью которой является метахроматическое окрашивание зон демиелинизации. В клинике преобладает задержка развития, парезы, судорожные приступы, экстрапирамидные и мозжечковые расстройства, нарушение зрения. В ходе диагностики проводится исследование цереброспинальной жидкости, уровня сульфатидов, активности арилсульфатазы А, КТ/МРТ головного мозга, генетические обследования. Возможна пренатальная диагностика. Лечение симптоматическое, в отдельных случаях проводится трансплантация пуповинной крови или стволовых клеток.
Общие сведения
Метахроматическая лейкодистрофия — один из основных видов лейкодистрофии, характеризующийся, как и другие ее типы, задержкой психомоторного развития, расстройством психики, спастическими парезами, мозжечковым синдромом, экстрапирамидными нарушениями, судорожным синдромом и атрофией зрительных нервов. Встречается в популяции с частотой 1 случай на 40 тыс. Наследуется аутосомно-рецессивно. Впервые выделена как нозологическая форма в 1910 г. Альцгеймером, подробно описана в 1925 г. Шольцем. Время манифестации заболевания существенно варьирует и обуславливает его клиническое течение. В соответствии с этими особенностями выделяют несколько вариантов патологии: врожденную (раннедетскую) форму, позднедетскую форму Гринфилда, ювенильную форму Шольца и взрослую форму. Наиболее часто наблюдается познедетская форма. В виду отсутствия эффективных способов лечения метахроматическая лейкодистрофия является проблемной патологией для современной педиатрии, неврологии и генетики.
Причины
Основным субстратом заболевания выступает дефект расположенного на 22-й хромосоме гена, ответственного за синтез арилсульфатазы А. Результатом дефицита указанного энзима является блокировка метаболизма сульфатида в галактоцереброзид. Сульфатиды откладываются в белом веществе головного и спинного мозга, коже, соматических органах (печени, легких, сердце, почках) и в костях. Однако при этом функция внутренних органов не страдает (исключением является желчный пузырь), а в мозговом веществе происходят прогрессирующие дегенеративные изменения, ведущие к гибели заболевшего.
Отложение сульфатидов в нервной ткани приводит к разрушению миелина и накоплению продуктов его распада. В процесс демиелинизации вовлекаются не только структуры ЦНС, но и периферические нервные стволы. В головном мозге формируются диффузные очаги демиелинизации, дающие при их гистохимическом исследовании метахроматическое окрашивание.
Симптомы метахроматической лейкодистрофии
Врожденная метахроматическая лейкодистрофия дебютирует до 3-месячного возраста задержкой развития и эписиндромом. Быстро присоединяется спастический парез, расстройства глотания. Дети погибают на 1-ом году жизни.
Позднедетская метахроматическая лейкодистрофия (поздняя инфантильная форма) обычно манифестирует на 2-ом году жизни ухудшением моторики и задержкой психического развития. Отмечается неустойчивая походка, понижение мышечного тонуса. В течении позднедетской формы различают 4 периода. Первый характеризуется мышечной гипотонией и слабостью, угасанием сухожильных рефлексов, затруднением ходьбы. Длится от 1-3 мес. до 1 года, иногда и дольше. Второй период знаменуется выраженным отставанием в интеллектуальной сфере, сменой гипотонии на гипертонию мышц. Ребенок утрачивает способность стоять. Наблюдается дизартрия, атрофия зрительных нервов. Период занимает несколько месяцев. В третьем периоде отмечается тетраплегия, тяжелая олигофрения, бульбарный и псевдобульбарный паралич. Четвертый период сопровождается утратой реакций на окружающие события. Ребенок не говорит, не может принимать пищу, развивается полная слепота. При хорошем уходе и кормлении через гастростому или желудочный зонд данный период может продолжаться 1-2 года.
Ювенильная метахроматическая лейкодистрофия начинается после 3-летнего возраста в периоде до 10 лет (чаще в возрасте около 6 лет). Дебютирует эмоциональной лабильностью, изменениями в поведении, снижением когнитивных функций (у школьников происходит резкое ухудшение успеваемости), атаксией, затруднениями при ходьбе. Зачастую отмечаются эпиприступы. Заболевание неуклонно прогрессирует и, в зависимости от начала симптоматики, к 10-15 годам жизни приводит к летальному исходу.
Взрослая метахроматическая лейкодистрофия манифестирует после пубертата, может возникать до 60-летнего возраста. Как правило, имеет начало с психических расстройств шизофреноподобного или психопатического характера, отчего заболевшие первоначально становятся пациентами психиатра. В отдельных случаях дебют происходит с симптомов полиневропатии. Развитие патологических изменений происходит медленнее, чем при других возрастных вариантах заболевания. В позднем периоде развиваются тетрапарез, бульбарные нарушения, деменция. Летальный исход наблюдается спустя 10-20 лет от начала симптоматики.
Диагностика метахроматической лейкодистрофии
Диагностические мероприятия имеют комплексный характер и позволяют отдифференцировать метахроматическую лейкодистрофию от других нейродегенеративных заболеваний и других форм лейкодистрофии. Проводится люмбальная пункция, при исследовании цереброспинальной жидкости определяется повышенная концентрация белка, дефицит арилсульфатазы, белково-клеточная диссоциация. Электромиография выявляет увеличение длительности проведения нервных импульсов. КТ головного мозга визуализирует расширенные желудочки и определяет пониженную плотность белого церебрального вещества. МРТ головного мозга выявляет очаги демиелинизации.
Важное диагностическое значение имеют биохимические исследования: определение сульфатидов в крови и моче, оценка активности арилсульфатазы А в лейкоцитах взятой на анализ крови. Пациентам показана консультация генетика с проведением генеалогического исследования; возможна ДНК-диагностика. Разработан также метод пренатальной диагностики патологии — определение активности арилсульфатазы А в клетках полученной при амниоцентезе амниотической жидкости. Исследования показали, что у носителей патогенного гена также отмечается сниженный уровень арилсульфатазы А. В связи с этим вместо пренатальной диагностики плода предлагается обследовать родителей будущего ребенка, чтобы избежать медаборта плода, являющегося лишь носителем дефектного гена.
Лечение метахроматической лейкодистрофии
Терапия, способная предотвратить летальный исход заболевания, пока не найдена. Осуществляется лечение, направленное на купирование его отдельных симптомов: противосудорожная терапия, борьба с контрактурами суставов; на поздних стадиях — профилактика пролежней, парентеральное питание. Проводится поиск более эффективных способов лечения, особенно в области генной терапии.
Предпринимаются попытки лечения путем трансплантации костного мозга и пуповинной крови. У ряда пациентов пересадка стволовых клеток позволяет добиться временной стабилизации состояния и замедления прогрессирования патологических изменений. Донором стволовых клеток обычно выступает родственник больного, не имеющий лейкодистрофии и тщательно обследованный. Однако следует помнить, что сама трансплантация может повлечь за собой целый ряд осложнений: отторжение, интеркурентные инфекции, реакцию «трансплантат против хозяина». Кроме того, при быстром прогрессировании симптомов летальный исход опережает наступление эффекта трансплантации.
Прогноз
Пока не найдена эффективная терапия лейкодистрофий, она имеет крайне неблагоприятный прогноз. При врожденной форме дети не доживают до 1 года. При позднедетском варианте продолжительность болезни, как правило, не превышает 4 года, при ювенильном — 6 лет. Среди пациентов со взрослой формой известны отдельные случаи, когда продолжительность жизни составила около 50 лет. Пока единственным способом предупреждения лейкодистрофии является недопущение рождения ребенка, имеющего соответствующую генную мутацию. В этом плане основное значение имеет генетическое консультирование пар, планирующих деторождение, а также обследование будущих родителей из группы риска на степень активности арилсульфатазы А.
Лейкодистрофия
Общие сведения
Лейкодистрофия головного мозга — врожденное заболевание нервной системы. Википедия дает следующее определение данной патологии: «это группа тяжелых наследственных заболеваний, которые характеризуются поражением белого вещества головного мозга спинного». Это нейродегенеративные, достаточно редкие заболевания, для которых характерно нарушение обмена веществ, связанного с врожденным дефектом того или иного фермента, что сопровождается накоплением метаболитов, которые вызывают разрушение миелина белого вещества мозга и прогрессирующую его дегенерацию.
Группа лейкодистрофий включает более 60 форм, которые отличаются видом мутации и возрастом проявления болезни, что влияет на прогноз заболевания. В зависимости от возраста формы могут подразделяться на варианты: инфантильный, ювенильный и взрослый. Все эти заболевания сопровождаются нарушением передачи нервных импульсов в ЦНС, в связи с чем у больных возникают сначала двигательные, а затем и интеллектуальные расстройства, задержка психомоторного развития. По мере разрушения миелина расстройства прогрессируют и за несколько лет у больных развивается тяжелая физическая и психическая деградация. Некоторые формы имеют отличительные симптомы, связанными с поражением и других органов кроме ЦНС. Многие формы настолько редко встречаются, что даже в мировой медицинской литературе описано несколько сотен случаев и наблюдений за больными.
Патогенез
Генетически обусловленный дефект приводит к нарушению обмена (чаще нарушается метаболизм липидов). Это влечет отложение того или иного вещества (метаболита) в тканях. Прежде всего поражается головной мозг и спинной, почки и печень. Токсические метаболиты вызывают разрушение миелина, гибель или атрофию нейронов (клетки нервной ткани), при этом погибшие нейроны замещаются глиальной тканью (соединительная ткань), которая разрастается. Любая лейкодистрофия характеризуется основными патогенетическими процессами: диффузная гибель миелина в полушариях, скопление продуктов, которые образуются после его распада и усиленное разрастание глии. При отдельных формах отмечается специфическая картина — метахроматическое (суданофильное) окрашивание распавшихся продуктов миелина или скопление в зонах распада характерных глобоидных клеток. При болезни Александера в результате мутации в нервной ткани накапливается генетически измененный (мутантный) белок GFAP.
Классификация
Наследственные лейкодистрофии по характеру являются гипомиелинизирующими — миелин изначально не образуется или образуется в недостаточном количестве. Большинство из этих заболеваний наследуется по аутосомно-рецессивному признаку — это значит, что вероятность заболевания у ребенка составляет 25%, если оба родителя-носители гена. В таких случаях с одинаковой частотой в семьях заболевают мальчики и девочки, рожденные от близкородственных браков.
Есть форма, которая характеризуется наследованием, сцепленным с Х хромосомой (адренолейкодистрофия) — она передается Х-хромосомой матери-носительницы болезни. Чаще всего встречаются метахроматическая лейкодистрофия, Пелицеуса-Мерцбахера (или суданофильная), адренолейкодистрофия, болезнь Краббе, Александера и Канавана. Кратко остановимся на этих формах.
Метахроматическая лейкодистрофия — одна из частых и изученных форм. Девочки и мальчики поражаются одинаково часто. При данной патологии отмечается дефицит лизосомного фермента арилсульфатазы. Этот дефект приводит к тому, что в белом веществе головного мозга, периферических нервов и органах (печень, легкие, почки, сердце) накапливаются специфические метаболиты сульфатиды, которые при гистохимическом исследовании дают специфическое метахроматическое окрашивание. Функция внутренних органов не страдает, а в мозговом веществе прогрессируют дегенеративные изменения. Метахроматическая лейкодистрофия по клинике делится на типы: врожденный, поздний инфантильный, ювенильный (ранний и поздний) и взрослый. Все типы протекают с ухудшением двигательной и психической функции, но эти нарушения возникают в разный возрастной период и степень прогрессирования тоже разная.
Врожденная метахроматическая форма развивается до 3-х месяцев и проявляется эпилептическим синдромом и задержкой развития. К ним присоединяется парез и прогрессирующие расстройства глотания. Малыши умирают на первом году жизни.
Поздняя детская форма — самая частая. Заболевание проявляется в 6 месяцев — 4 года. Дети, которые нормально развивались до 8-9 месяцев к году жизни теряют приобретенные навыки — у них нарушается походка, они перестают сидеть и ходить, появляется разболтанность суставов, снижаются сухожильные рефлексы и прогрессирует мышечная слабость, нарушается функция глотания и ухудшается зрение (атрофия зрительных нервов). Постепенно развивается нарушение функции ног, а затем и рук (спастический тетрапарез), нарушения глотания. При хорошем питании через желудочный период продолжается 1-2 года. Но потом двигательная и когнитивная функция быстро прогрессируют, и такие дети умирают в течение 5 лет с начала заболевания.
Ведущий симптом при ювенильной форме (6-10 лет) — нарушение координации движений (мозжечковая атаксия). Больные неустойчивы, ходят неуверенно с широко расставленными ногами, отмечается шаткость при походке. С поздней ювенильной формой больные доживают до взрослого возраста. Взрослая форма проявляется нарушением поведения, из-за чего пациентов часто принимают за психиатрических больных, и снижением когнитивной функции. Постепенно развиваются нарушения движений. Дети редко доживают до десяти лет.
Взрослая форма начинается после пубертата в период до 50-60-лет. Начинается с психических расстройств (психопатия, шизофреноподобный синдром). Также развиваются полинейропатии. Если сравнивать с другими возрастными вариантами, то изменения прогрессируют медленно и заканчивается заболевание тетрапарезом и возрастной деменцией.
Лейкодистрофия Пелицеуса-Мерцбахера связана с генетическим дефектом синтеза апопротеина — белка, который важен для функции клеток олигодендроцитов, участвующих в миелинизации аксонов. Передается по аутосомно-рецессивному признаку: если оба родителя носители мутантного гена в 25% рождается больной ребенок. Второй тип наследования — сцепленная с полом передача (только мальчикам в семье или девочкам).
Проявляется болезнь рано — с 5 до 10 месяцев и имеет медленное развитие. В течение болезни появляется «светлый» промежуток, очень долго длящийся. В связи с этим больные доживают до зрелого возраста и летальный исход возможен только в возрасте 20-30 лет. Болезнь Пелицеуса-Мерцбахера в младенчестве проявляется кивательными движениями головы, блуждающими движениями глаз нистагмом, задержкой развития. Когда малыш начинает ходить, у него появляется атаксия и спастичность конечностей, хореоатетоз (сочетание быстрых и порывистых движений с медленными судорожными). Постепенно развивается нарушение речи и атрофия зрительных нервов. Умственное развитие детей не страдает.
Адренолейкодистрофия связана с мутациями гена АВСD1 и изменением белка ALDP. При генетической диагностике обнаруживают мутации гена ABCD1 (это могут точечные мутации, делеции нуклеотидов и крупные делеции). При этом нарушается транспорт нормальных жирных кислот в миелиновую оболочку и образуются аномальные сверхдлинноцепочечные жирные кислоты в большом количестве, оказывающие токсическое действие на миелин. В результате токсического действия концентрация миелина резко снижается. Помимо поражения ЦНС и периферической нервной системы отмечается поражение надпочечников в виде их недостаточности. В зависимости от преобладания симптомов в клинике выделяют церебральную форму, периферическую и форму только с надпочечниковой недостаточностью.
Церебральная Х-сцепленная адренолейкодистрофия может проявляться в детском возрасте (пик 7-8 лет, детская форма), юношеском (манифестирует в 10-21 лет, юношеская форма) и во взрослом возрасте (30-50 лет, встречается редко). Детская и юношеская формы характеризуются быстрым прогрессированием двигательных нарушений, интеллектуальных и поведения. В детском возрасте наиболее часто встречаются гиперактивное поведение или противоположность ему — аутистическое поведение. У детей возникает агрессивность, снижается память и внимание, возникают проблемы с обучением, нарушается походка и прогрессирует слабоумие.
Значительно реже бывают нарушения зрения и слуха, а также надпочечниковая недостаточность (низкое давление, гиперпигментация кожи, слабость, рвота и тошнота, возникающие периодически). В юношестве прогрессирует умственная отсталость, прогрессивно ухудшается память, развивается спастический тетрапарез (нарушается двигательная функция рук и ног), снижается зрение и слух, появляются судороги. У взрослых заболевание проявляется деменцией и шизофренией. Также у больных нарушается функция глотания и зрения (выпадают поля зрения). Чаще всего прогноз неблагоприятный: несколько лет от начала первых симптомов заболевание прогрессирует и приводит к смерти.
Лейкодистрофия Краббе связана с дефицитом определенного лизосомного фермента, что обусловлено мутациями в гене GALC. При недостатке этого фермента в нервной ткани накапливается галактозилсфингозин — высокотоксичное вещество, вызывающее демиелиенизацию и гибель клеток с образованием в очагах больших глобоидных образований. Болезнь Краббе бывает нескольких подтипов: инфантильный, поздний инфантильный, взрослый и ювенильный. Самая частая из всех форм — инфантильная, она считается классической и составляет до 90% всех случаев.
Первые проявления заболевания наблюдаются в 3-6 месяцев. Сначала у малышей появляется гипервозбудимость, повышенный мышечный тонус, рвота, гастроэзофагеальный рефлюкс, плохая прибавка веса и задержка развития (до этого периода ребенок развивался нормально). На втором этапе заболевания отмечается регресс психомоторного развития (теряются все навыки), появляются судороги и опистотонус, наступает атрофия зрительных нервов (слепота) и прогрессирует гипотрофия (нарушение питания). На третьей стадии заболевания ребенок полностью теряет произвольные движения, и у него возникает децеребрационная поза, которая свидетельствует о тяжелом поражении головного мозга.
Лейкодистрофия Канавана обусловлена мутацией гена ASPA, ответственным за синтез фермента аспартоацилазы. Этот фермент расщепляет токсичный N-ацетиласпартат. Накопление токсичного вещества вызывает дегенерацию серого и белого вещества мозга. Тип наследования аутосомно-рецессивный с передачей гена от обоих родителей.
Болезнь Кэнэвэн-ван-Богарта-Бертрана развивается постепенно и сначала ребенок развивается нормально. Через несколько месяцев навыки начинают угнетаться, снижается мышечная активность, увеличивается спастичность мышц, взгляд становится нефиксированным, затрудняется вскармливание из-за нарушений глотания, а также постепенно увеличивается объем головы. Болезнь прогрессирует стремительно, но произвольные движения пока сохраняются. Потом ребенку становится трудно фиксировать голову, развиваются спастические парезы рук и ног. По мере прогрессирования глотательный рефлекс утрачивается и ребенка кормят через пищеводный зонд. Развиваются судорожные припадки, реакции на раздражители отсутствуют и утрачивается зрение — эти симптомы являются пиком заболевания. Развитие симптомов может быть быстрым (в течение нескольких месяцев) и длительным (до 10 лет). Бактериальные или вирусные инфекции — частые осложнения этого заболевания.
Причины
Как было указано выше, причиной этой группы заболеваний являются генные мутации и наследование патологии от родителей. Вид мутаций установлен для наиболее распространенных форм. Мутации выявляются в генах, кодирующих различные лизосомальные ферменты:
Симптомы
В зависимости от формы лейкодистрофия у ребенка проявляется или в грудном возрасте (первые месяцы) или раннем детстве. До этого времени ребенок развивается нормально и не отстает от сверстников. Постепенно развивающиеся изменения в ткани мозга (головного или спинного) проявляются неврологическими расстройствами.
Первыми появляются двигательные нарушения: ухудшается координация, ребенку трудно удерживать тело в равновесии, он перестает сидеть и ходить. Развивается мышечная слабость, изменяется тонус мышц (чаще всего он повышается, но может снижаться), появляются мышечные подергивания, а потом судорожные приступы. К двигательным расстройствам присоединяются психические нарушения (меняется поведение), ухудшается интеллект и память. Вышеперечисленные симптомы неуклонно прогрессируют. Постепенно ухудшаются слух и зрение. На поздних стадиях развиваются параличи, выраженная олигофрения, слепота, глухота, ребенок теряет возможность глотать. В терминальной стадии наблюдается децеребрационная ригидность. Больной лежит в позе разгибания. При этом шея и позвоночник напряжены, а голова запрокинута, ноги разогнуты и повернуты внутрь, могут быть скрещены. Стопы и руки разогнуты, а пальцы сжаты в кулак. Скорость прогрессирования симптомов заболевания больше, чем раньше проявились первые симптомы. Периферическая нейропатия у ребенка — важная черта метахроматической лейкодистрофии и болезни Краббе, при которых нарушается метаболизм липидов миелина.