Лейкоз что это симптомы у подростков
Лейкоз у детей и подростков
Что такое лейкоз?
Лейкоз — это рак крови и костного мозга. Он является наиболее распространенным онкологическим заболеванием у детей и подростков. В США ежегодно диагностируется около 3500–4000 случаев лейкоза у детей.
Острый лимфобластный лейкоз (ОЛЛ)
Острый миелоидный лейкоз (ОМЛ)
Хронический миелоидный лейкоз (ХМЛ)
Ювенильный миеломоноцитарный лейкоз (ЮММЛ)
Острый лимфобластный лейкоз (ОЛЛ) у младенцев
Рецидив острого лимфобластного лейкоза (ОЛЛ)
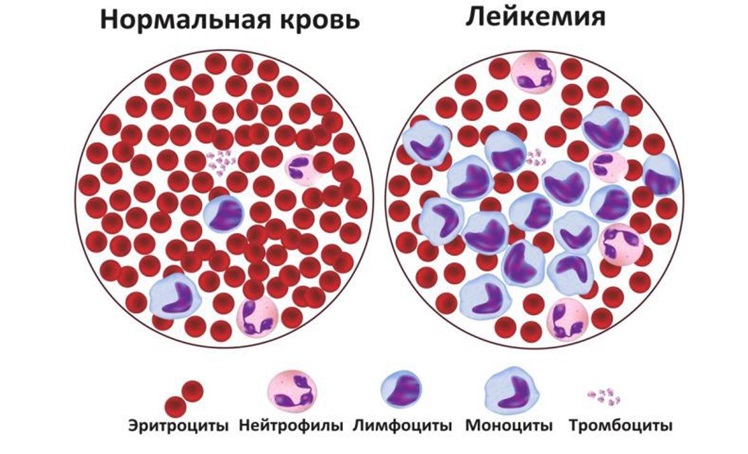
У пациентов с лейкозом не происходит правильного созревания кроветворных клеток. Кровь вырабатывает слишком много незрелых клеток крови или лейкозных клеток.
Когда это происходит, функция крови нарушается. В ней становится недостаточно:
Острые лейкозы чаще всего возникают у детей.
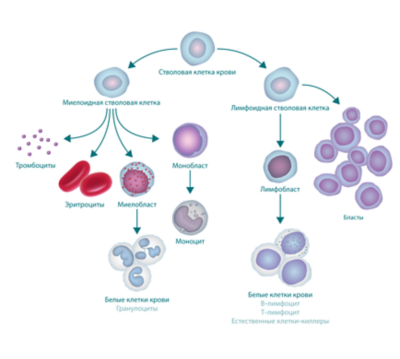
Процесс кроветворения, приводящий к образованию бластов.
Признаки и симптомы лейкоза
К признакам и симптомам относятся:
Диагностика лейкоза
Лечение лейкоза
Другие возможные методы лечения:
Прогноз (исход) при лечении лейкоза
Острые лейкозы
Общая 5-летняя выживаемость при остром лимфобластном лейкозе (ОЛЛ) у детей составляет примерно 90%.
Общая 5-летняя выживаемость детей с острым миелоидным лейкозом (ОМЛ) составляет 65–75%. Тем не менее, коэффициенты выживаемости варьируются в зависимости от подвида ОМЛ и других факторов. Например, показатель эффективности лечения для острого промиелоцитарного лейкоза (ОПМЛ), одного из подвидов ОМЛ, в настоящее время выше 90%, но показатели для некоторых других подвидов ОМЛ ниже.
Хронические лейкозы
Для хронических лейкозов показатель 5-летней выживаемости менее полезен, поскольку дети могут долгое время жить с лейкозом без фактического излечения. В прошлом показатели 5-летней выживаемости при хроническом миелоидном лейкозе (ХМЛ) составляли 60–80%, но в настоящее время они намного выше.
—
Дата изменения: июнь 2018 г.
Химиотерапия
Химиотерапия — это лечение рака с помощью мощных лекарственных препаратов. Они уничтожают злокачественные клетки или останавливают их рост.
Подробнее о химиотерапии
Острый лимфобластный лейкоз (ОЛЛ)
Острый лимфобластный лейкоз (ОЛЛ) является наиболее распространенным онкологическим заболеванием у детей, злокачественным заболеванием крови и костного мозга.
Лейкозы у детей: симптомы, диагностика, лечение
Лейкозы относятся к большой группе злокачественных новообразований системы крови под названием «гемобластозы». Лейкоз (от греческого слова «leukos» — белый) — злокачественная опухоль, возникающая из ранних незрелых кроветворных клеток костного мозга и метастазирующая из костного мозга в кровь, лимфатические узлы, печень, селезенку, головной мозг, спинной мозг и другие органы и ткани.
Все лейкозы можно разделить на острые лимфобластые, острые миелоидные лейкозы (ОМЛ) и хронический миелолейкоз.
Острый лимфобластный лейкоз
Более 80% всех лейкозов у детей составляет острый лимфобластный лейкоз (ОЛЛ). Причиной его развития является химерный ген TEL/AML, формирование которого происходит внутриутробно, возможно, в результате спонтанных ошибок в процессе репликации и репарации ДНК. Накопление генетических аномалий в опухолевом клоне ведет к блоку нормальной клеточной дифференцировки и нарушениям в процессе пролиферации и апоптоза.
В соответствии с франко-американо-британской (FAB) классификацией выделяют три морфологических варианта: L1, L2, L3.
Клинические симптомы ОЛЛ обусловлены степенью инфильтрации костного мозга лимфобластами, а также наличием экстрамедуллярного распространения процесса. Нередко отмечаются общие симптомы опухолевой интоксикации, а именно, повышение температуры тела, снижение аппетита, слабость, вялость. В течение процесса выделяют несколько периодов: начальный, развернутый, период ремиссии.
Развернутый период характеризуется бурным началом, многообразием клинических симптомов. К симптомам общей интоксикации присоединяются костные боли вследствие лейкозной инфильтрацией костной ткани (чаще поражаются диафизы длинных трубчатых костей), артралгии, вызванные лейкемической инфильтрацией суставов. Кожные покровы и слизистые становятся бледными. К сожалению, нередко на них появляются кровоизлияния, обусловленные геморрагическим синдромом, а также кровотечения (носовые, желудочно-кишечные, почечные). Увеличение периферических лимфатических узлов (шейно-надключичных, подмышечных, паховых) является одним из основных симптомов заболевания. Практически у всех пациентов отмечается обусловленное пролиферацией лейкозных клеток увеличение печени и селезенки. В некоторых случаях у пациентов поражение кожи и слизистых оболочек проявляется в виде лейкемидов, некроза, гингивита и стоматита.
Таким образом, можно выделить несколько симптомокомплексов, характерных для ОЛЛ:
При диагностике оцениваются морфологические особенности бластов костного мозга и периферической крови. Помимо обнаружения опухолевых клеток лимфоидной линии кроветворения при окраске по Романовскому – Гимзе, проводятся следующие методы исследования:
Для подтверждения диагноза ОЛЛ необходимо комплексное обследование, в котором ведущая роль отводится морфологическому методу.
В настоящее время используются программы лечения BFM (БФМ: Берлин-Франкфурт-Мюнстер) и МВ (МБ: Москва-Берлин).
Все лечение можно разделить на базисное и сопроводительное. Базисная терапия представляет собой системную и локальную химиотерапию и, при необходимости, лучевую терапию. Сопроводительное лечение обязательно назначается для профилактики инфекционных осложнений и коррекции постцитостатических реакций. Выделяют следующие этапы в лечении злокачественных процессов: индукция ремиссии, консолидация ремиссии (как правило, несколько фаз), поддерживающее лечение.
Острый миелоидный лейкоз
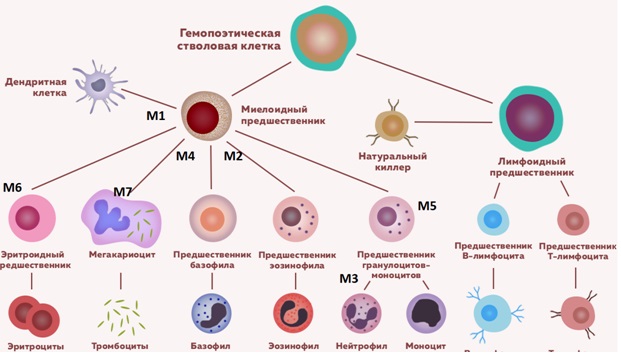
Острый миелоидный лейкоз составляет 15% всех острых лейкозов у детей. Существующая FAB-классификация (Франко-Американо-Британская) позволяет разделить ОМЛ на следующие варианты:
Схема гемопоэза с клетками предшественниками острого миелоидного лейкоза
Клиническая картина ОМЛ также складывается из анемического, геморрагического и токсического синдромов, которые являются следствием снижения продукции эритроцитов, тромбоцитов и гранулоцитов.
У 50% пациентов отмечается увеличение размеров печени (гепатомегалия) и селезенки (спленомегалия) вследствие инфильтрации органов опухолевыми клетками.
Внекостномозговые проявления заболевания связаны с лейкозной инфильтрацией центральной нервной системы и метастатическим поражением оболочек и вещества головного и спинного мозга (нейролейкемия). В этих ситуациях отмечается постоянная головная боль, возможна рвота, вялость, выявляется отек дисков зрительных нервов, могут быть нистагм, косоглазие, другие признаки поражения черепно-мозговых нервов, выявляются ригидность затылочных мышц, симптом Кернига.
Решающую роль в диагностике также имеет цитохимическое, иммунофенотипическое и морфологическое исследование бластов в костном мозге и периферической крови.
Ремиссию заболевания можно достичь посредством проведения высокодозной полихимиотерапии с последующей трансплантацией гемопоэтических стволовых клеток от HLA-геноидентичного родственного или альтернативного (неродственного, гаплоидентичного) донора у пациентов группы высокого риска рецидива. Благодаря адаптивным протоколам удается достичь ремиссии у 90% детей.
Хронические миелолейкоз
Хронический лейкоз – это вариант гемобластоза, субстратом которого являются созревающие клетки. У детей встречается только хронический миелолейкоз, который характеризуется пролиферацией гранулоцитарного ростка, гиперплазией миелоидной ткани, миелоидной метаплазией кроветворных органов, ассоциированной с хромосомной транслокацией t(9;22)(q34;q11), в результате которой образуется химерный онкоген BCR-ABL.
В течение хронического миелолейкоза выделяют три фазы:
В дебюте заболевание трудно диагностировать, поскольку основные симптомы обусловлены общим опухолевым симптомокомплексом и носят преходящий характер. Наиболее частые симптомы, присоединяющиеся позднее – гепатомегалия и спленомегалия. Нарастающая интоксикация приводит к появлению слабости, утомляемости, повышению температуры тела, болям в костях.
В периферической крови отмечается гиперлейкоцитоз (до 200 – 300 х 10 9 /л и более) с увеличением содержания гранулоцитов до 95% и преобладанием незрелых клеток гранулоцитарного ряда: промиелоцитов, миелоцитов, метамиелоцитов, миелобластов, базофилов (до 10%) и эозинофилов (до 5%). Характерна анемия и повышение СОЭ. Уровень тромбоцитов преимущественно в норме, однако может отмечаться гипертромбоцитоз (до 600 х 10 9 /л и более).
В пунктате костного мозга отмечается увеличение числа миелокариоцитов за счет пролиферирующего пула клеток гранулоцитарного ряда с увеличением базофилов и эозинофилов. Позднее отмечается угнетение эритронормобластического и мегакариоцитарного ростков кроветворения.
Основным средством терапии и стандартом лечения хронического миелолейкоза в настоящее время является применение ингибиторов тирозинкиназы (ИТК). Данные препараты имеют механизм таргетного (целенаправленного) воздействия на BCR-ABL-положительные опухолевые клетки и должны назначаться всем пациентам после подтверждения диагноза. Для оценки эффективности и переносимости терапии ИТК рекомендуется регулярный мониторинг гематологических, цитогенетических и молекулярно-генетических и других показателей у пациента.
Список литературы
Авторская публикация:
Кулева С.А.
Заведующая отделением, врач-детский онколог, ведущий научный сотрудник, профессор НМИЦ онкологии им. Н.Н. Петрова
Иванова Светлана Вячеславовна
Врач-детский онколог, научный сотрудник, кандидат наук НМИЦ онкологии им Н.Н. Петрова
Лейкоз у детей
Лейкоз у детей – злокачественное заболевание крови, характеризующееся опухолевой пролиферацией незрелых клеток-предшественников лейкоцитов. Клинические проявления лейкоза у детей могут включать увеличение лимфатических узлов, геморрагический синдром, боли в костях и суставах, гепатоспленомегалию, поражение ЦНС и др. Диагностике лейкоза у детей способствует развернутый общий анализ крови, проведение стернальной пункции с исследованием пунктата костного мозга. Лечение лейкоза у детей проводится в специализированных гематологических стационарах с помощью химиотерапии, иммунотерапии, заместительной терапии, трансплантации костного мозга.
Общие сведения
Лейкоз у детей (лейкемия) – системный гемобластоз, сопровождающийся нарушением костномозгового кроветворения и замещением нормальных клеток крови незрелыми бластными клетками лейкоцитарного ряда. В детской онкогематологии частота лейкозов составляет 4-5 случаев на 100 тыс. детей. Согласно статистике, острый лейкоз является самым частым онкологическим заболеванием детского возраста (примерно 30%); наиболее часто рак крови поражает детей в возрасте 2-5 лет. Актуальной проблемой педиатрии служит наблюдаемая в последние годы тенденция к росту заболеваемости лейкозами среди детей и сохраняющаяся высокая летальность.
Причины лейкоза у детей
Некоторые аспекты развития лейкоза у детей до настоящего времени остаются неясными. На современном этапе доказано этиологическое влияние радиационного излучения, онкогенных вирусных штаммов, химических факторов, наследственной предрасположенности, эндогенных нарушений (гормональных, иммунных) на частоту возникновения лейкоза у детей. Вторичный лейкоз может развиться у ребенка, перенесшего в анамнезе лучевую или химиотерапию по поводу другого онкологического заболевания.
На сегодняшней день механизмы развития лейкоза у детей принято рассматривать с точки зрения мутационной теории и клоновой концепции. Мутация ДНК кроветворной клетки сопровождается сбоем дифференцировки на стадии незрелой бластной клетки с последующей пролиферацией. Таким образом, лейкозные клетки – есть не что иное, как клоны мутировавшей клетки, неспособные к дифференцировке и созреванию и подавляющие нормальные ростки кроветворения. Попадая в кровь, бластные клетки разносятся по всему организму, способствуя лейкемической инфильтрации тканей и органов. Метастатическое проникновение бластных клеток через гематоэнцефалический барьер приводит к инфильтрации оболочек и вещества головного мозга и развитию нейролейкоза.
Отмечено, что у детей с болезнью Дауна лейкоз развивается в 15 раз чаще, чем у других детей. Повышенный риск развития лейкоза и других опухолей имеется у детей с синдромами Ли-Фраумени, Клайнфельтера, Вискотт-Олдрича, Блума, анемией Фанкони, первичными иммунодефицитами (Х-сцепленной агаммаглобулинемией, атаксией-телеангиэктазией Луи-Барр и др.), полицитемией и др.
Классификация лейкоза у детей
На основании продолжительности заболевания выделяют острую (до 2-х лет) и хроническую (более 2-х лет) формы лейкоза у детей. У детей в абсолютном большинстве случаев (97%) встречаются острые лейкозы. Особую форму острого лейкоза у детей представляет врожденный лейкоз.
В ряду нелимфобластных лейкозов, в зависимости от преобладания тех или иных бластных клеток, различают миелобластный малодифференцированный (M1), миелобластный высокодифференцированный (М2), промиелоцитарный (М3), миеломонобластный (М4), монобластный (М5), эритромиелоз (М6), мегакариоцитарный (М7), эозинофильный (М8), недифференцированный (М0) лейкоз у детей.
В клиническом течении лейкоза у детей выделяют 3 стадии, с учетом которых выстраивается лечебная тактика.
Симптомы лейкоза у детей
В большинстве случаев клиника лейкоза развивается исподволь и характеризуется неспецифическими симптомами: утомляемостью ребенка, нарушением сна, снижением аппетита, оссалгиями и артралгиями, немотивированным повышением температуры тела. Иногда лейкоз у детей манифестирует внезапно с интоксикационного или геморрагического синдрома.
У детей, страдающих лейкозом, отмечается выраженная бледность кожных покровов и слизистых оболочек; иногда кожа приобретает желтушный или землистый оттенок. Вследствие лейкемической инфильтрации слизистых оболочек у детей нередко возникают гингивит, стоматит, тонзиллит. Лейкемическая гиперплазия лимфатических узлов проявляется лимфаденопатией; слюнных желез – сиаладенопатией; печени и селезенки – гепатоспленомегалией.
Для течения острого лейкоза у детей типичен геморрагический синдром, характеризующийся кровоизлияниями в кожу и слизистые, гематурией, носовыми, маточными, желудочно-кишечными, легочными кровотечениями, кровоизлияниями в полость суставов и др. Закономерным спутником острого лейкоза у детей является анемический синдром, обусловленный угнетением эритропоэза и кровотечениями. Выраженность анемии у детей зависит от степени пролиферации бластных клеток в костном мозге.
Кардиоваскулярные расстройства при лейкозах у детей могут выражаться развитием тахикардии, аритмии, расширением границ сердца (по данным рентгенографии органов грудной клетки), диффузными изменениями миокарда (по данным ЭКГ), снижением фракции выброса (по данным ЭхоКГ).
Интоксикационный синдром, сопровождающий течение лейкоза у детей, протекает со значительной слабостью, лихорадкой, потливостью, анорексией, тошнотой и рвотой, гипотрофией. Проявлениями иммунодефицитного синдрома при лейкозе у детей служит наслоение инфекционно-воспалительных процессов, которые могут принимать тяжелое, угрожающее течение. Гибель детей, страдающих лейкозом, нередко происходит вследствие тяжелой пневмонии или сепсиса.
Крайне опасным осложнением лейкоза у детей является лейкемическая инфильтрация головного мозга, мозговых оболочек и нервных стволов. Нейролейкоз сопровождается головокружением, головной болью, тошнотой, диплопией, ригидностью затылочных мышц. При инфильтрации вещества спинного мозга возможно развитие парапареза ног, нарушения чувствительности, тазовых расстройств.
Диагностика лейкоза у детей
Ведущая роль в первичном выявлении лейкозов у детей принадлежит педиатру; дальнейшее обследование и ведение ребенка осуществляется детским онкогематологом. Основу диагностики лейкозов у детей составляют лабораторные методы: исследование периферической крови и костного мозга.
Стернальная пункция и исследование миелограммы являются обязательными в диагностике лейкоза у детей. Решающим аргументом в пользу заболевания служит содержание бластных клеток от 30% и выше. При отсутствии четких данных за лейкоз у детей по результатам исследования костного мозга, прибегают к трепанобиопсии (пункции подвздошной кости). Для определения различных вариантов острого лейкоза у детей выполняются цитохимические, иммунологические и цитогенетические исследования. С целью подтверждения диагноза нейролейкоза проводится консультация детского невролога и детского офтальмолога, люмбальная пункция и исследование цереброспинальной жидкости, рентгенография черепа, офтальмоскопия.
Вспомогательное диагностическое значение имеют УЗИ лимфатических узлов, УЗИ слюнных желез, УЗИ печени и селезенки, УЗИ мошонки у мальчиков, рентгенография органов грудной клетки, КТ у детей (для выявления метастазов в различных анатомических регионах). Дифференциальную диагностику лейкозов у детей следует проводить с лейкозоподобной реакцией, наблюдаемой при тяжелых формах туберкулеза, коклюше, инфекционном мононуклеозе, цитомегаловирусной инфекции, сепсисе и имеющей обратимый транзиторный характер.
Лечение лейкоза у детей
Дети с лейкозами госпитализируются в специализированные учреждения онкогематологического профиля. В целях профилактики инфекционных осложнений ребенок помещается в отдельный бокс, условия в котором максимально приближенны к стерильным. Большое внимание уделяется питанию, которое должно быть полноценным и сбалансированным.
Основу лечения лейкозов у детей составляет полихимиотерапия, направленная на полную эрадикацию лейкозного клона. Протоколы лечения, используемые при острых лимфобластных и миелобластных лейкозах, различаются комбинацией химиопрепаратов, их дозами и способами введения. Поэтапное лечение острого лейкоза у детей предполагает достижение клинико-гематологической ремиссии, ее консолидацию (закрепление), поддерживающую терапию, профилактику или лечение осложнений.
В дополнение к химиотерапии может проводиться активная и пассивная иммунотерапия: введение лейкозных клеток, вакцины БЦЖ, противооспенной вакцины, интерферонов, иммунных лимфоцитов и др. Перспективными методами лечения лейкоза у детей служит трансплантация костного мозга, пуповинной крови, стволовых клеток.
Симптоматическая терапия при лейкозах у детей включает переливание эритроцитарной и тромбоцитарной массы, проведение гемостатической терапии, антибиотикотерапию инфекционных осложнений, дезинтоксикационные мероприятия (внутривенные инфузии, гемосорбцию, плазмосорбцию, плазмаферез).
Прогноз лейкоза у детей
Перспективы развития заболевания определяются многими факторами: возрастом возникновения лейкоза, цитоиммунологическим вариантом, стадией диагностирования и т. д. Худший прогноз следует ожидать у детей, заболевших острым лейкозом в возрасте до 2-х лет и старше 10-ти лет; имеющих лимфаденопатию и гепатоспленомегалию, а также нейролейкоз на момент установления диагноза; Т- и В-клеточные варианты лейкоза, бластный гиперлейкоцитоз. Прогностически благоприятными факторами служат острый лимфобластный лейкоз L1 типа, раннее начало лечения, быстрое достижение ремиссии, возраст детей от 2 до 10 лет. У девочек с острым лимфобластным лейкозом вероятность излечение несколько выше, чем у мальчиков.
Отсутствие специфического лечения лейкоза у детей сопровождается 100%-ной летальностью. На фоне современной химиотерапии пятилетнее безрецидивное течение лейкоза отмечается у 50-80% детей. О вероятном выздоровлении можно говорить после 6-7 лет отсутствия рецидива. Во избежание провокации рецидива детям не рекомендуется физиотерапевтическое лечение, изменение климатических условий. Вакцинопрофилактика проводится по индивидуальному календарю с учетом эпидемической ситуации.
Как распознать лейкоз по анализу крови?
Врач-гематолог, доктор медицинских наук Сергей Семочкин про острый лимфобластный лейкоз
Врач-гематолог, профессор кафедры онкологии, гематологии и лучевой терапии РНИМУ им. Н. И. Пирогова Минздрава России, доктор медицинских наук Сергей Семочкин рассказал: можно ли распознать острый лимфобластный лейкоз (ОЛЛ) на ранней стадии и поставить диагноз по анализу крови; объяснил, как лечат ОЛЛ и кому показана трансплантация костного мозга (ТКМ).
Каковы ранние симптомы острого лимфобластного лейкоза? Можно ли их увидеть и распознать ОЛЛ?
В данном случае все достаточно просто, потому что слово «острый» означает, что заболевание внезапное и зачастую симптомы очень выразительные. Самый частый симптом — это лихорадка, т.е. повышение температуры тела. Лихорадка может быть как субфебрильной, так и ярко выраженной, до 39 градусов. Появятся изменения, связанные с поражением костного мозга. Снижение гемоглобина приведет к слабости и быстрой утомляемости. Могут увеличиться лимфатические узлы, появиться дискомфорт в брюшной полости за счет того, что увеличиваются размеры печени и селезенки. Могут быть проявления кровоточивости — даже во время чистки зубов. У некоторых пациентов ОЛЛ может начаться с неврологических проявлений – головных болей, головокружения и прочих проблем. Симптоматика обширная, но в данном случае она является достаточно острой, внезапно возникшей.
Можно ли поставить диагноз по анализу крови? Что он покажет?
Как правило, в анализе крови есть ярко выраженные показатели: изменены ростки кроветворения, количество лейкоцитов выходит за пределы нормы — может упасть ниже нормальных значений, а может стать запредельно огромным. Мне встречались пациенты, у которых количество лейкоцитов при норме от 4 до 9 тысяч повышалось до 200 тысяч на мкл. Тромбоциты тоже в ряде случаев очень сильно снижены, но главное – изменение количества лейкоцитов. Очень важным маркером является выход опухолевых клеток в кровь, когда в крови появляются незрелые ранние клетки, которые называют бластными. Если в анализе крови выявили бластные клетки, то это, скорее всего, либо острый лейкоз, либо миелодиспластический синдром.
Как пациент попадает к гематологу?
Анализ крови с характерными изменениями — повод для немедленного вызова скорой помощи и госпитализации пациента в профильный стационар. При лечении детей и подростков у онкогематолога, как правило, есть один-два дня ни диагностику, лечение необходимо начинать, как можно раньше. В диагностику входит повторный анализ крови, затем – верификация диагноза, для которой проводят биопсию костного мозга. У маленьких детей ее проводят под общей анестезией, у взрослых — под местной. С помощь небольшой иглы делаю прокол грудины или подвздошной кости. У детей пункцию грудины не делают. Полученный образец костного мозга, который выглядит как обычная пробирка с кровью, отправят в лабораторию, где для подтверждения диагноза проведут целый спектр исследований. Главный критерий – увеличение количества бластных клеток. Только по внешнему виду и по количеству бластных клеток определить вариант лейкоза – невозможно. Еще в 1913 году установили, что есть лимфоидный, а есть миелоидный вариант лейкоза. Для верификации применяются специальные лабораторные методы: иммунологические и химические. Существует специальный прибор – проточный цитометр, с помощью которого определяют маркеры, характеризующие данный тип клеток. Для определения подвида острого лейкоза, применяют целый спектр генетических исследований, чтобы выйти на более целевую терапию у этих пациентов.
Каковы причины возникновения ОЛЛ? Существует мнение, что этот вид лейкоза очень сильно взаимосвязан с экологическими проблемами, передается по наследству и часто возникает у тех, кто уже переболел каким-то онкологическим заболеванием. Правда это или нет?
Истинную причину возникновения лейкоза у взрослых можно выявить только в 5% случаев, в 95% совершенно непонятно, что там к чему привело. У детей все несколько интересней.
Как возникает лейкоз? В генетическом материале клетки возникает некая первичная мутация, которая сама по себе далеко не всегда приводит к лейкозу. В дальнейшем к этой мутации присоединяются другие, и когда болезнь все же возникает, в клетке накоплено уже много молекулярных событий, сочетание которых привело возникновению заболевания. Пик острого лимфобластного лейкоза приходится на детей от двух до четырех лет, потом заболеваемость падает. Следующий пик приходится на 18-29 лет, потом снова спад. После 60 лет — опять небольшой рост.
У части детей раннего возраста прослеживается некая врожденная составляющая этой проблемы. Встречаются случаи ОЛЛ у плода или новорожденного, когда ребенок рождается уже с заболеванием, либо заболевает в течение первого года жизни. Исследования пуповинной крови показали, что у новорожденных встречаются лейкемические поломки, врожденные мутации, которые могут привести к возникновению лейкоза. И мутацию эту вызывает наследственный фактор, сработавший во время внутриутробного развития. По разным данным, общее количество таких младенцев составляет от 1 до 5%. Дальше многое зависит от инфекционной обстановки, сложившейся вокруг ребенка. Многочисленные инфекции, перенесенные в детстве, способствуют формированию нормальной иммунной системы, которая нейтрализует наследственный фактор.
Если говорить про экологические проблемы, то с ними четкой связи не выявлено.
Влияет ли УФ-излучение, СВЧ, солнечные лучи, радиация?
В Хиросиме и Нагасаки повышенная заболеваемость держалась около 12 лет. После Чернобыля у многих пострадала щитовидная железа, но заболеваемость лейкозами не выросла. Все зависит от типа изотопов попавших в окружающую среду. В Фукусиме тоже этого не случилось, потому что концентрация радиоактивных веществ сильно разбавилась морской водой.
Вред ультрафиолета научно доказан только в отношении меланомы. Четкой связи с ОЛЛ нет. Своим бывшим пациентам мы не разрешаем посещать солярий и не рекомендуем загорать, потому что хотя связь и не доказана, совсем исключать этот фактор тоже нельзя.
Если говорить об СВЧ-излучении, домашние микроволновые печи абсолютно безопасны.
Как лечат ОЛЛ? Что ждет пациента?
Концепция лечения ОЛЛ, которая до сих поре лежит в основе протоколов лечения ОЛЛ, была разработана американским педиатром Дональдом Пинкелем еще в 1962 году. Она включает в себя четыре этапа: индукция ремиссии, консолидация, воздействие на центральную нервную систему и длительный этап поддерживающей терапии на протяжении двух-трех лет. Во всем мире проводится лечение по клиническим протоколам, разработанным в результате кооперированных исследований. Согласно некоторым работам, строгое следование протоколам повышает выживаемость пациентов на 15-20% по сравнению с индивидуализированным лечением. В протоколе прописаны все действия: от первого дня до последнего. В нем есть указания, как и в какой момент оценивать возникающие осложнение и что с ними делать. В России два центра, активно ведущих такие протоколы. Центр им. Дмитрия Рогачева, где Александр Исаакович Карачунский в течение многих лет, с начала 1990-х, ведет серию протоколов «Москва — Берлин». Каждые пять лет дизайн протоколов пересматривают, чтобы улучшить лечение отдельных категорий пациентов. уже в течение многих лет с начала 90-х годов серию протоколов Москва-Берлин. Каждые пять лет меняется дизайн протоколов, направленных на улучшение лечения отдельных категорий пациентов. Во взрослой практике — это НМИЦ гематологии, где ведут кооперированные исследования по острому лимфобластному лейкозу у взрослых.
В каких случаях показана трансплантация костного мозга (ТКМ)?
В отличие от острого миелоидного лейкоза, показаний к аллогенной (от донора) ТКМ меньше. Ее назначают пациентам, которые не достигли ремиссии в указанные протоколом сроки или имеют неблагоприятный цитогенетический вариант заболевания. В детской практике выздоравливают более 90% детей, и примерно 15-20% являются кандидатами для аллогенной ТКМ. У взрослых процент пациентов нуждающихся в трансплантации несколько выше, за счет того, что генетических операций высокого риска становится намного больше и ответ на стандартное лечение хуже. Когда мы обсуждали хронический миелолейкоз, там фигурировала филадельфийская хромосома — транслокация (9;22). При ОЛЛ это абсолютно негативный фактор прогноза. У детей такая мутация встречается меньше чем в 5% случаев, у людей старше 50-60 лет примерно половина В-линейных ОЛЛ будет с филадельфийской хромосомой. В отличие от хронического миелолейкоза, применение ингибиторов тирозинкиназы при остром лимфобластном лейкозе не столь успешно. Вот поэтому во взрослой практике ТКМ необходимо проводить примерно 30% пациентов. Возрастной порог для аллогенной ТКМ — в районе 55 лет, это разумно.
Как часто случаются рецидивы с ОЛЛ?
Если мы говорим про взрослых людей, то рецидивы случаются почти в 40% случаев. Бывают ранние рецидивы, которые случаются прямо на терапии. В таком случае необходимо менять лечение, делать его более интенсивным и тяжелым. В таких случаях, как правило, показана ТКМ. Поздний рецидив может случиться и через 20 лет. К сожалению мы не можем убрать причину, которая вызывает это заболевание — оно может вернуться.
Можно ли планировать беременность после ОЛЛ?
Длительная химиотерапия нарушает фертильность, поэтому лучше провести криоконсервацию спермы/яйцеклетки, а еще лучше эмбриона — это более надежный способ. У мужчин, как правило, серьезно нарушается сперматогенез, но у женщин дело обстоит несколько лучше. Вероятность забеременеть и выносить здорового ребенка высока. Если прошло не менее пяти лет в ремиссии, никаких ограничений нет.
Может ли беременность быть провоцирующим фактором для рецидива?
Скорее, нет. Это не такое частое явление, как при некоторых других заболеваниях, где беременность действительно может стать провоцирующим фактором.
Передается ли ОЛЛ по наследству?
Лимфобластный лейкоз – редкое заболевание, поэтому вероятность того, что он случится у ребенка, рожденного от родителей после ОЛЛ, крайне мала.
Как будут лечить ОЛЛ в будущем?
Представляется, что в основе лечения онкологических заболеваний в будущем станет активация собственного иммунитета. Нам необходимо настроить иммунную систему таким образом, чтобы она распознавала и убирала раковые клетки. Сейчас мы находимся на раннем этапе развития CAR-T-терапии, но через какое-то время технологии настолько усовершенствуются, что, скорее всего, она станет одним из основных методов терапии при целом ряде онкогематологических заболеваний. Суть метода заключается в том, что у пациента собирают его собственные Т-лимфоциты и отправляют в специальную лабораторию. Эта лаборатория может быть в другом городе, стране — не важно. В лаборатории эти Т-лимфоциты перепрограммируются: в них появляется информация об опухолевых клетках, присутствующих в организме пациента. После перепрограммирования Т-лимфоциты вводят обратно пациенту, она находят раковые клетки и возникает ремиссия. Основные проблемы – создать качественный процесс распознавания и разработать стандартные протоколы лечения.
Много вопросов возникает в понимания биологии заболевания, потому как каждый конкретный случай весьма индивидуален. Мы знакомы только с грубыми поломками, но каждая отдельная поломка провоцирует различное течение болезни. Мы уже сейчас можем полностью секвенировать геном опухолевой клетки и главное научиться понимать, что в патогенезе является ключевым и как на это можно воздействовать, тогда мы ближе подойдем к полному излечению болезни. За этим будущее.