Лигнин для чего применяется
Лигнин гидролизный
Лигнин является сложным (сетчатым) ароматическим природным полимером, который входит в состав наземных растительных организмов, продуктом биосинтеза. Лигнин занимает втрое место после целлюлозы по распространенности среди полимеров на земле. Он играет очень важную роль в естественном круговороте углерода. Образование лигнина стало возможным вследствие эволюционного перехода растений от водного к наземному образу жизни для того, чтобы обеспечить жесткость и устойчивость стеблей и стволов (как хитин у членистоногих).
Происхождение лигнина
В составе растительной ткани преобладает целлюлоза, гемицеллюлоза и лигнин. Древесина хвойных пород содержит примерно 23-38 % лигнина, в то время как лиственные породы содержат от 14 до 25%, солома злаков включает примерно 12-20% от массы. Лигнин содержится в клеточных стенках, а также в пространстве между клетками. Таким образом, он скрепляет волокна целлюлозы.
Совместно с гемицеллюлозами он отвечает за показатель механической прочности ствола и стебля. Благодаря лигнину достигается герметичность клеточных стенок, а вследствие наличия красителей в лигнине древесина имеет свой характерный цвет.

Примечательно, что лигнин не производят специально. Он, как и его химически модифицированные формы, представляет собой отходы биохимического производства. Во время физико-химических методов переработки растительных волокон молекулярная масса лигнина снижается в несколько раз, но растет его химическая активность.
Получение лигнина
Лигнин, который получается в ходе сульфатного производства, называют сульфатным лигнином. Он в больших количествах степени утилизируется в энергетических установках целлюлозных предприятий.
В сульфитной промышленности получаются смеси сульфитных лигнинов (лигносульфонатов), определенный объем которых скапливается в лигнохранилищах, а остаток попадает со сточными водами завода в акватории рек и озер.
Физические свойства лигнина
Лигнин имеет уровень плотности в пределах 1,25-1,45 г/см3, при этом коэффициент преломления составляет 1,6. Гидролизный лигнин отличается теплотворной способностью, составляющей у абсолютно сухого лигнина 5500-6500 ккал/кг. Теплотворная способность лигнина с уровнем влажности 18-25% достигает 4400-4800 ккал/кг, а у лигнина с уровнем влажности 65% этот показатель составляет лишь 1500-1650 ккал/кг.
Структура частиц гидролизного лигнина – это не плотное тело, а развитая система микро- и макропор. Показатель его внутренней поверхности очень сильно зависит от уровня влажности, например, влажный материал имеет поверхность 760-790 м2/г, а сухой лишь 6 м2/г.
Средневесовая молекулярная масса лигнинов древесины ели, выделенных различными методами
Вид лигнина
Метод определения
Растворитель
Молекулярная масса
Щелочной из солянокислотного
Использование лигнина
Широкое применение лигнина обусловлено его свойствами. Ниже представлены самые востребованные сферы использования гидролизного лигнина:
Брикеты из лигнина

Лигнин. Что такое лигнин, происхождение, получение, свойства и применение лигнина
Происхождение и получение лигнина
Вместе с гемицеллюлозами он определяет механическую прочность стволов и стеблей. Лигнин обеспечивает герметичность клеточных стенок ( для воды и питательных веществ) и благодаря содержащимся в нем красителям определяет цвет одревесневевшей ткани.
Лигнин прочно физически и химически инкорпорирован в структуре растительной ткани и эффективное выделение его оттуда промышленными методами представляет весьма сложную инженерную задачу.
В гидролизной промышленности получают порошковый т.н. гидролизный лигнин.
В целлюлозном производстве образуются водорастворимые формы лигнина. Существуют две основные технологии варки целлюлозы, более распространенная сульфатная варка (щелочная) и менее употребляемая сульфитная (кислотная) варка.
Лигнин получаемый в сульфатном производстве, т.н. сульфатный лигнин в большой степени утилизируется в энергетических установках целлюлозных заводов.
В сульфитном производстве образуются растворы сульфитных лигнинов (лигносульфонатов), часть которых накапливается в лигнохранилищах, а часть уходит со сточными водами предприятия в реки и озера.
В английской литературе выделяют также:
В той или иной степени утилизацией лигнина занимаются сами производящие его предприятия, но гидролизный лигнин, сульфатный лигнин и лигносульфонаты присутствуют на рынке и как товарные продукты. Международных или российских стандартов на технические лигнины не существует и они поставляются по различным заводским техническим условиям.
Формула и химические свойства лигнина
Принято считать, что молекула лигнина состоит из атомов углерода, кислорода и водорода.
В литературе встречается несколько вариантов формулы лигнина.
Лигнины получаемые из разных растений значительно отличаются друг от друга по химическому составу.
Молекула лигнина неопределенно велика и имеет много разнообразных функциональных групп.
Общей структурной единицей всех видов лигнина является фенилпропан (C9H10), а различия связаны с разным содержанием функциональных групп.
При нормальных условиях лигнин плохо растворяется в воде и органических растворителях. В химических технологиях и в окружающей среде лигнин может участвовать в самых разнообразных химических рекациях и превращениях. Обладает биологической активностью.
Лигнин проявляет пластические свойства при повышенном давлении и температуре, особенно во влажном состоянии.
Утилизация лигнина в природе
Деградация полимерного лигнина происходит под воздействием внеклеточных ферментов-оксидоредуктаз грибов. К данным ферментам в первую очередь относятся лининолитические пероксидазы: лигнин-пероксидаза и Mn-пероксидза, а так же внеклеточная оксидаза – лакказа. Так же лигнинолитичекий комплекс грибов содержит вспомогательные ферменты, в первую очередь производящие перекись водорода для пероксидаз и активные фермы кислорода. Сюда включают такие ферменты как пиранозооксидаза, глюкзооксидаза, глиоксальоксидаза, алклгольарилоксидаза и целлобиозозодегидрогеназа.
Экономическое значение лигнина
Ежегодно в мире получается около 70 млн. тонн технических лигнинов. В энциклопедиях пишут о том, что лигнин является ценным источником химического сырья. К сожалению, пока это сырье организационно, экономически и технически не слишком и не всегда доступно.
Например, разложение лигнина на более простые химические соединения (фенол, бензол и т.п.) при сравнимом качестве получаемых продуктов обходится дороже их синтеза из нефти или газа. По данным International Lgnin Institute в мире используется на промышленные, сельскохозяйственные и др. цели не более 2% технических лигнинов. Остальное сжигается в энергетических установках или захоранивается в могильниках.
В некоторых исследованиях отмечается мутагенная активность технических лигнинов.
Таким образом в народохозяйственном балансе технические лигнины пока представляют собой значительную и постоянно растущую отрицательную величину.
Свойства гидролизного лигнина
Лигнин нетоксичен, обладает хорошей сорбционной способностью.
Некоторые направления применения гидролизного лигнина:
— производство топливных брикетов, в т.ч. в смеси с опилками, угольной и торфяной пылью;
— производства топливного газа, в т.ч. с выработкой электроэнергии в газопоршневых газогенераторах;
— производство брикетированных восстановителей для металлов и кремния;
— производство углей, в т.ч.активированных;
— сорбенты для очистки городских и промышленных стоков, сорбенты для разлитых нефтепродуктов, сорбенты тяжелых металлов, технологические сорбенты;
— сорбенты медицинского и ветеринарного назначения («Полифепан» и т.п.);
— порообразователь в производстве кирпича и др. керамических изделий (взамен опилок и древесной муки);
— сырье для выработки нитролигнина (понизителя вязкости глинистых растворов, применяемых при бурении скважин);
— наполнитель для пластмасс и композиционных материалов, связующее для композиционных материалов («Арбоформ», лигноплиты и т.п.);
— приготовление органических и органо-минеральных удобрений, структурообразователей для естественных и искусственных почв, гербицид при возделывании некоторых культур (бобовых);
— сырье для производства фенола, уксусной и щавелевой кислот;
— добавка в асфальтобетоны (приготовление лигнино-битумных смесей и пр).
Товарные лигносульфонаты получают упариванием обессахаренного сульфитного щелока и выпускают в виде жидких и твердых концентратов сульфитно-спиртовой барды (мол. масса от 200 до 60 тыс. и более), содержащих 50-90% сухого остатка. Лигносульфонаты имеют высокую поверхностную активность, что позволяет использовать их в качестве ПАВ в различных отраслях промышленности, например:
— в строительстве для укрепления низкопрочных материалов и грунтов, а также для обеспыливания покрытий дорожных покрытий, в качестве эмульгатора в дорожных эмульсиях;
— в сельском и лесном хозяйстве для противоэррозиооной обработки почв;
— в качестве сырья для производства ванилина;
— добавка для гранулирования пылящих материалов, антислеживатель.
Представляет собой раствор натриевых солей, характеризующихся высокой плотностью и химической стойкостью. Сульфатный лигнин в сухом виде представляет собой порошок коричневого цвета. Размер частиц лигнина, колеблется в широком интервале от 10 (и менее) мкм до 5 мм. Он состоит из отдельных пористых шарообразных частиц и их комплексов с удельно поверхностью до 20 м 2 /г.
В сульфатном лигнине промышленной выработки в среднем содержится, %: золы — 1,0—2,5, кислоты в расчете на серную — 0,1—0,3, водорастворимых веществ — 9, смолистых веществ — 0,3—0,4, лигнина Класона — около 85. Лигнин имеет достаточно постоянный функциональный состав. В сульфатном лигнине присутствует сера, массовое содержание которой составляет 2,0—2,5%, в том числе несвязанной — 0,4—0,9 %.
Термическая обработка сульфатного лигнина вызывает его разложение с образованием летучих веществ начиная с температуры 190 о С.
Сульфатный лигнин отнесен к практически нетоксичным продуктам, применяемый в виде влажной пасты не пылит и не пожароопасен.
Направления использования сульфатного лигнина:
— сырье для производства фенолоформальдегидных смол и пластиков;
— связующее для бумажных плит, картонов, древесностружечных и волокнистых плит;
— стабилизатор химических пен;
— пластификатор бетонов, керамических и огнеупорных изделий;
— сырье для производства активных осветляющих углей «типа коллактивита».
Литература о лигнине и его применениях
Лигнину и техническим лигнинам посвящена очень большая литература (десятки книг, сотни диссертационных работ и тысячи журнальных статей) на всех основных языках. Многие из них доступны и в интернете, см. например, «Лигнин» статья в Википедии.
Для получения первого впечатления можно использовать, например, следующие имеющиеся в сети книги:
— Химия лигнина, Ф.Э. Браунс, Д.А. Браунс, М. Лесная промышленность, 1964;
— Химия древесины и целлюлозы В.М.Никитин, А.В. Оболенская, В.П. Щеголев М. Лесная промышленность, 1978;
— Переработка сульфатного и сульфитного щелоков, под ред. П.Д. Богомолова и С.А. Сапотницкого, М. Лесная промышленность, 1989;
— Конструкионные материалы из лигнинных веществ, В.А. Арбузов, М. Экология, 1991.
Примечание. Существующие технологии переработки и делигнификации целлюлозного сырья связаны с большими капиталовложениями и не вполне совершенны с точки зрения экологии и др. факторов. Ученые давно изыскивают другие, более эффективные способы организации целлюлозных и биохимических производств, но пока эти разработки не нашли широких промышленных применений.
Уровень потребления и производства целлюлозы, бумаги и др. продуктов биохимии считаются для крупных стран важнейшими показателями развитости экономики в целом. Разумеется не биохимики вносят решающий вклад в загрязнение природы разнообразными отходами и вредными веществами, но там где есть крупные биохимические предприятия их вклад в загрязнение атмосферы и водных ресурсов может быть весьма существенным.
Очевидно, что руководители лесохимической подотрасли на протяжении десятилетий вполне успешно шантажировали государство, кажется что это явление продолжается и сейчас. Заложниками, как всегда, становятся работники предприятий, местные жители и «братья наши меньшие». Закрытие и перепрофилирование Приозерского ЦБК уже принесло заметное улучшение экологии Ладожского озера, однако большое количество приозерцев остаются без работы и по сей день, а город Приозерск находится в депрессивном состоянии.
Отрицать возможность использования лигнина в промышленности и сельском хозяйстве было бы неправильно. Десятилетиями сотни научных организаций во всем мире занимаются исследованиями и разработками в области утилизации свежеизвлеченного и хранимого лигнина. Многие из них в разные годы уже внедрены в промышленности. Дополнительную актуальность эти работы получают в свете возросшего в последние годы интереса к решению экологических проблем и к промышленному использованию всей гаммы растительных ресурсов (biorefinery).
Скорее всего решить проблемы рационального развития биохимических производств без государственного внимания не удастся, ибо рынок головы не имеет, а его нервные узлы как у дождевого червяка расположены в пищеводе. Что, собственно говоря, в очередной раз доказал «начавшийся в 2008 г.» экономический кризис. Произошел ли он при помощи знаменитой невидимой его руки или другого сокрытого члена значения не имеет.
Лигнин Гидролизный
Химическое название
Сложный трехмерный сетчатый биополимер, ароматической природы. Не существует общей структурной формулы, равно как и названия для Лигнина Гидролизного.
Химические свойства
Данное вещество представляет собой аморфное порошкообразное соединение. Цвет: различные оттенки коричневого. Соединение обладает специфическим запахом. Молекулярная масса от 5000 до 10000. В Лигнине Гидролизном самого лигнина – порядка 50-80%, все остальное — примеси (трудногидролизуемые полисахариды, смолистые вещества, зольные ферменты). Средство плохо растворимо в воде и органических растворителях.
В сухом виде вещество хорошо горит, при распылении взрывоопасно. Температура воспламенения 195 градусов Цельсия, тлеть средство начинает при 185 градусах.
Гидролизный Лигнин нашел широкое применение в различных отраслях науки и промышленности.
Фармакологическое действие
Сорбирующее, антиоксидантное, антидиарейное, гиполипидемическое.
Фармакодинамика и фармакокинетика
В желудочно-кишечном тракте вещество адсорбирует различные микроорганизмы и продукты их жизнедеятельности, ксенобиотики, токсины, радиоактивные изотопы, аллергены, аммиак, тяжелые металлы. Средство оказывает положительное влияние в целом на функционирование ЖКТ, тем самым, компенсируя недостаток пищевых волокон, нормализуя микрофлору.
Данное соединение не метаболизируется, после проникновения в желудочно-кишечный тракт выводится в неизменном виде.
Показания к применению
Лекарственное средство используют:
Противопоказания
Препараты на основе Лигнина Гидролизного противопоказаны:
Побочные действия
Обычно вещество хорошо переносится. Редко могут возникнуть: запор, реакции гиперчувствительности, несварение желудка.
Лигнин Гидролизный, инструкция по применению (Способ и дозировка)
Средство выпускают в виде таблеток, гранул, пасты или порошка. В любом случае показан прием вещества перед едой, несколько раз в день.
Перед употреблением вещество необходимо растворить в 300-400 мл воды, перемешивая 2 минуты.
Дозировка устанавливается врачом в том или ином конкретном случае.
Как правило, взрослым назначают от 5 до 7 грамм в средства в день. Для детей, в зависимости от веса, суточная дозировка вдвое меньше.
Курс лечения определяет врач.
Передозировка
Не отмечено случаев передозировки лекарственным средством.
Взаимодействие
Вследствие способности лигнина абсорбировать лекарственные средства, он может снижать их эффективность, замедлять всасывание в ЖКТ.
Условия продажи
Рецепт на препарат не требуется.
Особые указания
При тяжелом течении инфекционных заболеваний рекомендуется использовать средство в составе комплексной терапии.
Следует соблюдать временной интервал между приемом лекарства и прочих препаратов.
При длительном использовании рекомендуется сочетать средство с витаминами группы В, Е, К, D и кальцием.
При беременности и лактации
Лекарство безопасно в использовании у беременных и кормящих женщин.
Лигнин для чего применяется
Лигнин является одним из наиболее распространенных природных полимеров и крупнотоннажным отходом гидролизной и целлюлозно-бумажной промышленности. В то же время лигнин – потенциальный источник для получения ароматических соединений в качестве альтернативы ископаемому топливу [13, 14].
Проблема увеличения ценности лигнина как вторичного сырья не теряет актуальности. В этой связи окислительная деструкция полимерной молекулы лигнина представляет собой традиционный и, одновременно, перспективный подход и позволяет получать высокофункциональные мономерные и олигомерные продукты, которые далее могут применяться в химической и фармацевтической и многих других областях промышленности [11, 13, 14]. Особое внимание уделяется каталитическим методам окисления, в том числе биокатализу, биомиметическому, металлоорганическому катализу [15]. Перспективной технологией модифицирования лигнинов с высокой степенью утилизации является фотокатализ, в результате которого могут быть получены такие низкомолекулярные продукты, как, например, фенол, бензол, толуол и ксилол [14]. Значительное количество публикаций посвящено процессам электрохимического модифицирования лигнинов с целью увеличения их реакционной способности и дальнейшего применения в качестве активных ингредиентов композиционных материалов [2–4, 6–8, 10].
Наиболее распространенные способы модифицирования лигнина – окисление и хлорирование. Модифицирование лигнина во многих случаях осуществляют в щелочных растворах, что связано с растворением лигнина в данной среде и наиболее глубокими и полными процессами окисления. Однако в этом случае возникают проблемы дальнейшей утилизации отработанных растворов. Кислые и органические растворы также пригодны для окислительного модифицирования лигнинов [2–4, 8, 10]. Так, при электролизе ГЛ в растворе соляной кислоты параллельно с процессами присоединения атомов хлора (либо электрофильного замещения функциональных групп лигнина атомами хлора) происходит сильное окисление лигнина. Параллельно с внедрением в структуру атомов хлора происходит деструкция и значительное уменьшение молекулярной массы лигнина [2, 4]. Электролиз гидролизных лигнинов в растворах плавиковой кислоты приводит к получению сильно окисленных препаратов лигнина [8].
Окисленные лигнины представляют значительный интерес как антипирены для композиционных материалов и, в частности, для материалов из древесины [9]. Механизм действия окисленного лигнина в качестве огнезащитной пропитки древесины основан на поверхностном коксообразовании за счет реакций твердофазного ингибирования процессов высокотемпературной деструкции целлюлозы затрудненными полифенолами, содержащимися в структуре лигнина.
В данной публикации представлены результаты исследований по разработке негорючих композиций на основе эпоксидной смолы и лигнинов, немодифицированных и окисленных (содержащих хлор (ОХЛ) и без хлора (ОЛ)).
Материалы и методы исследования
Окисленные лигнины получали модифицированием гидролизного лигнина (ГЛ) кукурузной кочерыжки следующего состава ( %): С – 66,6; Н – 6,1; О – 27,3; ОСН3 – 17,8; СООН – 5,7; ОНфен – 4; ОНобщ – 14,2; СОобщ – 3,2. Исходный лигнин размалывали в шаровой мельнице и просеивали, отбирали фракцию менее 45 мкм. Содержание карбоксильных групп в ГЛ составляло 5,7 %, общих гидроксильных 17,8 %. Процессы окисления и хлорирования проводили в бездиафрагменном электролизере объемом 500 мл при температуре окружающей среды на анодах из углеродных материалов [9, 10] в растворах соляной и плавиковой кислот. Для синтезов в растворах плавиковой кислоты, в частности, применяли электролизер из полипропилена и электроды из стеклографита. Соответственно получали окисленный хлорированный лигнин (ОХЛ) в растворе соляной кислоты и окисленный лигнин (ОЛ) – в растворе плавиковой кислоты. После окончания электролиза модифицированный лигнин отфильтровывали досуха, промывали дистиллированной водой до нейтральной реакции среды и высушивали. Кислые электролиты корректировали добавлением исходного электролита и снова использовали. Окисленные лигнины сушили до постоянной массы и применяли для получения композиций.
Эпоксидные композиции готовили на основе смолы ЭД-20 (ГОСТ 10587-84). В качестве антипиренов применяли: моногидрат дигидроортофосфата кальция – Ca(H2PO4)2•H2O; полифосфат аммония (ПФА) – (NH4PO3)n. В качестве пластификатора и для улучшения свойств огнестойкости применяли трикрезилфосфат (TКФ) – (СН3С6Н4O)3РО.
Образцы композиций получали в гибких формах из полипропилена. Компоненты перемешивали вручную. Полученную смесь выдерживали в термошкафу при температуре 50 °С. Твердость по Бриннелю определяли в соответствии с ГОСТ 4670-91. Плотность образцов устанавливали методом гидростатического взвешивания. Водопоглощающую способность определяли по увеличению массы образцов после их выдерживания в дистиллированной воде в течение 24 ч при комнатной температуре.
Результаты исследования и их обсуждение
Проблема снижения горючести эпоксидных композитов весьма актуальна [1, 5, 6, 11, 12]. Применению модифицированных лигнинов в качестве ингредиентов эпоксидных полимеров, в частности, посвящены публикации [1, 6].
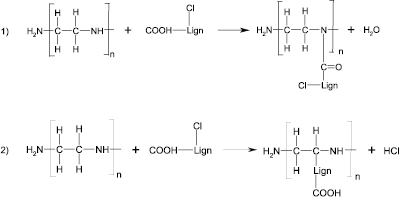
Химическая активность макромолекул окисленных лигнинов в реакциях полимеризации или сополимеризации главным образом определяется реакционной способностью –ОН-групп (алифатической и ароматической части молекулы), в том числе в составе карбоксильных групп, и других модифицирующих групп и атомов. Авторы работы [6] исследовали отверждение эпоксидных олигомеров электрохимически фосфорилированным лигнином с содержанием фосфора до 18 %. Показано, что отверждение эпоксидных олигомеров происходит за счет взаимодействия =POCl и –POCl2 групп в составе модифицированного лигнина с эпоксидными группами, а увеличение содержания фосфора в модифицированном лигнине способствует значительному понижению температуры отверждения эпоксидной композиции вплоть до 15–20 °С и сокращению времени отверждения. Особенностью лигнинов, модифицированных хлором в кислой среде, является высокое содержание карбоксильных групп. Именно карбоксильные группы, как было ранее доказано, в значительной степени определяют реакционную способность лигнинов в реакциях с эпоксидными олигомерами. При взаимодействии ОХЛ с эпоксидной смолой возможны следующие реакции:
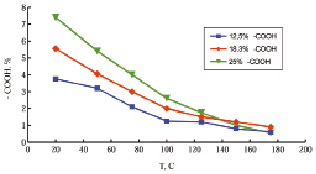
Степень взаимодействия эпоксидной смолы с ОХЛ, содержащими 12,5, 18,3 и 25 % групп –СООН, выражается зависимостью содержания остаточных карбоксильных групп от температуры отверждения эпоксидных композитов (рисунок).
Содержание остаточных карбоксильных групп в композициях ЭД-20 + 30 % ОХЛ в зависимости от температуры отверждения. Содержание карбоксильных групп в образцах ОХЛ: 1 – 25 %, 2 – 18,3 %, 3 – 12,5 %
При комнатной температуре взаимодействие ОХЛ с ЭДП не происходит. Однако по мере увеличения температуры вплоть до 125 °С в отвержденных образцах наблюдается интенсивное уменьшение содержания –СOOH групп, которое замедляется в интервале температур 125…175 °С.
Аналогичные результаты наблюдали при исследовании взаимодействия ОЛ с ЭДП. При этом следует отметить, что, несмотря на взаимодействие окисленных лигнинов (хлорированных и без хлора) с эпоксидной смолой, отверждение композиций в полной мере не происходит, как это наблюдалось при работе с фосфорилированными лигнинами авторами [6]. Поэтому отверждение композиций на основе эпоксидной смолы и лигнинов проводили с добавлением полиэтиленполиамина (ПЭПА).
Наилучшие составы композиций, выявленные в результате проведения экспериментов при температуре окружающей среды, представлены в табл. 1.
Результаты отверждения компаундов на основе эпоксидной смолы ЭД-20 и лигнинов