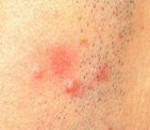
Лимфоидный инфильтрат это что за болезнь
Воспалительный инфильтрат
Для обозначения подобных форм воспалительных заболеваний многие авторы пользуются противоречивыми по значению терминами «начинающаяся флегмона», «флегмона в стадии инфильтрации» или вообще опускают описание указанных форм заболевания. В то же время отмечается, что формы одонтогеннои инфекции с признаками серозного воспаления околочелюстных мягких тканей встречаются часто и в большинстве случаев хорошо поддаются лечению.
Что провоцирует / Причины Воспалительного инфильтрата:
Воспалительные инфильтраты составляют многообразную по этиологическому фактору группу. Проведенные исследования показали, что у 37 % больных был травматический генез заболевания, у 23 % причиной служила одонтогенная инфекция; в остальных случаях инфильтраты возникали после различных инфекционных процессов. Эта форма воспаления отмечается с одинаковой частотой во всех возрастных группах.
Симптомы Воспалительного инфильтрата:
Воспалительные инфильтраты могут иметь травматический генез. Локализуются они практически во всех анатомических отделах челюстно-лицевой области, несколько чаще в щечной и области дна полости рта. Воспалительные инфильтраты постинфекционной этиологии локализуются в поднижнечелюстной, щечной, околоушно-жевательной, подподбородочной областях. Четко прослеживается сезонность возникновения заболевания (осенне-зимний период). Дети с воспалительным инфильтратом чаще поступают в клинику после 5-х суток заболевания.
Диагностика Воспалительного инфильтрата:
Наибольшие трудности для дифференциальной диагностики представляют гнойные очаги, локализующиеся в пространствах, отграниченных снаружи группами мышц, например в подвисочной области, под m. masseter и др. В этих случаях нарастание симптомов острого воспаления определяет прогноз процесса. В сомнительных вариантах помогает обычная диагностическая пункция очага поражения.
При морфологическом исследовании биоптата из воспалительного инфильтрата обнаруживают типичные для пролиферативной фазы воспаления клетки при отсутствии или небольшом количестве сегментоядерных нейтрофильных лейкоцитов, обилие которых характеризует гнойное воспаление.
В инфильтратах почти всегда обнаруживают скопления дрожжевых и мицелиальных грибов рода Candida, Aspergillus, Mucor, Nocardia. Вокруг них формируются эпителиоидно-клеточные гранулемы. Мицелий грибов характеризуется дистрофическими изменениями. Можно предположить, что длительная фаза продуктивной тканевой реакции поддерживается грибковыми ассоциациями, отражающими возможные явления дисбактериоза.
Лечение Воспалительного инфильтрата:
К каким докторам следует обращаться если у Вас Воспалительный инфильтрат:
Инфильтрат
Инфильтрат — это скопление в тканях организма клеточных элементов, несвойственных для этой области, а также крови и лимфы. Его формирование сопровождается увеличением ткани в объеме, она уплотняется, меняет цвет, в очаге ощущается болезненность.
Лечение и прогноз этого состояния зависят от вида и причины его возникновения:
В медицине выделяется еще несколько разновидностей этого состояния.
Представляет собой скопление различных клеток в легочной ткани. При этом ткань уплотняется, увеличивается в объеме, а работа органов дыхания затрудняется. Причина образования инфильтрата легкого — проникновение инфекции и паразитов (аскаридоз), развитие опухоли, аллергический процесс.
Для определения патологии решающую роль играет рентгенологическое обследование. Также назначаются анализы крови для определения природы болезни и возможных возбудителей.
Лечение зависит от причины патологии. Терапию назначает врач-пульмонолог.
Инфильтрат после операции — это осложнение, возникшее в результате хирургического вмешательства. Причина развития патологии — инфицирование и травматизация тканей.
Также возникновению инфильтратов способствует нарушение кровообращения в области вмешательства и сниженная сопротивляемость инфекциям в послеоперационном периоде.
Патология развивается постепенно. Она обнаруживается на первой или второй неделе после операции. У человека поднимается температура, появляются боли в области брюшной полости, возникает задержка стула. В области вмешательства врач определяет болезненное уплотнение.
Инфильтрат опасен остановкой затягивания послеоперационной раны и ее нагноением, поэтому сразу при его обнаружении хирург назначает антибиотикотерапию.
Патология развивается на месте подкожных или внутримышечных уколов. Чаще всего инфильтрат возникает после инъекций в ягодичную мышцу: появляется болезненность, при пальпации обнаруживается уплотнение. Кожа краснеет, температура поднимается до субфебрильных цифр.
Причиной развития становится нарушение правил постановки уколов (тупые иглы, быстрое введение препарата, частые инъекции в одну и ту же область, несоблюдение правил асептики).
Для лечения инфильтрата используются местные средства (йодная сетка), методы физиотерапии (электрофорез), УВЧ и антибиотикотерапия.
Это осложнение острого аппендицита, которое проявляется в виде спаянных между собой тканей аппендикса с органами, расположенными поблизости (слепая кишка, тонкая кишка, сальник).
Образование формируется на 2–5 день от начала болезни. После формирования инфильтрата острую боль в правой подвздошной области сменяет тупая и ноющая. В крови также определяется воспаление (повышенное СОЭ, лейкоцитоз). Температура поднимается до субфебрильных цифр. Со временем уплотнение может нагноиться или рассосаться. Образование лечится консервативным путем: врач назначает антибиотики, физиотерапевтические процедуры. Через 2 месяца проводится плановая аппендэктомия.
Лимфоцитарная инфильтрация Джесснера-Канофа
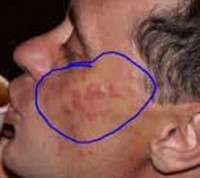
Лимфоцитарная инфильтрация Джесснера-Канофа – редкий хронический дерматоз, характеризующийся доброкачественной инфильтрацией кожи лимфоцитами. Заболевание имеет волнообразное течение, склонно к саморазрешению. Клинически проявляется высыпанием на неизменённой коже плоских гладких синюшно-розовых бляшек или папул, которые сливаются в очаги величиной с ладонь ребенка или взрослого. Первичные элементы имеют чёткие границы, шелушатся. Бляшки обычно единичные, располагаются на лице, шее, туловище, конечностях. Диагностируется клинически с гистологическим подтверждением, иногда проводят молекулярно-биологические исследования. Лечение – НПВС, гормональная терапия, препараты местного действия.
Общие сведения
Лимфоцитарная инфильтрация Джесснера-Канофа – доброкачественная псевдолимфома кожи с хроническим волнообразным рецидивирующим течением. Встречается редко. Чаще возникает у мужчин старше 20 лет. Сезонных, расовых различий не имеет, не эндемична. Иногда наблюдается улучшение в летний период. Впервые данная патология была описана в 1953 году, когда М. Джесснер и Н. Каноф рассмотрели ее как самостоятельное заболевание со сквозной инфильтрацией лимфоцитами всех слоёв дермы. Название «псевдолимфома» в 1965 году ввел К. Мач, объединивший инфильтрацию Джесснера-Канофа в одну группу с другими разновидностями лимфоцитарной инфильтрации.
В 1975 году О. Браун отдифференцировал тип заболевания, отнеся инфильтрацию лимфоцитами к В-клеточным псевдолимфомам, однако позже специалисты стали рассматривать патологию как Т-псевдолимфому. Именно Т-лимфоциты обеспечивают доброкачественное течение патологии и возможность спонтанной инволюции первичных элементов. Дальнейшие исследования показали, что в возникновении и течении лимфоцитарной инфильтрации Джесснера существенную роль играет иммунная система организма. Возможно, это связано с тем, что клетки иммунной системы располагаются в пищеварительном тракте, а он поражается в 70% случаев заболевания. Изучение лимфоцитарной инфильтрации Джесснера-Канофа продолжается и в настоящее время. Понимание причин возникновения и развития Т-лимфоидных процессов имеет большое значение в разработке патогенетического лечения псевдолимфом.
Причины лимфоцитарной инфильтрации
Наиболее вероятными причинами лимфоцитарной инфильтрации Джесснера-Канофа принято считать гиперинсоляцию, укусы клещей, инфекции, патологию желудочно-кишечного тракта, использование дерматогенной косметики и нерациональный приём лекарственных препаратов, провоцирующих системные иммунные нарушения, визуально представленные инфильтративными изменениями в коже. Механизм лимфоцитарной инфильтрации Джесснера-Канофа заключается в следующем: интактный эпидермис даёт Т-лимфоцитам возможность инфильтрировать глубокие слои дермы, располагаясь в сосочковых выростах и вокруг сосудистых сплетений по всей толще кожи. Триггеры заболевания запускают воспаление, на которое реагируют непосредственно клетки кожи и клетки иммунной системы. В процесс купирования воспаления включаются Т-лимфоциты, обеспечивающие доброкачественный ответ иммунной системы в виде пролиферации эпителиальных клеток дермы.
Одновременно в коже развивается банальное воспаление, проходящее три стадии: альтерации, экссудации и пролиферации с участием гистиоцитов – клеток ретикулярной ткани. Гистиоциты группируются и образуют островки, напоминающие лимфоидные фолликулы. На конечном этапе купирования воспаления два параллельных процесса пролиферации дополняют и усиливают друг друга. Так возникает очаг лимфоцитарной инфильтрации. Поскольку лимфоциты гетерогенны, оценка их гистохимических свойств с помощью иммунологических маркеров и моноклональных антител легла в основу иммунофенотипирования. Этот анализ имеет большое диагностическое значение в современной дерматологии.
Симптомы лимфоцитарной инфильтрации
Первичным элементом кожной сыпи при лимфоцитарной инфильтрации Джесснера-Канофа является крупная плоская розово-синюшная бляшка или папула с чёткими границами и гладкой поверхностью, имеющая тенденцию к периферическому росту. Сливаясь между собой, первичные элементы образуют кольцевидные или дугообразные «острова» с участками шелушения. Разрешение высыпавших элементов начинается с центра, поэтому сливные очаги могут иметь западание в центральной части. Типичной локализацией принято считать лицо, шею, околоушное пространство, затылок, лоб, щёки и скулы. Редко высыпания появляются на коже туловища и конечностях. Обычно первичный элемент одиночный, реже наблюдается тенденция к распространению процесса.
Лимфоцитарная инфильтрация Джесснера-Канофа характеризуется волнообразным рецидивирующим течением. Резистентна к проводимой терапии, способна спонтанно саморазрешаться. Рецидивы обычно возникают в местах прежней локализации, но могут захватывать и новые участки кожного покрова. Несмотря на длительное хроническое течение, внутренние органы в процесс не вовлекаются.
Диагностика лимфоцитарной инфильтрации
Заболевание диагностируется дерматологом на основании анамнеза, клиники, гистологии и люминесцентного микроскопирования (типичное свечение на границе дермоэпидермального соединения не определяется) с обязательной консультацией иммунолога и онколога. Гистологически при лимфоцитарной инфильтрации Джесснера-Канофа выявляется неизменённый поверхностный слой кожи. В толще дермальных слоёв обнаруживается группирование лимфоцитов и клеток соединительной ткани вокруг сосудов.
В сложных случаях проводят иммунотипирование опухоли, гистохимическое и молекулярное тестирование. К. Фан с соавторами рекомендуют основывать диагностику на результатах ДНК-цитофлюориметрии с анализом количества нормальных клеток (при лимфоцитарной инфильтрации Джесснера-Канофа более 97%). Дифференциальную диагностику проводят с саркоидозом, системной красной волчанкой, центробежной эритемой Биетта, кольцевидной гранулёмой, группой лимфоцитарных опухолей, токсикодермией и сифилисом.
Лечение лимфоцитарной инфильтрации
Лечение направлено на купирование острой фазы лимфоцитарной инфильтрации Джесснера-Канофа и увеличение продолжительности светлых промежутков. Терапия патологии неспецифическая. Отмечается хороший терапевтический эффект при назначении антималярийных препаратов (хлорохин, гидроксихлорохин) и нестероидных противовоспалительных средств (диклофенак, индометацин) после предварительного лечения сопутствующей патологии желудочно-кишечного тракта. Если состояние пищеварительной системы позволяет, применяют энтеросорбенты. Местно показаны гормональные кортикостероидные мази и кремы, а также инъекционные блокады очагов высыпаний триамцинолоном и бетаметазоном. При резистентности к проводимой терапии подключают плазмаферез (до 10 сеансов).
Лимфоидный инфильтрат это что за болезнь
Хронический аутоиммунный тиреоидит (АИТ) – классическое органоспецифическое аутоиммунное заболевание с образованием аутоантител, основным морфологическим проявлением которого является лимфоидная инфильтрация ткани щитовидной железы [3, 10]. Прошло уже около ста лет со дня первого описания аутоиммунного тиреоидита, однако и сегодня морфологическая диагностика аутоиммунных заболеваний щитовидной железы, в частности тиреоидита Хашимото, до сих пор является сложной задачей из-за многообразия гистологических форм [5, 9]. Многие авторы выделяют очаговый тиреоидит как форму аутоиммунного тиреоидита, относя его к ранней стадии заболевания, другие авторы выделяют очаговый тиреоидит как иммунную реакцию организма на различные патологические процессы щитовидной железы, не имеющие связь с аутоиммунным тиреоидитом [6, 7]. Имеются противоречивые данные по поводу гиперплазии тиреоидного эпителия в В-клетки. По данным одних авторов при очаговом тиреоидите в области лимфоплазмоцитарной инфильтрации тиреоидный эпителий имеет характерный вид и состоит из В-клеток, а по данным других, очаговый тиреоидит характеризуется отсутствием В-клеток [1, 7, 8]. В связи с противоречивыми данными возрастает важность изучения характера клеточной инфильтрации (2). На сегодняшний день имеется большое количество научных статей, посвященных морфологическому изучению щитовидной железы при АИТ, однако сведения о клеточном составе лимфоидной инфильтрации весьма скудные [4].
Цель исследования – изучение состава клеток лимфоидного инфильтрата при аутоиммунном и очаговом тиреоидите.
Материал и методы исследования
Исследование выполнено на основе изучения историй болезни и операционного материала, полученного от 72 больных с гистологически верифицированным диагнозом АИТ и 54 больных с очаговым тиреоидитом на фоне различных патологий щитовидной железы, прооперированных в городских больницах г. Ставрополя в период с 2009 по 2011 г.
Для гистологического и гистохимического исследования материал фиксировали в 10 % нейтральном формалине, заливали парафином и готовили срезы толщиной 5–6 мкм. Гистологические срезы гематоксилином и эозином для общих обзорных целей, по Ван Гизону, по Маллори в модификации Гейденгайна. Результаты выраженности того или иного признака оценивались полуколичественным методом, предложенным О.К. Хмельницким, по следующим критериям: 0 – отсутствует, (+) – слабая степень, (++) – умеренная степень, (+++) – выраженная реакция. Также проводили иммуногистохимические окраски всех срезов с использованием антител к CD4 (Т-хелперам), CD8 (Т-супрессорам) и B-лимфоцитам CD19. Для этого приготавливали парафиновые срезы толщиной 5 мкм, наклеивали на стекла, обработанные яичным альбумином. Затем срезы высушивали не менее суток при температуре 37 °С, подвергали депарафинизации и обезвоживанию, демаскировке антигенов (нагреванием на водяной бане до 95–99 °С) и непосредственно окрашиванию антителами. Для интерпретации результатов учитывали локализацию иммунореактантов и интенсивность их окрашивания, которую оценивали полуколичественным методом по следующим критериям: 0 – отсутствует, (+) – слабая реакция, (++) – умеренная реакция, (+++) – выраженная реакция. Морфометрический анализ проводился на микроскопе Nicon Eclipse E200 с цифровой камерой Nicon DS-Fil, персональном компьютере с установленным программным обеспечением NIS-Elements F 3.2.
Результаты исследования и их обсуждение
Макроскопически щитовидная железа при аутоиммунном тиреоидите нередко кремового цвета, плотная, бугристая, неравномерно дольчатая, зачастую спаяна с окружающими тканями, режется с трудом. Поверхность разреза беловато-желтая, непрозрачная, множество белесоватых втянутых тяжей разделяет ткань на мелкие неравные дольки, выступающие над поверхностью. Масса щитовидной железы варьировала от 15 до 38 грамм.
При очаговом тиреоидите щитовидная железа имела кремовый цвет, дольчатое строение, эластическую консистенцию, не спаянную с окружающими тканями, масса щитовидной железы варьировала от 23 до 29 грамм.
При гистологическом исследовании щитовидных желез с аутоиммунным тиреоидитом было выявлена различная степень выраженности инфильтрации. В 18 случаях площадь лимфоплазмоцитарной инфильтрации занимала 20 до 40 %, при этом инфильтрат образовывал лимфоидные фолликулы без четких границ и центров размножения. От 40 до 60 % в 41 случае в инфильтрате определялись крупные фолликулы с центрами размножения в них. В тканях щитовидных желез, содержащих более 60 % лимфоплазмоцитарной инфильтрации (13 случаев), помимо крупных фолликулов с центрами размножения, наблюдался более выраженный фиброз стромы.
Лимфоплазмоцитарные инфильтраты располагались как в строме, так и в паренхиме щитовидной железы. Вблизи инфильтратов определялась деструкция тиреоидного эпителия и более выраженная гиперплазия В-клеток. В двух случах (3 %) железы среди лимфоплазмоцитарной инфильтрации наблюдались отдельные участки эпидермоидной метаплазии фолликулярного эпителия.
При иммуногистохимическом исследовании определялась слабая (+) или умерено выраженная экспрессия (++) CD4 на Т-хелперах. Количество иммунопозитивных клеток лимфоидного инфильтрата варьировало от 8 до 15 % в одном поле зрения. При окраске CD8 во всех случаях выявлялась их выраженная экспрессия на Т-хелперах (+++), а количество иммунопозитивных клеток в инфильтрате варьировало от 31 до 47 %. CD19 экспрессировалась в цитоплазме B-лимфоцитов, при этом отмечалась выраженная (+++) степень экспрессии, а количество иммунопозитивных клеток в инфильтрате варьировало от 38 до 53 %.
При гистологическом исследовании материала с наличием очагового тиреоидита участки лимфоидной инфильтрации определялись преимущественно в строме щитовидной железы. При этом ни в одном из 54 случаев скопления лимфоидной ткани не образовывали фолликулов с центрами размножения. Во всех случаях площадь, занимаемая инфильтратом, не превышала 10 %. При иммуногистохимическом исследовании выявлена в равной степени выраженная (+++) экспрессия CD4 на Т-хелперах и CD8 на Т-супрессорах. При подсчете СD4 иммунопозитивных клеток выявлено от 35 до 57 % клеток в поле зрения. Количество CD8 иммунопозитивных клеток варьировало от 44 до 56 %. Отмечалось отсутствие экспрессии либо слабая (+) экспрессия CD19 на B-лимфоцитах, соответственно количество иммунопозитивных клеток инфильтрата от 0 до 5 % в поле зрения. Среди лимфоплазмоцитарной инфильтрации при очаговом тиреоидите участки эпидермоидной метаплазии тиреоидного эпителия не наблюдались.
Выводы
Лимфоплазмоцитарная инфильтрация при аутоиммунном тиреоидите занимает значительную площадь тиреоидного эпителия, располагается как в строме, так и в паренхиме ткани щитовидной железы. Лимфоидный инфильтрат включает в себя в равной степени В и Т-лимфоциты, однако среди Т-лимфоцитов отмечается увеличение количества Т-хелперов над Т-супрессорами.
В отличие от аутоиммунного тиреоидита, очаговый тиреоидит имеет следующие особенности.
Исходя из вышеуказанных оссобенностей нет оснований рассматривать очаговый тиреоидит как раннюю стадию аутоиммунного тиреоидита.
Рецензенты:
Коробкеев А.А., д.м.н., профессор, заведующий кафедрой нормальной анатомии, ГБОУ ВПО «Ставропольский государственный медицинский университет» Министерства здравоохранения РФ, г. Ставрополь;
Чуков С.З., д.м.н., профессор кафедры патологической анатомии, ГБОУ ВПО «Ставропольский государственный медицинский университет» Министерства здравоохранения РФ, г. Ставрополь.
Диагностика и лечение первичных Т-клеточных лимфом кожи
Первичные Т-клеточные кожные лимфомы представляют собой гетерогенную группу лимфопролиферативных заболеваний, характеризующуюся клональной пролиферацией Т-лимфоцитов в коже. Они составляют 75–80 % всех кожных лимфом. Разграничение первичных лимфом кожи и
Первичные Т-клеточные кожные лимфомы представляют собой гетерогенную группу лимфопролиферативных заболеваний, характеризующуюся клональной пролиферацией Т-лимфоцитов в коже. Они составляют 75–80 % всех кожных лимфом. Разграничение первичных лимфом кожи и вторичных ее поражений при других лимфомах требует тщательного анализа клинической картины, патологических, иммунологических и молекулярно-генетических данных. Первичные лимфомы кожи отличаются от нодальных лимфом характером течения, прогнозом и подходами терапии. Это обстоятельство вызвало необходимость создания подробной классификации, отражающей весь спектр первичных кожных лимфом. В 2005 г. на основе классификации ВОЗ для опухолей гемопоэтической и лимфоидной тканей [1] и классификации лимфом кожи Европейской организации по исследованию и лечению рака (EORTC) [2] создана ВОЗ/EORTC-классификация кожных лимфом, наиболее полно охватывающая весь спектр этих заболеваний [3].
Т- и NK-клеточные лимфомы кожи
— синдром гранулематозной вялой кожи.
— первичная анапластическая крупноклеточная лимфома кожи;
Самыми распространенными подтипами являются: ГМ, синдром Сезари, первичная анапластическая крупноклеточная лимфома кожи и лимфоматоидный папулез. Они составляют приблизительно 95 % всех Т-клеточных кожных лимфом.
ГМ — первичная эпидермотропная Т-клеточная лимфома кожи, отличительной чертой которой является пролиферация Т-лимфоцитов малых и средних размеров с церебриформными ядрами. Термин «грибовидный микоз» в настоящее время принято использовать только для классического варианта микоза Алибера–Базена, характеризующегося поэтапной эволюцией пятен, бляшек и узлов, или для вариантов со схожим клиническим течением.
Это наиболее часто встречающаяся Т-клеточная опухоль кожи, составляющая 1 % всех неходжкинских лимфом и 50% Т-клеточных кожных лимфом. Средний возраст заболевших — 57 лет, соотношение мужчин и женщин — 2 : 1 [4]. ГМ, особенно на ранних стадиях, может протекать «под маской» различных доброкачественных кожных процессов, таких как хроническая экзема, аллергический контактный дерматит или псориаз. Для начальных кожных проявлений характерна локализация на ягодицах и других защищенных от солнца областях. Заболевание обычно течет благоприятно, медленно прогрессируя в течение нескольких лет или даже десятилетий. Кожные морфологические элементы постепенно эволюционируют от пятен или бляшек до опухолевых узлов с признаками изъязвления. На поздних стадиях заболевания в патологический процесс могут вовлекаться лимфатические узлы и внутренние органы.
Гистологическая картина на ранних стадиях ГМ неспецифична и может быть схожа с таковой при доброкачественном воспалительном дерматозе: отмечаются периваскулярные инфильтраты в сочетании с псориазоформной гиперплазией эпидермиса [5]. Для бляшечной стадии характерен плотный полосовидный инфильтрат в верхней части дермы, содержащий высокий процент церебриформных лимфоцитов с выраженным эпидермотропизмом. Внутриэпидермальные скопления атипичных лимфоцитов (микроабсцессы Потрие) являются характерной чертой этой стадии, но встречаются лишь в 10 % случаев [6]. С прогрессированием в опухолевую стадию эпидермотропизм исчезает, а инфильтрат, состоящий из церебриформных лимфоцитов малых, средних и крупных размеров, становится диффузным и может проникать в подкожную жировую клетчатку.
Прогноз при ГМ напрямую зависит от стадии заболевания, характера и распространенности кожного процесса, а также наличия внекожных поражений.
 |
| Таблица 1. TNMB классификация грибовидного микоза |
В 1978 г. Национальным институтом рака США была предложена TNMB (tumor, node, metastasis, blood) — классификация кожных Т-клеточных лимфом, которая применима для определения стадий ГМ (табл. 1, 2) [8]. Данные о пятилетней выживаемости при грибовидном микозе/синдроме Сезари (ГМ/СС) в зависимости от стадии заболевания следующие: IA — 96 %, IB / IIA — 73 %, IIB / III — 44 %, IV — 27 %.
Кроме классической формы ГМ, имеется несколько вариантов этого заболевания с необычными клиническими и/или гистологическими характеристиками. Из них в классификации ВОЗ/EORTC выделены три клинико-патологических варианта: фолликулотропный ГМ, педжетоидный ретикулез и синдром гранулематозной «вялой» кожи [3].
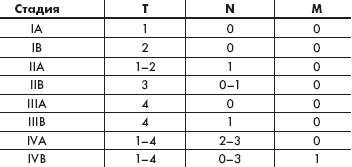 |
| Таблица 2. Стадии грибовидного микоза по классификации TNMB (США, 1978) |
Фолликулотропный ГМ характеризуется наличием фолликулотропного и часто неэпидермотропного инфильтрата. Клинически заболевание может проявляться фолликулярными папулами, бляшками и иногда опухолями, локализующимися чаще всего на голове и шее и сопровождающимися алопецией. Гистологически выявляется плотный периаднексальный (перифолликулярный) инфильтрат, состоящий из малых и средних лимфоидных клеток с церебриформными ядрами. Эпидермотропизм может отсутствовать. Волосяные фолликулы часто кистозно расширены, возможна муцинозная дегенерация фолликулярного эпителия.
Педжетоидный ретикулез (моноочаговая форма Ворингера–Колоппа) является благоприятно протекающей формой ГМ и характеризуется наличием одного очага в виде псориазоформной бляшки, локализующейся на нижних конечностях. Гистологическая картина характеризуется акантотическим эпидермисом, содержащим «спонгиоформный» инфильтрат из средних и крупных лимфоидных клеток с вакуолизированной цитоплазмой, расположенных поодиночке или скоплениями.
К одним из самых редко встречающихся вариантов ГМ относится синдром гранулематозной «вялой» кожи, характеризующийся клональной пролиферацией Т-лимфоцитов и дегенерацией эластических волокон в дерме. Заболевание клинически проявляется развитием в крупных складках своеобразных изменений кожи в виде появления складчатых, инфильтрированных и лишенных эластичности образований. Гистологическая картина характеризуется наличием плотного диффузного инфильтрата, состоящего из малых и средних лимфоидных клеток без выраженной атипии ядер, и отсутствием эластических волокон в сосочковой и сетчатой частях дермы. Специфическим гистологическим признаком данного заболевания считается наличие в инфильтрате многоядерных гигантских клеток, имеющих от 20 до 30 концентрически расположенных ядер. В их цитоплазме могут находиться лимфоциты, а также остатки эластических волокон.
Синдром Сезари характеризуется триадой признаков: эритродермия, лимфаденопатия и наличие опухолевых Т-лимфоцитов (клеток Сезари) в коже и периферической крови [9].
Гистологические изменения при синдроме Сезари сходны с таковыми при ГМ, однако эпидермотропизм может быть менее выражен.
Терапия ГМ/СС также зависит от стадии заболевания. На ранних стадиях, при локальных изменениях кожи, эффективна РUVA-терапия, которая позволяет получить полную ремиссию в подавляющем большинстве случаев [11–13]. При I и II стадиях PUVA-терапия может быть использована в комбинации с интерфероном α [14–16]. Применение агрессивных методов лечения (химио- и лучевая терапия) на ранних стадиях не меняет прогноз и, следовательно, неоправдано [17]. При распространенном поражении локальная лучевая терапия, тотальное облучение кожи (ТОК), экстракорпоральный фотоферез позволяют контролировать течение болезни, но имеют ограниченную доступность [18–21]. Когда заболевание становится резистентным к указанным методам лечения, используется комбинированная химиотерапия, однако вне зависимости от ее варианта продолжительность эффекта обычно не превышает 1 года [22–26]. В последнее время в лечении ГМ/СС все большее распространение получает применение биологических препаратов, механизм действия которых основан на специфическом связывании с различными антигенами на мембране опухолевых клеток. К ним относятся интегрированный протеин — Ontak и анти-CD52-моноклональное антитело — алемтузумаб (Кэмпас). Ontak является конъюгатом токсина дифтерии с интерлейкином-2, который после связывания с рецептором к интерлейкину-2 (СD25) подвергается эндоцитозу с последующим высвобождением внутри клетки дифтерийного токсина. Результатом этого процесса является нарушение синтеза белка и в конечном итоге апоптоз Т-лимфоцитов [27]. Кэмпас представляет собой гуманизированное IgG1-моноклональное антитело, специфически связывающееся с CD52-антигеном. Эффекторный механизм Кэмпаса изучен не до конца, он, вероятно, основан на антителозависимой клеточной цитотоксичности [28, 29], комплемент-обусловленном клеточном лизисе [30, 31] и апоптозе [32]. Опухолевые Т-лимфоциты экспрессируют на своей поверхности большое количество молекул CD52 (около 500 000 молекул на лимфоцит), и интенсивность экспрессии CD52 напрямую коррелирует с клиническим эффектом [33, 34]. Основанием для использования Кэмпаса при ГМ является его успешное применение при других Т-клеточных опухолях, например, при Т-клеточном пролимфоцитарном лейкозе [35]. По данным одного из наиболее крупных исследований по использованию Кэмпаса в терапии ГМ/СС, в которое было включено 22 больных со II–IV стадиями заболевания, ранее получавших другие виды лечения, общий ответ на терапию составил 55 %, полная ремиссия достигнута в 32 % случаев. Если предшествующее лечение включало в себя не более двух режимов терапии, общий ответ составлял 80 %. Медиана выживаемости без прогрессии для 12 больных, ответивших на лечение, составила 12 мес [36]. Клиническая картина до и после терапии ГМ препаратом Кэмпас представлена на рис. 1–4.
 |
| Рис. 1. Разрушение зоны эпидермально-дермального стыка. Распространение инфильтрата в эпидермис с образованием абсцессов Потрие. Рис. 2. Единичные лимфоидные клетки среди эпителиоцитов базального слоя эпидермиса (после терапии алемтузумабом) |
Первичная анапластическая лимфома кожи чаще развивается у лиц мужского пола, в основном в возрасте старше 60 лет. Клинически определяются обычно один или несколько узлов (в том числе подкожных), имеющих тенденцию к изъязвлению. Наиболее частая локализация высыпаний — верхние и нижние конечности. Гистологическая картина представлена диффузными инфильтратами в дерме и подкожно-жировой клетчатке, состоящими из клеток с анапластической или иммунобластной морфологией. Эпидермотропизм не характерен. Опухолевые клетки экспрессируют CD30, а также один или несколько пан-Т-клеточных антигенов (CD2, CD3, CD4, CD5). Экспрессия антигена эпителиальных мембран (EMA) и ALK-протеина обнаруживается крайне редко, что отличает первичную кожную анапластическую лимфому от нодальной анапластической лимфомы с поражением кожи [37].
Первичная анапластическая лимфома кожи имеет, как правило, доброкачественное течение. Пятилетняя выживаемость составляет около 90 %. Лучевая терапия или хирургическое удаление применяются в случае единичных очагов. У больных с множественными высыпаниями проводится лечение малыми дозами метотрексата (5–20 мг в неделю) или лучевая терапия. Только быстропрогрессирующее течение заболевания с внекожным распространением требует назначения полихимиотерапии.
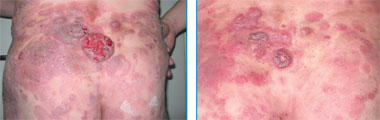 |
| Рис. 3. Множественные пятна, бляшки и опухолевые образования с элементами изъязвления на коже (до начала лечения). Рис. 4. Вид после терапии алемтузумабом |
Тип А характеризуется кожным инфильтратом состоящим из крупных атипичных клеток, напоминающих клетки Рида–Штернберга.
Тип В гистологически напоминает картину ГМ. Анапластические клетки встречаются в малом количестве или отсутствуют.
Тип С характеризуется мономорфным инфильтратом или наличием крупных кластеров CD30 + Т-лимфоцитов. Наиболее эффективным методом лечения является назначение малых доз метотрексата, особенно в случае распространенных высыпаний и частых обострений [3].
Таким образом, диагностика и лечение первичных Т-клеточных кожных лимфом требуют учета многих факторов и использования широкого спектра современных методов обследования (гистологических, иммунологических, молекулярно-генетических), позволяющих правильно определить прогноз и оптимизировать терапию.
По вопросам литературы обращайтесь в редакцию.
В. А. Доронин
ЦКБ № 2 им. Н. А. Семашко, Москва