Лимфоплазмоцитарная инфильтрация желудка выраженная что это
Лимфома желудка
Лимфома желудка – редкая, потенциально злокачественная или злокачественная опухоль, происходящая из лимфоидной ткани, расположенной в стенке желудка. Метастазирование наблюдается редко. Лимфома желудка проявляется преждевременным насыщением, болями в эпигастральной области, тошнотой, рвотой, нарушениями аппетита, снижением массы тела и повышением температуры. Диагностируется на основании истории болезни, клинических симптомов, данных осмотра, рентгенографии, КТ, МРТ, гастроскопии, биопсии, анализов крови на маркеры рака и других исследований. Лечение – антихеликобактерная терапия, резекция желудка или гастрэктомия, химиотерапия, диетотерапия.
Общие сведения
Лимфома желудка – злокачественное нелейкемическое новообразование, происходящее из лимфоидных клеток в стенке органа. Обычно отличается относительно благоприятным течением, медленным ростом и редким метастазированием, однако степень злокачественности опухоли может различаться. Чаще располагается в дистальной части желудка. Не связана с поражением периферических лимфоузлов и костного мозга. Лимфомы желудка составляют от 1 до 5% от общего количества неоплазий данного органа. Обычно развиваются в возрасте старше 50 лет. Мужчины страдают чаще женщин. На начальных стадиях прогноз благоприятный. Средняя пятилетняя выживаемость при лимфомах желудка всех стадий колеблется от 34 до 50%. Лечение проводят специалисты в области онкологии, гастроэнтерологии и абдоминальной хирургии.
Причины лимфомы желудка
Предшественницей данного новообразования является лимфоидная ткань, расположенная в слизистой оболочке в виде отдельных лимфоцитов и скоплений клеток. При определенных условиях (например, при хроническом гастрите, возникшем на фоне инфицирования Helicobacter pylori) такие скопления образуют лимфоидные фолликулы, в которых могут возникать участки атипии. С учетом того, что у 95% пациентов с лимфомой желудка при проведении обследования обнаруживаются различные штаммы Helicobacter pylori, эта инфекция рассматривается, как одна из основных причин возникновения данной патологии.
Наряду с Helicobacter pylori, развитие различных типов лимфом желудка может провоцироваться другими факторами, в том числе – контактом с канцерогенными веществами, длительным пребыванием в зонах с повышенным уровнем радиации, предшествующей лучевой терапией, приемом некоторых лекарственных препаратов, избытком ультрафиолетового излучения, неспецифическим снижением иммунитета, иммунными нарушениями при СПИДе, аутоиммунными заболеваниями и искусственным подавлением иммунитета после операций по трансплантации органов.
Классификация лимфом желудка
С учетом происхождения и особенностей клинического течения различают следующие виды лимфом желудка:
С учетом особенностей роста выделяют следующие разновидности лимфом желудка:
С учетом глубины поражения, определяемой при проведении эндоскопического УЗИ, различают следующие стадии лимфом желудка:
Наряду с приведенной выше классификацией для определения распространенности лимфомы желудка используют стандартную четырехстадийную классификацию онкологических заболеваний.
Симптомы лимфомы желудка
Специфические признаки отсутствуют, по своим клиническим проявлениям лимфома желудка может напоминать рак желудка, реже – язвенную болезнь желудка или хронический гастрит. Наиболее распространенным симптомом является боль в области эпигастрия, нередко усиливающаяся после приема пищи. Многие больные лимфомой желудка отмечают ощущение преждевременного насыщения. У некоторых пациентов развивается отвращение к определенным видам пищи. Характерно похудание, обусловленное чувством переполнения желудка и снижением аппетита. Возможно критическое снижение массы тела вплоть до кахексии.
При лимфоме желудка часто наблюдаются тошнота и рвота, особенно – на фоне употребления излишнего количества пищи, что еще больше способствует сокращению порций, отказу от еды и последующему снижению веса. При распространении онкологического процесса может развиваться стеноз желудка. В отдельных случаях у больных лимфомой желудка возникают кровотечения различной степени выраженности (в том числе – небольшие, с примесью крови в рвотных массах). Существует опасность развития тяжелых осложнений – перфорации стенки желудка при ее прорастании опухолью и профузного кровотечения при расположении лимфомы желудка вблизи крупного сосуда. Наряду с перечисленными симптомами отмечаются повышение температуры тела и обильное потоотделение, особенно в ночное время.
Диагностика лимфомы желудка
Диагноз устанавливается с учетом жалоб, истории заболевания, внешнего осмотра, пальпации живота, лабораторных и инструментальных исследований. Из-за неспецифичности симптоматики возможно позднее выявление лимфомы желудка, в литературе описаны случаи, когда временной период между появлением болей в эпигастрии и постановкой диагноза составлял около 3 лет. Основным способом инструментальной диагностики является гастроскопия, позволяющая определить расположение и тип роста опухоли. При проведении эндоскопического исследования лимфому желудка может быть трудно дифференцировать с раком, гастритом и немалигнизированной язвой.
Для уточнения диагноза эндоскопист осуществляет забор материала для последующего гистологического и цитологического исследования. Отличительной особенностью взятия эндоскопической биопсии при лимфомах желудка является необходимость забора ткани с нескольких участков (множественная или петлевая биопсия). Для определения распространенности онкологического процесса осуществляют эндоскопическое УЗИ и КТ брюшной полости. Для выявления метастазов назначают МРТ грудной клетки и МРТ брюшной полости. Несмотря на диагностические затруднения, из-за медленного роста большинство лимфом желудка выявляются на первой или второй стадии, что увеличивает вероятность благополучного исхода при данной патологии.
Лечение лимфомы желудка
При локализованных, благоприятно протекающих MALT-лимфомах осуществляют эррадикационную антихеликобактерную терапию. Допустимо использование любых схем лечения с доказанной эффективностью. При отсутствии результата после применения одной из стандартных схем больным лимфомой желудка назначают усложненную трехкомпонентную или четырехкомпонентную терапию, включающую в себя введение ингибиторов протонного насоса и нескольких антибактериальных средств (метронидазола, тетрациклина, амоксициллина, кларитромицина и т. д.). При неэффективности усложненных схем в зависимости от стадии лимфомы желудка проводят химиотерапию или системную терапию.
При других формах лимфомы желудка и MALT-лимфомах, распространяющихся за пределы подслизистого слоя, показано хирургическое вмешательство. В зависимости от распространенности процесса осуществляют резекцию желудка или гастрэктомию. В послеоперационном периоде всем пациентам с лимфомой желудка назначают химиопрепараты. В запущенных случаях применяют химиотерапию или лучевую терапию. Химиотерапия может провоцировать изъязвление и перфорацию стенки желудка (в том числе – бессимптомную), поэтому при использовании данной методики регулярно проводят КТ для выявления свободных жидкости и газа в брюшной полости. На поздних этапах лимфомы желудка существует угроза развития стеноза желудка, перфорации желудка или желудочного кровотечения, поэтому операции рекомендуется проводить даже при опухолях III и IV стадии.
Благодаря медленному росту, поздней инвазии в глубокие слои стенки желудка и достаточно редкому метастазированию прогноз при лимфомах желудка относительно благоприятный. Применение эррадикационной терапии на ранних стадиях MALT-лимфом обеспечивает полную ремиссию у 81% больных и частичную – у 9% больных. Радикальные хирургические вмешательства возможны в 75% случаев. Средняя пятилетняя выживаемость при лимфоме желудка I стадии составляет 95%. На II стадии этот показатель снижается до 78%, на IV – до 25%.
Особенности эндоскопической семиотики и антихеликобактерная терапия MALT-лимфом желудка
Лимфомы гастроинтестинального тракта охватывают от 14% до 27% всех экстранодальных поражений и составляют от 1% до 15% всех злокачественных опухолей желудочно-кишечного тракта. Чаще всего поражается желудок (50–75%), сравнительно реже тонкая кишка (20–35%
Лимфомы гастроинтестинального тракта охватывают от 14% до 27% всех экстранодальных поражений и составляют от 1% до 15% всех злокачественных опухолей желудочно-кишечного тракта. Чаще всего поражается желудок (50–75%), сравнительно реже тонкая кишка (20–35%). Лимфомы толстой кишки наблюдаются в 5–10% случаев. Самыми редкими признаны первичные неходжкинские лимфомы пищевода [1].
В 1983 году Brooks и Enterline [2] провели клинико-морфологическое исследование, где показали, что нодальные и экстранодальные лимфомы отличаются по биологическим свойствам и что экстранодальные варианты лимфомы имеют более благоприятный прогноз.
Brooks и Enterline впервые отметили патогенетическую связь между хроническим воспалением слизистой оболочки желудка и развитием лимфомы. Было высказано предположение, что многие типы лимфом желудка представляют собой злокачественную трансформацию доброкачественных и длительно текущих лимфоцитарных поражений желудка. Авторы пришли к тому заключению, что длительная антигенная стимуляция вместе с аутоиммунным феноменом в клетках слизистой оболочки желудка в целом приводят к появлению злокачественного клона. Эта гипотеза была подтверждена результатами клинико-морфологических исследований, проведенных при лимфомах слюнной и щитовидной желез. Было показано, что лимфомы этих желез могут возникнуть на фоне хронического тиреоидита и сиалоаденита с синдромом Шегрена или без него.
P. Isaacson и D. H. Wright [3] обратили внимание на то, что большая часть первичных лимфом желудка развивается на фоне хронических гастритов. Более того, было показано, что другие варианты экстранодальных лимфом также связаны с хроническими воспалительными процессами. Доказано, что Нelicobacter pylori — грамотрицательная спиралевидная бактерия, впервые выделенная из гастробиоптата австралийскими исследователями Warren и Marschall в 1983 году, является причиной подавляющего большинства случаев хронических гастритов. Она приводит к возникновению язвенной болезни желудка, 12-перстной кишки, является одним из факторов риска аденокарциномы желудка.
Показано, что при эрадикации этого микроорганизма симптомы хронического воспаления становятся менее интенсивными и снижается степень лимфоцитарной инфильтрации. В 1993 году были представлены доказательства, что Н. pylori играет важную роль в возникновении подгруппы лимфом желудка MALT-типа [4]. Рядом авторов [5] было высказано мнение, что Н. pylori вызывает нарушение физиологических и иммунологических процессов, окислительное повреждение ДНК и пролиферацию как гемапоэтических, так и клеток слизистой оболочки желудка. В дальнейшем было установлено, что 90% больных MALT-лимфомой инфицированы Н. pylori [6, 7, 8]. Было показано также, что Н. pylori непосредственно и посредством цитотокина вызывает пролиферацию Т-клеток и макрофагов, что сопряжено с высвобождением цитокинов (интерлейкина-2 и интерлейкина-6). Последние, в свою очередь, вызывают пролиферацию В-клеток, способствуют развитию лимфоидных фолликулов и агрегатов лимфоцитов в толще слизистой оболочки желудка [9].
Материалы и методы исследования
Эндоскопическая картина лимфом желудка изучена нами у 250 пациентов, при этом поражение у 160 (64%) больных расценено как первичное, а у 90 (36%) — как вторичное, наблюдаемых в РОНЦ с 1995 года, из которых было 99 пациентов с MALT-лимфомой желудка. Разработаны эндоскопические и эндосонографические критерии диагноза MALT-лимфомы, ее дифференциально-диагностические признаки, проведена оценка лекарственной терапии.
Результаты и их обсуждение
При тщательном анализе развития болезни нами установлено, что в группе с первичными лимфомами желудка практически одна треть (32%) пациентов имели гастроэнтерологический анамнез: язвенную болезнь желудка, хронический атрофический, гипертрофический или смешанные гастриты, зачастую ассоциированные с инфекцией H. pylori.
Согласно нашим наблюдениям длительность существования гастроэнтерологической патологии до установления наличия опухоли в группе с первичной лимфомой желудка весьма вариабельна: в течение первых трех месяцев диагноз установлен у 30,6% (49 больных), в течение 6 месяцев у 18,1% (29 больных), в срок от 6 до 12 месяцев у 15,6% (25 больных). Отдельно следует отметить, что практически у трети пациентов (27,5% — 44 пациента) диагноз первичной лимфомы желудка был установлен спустя год (табл. 1).
Также отдельно необходимо отметить, что диагноз первичной лимфомы желудка у 8% пациентов выявлен при плановом обследовании по поводу сопутствующей патологии и оказался диагностической находкой, так как заболевание у части больных протекало бессимптомно.
В группе пациентов со вторичным поражением желудка от момента установления диагноза первичной локализации процесса до времени выявления поражения желудка сроки были различны и представлены в табл. 2.
Как видно из представленных в таблице данных, поражение желудка в большинстве случаев развилось в первые два года от начала заболевания, что диктует нам необходимость обязательных периодических эндоскопических исследований желудка с целью своевременного выявления метастатического поражения его при лимфомах.
В нашей работе чаще всего при лимфомах желудка имело место инфильтративно-язвенное и инфильтративное его поражение — 28,4% и 21,6% соответственно, затем в 14,8% встречается язвенная форма роста опухоли. Гастритоподобный вариант опухоли отмечен в 14,4%. Реже встречались смешанная и экзофитная формы роста опухоли — 12,0% и 8,8% соответственно.
Причем, как показывает анализ наших данных, при MALT-лимфоме преобладала гастритоподобная форма роста, которая составила 34,3%.
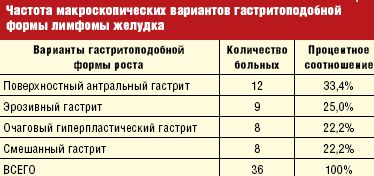
Эндоскопическая картина гастритоподобной формы лимфомы желудка является наиболее вариабельной и по преобладанию макроскопических признаков может проявляться в виде:
Естественно, такое деление является относительно условным, и эти формы выделяются нами по преобладанию наиболее выраженных указанных признаков, симулирующих ту или иную форму гастрита (табл. 3).
Анализируя полученные данные, чаще всего, в 33,4%, отмечался поверхностный антральный гастрит, вторым по частоте стал эрозивный гастрит — 25,0%, с одинаковой частотой в 22,2% встречается очаговый гиперпластический гастрит и смешанный гастрит.
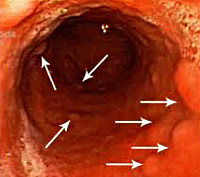
При гастритоподобной форме лимфомы желудка в виде антрального гастрита, как следует из самого определения, визуальные проявления опухоли симулируют воспалительные изменения в антральном отделе желудка, которые отмечены нами в 33,4%. При сохраненной эластичности стенок желудка отмечается пастозность, разрыхленность и очаговая гиперемия слизистой антрального отдела желудка, чередующаяся с участками белесоватого цвета, ее повышенная контактная кровоточивость. Как и при других вариантах, характерным является появление стекловидного блеска. При проведении биопсии подвижность и эластичность слизистой оболочки снижена, отмечается ее фрагментация.
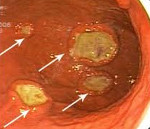
Изменения при лимфоме желудка в виде эрозивного гастрита отмечаются в 25,0% случаев и характеризуются наличием множественных поверхностный острых эрозий неправильной или щелевидной формы на фоне пастозной, неравномерно гиперемированной слизистой с усиленным сосудистым рисунком. Участки эрозий могут локализоваться в различных отделах желудка, чередуясь с неизмененной слизистой, либо занимать изолированную, ограниченную зону. Эластичность стенок остается, как правило, сохраненной или снижена незначительно.
Лимфома желудка в виде локального гиперпластического гастрита. Этот тип лимфомы отмечается в 22,2% случаев и характеризуется умеренным неравномерным утолщением складок на ограниченном участке чаще по большой кривизне и в проксимальном отделе желудка иногда с переходом на переднюю или заднюю стенки. Эластичность стенки сохранена, подвижность складок может быть сохраненной или сниженной. Поверхность складок покрыта вязкой стекловидной слизью, разрыхлена. При инсуффляции складки слизистой пораженного участка, как правило, не расправляются полностью.
В нашем исследовании инфицирование H. pylori было выявлено практически у всех больных при мелкоклеточном варианте и составило 96,7%, при промежуточном варианте MALT-лимфомы желудка — 90%, в отличие от смешанно-клеточных MALT-лимфом, при которых частота инфицирования составила только 53,8%.
При выявлении инфицирования H. pylori мы также определяли степень обсемененности. Оказалось, что при мелкоклеточных MALT-лимфомах высокая частота инфицирования сочетается с выраженной степенью обсемененности чаще (75,9%), чем при других подвариантах. Так, у больных с промежуточным вариантом наличие H. pylori-инфекции сопровождается выраженной степенью обсемененности достоверно реже и выявлено в 38,9%, при смешанных MALT-лифмомах выраженная степень обсемененности установлена у 57,1% пациентов.
Умеренная степень обсемененности при мелкоклеточных опухолях выявлена у 20,7%, при промежуточном варианте чаще — у 61,1%, а при смешанной MALT-лимфоме — у 14,3%.
Слабая степень обсемененности H. pylori встречается у больных MALT-лимфомой желудка крайне редко, она была определена лишь у трех пациентов.
Терапия больных первичной MALT-лимфомой представляет ряд особенностей. Это обусловлено тем, что в мировой практике накоплен относительно небольшой опыт использования всех видов лечебного воздействия — антихеликобактерной терапии, химиотерапии, лучевой терапии, хирургического лечения и их сочетаний.
Антихеликобактерная терапия использовалась нами только при I стадии (классификация Lugano, 1993) MALT-лимфомы желудка мелкоклеточного строения. Лечение проводилось в соответствии с рекомендациями Международного протокола LY03 по изучению MALT-лимфом желудка низкой степени злокачественности [10]. Нами применялась трехкомпонентная схема первой линии эрадикационной терапии, включающая одновременное применение в течение 10–14 дней следующих препаратов:
В результате проведенного лечения у 14 пациентов (87,5%) из 16 больных была достигнута полная ремиссия, у 2 больных (12,5%) констатирована стабилизация заболевания.
Терапевтический эффект антибиотикотерапии реализовался постепенно. Нами установлена последовательность исчезновения проявлений болезни. Первыми ликвидировались клинические симптомы: боль, изжога, тошнота, желудочный дискомфорт.
Вслед за эрадикацией H. pylori постепенно уменьшались визуальные эндоскопические проявления опухолевого поражения: сокращались размеры опухолевого поражения, подслизистой инфильтрации, уменьшался калибр складок слизистой, происходило рубцевание специфических язвенных дефектов, затем восстанавливалась нормальная архитектоника слизистой, исчезала деформация стенок желудка.
Необходимо акцентировать внимание на том, что сроки наступления полного терапевтического эффекта весьма вариабельны. Полная ремиссия, подтвержденная гистологическим и иммунологическим исследованием гастробиоптатов, была диагностирована у больных, получавших антихеликобактерное лечение, в сроки от 2 до 10 месяцев (медиана 5,5 месяцев).
Это означает, что лечение мелкоклеточных MALT-лимфом с применением антихеликобактерных препаратов — это терапия, осуществленная всего за 10–14 дней, но требующая в последующем взвешенного динамического наблюдения и корректной оценки происходящих изменений. Темп наступления полного клинического благополучия является косвенным признаком прогнозирования терапевтического эффекта.
Из 14 больных с подтвержденной полной ремиссией вследствие антихеликобактерной терапии только у одной больной в возрасте 51 год был констатирован рецидив заболевания при контрольном обследовании через 7 месяцев после окончания лечения без каких-либо клинических проявлений. Трактовка эндоскопической картины была сложной: осуществлялась дифференциальная диагностика между эрозивным гастритом и минимальными проявлениями лимфомы. Рецидив был подтвержден иммуноморфологическими исследованиями. В последующем больная получала последовательное лечение Лейкераном (хлорамбуцил), COP с эффектом, который расценен нами как стабилизация заболевания. Учитывая клиническое благополучие, а также наличие тяжелой сопутствующей патологии, было решено хирургическое лечение не применять, а больную оставить под динамическим наблюдением. В течение последующих 36 месяцев больной проводится регулярное обследование (каждые 4–5 месяцев). За этот период наблюдения прогрессирования заболевания не наступило по настоящее время.
Это наблюдение демонстрирует особое свойство мелкоклеточной MALT-лимфомы. Сочетание клинического благополучия с объективными данными стабилизации позволяет длительно наблюдать за больными на фоне проведения регулярного полноценного обследования.
Таким образом, антихеликобактерная терапия правомочна и эффективна при первичных MALT-лимфомах желудка, но при обязательном строгом соблюдении показаний к ее использованию — I стадия процесса с небольшим локализованным поражением слизистого и подслизистого слоев при H. pylori-позитивных опухолях. Обязательным является динамическое исследование опухолевого субстрата на наличие H. pylori, эрадикация которого необходима для реализации противоопухолевого эффекта. Отсутствие эрадикации H. pylori требует использования химиотерапии с повторными курсами антибиотикотерапии.
ХРОНИЧЕСКИЙ ГАСТРИТ
Какие классификации гастрита существуют в настоящее время? Каковы схемы лечения хронического гастрита? Понятие Термин «гастрит» обозначает воспаление слизистой оболочки. Подобным определением характеризуется острый гастрит. В то же время относитель
Какие классификации гастрита существуют в настоящее время?
Каковы схемы лечения хронического гастрита?
Понятие

В РФ статистических данных относительно распространенности хронического гастрита нет. В странах с развитой статистикой хронический гастрит фиксируется у 80—90% больных, причем атрофический гастрит встречается в 5% случаев — у лиц моложе 30 лет, в 30% случаев у лиц в возрасте от 31 до 50 лет и в 50—70% случаев — у лиц старше 50 лет.
Согласно выводам ленинградской школы гастроэнтерологов, этиологические факторы развития первичного (или собственного) хронического гастрита носят экзогенный характер (Helicobacter pylori (НР), желчные кислоты и лизолецитин в желудочном содержимом, погрешности в диете, курение и злоупотребление алкоголем, длительный нервно-психический стресс, продолжительный прием лекарственных средств, повреждающих слизистую оболочку, профессиональные вредности: металлическая и хлопковая пыль, пары концентрированных щелочей и кислот и т. д. (их около 30)) и эндогенный характер (наследственная предрасположенность, хронические инфекции, аутоимммунные заболевания, патология эндокринной системы, болезни обмена веществ, хроническая пищевая аллергия; хронические заболевания сердца, протекающие с декомпенсацией по большому кругу кровообращения и последующей тканевой гипоксией слизистой оболочки желудка и т. д. (их около 45)).
Патогенез хронического гастрита представлен бактериальными, иммунологическими и нейрогуморальными нарушениями, проявляющимися на уровне слизистой оболочки желудка в виде поверхностного и атрофического гастрита. Учитывая, что патогенез хронического гастрита для каждой формы и типа заболевания имеет свои особенности, необходимо рассмотреть классификацию хронического гастрита и в первую очередь остановиться на морфологической классификации. Согласно последней, выделяют острый, хронический, а также особые формы хронического гастрита.
Острый гастрит, как правило, является следствием острой инфекции и острого повреждения слизистой оболочки желудка химическими и токсическими факторами (концентрированными щелочами и кислотами, большими дозами алкоголя и т. д.). Эти формы гастрита нередко протекают с тяжелыми осложнениями, в связи с чем лечением острого гастрита занимаются не гастроэнтерологи, а инфекционисты, наркологи, хирурги.
К основным формам хронического гастрита относят поверхностный и атрофический. Впервые термины «поверхностный гастрит» и «атрофический гастрит» были предложены немецким хирургом R. Schindler в 1948 г. на основании данных эндоскопического исследования слизистой оболочки желудка. Эти термины получили всеобщее признание и использовались авторами всех классификаций хронического гастрита. Достоинством данной классификации является заложенный в ее основу важный принцип: сохранность или утрата нормальных желез, что имеет очевидное функциональное и прогностическое значение. В ряд классификаций включена и промежуточная (между поверхностным и атрофическим гастритом) форма гастрита, которую обозначают как поверхностный гастрит с начинающейся атрофией или гастрит с поражением желез без атрофии [1]. Однако последующие исследования показали, что от термина «гастрит с поражением желез без атрофии» все же следует отказаться, и подобные изменения желез следует считать атрофией. Поверхностный гастрит характеризуется дистрофическими (с уплощением апикальных отделов клеток, где содержатся секреторные гранулы с нейтральными мукополисахаридами, и их трансформацией из цилиндрической формы в кубическую) и дисрегенераторными изменениями клеток поверхностного эпителия, наличием воспалительной инфильтрации собственной пластинки слизистой оболочки. Для оценки степени выраженности воспаления слизистой оболочки желудка используют визуально-аналоговую шкалу [1]. В зависимости от степени распространенности дистрофически измененных клеток среди «нормальных» клеток поверхностного эпителия в поле зрения, а также глубины проникновения воспалительной инфильтрации в толщину слизистой оболочки выделяют слабо выраженный (первая стадия воспалительной активности), умеренно выраженный (вторая стадия воспалительной активности) и сильно выраженный (третья стадия воспалительной активности) поверхностные гастриты. При слабо, умеренно и сильно выраженном поверхностном гастрите дистрофически измененные клетки среди «нормальных» клеток поверхностного эпителия занимают разный процент в поле зрения слизистой оболочки; при этом воспалительная инфильтрация проникает в глубь собственной пластинки слизистой оболочки на уровне желудочковых ямок (слабо выраженная), на уровне верхних и средних отделов желез (умеренно выраженная) и до мышечной пластинки слизистой оболочки (сильно выраженная). Атрофический гастрит характеризуется дистрофическими и дисрегенераторными изменениями клеток поверхностного эпителия, сплошной воспалительной инфильтрацией слизистой оболочки желудка (как при сильно выраженном поверхностном гастрите) и уменьшением числа (атрофией) нормальных желез. В зависимости от уменьшения количества желез в собственной пластинке слизистой оболочки выделяют умеренную и выраженную степени атрофии (менее 50% поля зрения и более 50% поля зрения окуляра микроскопа). Клетки эпителия сохранившихся желез желудка подвергаются дисрегенераторным изменениям, например с появлением в эпителии фундальных желез среди главных и париетальных клеток — клеток, содержащих в секреторных гранулах нейтральные мукополисахариды (феномен «мукоидизации желез»), клеток-гибридов (клетка содержит признаки двух разных клеток), кишечных ферментов (щелочная фосфатаза и сукцинатдегидрогеназа). В 50% случаев атрофический гастрит сочетается с элементами «структурной перестройки» слизистой оболочки (кишечная метаплазия, пилорическая метаплазия фундальных желез, ворсинчатая метаплазия, панкреатическая метаплазия, дисплазия или неоплазия эпителия).
Элементы «структурной перестройки» есть результат «качественной» дисрегенерации недифференцированных клеток, при этом недифференцированные клетки эпителия желез относят к стволовым клеткам — родоначальникам всех прочих видов клеток поверхностного и железистого эпителия [1]. Среди них наиболее часто встречается кишечная метаплазия, впервые обнаруженная Купфером более 100 лет назад. Выделяют тонкокишечную (или полную), незрелую и зрелую толстокишечную метаплазию, при этом зафиксировано, что переход одного вида кишечной метаплазии в другой происходит в среднем через пять-шесть лет. Как известно, рак обычно обнаруживается в слизистой оболочке желудка и толстой кишки. В связи с этим зрелую толстокишечную метаплазию относят к предраковым изменениям, однако рак возникает не в метаплазированном эпителии, а на участках с дисплазией, которая часто обнаруживается в слизистой оболочке с толстокишечной метаплазией.
Пилорическая метаплазия фундальных желез внешне напоминает пилорические железы желудка. Однако имеется и различие — отсутствие шеечных отделов желез, высокая устойчивость к атрофии, G-клетки встречаются крайне редко, на порядок больше суммарного белка. Пилорическую метаплазию обнаруживают, как правило, при атрофическом гастрите на месте зажившей эрозии или язвы. Реснитчатая метаплазия — это скопления клеток поверхностного или железистого эпителия, имеющего длинные и тонкие реснички. Впервые она была описана профессором Шивасаки в 1986 г. Эту метаплазию часто обнаруживают на участках с кишечной метаплазией, однако ее связь с раком желудка не подтверждена.
В 1993 г. профессор C. Doglioni с соавт. впервые описал панкреатическую метаплазию слизистой оболочки желудка. Клетки панкреатической метаплазии похожи на ацинарные клетки поджелудочной железы. В подслизистом слое и мышечной оболочке желудка часто обнаруживают гетеротопическую ткань поджелудочной железы, которую обозначают как хористома. Хористома и панкреатическая метаплазия клеток поверхностного эпителия представляют собой разные структуры. Связи панкреатической метаплазии с опухолями желудка не установлено.
Истинным предраковым изменением слизистой оболочки желудка считается дисплазия эпителия, при этом выделяют три степени дисплазии [1]: слабую, умеренную и выраженную (или тяжелую). Наиболее опасной в плане трансформации в рак желудка считается тяжелая дисплазия эпителия. Слабая и умеренная дисплазии эпителия трудно отличимы от воспалительной дисплазии, обнаруживаемой в краях эрозий и язв (при воспалительной дисплазии, в отличие от истинной, в эпителии обнаруживаются многочисленные лейкоциты). При заживлении эрозий и язв воспалительная дисплазия исчезает, а истинная всегда остается. Проспективное мультицентровое изучение дисплазии [4] дало основание для объединения слабой и умеренной дисплазии в одну группу.
В классификации оставлены только две степени — слабая и тяжелая. При слабой дисплазии, выявленной у больных старше 60 лет на фоне выраженного гастрита, рекомендуется проведение повторных ЭГДС и биопсий каждые 6—12 месяцев [1]. Тактика ведения больных с тяжелой дисплазией определена в монографии Л. И. Аруина и соавт. [1]. При обнаружении тяжелой дисплазии больному необходимо в течение 10 дней повторить ЭГДС одним и тем же эндоскопистом со взятием множественных биопсий. При определении тяжелой дисплазии вновь рекомендовано каждые три месяца в течение года делать ЭГДС со взятием многочисленных биопсий. Если при одном из иследований в биопсиях тяжелой дисплазии не обнаружено, динамическое наблюдение с трехмесячным проведением ЭГДС в течение года тем не менее следует продолжить. Ибо известно, что тяжелая дисплазия эпителия трансформируется в рак in situ в сроки от трех месяцев до 20—30 лет [1]. Существует другая классификация дисплазий эпителия, в которой выделяют дисплазию низкой степени и дисплазию высокой степени [1]. Известно, что дисплазия — это истинная неоплазия, только без признаков инвазии.
В 2000 г. появилась новая классификация дисплазий слизистой оболочки желудка — согласованная Международная (Венская) классификация эпителиальных неоплазий пищеварительного тракта [2].
Атрофически-гиперпластический гастрит (согласно современной классификации — мультифокальный атрофический гастрит с очаговыми гиперплазиями) характеризуется сочетанием участков атрофии с участками гиперплазий, возникающих из недиференцированных клеток генеративной зоны желудка (ее локализация — дно желудочковых ямок и шейка желез). Очаговую гиперплазию слизистой оболочки желудка в настоящее время рассматривают как «раннюю» форму полипа (доброкачественная опухоль железистой природы). Общепринятой в настоящее время считают классификацию полипов желудка, предложенную Л. И. Аруином в 1981 г. [1]. Выделяют: 1. очаговую фовеолярную гиперплазию; 2. гиперплазиогенный (гиперпластический) полип; 3. высокодифференцированную аденому (промежуточная форма); 4. аденоматозный полип; 5. пролиферирующий аденоматозный полип (пограничное состояние); 6. прочие формы: эозинофильная гранулема, хористома (абберантная поджелудочная железа в желудке), фолликулярная гиперплазия и т. д. Эта классификация удобна тем, что позволяет выделить наиболее «ранние» формы полипа — очаговая гиперплазия — и разделить полипы по степени зрелости. Предраковым состоянием считаются аденоматозные полипы желудка, и на их долю приходится 4% от всех форм полипов.
Гипертрофический гастрит — утолщение слизистой оболочки желудка за счет клеточной гиперплазии собственной пластинки (интерстициальная форма), либо за счет гиперплазии желудочковых ямок и шейки желез (пролиферативная форма), либо же за счет гиперплазии самих желез (гландулярная форма). Крайней формой этого гастрита является гигантский гипертрофический гастрит (болезнь Менетрие, или «эксудативная гастропатия»).
Лимфоцитарный гастрит возникает на фоне аутоиммунного хронического гастрита тела желудка (или смешанного хронического пангастрита) и характеризуется многочисленными интраэпителиальными лимфоцитами, которые обнаруживаются среди клеток поверхностного эпителия (на 100 эпителиальных клеток фиксируется 30 и более лимфоцитов, в норме они не определяются). Патогенез этой формы гастрита до конца неясен. Полагают, что это особая иммунологическая реакция на НР, который в слизистой оболочке желудка не обнаруживается.
Гранулематозный гастрит характеризуется наличием мелких гранулем в собственной пластинке слизистой оболочки желудка на фоне поверхностного или атрофического гастрита. Чаще всего речь идет о болезни Крона, саркоидозе, болезни Вегенера желудочной локализации. Аналогичную картину могут дать паразиты или инородные тела желудка.
Эозинофильный гастрит возникает на фоне поверхностного или атрофического гастрита и характеризуется очаговыми и/или диффузными скоплениями эозинофилов в собственной пластинке слизистой оболочки желудка. Этот гастрит встречается, как правило, при аллергических заболеваниях и аллергозах. Нередко в качестве причинного фактора выступают пищевые аллергены или паразиты.
Инфекционный гастрит характеризуется очаговыми и/или диффузными скоплениями бактерий (гастроспириллы), вирусов (цитомегаловирусы), грибов (типа Candida) и моноцитарной реакцией на них в собственной пластинке слизистой оболочки желудка.
С 1968 г. отечественные гастроэнтерологи при постановке диагноза берут на вооружение клинико-морфологический подход, предполагающий выделение хронического гастрита с сохраненной, повышенной функцией желудка (в теле желудка — неизмененная слизистая оболочка, поверхностный гастрит), с умеренной или выраженной секреторной недостаточностью (в теле желудка — мультифокальный или очаговый, диффузный атрофический гастрит).
Зарубежные гастроэнтерологи используют топографическую классификацию хронического гастрита, впервые предложенную в 1972 г. группой австралийских исследователей во главе с профессорами R. C. Strickland и I. R. MacKay. Они предложили выделять хронический гастрит типа А (или «иммунологический») и хронический гастрит типа В (или «простой»). При хроническом гастрите типа А обнаружен очаговый или диффузный атрофический гастрит тела желудка, в антруме желудка — неизмененная слизистая оболочка или поверхностный гастрит. В то же время при хроническом гастрите типа В определяется очаговый или диффузный атрофический гастрит антрального отдела желудка с неизмененной слизистой оболочкой или поверхностным гастритом тела желудка. В 1975 г. профессор Гласс выделил хронический гастрит типа АВ, при котором очаговый или диффузный атрофический гастрит обнаруживался в антруме и в теле желудка. Немецкие исследователи M. Stolte и K. Heilmann в 1987 г. включили в классификацию новый тип гастрита — хронический гастрит типа С (или щелочной хронический рефлюкс-гастрит). Подобное деление ознаменовало собой начало нового принципиально важного этапа не только в классификации, но и в изучении патогенеза хронического гастрита.
В 1990 г. на 9-м Международном конгрессе гастроэнтерологов была представлена классификация гастритов, получившая название Сиднеевской. Морфологическая ее часть состояла из трех разделов: этиологического (префикс), топографического (корень) и гистологического (суффикс). Благодаря синтезу этиологии, топографии и гистологических характеристик, классификация не только содержала достаточно полное описание гастрита, но и приближала диагноз к нозологическому. Из Сиднеевской классификации были исключены ранее широко распространенные термины, такие, как поверхностный и атрофический гастрит, а также буквенные обозначения гастритов (А, В, АВ и С). Вместо терминов «поверхностный гастрит» и «атрофический гастрит» появились их морфологические элементы (воспаление, активность, атрофия, кишечная метаплазия, Helicobacter pylori) с оценкой степени тяжести (отсутствует, легкая, умеренная и тяжелая), а также морфологические элементы без оценки степени тяжести (неспецифические — отек, гемморрагии, эрозии, фиброз, уплощение клеток эпителия и специфические — гранулемы, радиационное поражение и т. д.). В соответствии с этиологией были выделены аутоиммунный хронический гастрит тела желудка (вместо хронического гастрита типа А), Helicobacter pylori, ассоциированный хронический гастрит антрума желудка (вместо хронического гастрита типа В), смешанный хронический пангастрит (вместо хронического гастрита типа АВ) и химико-токсикоиндуцированный хронический рефлюкс-гастрит (вместо хронического гастрита типа С). Были расширены понятия, касающиеся особых форм хронического гастрита: лимфоцитарный, гранулематозный, коллагеновый, эозинофильный, инфекционный (помимо Helicobacter pylori, ассоциированного).
Для оценки Сиднеевской классификации в конце 1994 г. в Хьюстоне (США) была выделена рабочая группа, в которую вошли 20 ведущих морфологов-гастроэнтерологов, специализирующихся в области изучения патологии желудка. В результате Сиднеевская классификация была принята в качестве основной. Дополнения же сводились к следующему:
Согласно предложенным классификационным дополнениям, в качестве основной формы хронического гастрита выделяют аутоиммунный хронический гастрит тела желудка, который характеризуется очаговым или диффузным атрофическим гастритом тела желудка и неизмененной слизистой оболочкой или поверхностным гастритом антрума желудка (НР-негативный). У этой группы больных определяются: аутоантитела типа IgG к париетальным клеткам (в 95% случаев), аутоантитела типа IgG к ферменту К/Na-АТФазе в париетальной клетке (в 70% случаев) с развитием умеренной или выраженной секреторной недостаточности; аутоантитела типа IgG к внутреннему фактору Кастла
(в 50% случаев) с развитием через пять-шесть лет гиперхромной В-12-дефицитной анемии, к которой через пять-шесть лет при отсутствии лечения анемии присоединяется фуникулярный миелоз спинного мозга с развитием пернициозной злокачественной анемии; гипопепсиногенемия 1, гипергастринемия с последующей гиперплазией антральных G-клеток. Возможно развитие злокачественного карциноида из ECL-клеток тела желудка, вследствие гипергастринемии, которая приводит к очаговой гиперплазии ECL-клеток тела желудка. Эти же изменения могут служить основой для развития рака желудка (гипергастринемия в сочетании с секреторной недостаточностью желудка — в условиях анацидности желудок заселяется кишечными бактериями, которые переводят нитраты в нитриты — потенциальные канцерогены первого порядка); возникает «диффузная» форма рака желудка. При Helicobacter pylori, ассоциированном хроническом гастрите антрума желудка, обнаруживают мультифокальный или диффузный атрофический гастрит с частым развитием кишечной метаплазии (тонококишечная, незрелая и зрелая толстокишечная метаплазия) в антруме желудка, неизмененная слизистая оболочка или поверхностный гастрит в теле желудка; Helicobacter pylori обнаруживается в 95% случаев; фиксируется сохраненная или повышенная секреторная функция желудка; нормопепсиногенемия 1 или гиперпепсиногенемия 1; нормогастринемия или гипогастринемия при нормальном числе или гипоплазии антральных G-клеток в зависимости от степени выраженности атрофического гастрита; аутоантитела типа IgG к G-клеткам обнаруживаются в 10—15% случаев. Эти изменения могут трансформироваться в «кишечную» форму рака желудка. Смешанный хронический пангастрит характеризуется мультифокальным и реже диффузным атрофическим гастритом антрума и тела желудка; Helicobacter pylori обнаруживается в 70% случаев. Эта форма гастрита характеризуется сохраненной или чаще умеренной секреторной недостаточностью; нормопепсиногенемией 1, реже гипопепсиногенемией 1, нормогастринемией, или реже гипогастринемия при нормальном числе, или реже гипоплазией антральных G-клеток. Эти изменения слизистой оболочки могут служить основой для развития «кишечной» формы рака желудка. Химико-токсикоиндуцированный хронический рефлюкс-гастрит развивается у оперированных больных по Бильрот-2 и у больных с многолетним дуоденогастральным рефлюксом (желчные кислоты и лизолецетин). Характеризуется мультифокальным или реже диффузным атрофическим гастритом с частой кишечной метаплазией; НР-негативный; функционально определяется умеренная или выраженная секреторная недостаточность; нормопепсиногенемия 1 или гипопепсиногенемия 1; гипогастринемия. Подобная форма гастрита служит основой для развития метаплазий, дисплазий и «кишечной» формы рака желудка.
Клинические проявления хронического гастрита
Клиническая картина хронического гастрита характеризуется как местными, так и общими расстройствами, как правило, появляющимися в периоды обострений. Местные признаки характеризуются симптомами желудочной диспепсии (тяжесть и чувство давления, полноты в подложечковой области, появляющиеся или усиливающиеся во время еды или вскоре после еды; отрыжка, срыгивание, тошнота, неприятный привкус во рту, жжение в эпигастрии, нередко изжога, свидетельствующая о нарушении эвакуации из желудка и забросе желудочного содержимого в пищевод). Эти проявления чаще возникают при определенных формах хронического антрального гастрита, которые ведут к нарушению эвакуации из желудка, повышению внутрижелудочкового давления, усилению желудочно-пищеводного рефлюкса и обострению всей перечисленной симптоматики.
При хроническом гастрите тела желудка проявления встречаются нечасто и сводятся преимущественно к тяжести в эпигастральной области, возникающей во время или вскоре после еды.
У больных с НР-ассоциированном хроническом гастритом, долгое время протекающим с повышением секреторной функцией желудка, могут появиться признаки «кишечной» диспепсии в виде расстройств дефекации (запоры, послабление, неустойчивый стул, урчание, вздутие живота). Часто они носят эпизодический характер и нередко становятся основой для формирования синдрома раздраженного кишечника (желудочно-тонкокишечный, желудочно-толстокишечный рефлюкс).
Из общих расстройств может фиксироваться: астеноневротический синдром (слабость, раздражительность, нарушения со стороны сердечно-сосудистой системы — кардиалгии, аритмии, артериальной неустойчивости с наклонностью к гипотонии). При атрофических формах хронического гастрита в стадии секреторной недостаточности у больных может развиться симптомокомплекс, схожий с демпинг-синдромом (внезапная слабость, бледность, потливость, сонливость, возникающие вскоре после еды). Иногда эти проявления сочетаются с кишечными расстройствами, с императивным позывом к стулу. У больных хроническим гастритом тела и развитием В-12-дефицитной анемии появляются слабость, повышенная утомляемость, сонливость, наблюдается снижение жизненного тонуса и утрата интереса к жизни; возникают боли и жжение во рту, языке; симметричные парестезии в нижних и верхних конечностях. У больных хроническим антральным, НР-ассоциированным гастритом в стадии секреторной гиперфункции может развиться «язвенно-подобный» симптомокомплекс, нередко свидетельствующий о предъязвенном состоянии.
Все эти проявления могут служить основой для диагностики хронического гастрита либо оценки стадии болезни или ее осложнений.
Диагностика хронического гастрита включает:
Примеры формулировки диагноза
Принципы лечения хронического гастрита
Учитывая наличие клинически и морфологически различающихся форм хронического гастрита, способы лечения также варьируют в зависимости от этиологии, морфологии, стадии болезни.
Диетические мероприятия должны включать в себя: назначение щадящей диеты в период обострения заболевания, подразумевающей механические, химические, объемные ограничения. Эти ограничения действуют только в период обострения; по мере его купирования питание должно становиться полноценным с соблюдением стимулирующего принципа в период ремиссии у больных с подавленной или с пониженной кислотной продукцией.
Лечение отдельных форм хронического гастрита
Аутоиммунный фундальный атрофический гастрит (тип А)
Условно выделяют следующие стадии болезни:
Если диагноз аутоиммунного фундального гастрита подтвержден и фиксируется начальная стадия болезни с сохраненной секреторной функцией желудка при серьезном нарушении иммунных процессов, может быть предпринята попытка лечения глюкокортикоидными гормонами (короткими курсами, средними дозами, не превышающими 30 мг преднизолона в сутки при условии проведения иммунных тестов). При отсутствии эффекта проведения повторного курса такой терапии нецелесообразно, так как повторное или продолжительное лечение глюкокортикоидными гормонами индуцирует атрофию слизистой оболочки желудка [3].
Подобная возможность лечения сохраняется и в прогрессирующей стадии болезни, а также у больных с сохраненной секреторной функцией желудка.
На стадии стабилизации процесса, при отсутствии клинических проявлений, больные в лечении не нуждаются.
При развитии осложнений при нарушенном желудочном пищеварении может быть назначен желудочный сок по одной столовой ложке на полстакана воды, небольшими глотками во время еды в сочетании с полиферментными препаратами (лучше креон или панцитрат).
При нарушении моторики — она становится или непрерывной, или «стремительной», так как привратник постоянно открыт — нарушен его «запирательный механизм», иногда оказывается достаточно назначение желудочного сока или в сочетании с препаратами, влияющими на моторику выходного отдела (мотилак, мотилиум курсом с переходом на поддерживающие дозы, длительно — перманентно; может быть использован лингвальный вариант препарата при эпизодическом расстройстве желудочной эвакуации).
При развитии В12-дефицитной анемии проводится лечение витамином В12 (начальный курс по 2000 мкг, восемь—десять инъекций ежедневно). Эта норма, по существу, покрывает годовую потребность в витамине В12. При анемии с явлениями фуникулярного миелоза ежедневная доза увеличивается до 400—500 мкг. В периоде ремиссии проводится поддерживающая терапия по 100 мкг два раза в неделю. Спустя четыре—шесть месяцев от начала лечения витамином В12 может развиться или проявиться дефицит железа, в этом случае в комплекс терапевтических мер необходимо ввести препараты железа (короткими курсами).
При установлении факта гиперфункции и гиперплазии антральных G-клеток необходимо фиксировать внимание на очаговых фовеолярных гиперплазиях слизистой оболочки желудка и, при обнаружении карциноидных опухолей — удалить их (способ удаления должен соответствовать локализации, размерам, активности и распространенности в толщу стенки).
Хронический антральный гастрит, НР-ассоциированный (тип В)
Основным принципом лечения данного типа хронического гастрита должно быть уничтожение в слизистой оболочке желудка бактерий НР, а также меры по стабилизации состояния больного и продление периода ремиссии. Согласно рекомендации Европейской ассоциации гастроэнтерологов — Маастрихт I (1996 г.), эрадикации подлежали все формы активного хронического гастрита, а в соответствии с рекомендациями Маастрихт II (2000 г.) — только атрофические гастриты. Однако в эту же группу попадают пациенты, страдающие НР-ассоциированной язвенной болезнью, лица после резекции желудка по поводу рака и язвенной болезни, а также больные, которым должно быть проведено лечение «по требованию». Так что в целом это достаточно обширная группа больных, а если учесть, что часть пациентов с активными формами хронического гастрита имеют те или иные клинические проявления, связанные с нарушением эвакуации из желудка, а также с сочетанием хронического антрального гастрита с рефлюкс-эзофагитом, то показания к лечению заметно расширяются.
Перед началом лечения должен быть установлен статус НР, включающий информацию о степени инфицированности (высокая, умеренная, малая), активности уреазного теста, активности воспаления. В зависимости от полученных результатов определяется продолжительность лечения — от семи до 14 дней, либо доза антибактериальных препаратов. Используемая комбинация первой линии лечения включает: ингибитор «протонной помпы» в полной суточной дозе (40 мг) либо два антибиотика: клацид (кларитромицин) — 1000 мг в сутки; амоксициллин — 2000 мг в сутки, либо кларитромицин в сочетании с фуразолидоном — 400 мг в сутки. У больных с резко пониженной секреторной функцией вместо ингибиторов кислотной секреции должен быть использован висмут (препарат де-нол 240 мг два раза в сутки). Оценку эффективности эрадикационного лечения следует проводить через четыре—шесть недель после окончания лечения. Если эрадикация не достигнута, то необходимо комбинированное лечение с включением четырех препаратов (на основе либо блокаторов секреции, либо де-нола) с использованием тетрациклина до 2000 мг в сутки, амоксициллина до 2000 мг в сутки, фуразолидона до 400 мг в сутки, либо с применением антибиотиков после определения чувствительности к ним НР. Продолжительность лечения определяется НР-статусом.
Хронический химико-токсикоиндуцированный или желчный рефлюкс-гастрит (тип С)
Этот диагноз объединяет большую группу больных, включающую пациентов с резецированным желудком, людей, получавших нестероидные противовоспалительные препараты, а также пациентов с рефлюксом дуоденального содержимого, страдающих алкогольной болезнью. Терапия зависит от основного причинного фактора. Так как желчные кислоты и лизолецитин оказывают повреждающее действие только при наличии соляной кислоты, то, в зависимости от выраженности клинических проявлений, могут быть использованы блокаторы кислотной секреции (выбор которых зависит от кислотной продукции). При рефлюкс-гастрите препаратом выбора является магалфил 800 (в суточной дозе 3200—4800 мг или четыре—шесть таблеток); полные лечебные дозы больной получает до фиксации стадии ремиссии, затем необходимо продолжить прием препарата в поддерживающих дозах: одну-две таблетки в сутки (связывающая способность препарата желчных кислот не уступает холестирамину). Следовательно, в данной ситуации магалфил 800 является препаратом выбора. Если решается вопрос о целесообразности длительного лечения НПВС и обнаруживается НР-ассоциированный, антральный гастрит, то следует провести эрадикационное лечение — это уменьшает количество осложнений, либо проводить данную терапию на фоне блокаторов кислотной продукции. Симптоматическая терапия проводится по обычным принципам и включает как диетические мероприятия, так и прием прокинетиков (мотилак, мотилиум), нормализацию пассажа химуса по кишечнику, использование препаратов поглощающих газ (кремний-содержащих), нормализацию дисбиоза и стула при наклонности к запору.
Прочие формы хронического гастрита
Больные часто нуждаются в симптоматическом лечении, в зависимости от ведущего симптомокомплекса. При эозинофильном гастрите необходимо уточнение его патогенеза. Если он является симптомом «эозинофильной болезни», то следует лечить эту болезнь; если налицо симптоматический вариант — необходимо искать причину развития заболевания и устранить ее. Особые формы хронического гастрита, как правило, не имеют клинических проявлений и не нуждаются в симптоматическом лечении, а скорее требуют выработки определенной тактики наблюдения, кратности осмотра и морфологической динамики, в конечном итоге определяющей тактику ведения больных.
Литература.
О. Н. Минушкин, доктор медицинских наук, профессор
И. В. Зверков,
УНЦ МЦ УД Президента РФ, Москва