Лимфопролиферативное заболевание что это лечение
Аутоиммунный лимфопролиферативный синдром
Аутоиммунный лимфопролиферативный синдром – группа генетически обусловленных заболеваний, которые возникают по причине наследственных или соматических мутаций в генах, отвечающих за различные этапы FAS-обусловленного апоптоза. Симптоматика может быть вариабельной и наиболее часто включает в себя лимфаденопатию, спленомегалию и разнообразные аутоиммунные поражения системы крови, печени, щитовидной железы. Диагностика аутоиммунного лимфопролиферативного синдрома производится на основании результатов общего и биохимического анализов крови, биопсии лимфатических узлов, генетических исследований. Специфического лечения заболевания в настоящий момент нет, применяют комбинации иммунносупрессивной и цитотоксической терапии.
Общие сведения
Аутоиммунный лимфопролиферативный синдром (АЛС, ALPS, синдром Канале-Смит) – группа иммунодефицитных состояний, характеризующихся аутоиммунными цитопениями, лимфаденопатией, спленомегалией. Первые данные о заболевании стали поступать в 1968-м году, после чего вскоре началось бурное изучение патологии. Изначально АЛС был отнесен к первичным иммунодефицитам, однако со временем были обнаружены формы синдрома, обусловленные соматическими мутациями в детском и подростковом организме.
Данные о встречаемости у разных исследователей довольно сильно различаются, на сегодняшний момент описано более 500 случаев различных форм аутоиммунного лимфопролиферативного синдрома. Наследственные формы заболевания передаются по аутосомно-доминантному типу, при этом в развитии врожденных форм также довольно велика роль спонтанных мутаций. Среди больных с одинаковой частотой встречаются как мальчики, так и девочки.
Причины
Выяснено, что причиной любого типа АЛС является нарушение FAS-опосредованного апоптоза лимфоцитов. При образовании Т-лимфоцитов те линии, которые способны атаковать собственные ткани, уничтожаются за счет активизации рецепторов CD-95 (Fas-рецепторов) на поверхности их мембраны. Активация CD-95, относящегося к группе рецепторов фактора некроза опухолей, запускает многостадийную реакцию с участием каспаз, которая оканчивается апоптозом клетки.
При аутоиммунном лимфопролиферативном синдроме генетические мутации приводят к блоку этого процесса на определенном этапе, из-за чего устранения потенциально опасных клонов Т-лимфоцитов не происходит, и они начинают накапливаться в лимфатических узлах. Кроме того, создаются условия для аутоиммунного поражения органов и тканей.
Наиболее часто встречаются наследственные и спонтанные мутации в гене TNFRSF6, который кодирует собственно Fas-рецептор. При этом нарушение структуры белка (особенно домена, отвечающего за взаимодействие с FADD-молекулой) приводит к тому, что он становится неспособным выполнять свои рецепторные функции и активизировать апоптоз. Возможны и соматические мутации в гене FAS, которые в полной мере проявляют себя в позднем детском или подростковом периоде, и поэтому их относят к отдельной группе АЛС.
Второй по распространенности вариант аутоиммунного лимфопролиферативного синдрома обусловлен мутацией в гене CASP10, кодирующем цистин-аспарагин кислотную протеазу (каспаза-10). Этот белок играет ключевую роль в передаче сигнала об апоптозе с клеточной мембраны в ядро клетки. К этому же варианту относят и мутации гена CASP8.
Третьим по распространенности является аутоиммунный лимфопролиферативный синдром, который вызван мутацией в гене FASLG, кодирующем Fas-лиганд или рецептор CD-178. Он играет вспомогательную роль в распознавании факторов, стимулирующих апоптоз, и участвует в передаче сигнала в клетку.
Некоторые формы АЛС обусловлены мутацией гена NRAS, который кодирует «малый G-белок», принимающий участие в качестве вторичного мессенджера в передаче сигналов с мембраны в клетку, в том числе и ядро. Примерно в трети случаев аутоиммунного лимфопролиферативного синдрома врачам-иммунологам не удается установить непосредственную причину заболевания.
Классификация аутоиммунного лимфопролиферативного синдрома
При помощи методов современной генетики удалось выявить шесть основных форм АЛС:
ALPS 1A – вызвана мутацией гена TNFRSF6, расположенного на 10-й хромосоме, чаще всего имеет врожденный характер, наследуется по аутосомно-доминантному типу. По статистике, более 40% АЛС относятся именно к этой разновидности.
ALPS 1В – обусловлена мутацией гена FASLG, также довольно часто приводит к врожденному аутоиммунному лимфопролиферативному синдрому. К этому типу относят около 10% от всех клинических случаев АЛС.
ALPS 1m – ее причиной являются соматические мутации в гене FAS, возникающие в детском или подростковом возрасте и поэтому приводящие к поздним формам АЛС. При этом повреждение гена должно произойти в полипотентной клетке-предшественнице, которая способна дать начало многим линиям лимфоцитов. При этой форме наиболее часто возникает внезапная самопроизвольная ремиссия заболевания.
ALPS 2 – вызвана мутацией в генах CASP10 и, по некоторым данным, CASP8, которые кодируют белки-каспазы, передающие сигнал об апоптозе от рецептора к ядру клетки. Эта форма аутоиммунного лифопролиферативного синдрома составляет примерно 25% от всех случаев заболевания, может быть как врожденной, так и проявиться в более старшем возрасте.
ALPS 3 – мутация какого гена и характер ее наследования при этой форме неизвестны. Особенностью такого варианта АЛС является нарушение не только FAS-, но и IL2-опосредованного апоптоза, а также более тяжелый характер течения.
ALPS 4 – обусловлена мутацией гена NRAS, также кодирующего белки-передатчики внутриклеточного сигнала. Данный тип аутоиммунного лимфопролиферативного синдрома характеризуется более доброкачественным течением и умеренной выраженностью симптомов.
Симптомы аутоиммунного лимфопролиферативного синдрома
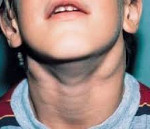
Симптомы АЛС довольно вариабельны из-за большого количества мутаций, которые могут приводить к такому состоянию. Начало заболевания можно заметить уже на 15-й день после рождения (при врожденных формах), в детском или подростковом возрасте в случае соматических мутаций в генах FAS, CASP10 или NRAS. Обычно первым проявлением заболевания является лимфаденопатия – подмышечные, паховые или шейные лимфатические узлы увеличиваются в размерах, но при этом безболезненны и не спаяны с окружающими тканями. Регистрируется спленомегалия, в некоторых случаях она сопровождается увеличением печени (гепатоспленомегалия).
Аутоиммунные проявления АЛС регистрируются обычно через некоторое время после лимфаденопатии и увеличения селезенки. В основном это поражения кровяных ростков – тромбоцитопения, гемолитическая анемия, приводящая к желтухе, изредка нейтропения. Помимо крови, аутоиммунному поражению могут подвергаться органы ЖКТ (возникают гастрит, панкреатит, колит, аутоиммунный гепатит). На коже могут проявляться признаки васкулита, делая клинику аутоиммунного лимфопролиферативного синдрома схожей с таковой при системной красной волчанке. Кроме того, могут возникать аутоиммунные формы тиреоидита, гломерулонефрита, поражаться суставы, ткани глаза (иридоциклит, увеит). Нередки поражения центральной нервной системы – эпилептические припадки, миелиты, мозжечковая атаксия.
Выраженность симптомов и их количество может значительно варьироваться у каждого конкретного больного. Кроме того, при аутоиммунном лимфопролиферативном синдроме в десятки раз возрастает риск развития злокачественных опухолей, так как опухолевые клоны лимфоцитов также устраняются посредством апоптоза.
Примерно в 20% случаев АЛС приводит к неходжкинским лимфомам (лимфома Беркитта, фолликулярная лимфома), описаны и другие онкологические заболевания. Из-за этого проявления АЛС могут быть ошибочно определены как следствие опухолевой инфильтрации лимфоидной ткани. Среди других осложнений аутоиммунного лимфопролиферативного синдрома наиболее часто встречается травматический разрыв селезенки, сепсис и другие инфекционные поражения.
Диагностика
Диагностика АЛС производится на основании осмотра, а также лабораторных, иммунологических и генетических исследований. При осмотре выявляют увеличение более чем трех групп лимфатических узлов, спленомегалию, увеличение печени. Анализ крови может показывать уменьшение количества некоторых клеток (анемию, тромбоцитопению), у части больных определяется высокая (до 30%) эозинофилия. Проба Кумбса положительная, в биохимическом анализе крови определяется выраженная гипергаммаглобулинемия.
Одним из высокочувствительных методов иммунологической диагностики аутоиммунного лимфопролиферативного синдрома является проточная иммуноцитофлюориметрия, проводимая с целью выявления количества лимфоцитов с атипичным набором рецепторов (CD3+CD4-CD8-). При АЛС количество таких клеток превышает 1% от всех лимфоцитов. В биоптате лимфатических узлов определяется фолликулярная гиперплазия, результатом гистологического исследования селезенки служит лимфоидная гиперплазия.
Врачом-генетиком может быть произведено секвенирование гена FAS с целью выявления мутаций, ставших причиной аутоиммунного лимфопролиферативного синдрома. С учетом значительной величины этого гена для ускорения и удешевления процедуры поиск может быть произведен лишь в отдельных экзонах гена FAS, в которых наиболее часто обнаруживаются нарушения – эти участки называют «горячими точками». Таким образом, при помощи генетической диагностики можно определить АЛС только 1А, 1В и 1m типов. Методики определения остальных форм АЛС генетическими методами на сегодняшний день не разработаны. Изучение наследственного анамнеза в ряде случаев будет неэффективно из-за значительной доли форм заболевания, вызванных соматическими мутациями.
Лечение аутоиммунного лимфопролиферативного синдрома
Этиотропное лечение аутоиммунного лимфопролиферативного синдрома не разработано, патогенетическая терапия сводится к применению иммуносупрессивных и цитотоксических средств. В качестве средств, подавляющих аутоиммунную активность, наиболее часто используют кортикостероиды (преднизолон, дексаметазон). К специфическим препаратам, ограничивающим скорость пролиферации лимфоцитов, относят микофенолата мофетил, сиролимус. Также при аутоиммунном лимфопролиферативном синдроме активно применяются традиционные цитотоксические средства – метотрексат, циклоспорин А и другие.
При значительном увеличении селезенки или отсутствии эффекта от консервативного лечения прибегают к спленэктомии. Пересадка костного мозга и использование стволовых клеток в долгосрочной перспективе давали только временный эффект. При значительно выраженных гематологических нарушениях применяют гемотрансфузии, введение эритроцитарной или тромбоцитарной массы. Больному следует избегать физических нагрузок, использовать высоковитаминную диету.
Прогноз
Прогноз заболевания, ввиду высокой вариабельности и выраженности симптомов, неопределенный или неблагоприятный. У большей части больных проявления заболевания постепенно нарастают, со временем приводя к летальной анемии, тромбоцитопении, билиарному циррозу печени. Также важную роль в прогнозе играют нарушения иммунитета, так как нередко причиной смерти выступают сепсис и другие инфекционные поражения. В прогнозе аутоиммунного лимфопролиферативного синдрома следует учитывать и повышенный риск онкологических заболеваний, примерно пятая часть больных умирает от различных типов лимфом. В некоторых случаях возникает спонтанная и длительная ремиссия патологии.
Лимфопролиферативное заболевание что это лечение
Часть 1. Введение. Классификация. Неходжкинские лимфомы
(лекция для врачей и студентов)
Учение о лимфопролиферативных заболеваниях является, пожалуй, самой обширной областью гематологии. Обращение к этой теме традиционно сопряжено с трудностями, обусловленными отсутствием классификации базирующейся на едином сквозном признаке. Поскольку клетки, составляющие иммунную систему являются широко распространенными и обладают значительной функциональной гетерогенностью, лимфопролиферативные заболевания могут возникать фактически в любом органе и иметь различные гистологические черты, клинические проявления и прогноз.
По месту первичного возникновения лимфопролиферативные заболевания могут быть разделены на две большие группы. Лимфопролиферативные заболевания, первично возникающие в костном мозге обозначаются термином «лейкоз» (например хронический лимфолейкоз). Если опухоль первично возникает в лимфоидной ткани, расположенной вне костного мозга (в лимфатических узлах), то такое заболевание обозначается термином «лимфома». При развитии лимфомы из лимфоидной ткани какого-либо органа (печени, толстой кишки, головного мозга) к термину «лимфома» добавляется указание органа, из лимфоидной ткани которого данная опухоль происходит (например «лимфома головного мозга»).
У больных лимфомой с течением времени нередко происходит колонизация костного мозга опухолевыми клетками из первичного очага. Для обозначения таких случаев используют термин «лимфома с лейкемизацией».
Для точной характеристики лимфопролиферативного процесса (выделения самостоятельных нозологических форм) используется несколько характеристик клеточного состава (морфологического субстрата) опухоли.
Ниже представлена одна из последних классификаций лимфопролиферативных заболеваний. Классификация основана на морфологических, иммунофенотипических и молекулярногенетических признаках, описываемых для каждого из выделяемых заболеваний.
Представленная классификация не является окончательным решением задачи по разграничению лимфопролиферативных заболеваний поэтому в ней можно встретить термин «предварительный». Он используется обозначения тех нозологических форм, необходимость выделения и критерии диагностики которых еще нуждаются в дополнительном уточнении.
Евро-Американская классификация лимфопролиферативных заболеваний (по N.L.Harris et al., 1994).
I. Опухоли из ранних предшествеников В-лимфоцитов:
— лейкемия/лимфома из предшественников В-лимфобластов.
II. Периферические В-клеточные опухоли.
1. В-клеточный хронический лимфолейкоз /пролимфоцитарный лейкоз /лимфома из малых лимфоцитов.
2. Лимфоплазмоцитарная лимфома /иммуноцитома.
3. Лимфома из мантийных клеток.
4. Лимфома из фоликулярного центра, фолликулярная
предварительные цитологические категории:
I— мелкоклеточная; II— смешанная мелкие и крупные клетки;
предварительные субтипы: диффузная, преимущественно мелкоклеточная.
5. В-клеточная лимфома маргинальной зоны.
Предварительный субтип: узловая (+/- моноцитоидные В-клетки).
6. Предварительный тип: Лимфома селезенки, происходящая из маргинальной зоны
7. Волосковоклеточный лейкоз.
8. Плазмоцитома /плазмоклеточная миелома.
9. Диффузная лимфома из крупных В-клеток.
субтип: преимущественно медиастенальная (тимусовая)
10. Лимфома Беркитта.
11. Предварительный тип: В-клеточная лимфома высокой степени злокачественности, Беркитт-подобная.
Т-клеточные опухоли и опухоли из натуральных киллеров.
I. Опухоль из ранних предшественников Т-клеток:
— лейкемия/лимфома из предшественников Т-лимфобластов
II. Периферические Т-клеточные опухоли и опухоли из натуральных киллеров (НК-клеточные).
1. Т-клеточный хронический лимфолейкоз /пролимфоцитарный лейкоз.
2. Лейкоз из больших гранулярных лимфоцитов.
3. Грибовидный микоз /синдром Сезари.
4. Периферическая Т-клеточная лимфома, неспецифическая
предварительные цитологические категории: из клеток среднего размера; смешанная из средних и крупных клеток;
крупноклеточная; из лимфоэпителиоидных клеток;
Предварительный субтип: гепатоспленическая гамма, дельта
Предварительный субтип: субкутаниальная панникулярная
5. Ангиоиммунобластная Т-клеточная лимфома.
6. Ангиоцентричная лимфома.
7. Интестинальная Т-клеточная лимфома (+/- связанная с энтеропатией).
8. Т-клеточная лейкемия/лимфома взрослых.
9. Анапластическая крупноклеточная лимфома, CD30+, Т- и нуль-клеточного типов.
10. Предварительный тип: анапластическая крупноклеточная лимфома, Ходжкин-подобная.
Болезнь Ходжкина (лимфогранулематоз).
I. Лимфоидное преобладание.
II. Нодулярный склероз.
III. Смешанноклеточный вариант.
VI. Лимфоидное истощение.
V. Предварительный тип: лимфоидно богатый классический вариант болезни Ходжкина.
Представленная таблица наглядно иллюстрирует сложность создания общеприемлемой классификации лимфопролиферативных заболеваний. Для упрощения понимания материала отметим, что основными группами лимфопролиферативных заболеваний являются:
— В-клеточные лимфопролиферативные заболевания,
— Т-клеточные лимфопролиферативные заболевания,
— лимфогранулематоз (болезнь Ходжкина).
В— и Т-клеточные лимфопролиферативные заболевания (исключая В— и Т-клеточные лейкозы) объединяют в общую группу обозначаемую термином «неходжкинские лимфомы».
Этиология лимфом остается неизвестной. Среди этиологических факторов традиционно рассматриваются такие, общие для всех неопластических заболеваний, факторы как ионизирующая радиация, химические канцерогены, неблагоприятные условия окружающей среды. Дополнительно следует остановиться на роли вирусов, поскольку в ряде случаев развития лимфом прослеживается выраженная взаимосвязь между воздействием вируса и опухолевым ростом. Так было продемонстрировано, что у детей больных эндемической африканской лимфомой Беркитта в 95% случаев имеет место инфицирование вирусом Эпштейн—Барр.
Вирус Эпштейна—Барр является причиной инфекционного мононуклеоза, состояния клинически схожего с абортивным течением лимфомы. Инфекционный мононуклеоз представляет собой наглядную модель в которой индуцированная вирусом Эпштейна—Барр пролиферация В-лимфоцитов, способных к злокачественной прогрессии, подавляется нормальным Т-клеточным ответом.
Показано, что вирус Эпштейна—Барр индуцирует развитие фатальной лимфомы у мужчин происходящих из семей с прослеживающимся анамнезом недостаточности иммунной системы. Такие больные имеют генетический дефект сцепленный с X-хромосомой (X q24-q27). Этот генетический дефект иммунорегуляции является причиной дефицита иммунного ответа, направленного против вируса Эпштейна—Барр.
Таким образом, несмотря на прослеживаемую при некоторых лимфомах видимую моноэтилогическую природу опухоли, все же при доскональном рассмотрении вопроса обращает на себя внимание сочетание нескольких причинных факторов.
Под действием этиологических факторов клетки иммунной системы могут подвергаться злокачественной трансформации. Лимфоидные клетки могут стать злокачественными на любом этапе дифференцировки. При этом они размножаются (пролифелируют) и создают клон клеток замерших на определенной стадии созревания.
В патогенезе лимфопролиферативных заболеваний особое место отводится роли онкогенов в развитии заболевания. Так для многих B-клеточных опухолей характерно усиление экспрессии клеточного протоонкогена c-myc. Протоонкоген c-myc имеет решающее значение для перехода лимфоцитов, а возможно, и других клеток из состояния покоя (период G0 клеточного цикла) в последующие фазы клеточного цикла. Усиление экспрессии c-myc является одним из ранних событий, связанных с активацией лимфоцитов. Прекращение экспрессии c-myc сопряжено с выходом из цикла и возвращение в фазу G0.
Таким образом, неконтролируемая экспрессия c-myc будет препятствовать выходу клеток из цикла и заставит их постоянно размножаться. Именно такая ситуация наблюдается при неопластических B-лимфопролиферативных заболеваниях, когда злокачественные клетки в результате реципрокной транслокации участков хромосом, содержащих локус c-myc, экспрессируют высокий уровень белка c-myc. Этот белок представляет собой команду для клетки осуществить деление. Так, например, в большинстве случаев уже упомянутой лимфомы Беркитта ген, расположенный на длинном плече хромосомы 8 в фокусе 24 (8q24), в результате реципрокной транслокации становится рядом с геном тяжелой цепи «мю», расположенном на хромосоме 14 в локусе q32. Эти два гена соединяются таким образом, что их транскрипция идет в обратном направлении, и ген c-myc транскрибируется с нормальных собственных промоторов, а не с промоторов гена мю-цепи. Считают, что следствием такой транслокации является нарушение нормальных механизмов подавления активности гена c-myc в результате чего клетка постоянно получает сигнал к делению.
Аномалии хромосом часто встречаются при лимфопролиферативных заболеваниях. Для большинства лимфом и лейкозов характерны поломки хромосом, при которых возможны транслокации генов, расположенных вблизи локусов, кодирующих иммуноглобулины в B-клетках или антигенсвязывающие рецепторы в T-клетках, но далеко не всегда в эти поломки вовлечены гены c-myc.
Утрата контроля над пролиферацией, вызванная нарушением регуляции экспрессии c-myc или другими аналогичными последствиями транслокаций хромосомного материала, открывает путь к неоплазии, но сама по себе недостаточна для злокачественной трансформации. Имеющиеся данные свидетельствуют, что для окончательного становления автономной пролиферации клеток (опухоли) необходимо наличие еще как минимум одного случайного неблагоприятного события.
Дальнейшие патогенетические изменения в организме при лимфоме связаны с ростом и метаболизмом опухоли. Очень часто опухолевые клетки подавляют развитие аналогичных нормальных клеток и вызывают иммунологическую недостаточность (иммунодефицитное состояние). У больных лимфомой часто отмечается повышенная склонность к различного рода инфекциям. Кроме иммунологической недостаточности у больных могут развиваться иммунные реакции, обусловленные продукцией антител направленных против антигенов собственных тканей. Примером этому могут служить случаи развития иммунной гемолитической анемии или иммунной тромбоцитопении у больных с лимфомой.
Кроме того, при лимфоме могут вырабатываться антитела направленные против эритроцитарных предшественников в костном мозге, что приводит к практически полной гибели этих клеток с развитием так называемой парциальной красноклеточной аплазии.
Поражение костного мозга при лимфоме (лейкемизация) влечет за собой развитие недостаточности костномозгового кроветворения с развитием цитопении периферической крови.
Как уже было сказано, характер клинические проявления при лимфоме и интенсивность выраженности отдельных симптомов зависит главным образом от степени дифференцировки клеток, составляющих морфологический субстрат опухоли. Опухоли состоящие из зрелых клеток, как правило, будут давать менее выраженную клиническую симптоматику, чем опухоли состоящие из плохо дифференцированных (незрелых) клеток. Однако, следует всегда помнить, что клинические проявления при лимфоме не могут служить основанием для вывода о степени злокачественности опухоли. Поскольку опухоль из незрелых клеток может сопровождаться минимальной симптоматикой и наоборот, зрелоклеточная опухоль может сопровождаться бурной клинической картиной.
Наиболее часто в дебюте заболевания появляется опухоль лимфатического узла или любой другой локализации. Часто сама опухоль не вызывает ни каких субъективных ощущений у больного и может быть обнаружена при случайном осмотре. Общая симптоматика складывается из обычных для неоплазий слабости, повышенной утомляемости, снижении массы тела. Специфичность этих симптомов мала.
Достаточно патогномоничными для развития лимфопролиферативной опухоли является триада признаков, состоящая из жалоб на проливные поты, особенно в ночные часы, немотивированный кожный зуд и плохую переносимость укусов кровососущих насекомых. В ряде случаев появление одного или нескольких симптомов из указанной триады может на несколько лет опережать развитие самой опухоли.
Нередко у больных с лимфомой отмечаются серьезные иммунологические расстройства, такие как иммунная гемолитическая анемия, иммунная тромбоцитопения, волчаночноподобный синдром.
Иммунологическая недостаточноть у больных лимфомами открывает ворота для присоединения бактериальных и вирусных инфекций. Бактериальные агенты чаще всего вызывают развитие острой пневмонии или инфекции мочевыводящих путей. Среди вирусных инфекций на первом месте стоят инфекции, вызываемые вирусами герпеса.
Картина периферической крови обычно имеет минимальные отклонения от нормальной. При отсутствии иммунного разрушения клеток, показатели красной крови обычно не изменены. Это положение справедливо и для уровня тромбоцитов. В ряде случаев может иметь место умеренный лейкоцитоз за счет увеличения количества зрелых лимфоцитов. Часто у больных лимфомой наблюдается эозинофилия.
При исследовании препаратов костного мозга обычно определяется нормальный клеточный состав, иногда может иметь место умеренное (около 20%) увеличение количества зрелых лимфоцитов. При распространении опухоли на костный мозг (лейкемизация) в аспирате определяются клетки морфологически схожие с клетками первичного очага лимфомы.
Колонизация костного мозга опухолевыми клетками будет неизбежно приводить к сокращению плацдарма для нормального гемопоэза. Следствием недостаточности костномозгового кроветворения является развитие цитопении периферической крови.
Диагноз лимфомы основывается на исследовании морфологического субстрата опухоли. Обычно исходной точкой диагностического поиска является обнаружение немотивированного увеличения лимфатических узлов.
Увеличение лимфатического узла без видимых причин до размера более 1 см и существование такого увеличенного узла более 1 месяца является основанием для выполнения биопсии лимфоузла.
Как уже говорилось, лимфоидные клетки могут стать злокачественными на любом этапе дифференцировки. При этом они пролифелируют и создают клон клеток, замерших на определенной стадии созревания. Опухолевые клетки несут маркеры нормальных лимфоцитов, типичные для той стадии, на которой прекратилось дальнейшее созревание. С введением в практику моноклональных антител появилась возможность классифицировать лимфоидные злокачественные новообразования исходя из иммунологического фенотипа опухолевых клеток.
Уже около 15 лет для диагностики лимфопролиферативных опухолей используется молекулярногенетический метод исследования перестройки (реаранжировки) генов.
Перестройка генов иммуноглобулинов является неотъемлемым и уникальным этапом в развитии В-лимфоцитов и не наблюдается ни в каких других клетках. Выявление реаранжировки генов иммуноглобулинов с помощью молекулярногенетических методов исследования позволяет достоверно установить принадлежность опухолевых клеток к В-клеткам.
Выявление определенных последовательностей в реаранжировке генов иммуноглобулинов позволяет разграничить различные варианты В-клеточных неоплазм.
Реаранжировка генов, кодирующих рецепторы Т-лимфоцитов является уникальным свойством, отличающим Т-лимфоциты от всех остальных клеток. Это свойство также используется для диагностики лимфопролиферативных опухолей Т-клеточного происхождения.
Таким образом, современная диагностика лимфом представляет комплексный процесс, сочетающий сразу несколько методов исследования. Только такой подход может обеспечить точную верификацию диагноза являющего основой выбора максимально эффективного лечения для больного.
К сожалению, известные трудности, существующие в нашей стране, не позволяют отечественной гематологической науке поступательно двигаться вперед. Если по уровню знаний (получаемых из зарубежных журналов) и пониманию проблемы (отечественная гематологическая школа, основанная И.А.Кассирским, длительное время не знала себе равных) наши ученые и практические врачи не уступают свои западным коллегам, а зачастую и превосходят их, то в практическом воплощении современных знаний мы безнадежно застряли на уровне середины 80-х годов.
На сегодняшний день большинство гематологических центров могут проводить лишь упрощенный вариант диагностики неходжкинских лимфом подразделяя их по степени злокачественности:
Современная терапия лимфом основывается на точной верификации подварианта опухоли. Упрощенная диагностика лимфом, не позволяющая поставить точный диагноз и формирующая лишь «групповой» диагноз (например «лимфома высокой степени злокачественности»), существенно ухудшает возможность оказания помощи больному.
В зависимости от нозологического диагноза и стадии заболевания лечение лимфом строится на использовании программ полихимиотерапии и лучевой терапии. В качестве цитостатических агентов чаще всего используются циклофосфан, рубомицин, винкристин, преднизолон (программа CHOP) и некоторые другие препараты.
При отсутствии лейкемизации заболевания имеется хорошая возможность проведения интенсивной химиотерапии с последующей трансплантацией аутологичного костного мозга, заготовленного у больного до проведения интенсивного лечения. Кроме аутотрансплантации, при наличии соответствующих условий, для лечения лимфом применяется аллогенная трансплантация костного мозга.
Современное лечение лимфом, основывается на точном морфологическом диагнозе, позволяющее продлевать и сохранять жизнь больным, требует слаженной работы многих специалистов, привлечения наукоемких и ресурсоемких технологий и, безусловно, зависит от экономической политики государства в области здравоохранения.
[an error occurred while processing this directive]