Лимфоваскулярная инвазия что это такое
Лимфоваскулярная инвазия что это такое
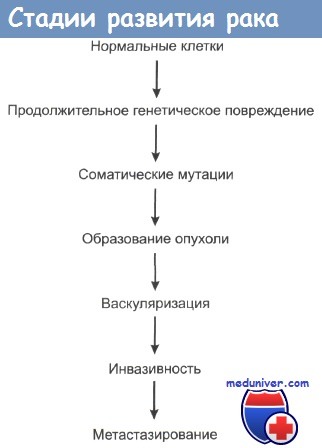
Можно сказать, что раковые клетки в определенной степени не реагируют на механизмы, контролирующие рост и развитие нормальной ткани. При пролиферации нормальной ткани непосредственный контакт клетки со своими соседями обычно служит сигналом к прекращению размножения. Это контактное торможение отсутствует в опухолевых тканях.
При подкожном введении раковых клеток иммунодефицитным мышам происходит рост и развитие опухоли, что никогда не случается при введении здоровых клеток. Раковые клетки отличаются от здоровых по составу мембранных гликопротеинов, по микропотенциалам на клеточной мембране, а также характеризуются повышенным содержанием сиаловой кислоты. Локомоторный клеточный аппарат (микротрубочки и микрофиламенты) раковых клеток деградирует, клетка теряет присущие ей формы, отмечается миграция цитоплазмы раковой клетки в зону контакта со здоровыми клетками.
Одновременно раковые клетки становятся локально инвазивными, хотя биохимические основы этого свойства до сих пор четко не выявлены. Опухолевые клетки часто демонстрируют пониженную адгезивность в сравнении с нормальными клетками. Важным моментом механизма инвазии является секреция определенных ферментов. Некоторые ферменты играют ключевую роль в протеолизе внутриклеточного матрикса, который всегда сопровождает инвазию раковых клеток. К таким ферментам относится семейство матричных металлопротеиназ (ММП), которое включает в себя колллагеназы, желатиназы и стромолизины.
Эти ферменты экскретируются в неактивной форме. Последующий разрыв сульфгидрильной группы и присоединение атома металла (чаще всего цинка) приводят к изменению конформации фермента и переводят его в активное состояние. Тканевые ингибиторы металлопротеиназ (ТИМП) прекращают действие этих ферментов. Некоторые типы тканей изначально обладают повышенной устойчивостью к инвазии. Это, например, компактная костная ткань, ткани крупных сосудов и хрящевая ткань. Предположительно способность к инвазии у опухолевых клеток появляется в результате трансформации нормальных процессов реконструкции и восстановления здоровых тканей. Тем не менее к настоящему моменту неизвестно, какие конкретно изменения генетической структуры раковых клеток ответственны за инвазивный рост.
По мере роста опухоли она выделяет в кровь ангиогенные факторы, которые стимулируют прорастание опухоли кровеносными сосудами и формирование сети капилляров. Сосудистая система кровоснабжения опухоли может стать мишенью для различных видов противораковой терапии. Опухоль стимулирует пролиферацию эндотелиальных клеток, выделяя ангиогенные цитокины, такие как эндотелиальный фактор роста сосудов (ЭФРС), ТФР и факторы роста фибробластов. Эндотелиальные же клетки в свою очередь могут стимулировать рост клеток опухоли. В одном грамме опухолевой ткани может находиться до 10-20 млн эндотелиальных клеток, которые не являются неопластическими.
Антигены нормальных эндотелиальных клеток, включая и профакторы свертываемости крови, могут быть разрегулированы в активно пролиферирующей под действием опухоли эндотелиальной ткани. В дополнение к действию цитокинов, гипоксия, развивающаяся в сети опухолевого кровоснабжения, может стимулировать выбросы ЭФРС и других факторов. В ходе ангиогенеза эндотелиальные клетки внедряются в строму опухоли, активно делятся там с образованием зачатков новых капилляров, которые затем развиваются в сосудистую систему опухоли. Как и в случае инвазии опухолевых клеток, этот процесс идет с участием продуцируемых эндотелием ММП и их естественных ингибиторов.
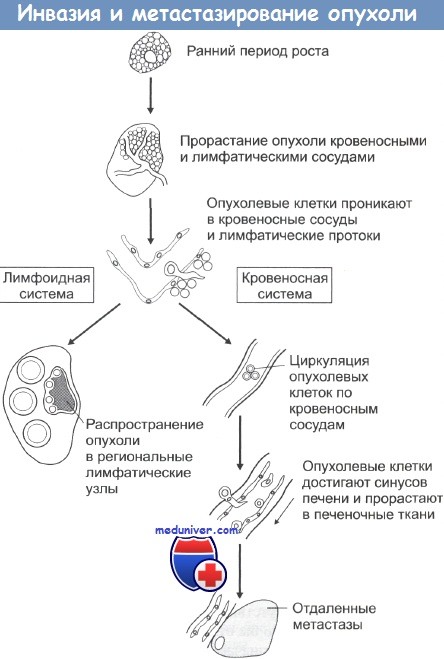
При локальной инвазии рака опухолевые клетки могут попадать в сосудистую систему и давать начало метастазам. Последовательность событий при метастазировании показана на рисунке. Распространение раковых клеток по лимфатической системе, что особенно характерно при карциномах, происходит при попадании опухолевых клеток в лимфатические протоки с последующим оседанием их в местах разветвления протоков и в ближайших лимфатических узлах. Вслед за этим обычно происходит инфильтрация опухолевыми клетками и отдаленных лимфоузлов. Распространение через кровяное русло проходит при проникновении раковых клеток в кровеносные сосуды рядом с местом первичной локализации опухоли либо через грудные протоки. Подхваченные током крови раковые клетки затем захватываются ближайшими капиллярными сетями, чаще всего сетями печени и легких, и оседают в них. При оценке направлений метастазирования очень важно учитывать первичную локализацию опухоли.
Например, опухоли пищеварительного тракта обычно метастазируют через воротную вену в печень. Опухоли также могут метастазировать непосредственно сквозь прилегающие ткани. Так возникающие в брюшной полости новообразования могут очень быстро рассеяться по всему внутрибрюшинному пространству, а клетки рака легкого могут мигрировать через плевру. Некоторые опухоли метастазируют в определенные органы и ткани, другие — бессистемно. Саркомы, например, почти всегда метастазируют в легкие, рак молочной железы поражает также ткани осевого скелета. Тем не менее биологических механизмов, объясняющих такую избирательность, пока не найдено.
Региональные лимфоузлы могут осуществлять барьерную функцию, предотвращая распространение метастазов за пределы области первичной локализации опухоли. До сих пор четко не выяснено, каким образом и за счет каких специфических иммунных механизмов лимфатические узлы создают барьер на пути распространения опухоли.
Проникая в кровеносное русло в районе первичной опухоли, раковые клетки затем могут достигать других органов и тканей. Для того чтобы дать начало новым очагам опухоли, эти клетки на новом месте должны, во-первых, проникнуть в ткани через эндотелий капилляров, а во-вторых, выжить при атаках местных иммунных систем защиты, таких как фагоцитирующие клетки и так называемые естественные киллеры (ЕК).
Способность к инвазированию и расселению в отдаленных органах и тканях у различных видов опухолей сильно варьирует. Эта способность, по-видимому, определяется степенью экспрессии того участка генома, который и обусловливает злокачественный рост клеток. Действительно, со временем почти все раковые опухоли накапливают все больше и больше генетических изменений в своих клетках и приобретают способности к инвазии и метастазированию. Но даже при клиническом обнаружении опухоли метастазы и инвазия могут проявиться лишь спустя несколько лет. Типичным примером является карцинома низкой степени злокачественности. Следует отметить, что даже однотипные виды рака с одинаковой степенью дифференцированности опухолевых клеток по-разному метастазируют у разных больных.
Все это говорит о необходимости поиска молекулярных маркеров, которые смогли бы предсказывать исход течения онкологического заболевания более точно, чем диагностика по гистологическому типу опухоли (хотя последний метод в настоящее время является наиболее точным из всех возможных). Кроме того, даже конкретная опухоль может быть в значительной степени гетерогенной и состоять из клеток, различных по своему метастатическому потенциалу, что было показано на клонированных субпопуляциях, выделенных из одной опухоли. Биологические причины такой вариабельности в настоящее время неизвестны.
Совершенно ясно, что для успешного лечения онкологических пациентов необходимо проводить масштабные исследования в области нахождения механизмов тканевой инвазии, метастатического роста и поиска биологических причин гетерогенности опухолей. Отсутствие гомогенности в опухолях, сходство опухолевых клеток со здоровыми клетками породившей ее ткани, и отсутствие четкого единичного критерия, по которому можно было бы отличить раковую клетку от здоровой, — все это вместе означает, что наши рассуждения о противоопухолевом иммунитете или о механизмах действия лекарственных цитостатических препаратов должны приниматься с изрядной долей скептицизма, особенно если они базируются на экспериментах с гомогенными опухолевыми культурами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лимфоваскулярная инвазия что это такое
хирург-онколог, маммолог, кандидат медицинских наук
Ленинградская область, Всеволожский район, пос.Кузьмоловский, Заозерная ул., 2
Врач в третьем поколении. Закончил в 1998 году с отличием Санкт-Петербургскую государственную медицинскую академию им. И.И. Мечникова, после чего сразу же поступил в клиническую ординатуру по хирургии этой же академии. Во время обучения в клинической ординатуре, которую с отличием закончил в 2000 году, получил специализацию по онкологии (1999). Начиная с 1999 года, обучение проводилось на базе Ленинградского областного онкологического диспансера (отделение общей онкологии). С 2000 по 2004 год проходил обучение в аспирантуре и в 2004 году защитил кандидатскую диссертацию на тему «Хирургическое и адъювантное лечение ранних форм рака молочной железы». Имею действительные сертификаты по хирургии (2021) и онкологии (2018), реконструктивной и пластической хирургии (2019). Являюсь лучшим маммологом Санкт-Петербурга 2016 года по версии сайта НаПоправку, лучшим маммологом Санкт-Петербурга в 2020 и 2021 годах по версии Prodoctorov.Ru
Лечу рак молочной железы по федеральным квотам в Клинической больнице Российской академии наук, принимаю и лечу пациентов в клинике онкологических решений ЛУЧ
С 2004 года являюсь главным исследователем и координатором международных клинических исследований по раку молочной железы в Ленинградском областном клиническом онкологическом диспансере, клинике онкологических решений ЛУЧ.
Имею более 10 печатных работ, в том числе в центральной зарубежной печати.
Рабочий телефон +7921 945 33 18
Мобильный телефон +7 921 945 33 18
Телефон администратора +7 981 710 40 41
Лимфоваскулярная инвазия что это такое
ГБУЗ Ярославской области «Клиническая онкологическая больница»
ФГБУ «Поликлиника №1» Управления делами Президента РФ
Ярославский государственный медицинский университет, Ярославль, Россия
Поверхностная карцинома тела желудка и лимфоваскулярная инвазия
Журнал: Доказательная гастроэнтерология. 2019;8(4): 22-27
Крайнова Е. А., Никонов Е. Л., Шубин Л. Б. Поверхностная карцинома тела желудка и лимфоваскулярная инвазия. Доказательная гастроэнтерология. 2019;8(4):22-27.
Krainova E A, Nikonov E L, Shubin L B. Superficial gastric cancer and lymphovascular invasion. Russian Journal of Evidence-Based Gastroenterology. 2019;8(4):22-27.
https://doi.org/10.17116/dokgastro2019804-05122
ГБУЗ Ярославской области «Клиническая онкологическая больница»
Цель исследования — усовершенствование гистологической диагностики поверхностных карцином желудка и выявление возможной связи гистологического строения опухоли и локализации ее в двух типах слизистой оболочки (тело, антрум) с лимфоваскулярной инвазией. Материал и методы. Для анализа использованы архивные гистологические препараты операционного хирургического и эндоскопического материала поверхностного Т1 РЖ. Определяли степень дифференцировки опухоли G1—G4, выявляли лимфоваскулярную инвазию с применением иммуногистохимического метода. Результаты. Лимфоваскулярная инвазия статистически значимо выше в опухолях тела желудка, в карциномах с дифференцировкой G2 и G3, в карциномах папиллярного гистологического типа. Выводы. Необходимы дальнейшие уточнения гистологических критериев эндоскопической курабельности в соответствии с локализацией опухоли, степенью дифференцировки.
ГБУЗ Ярославской области «Клиническая онкологическая больница»
ФГБУ «Поликлиника №1» Управления делами Президента РФ
Ярославский государственный медицинский университет, Ярославль, Россия
Рак желудка (РЖ) — это гетерогенная группа карцином с плохим в целом прогнозом, который зависит от стадии и представляется наиболее благоприятным при ранних поверхностных формах. Понятие «поверхностный» гастроинтестинальный рак определяется как инвазивный рак с ростом в пределах слизистого и подслизистого слоев. Поверхностные карциномы соответствуют T1 карциномам по классификации TNM 8-го издания [1].
Выявление рака желудка на ранней стадии позволяет проводить органосохраняющее эндоскопическое лечение, не приводящее к инвалидизации пациентов. По средним общемировым данным, 10-летняя выживаемость пациентов составляет около 90% [2].
Завершающим важным этапом лечения является гистологическое исследование материала эндоскопической диссекции с изучением в том числе горизонтальных и вертикального краев резекции и заключением о резектабельности материала (рис. 1, 2). 

По всем случаям патологоанатом оценивает гистологический тип опухоли. Существует несколько патогистологических систем классификации для диагностики рака желудка. По-прежнему неясно, какая система классификации предоставляет самую верную информацию, поэтому ее выбор в рутинной работе может варьировать. В дополнение к на-иболее используемому классу систем, таких как классификации P. Lauren [3] и ВОЗ [4], другие авторы попытались охарактеризовать и классифицировать рак желудка на основе микроскопической морфологии и применительно к клиническому результату.
Самая распространенная классификационная система — система ВОЗ не учитывает особенности гистогенеза и дифференцировки и включает 5 основных гистологических типов карцином — папиллярную, тубулярную, муцинозную, слабокогезивную и смешанную карциномы, а также около 10 редких подтипов. Считается, что папиллярные, тубулярные и муцинозные формы относятся к дифференцированным вариантам (высоко- или умеренно-, G1—G2), а разные формы слабокогезивного рака, включая перстневидно-клеточный, — к низко- или недифференцированному раку (G3—G4). Дифференцировка карцином желудка основывается на доле формирования железистых структур (высоко/G1 — более 95%; умеренно/G2 — 50—95%; низко/G3 — менее 50%), в недифференцированных (или мелкоклеточных) карциномах G4 отсутствует формирование железистых (тубулярных, папиллярных) структур на всех участках.
Наличие в гистологическом материале лимфоваскулярной инвазии подтверждено как наиболее важный прогностический признак и фактор риска для метастазирования в лимфатические узлы при раннем раке желудка [5—9]. При его обнаружении должен решаться вопрос о дальнейшем применении хирургического метода лечения вне зависимости от резектабельности опухоли.
В настоящее время нет полной ясности в вопросе о связи лимфоваскулярной инвазии с гистологическим типом опухоли по классификации ВОЗ и степенью дифференцировки — G1—G4. В руководстве D. Allen [10] упоминается о выявленных «парадоксальных» закономерностях, связанных с лучшим прогнозом при раннем диффузном раке, чем при интестинальном типе с выявленной инвазией в сосуды. Есть также упоминание о том, что ранних раков из общего числа карцином желудка около 10%, тем не менее они имеют высокую долю лимфоваскулярной инвазии (25%). H. Yu и соавт. [11] говорят о худшем прогнозе при «ранних» раках папиллярного строения, чем при тубулярных аденокарциномах.
N. Oue и соавт. [12] утверждают, что рак желудка — гетерогенное заболевание с различными фенотипами, и учитывают возможность разделения карцином желудка на кишечный и желудочный типы.
В литературе [13—15] описывается все больше случаев ранних раков желудочного фенотипа и иммунофенотипа, таких как аденокарцинома пилорических желез с преимущественной локализацией в теле желудка, карцинома из фундальных желез. По некоторым данным, более плохой прогноз и наличие метастазов в лимфатические узлы имеют корреляцию с локализацией в проксимальных анатомических отделах желудка, включая тело и угол.
Цель исследования — усовершенствование гистологической диагностики поверхностных карцином желудка и выявление возможной связи гистологического строения опухоли и локализации ее в двух типах слизистой оболочки (тело, антрум) с лимфоваскулярной инвазией.
Проанализировано 135 послеоперационных случаев спорадического рака желудка с инвазией в пределах слизистого pT1a и подслизистого слоев pT1b по системе TNM в отсутствие метастазов в лимфатические узлы. Оценивали гистологические архивные материалы после хирургических операций (резекция желудка, гастрэктомия) — 85 случаев и после эндоскопических операций (эндоскопическая резекция слизистой и подслизистая диссекция) — 50 случаев. Сравнивали ldt-группы РЖ с локализацией в антральном отделе желудка и теле (кислотопродуцирующий тип слизистой оболочки) желудка.
В соответствии с классификацией ВОЗ 2010 и TNM 8 использовали четыре степени гистологической дифференцировки опухолей:
1. Высокодифференцированные тубулярные аденокарциномы (G1), наличие в опухоли сформированных желез.
2. Высокодифференцированный папиллярный вариант (исследован отдельно).
3. Умеренно дифференцированные аденокарциномы (G2), формирующие тубулярные и ацинарные структуры, с умеренной клеточной атипией.
4. Низкодифференцированные аденокарциномы (G3) с наличием ацинарных или криброзных структур и выраженной клеточной атипией (рис. 3). 
5. Недифференцированные карциномы (G4), опухоли с диффузным или солидным типом роста, включая перстневидно-клеточный вариант.
Уточнялось наличие инвазии в лимфатические сосуды с использованием иммуногистохимического метода моноклональным антителом Podoplanin (D2−40) на иммуностейнере автоматическом BenchMark XT («Вентана Медикал Системс С.А..», Франция) (см. рис. 3).
Статистическая обработка производилась при помощи программы Statistica 10 версия (StatSoft Inc., 2011 г.).
Данные результатов сравнения частоты выявления РЖ по локализации представлены в таблице. 
Карциномы антрального отдела желудка выявлены как статистически значимо более частая локализация по сравнению с локализацией в теле желудка: χ 2 (df=1) 8,79, p=0,0030.
Поскольку инвазия в сосуды — один из самых важных факторов в отношении перспективы пациента, мы взяли этот показатель как основной и изучили методом непараметрической статистики (χ 2 Пирсона) корреляцию со следующими показателями: гистологический тип строения (3 варианта — тубулярный, папиллярный, общая группа низко- и недифференцированных карцином), степень дифференцировки по TNM 8 (4 группы — G1, G2, G3, G4) и локализация (2 варианта — тело и антрум).
Получены следующие результаты. Лимфоваскулярная инвазия статистически значимо выше в аденокарциномах с папиллярным вариантом строения: χ 2 (df=1) 6,79, p=0,0092. Остальные гистологические варианты, включая высокодифференцированные тубулярные, низко- и недифференцированные, не имели статистически значимых различий по этому критерию.
1. Лимфоваскулярная инвазия статистически значимо выше в умеренно- и низкодифференцированных G2, G3 аденокарциномах, чем в аденокарциномах G1 и G4: χ 2 (df=1) 8,63, p=0,0033.
2. Лимфоваскулярная инвазия статистически значимо выше в опухолях с локализацией в теле желудка, в участках кислотопродуцирующего типа: χ 2 (df=1) 10,45, p=0,0012.
Очевидно, что степень дифференцировки опухоли важна при оценке дальнейшего риска прогрессии, в то же время группа недифференцированных карцином не имеет корреляции с наличием лимфоваскулярной инвазии. Этот факт может свидетельствовать об эндоскопической резектабельности G4 карцином при ранних формах. Гистологические типы практически не играют роли при оценке риска развития лимфоваскулярной инвазии, за исключением папиллярного типа строения — с худшим, вероятно, прогнозом. Оценка гистологических типов больше важна при сравнении эндоскопической картины и типов рисунков строения. Аденокарциномы тела желудка, вероятно, имеют большую склонность к лимфоваскулярной инвазии по сравнению с локализацией опухоли в антральном отделе, это может подтверждать факт различия в канцерогенезе некоторых вариантов опухолей с преимущественной локализацией в теле желудка, более склонных к прогрессированию.
Изучение морфологии рака желудка при поверхностном опухолевом росте может наглядно демонстрировать этапы канцерогенеза с изучением фонового процесса и постканцерогенеза с учетом клинических данных. Исследуемые пациенты в целом имеют хорошие показатели выживаемости, как и описано при этих стадиях. Большинство пациентов не имеют опухоли с глубокой инвазией в подслизистый слой и метастазов в лимфатические узлы, а частота летальности 10% объясняется, вероятно, комбинацией множества неясных в настоящее время факторов. Необходимы дальнейшие уточнения гистологических критериев для выбора лечения в соответствии с локализацией опухоли, типом опухоли, степенью дифференцировки.
Концепция и дизайн исследования — Е.Н., Е.К.
Сбор и обработка материала — Е.К.
Статистическая обработка — Л.Ш.
Написание текста — Е.К.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Инвазивный рак
Независимо от вида и степени онкологии, следует отметить, что это крайне тяжелое заболевание. Причем его течение и развитие крайне сложно предугадать. Оно имеет определенные особенности.
«Инвазивный рак» – таким термином специалисты называют вид онкологии, при котором ткани, подвергшиеся мутации, распространяются за границы пораженной области на здоровые части тела. Начальная стадия инвазивного рака проявляется как развивающаяся опухоль. Этот процесс подразумевает проникновение измененных онкологией клеток в ткани на глубину до 6 мм за пределами пораженного участка.
Практика показывает, что больше всего шансов на эффективное лечение болезни наблюдается в момент стадии микроинвазии. Раковые опухоли имеют одинаковую природу происхождения с инвазивной карциномой.
Какие виды инвазивного рака существуют
Сегодня врачи-онкологи выделяют три разновидности инвазивного рака.
Первая. Карцинома протоковая. Данная патология возникает у женщин. Измененные клетки атакуют проток, по которому во время лактации течет молоко. Такой вид заболевания является наиболее распространенным и считается чрезвычайно опасным. Аномальные клетки в случае возникновения такой карциномы быстро проникают в лимфоток или системные кровотоки. Такая онкология проявляется в изменении формы женских сосков, приводя их деформации. Чаще всего с подобной проблемой сталкиваются женщины от 55 лет. Есть три стадии протокового карцинома:
Вторая. Рак протоковый преинвазивный. В этой стадии патология еще не может распространяться на ткани других органов, однако есть высокий шанс того что рак перейдет в инвазивную форму.
Третья. Рак дальковый инвазивный. Такой вид онкологии развивается из частей клеточных желез. Этот вид заболевания встречается в 10-16% случаев. При таком раке возникает одна или несколько опухолей. Еще стоит отметить, что данный тип рака крайне сложно диагностируется, так как при его развитии нет внешних факторов указывающих на заболевание.
Неспецифированные формы инвазивной онкологии
Данная форма заболевания отличается тем, что ее сложно отнести к конкретному виду: пртоковой карциноме или дольковому раку. Сегодня специалисты выделяют следующие виды неспецифированного рака:
Общим свойством всех выше перечисленных патологий является их гормонозависомость. Рак имеет эстрогены и рецепторы, поэтому его можно эффективно лечить с помощью специальной гормональной терапии. Однако если болезнь изначально образовалась в предменопаузе, то это значит, что она не имеет рецепторов и нужно применять другие средства борьбы.
Специалисты считают, что при развитии инвазивного рака, медуллярный вид опухолей лучше подается терапии и лечению, чем дольковая карцинома, протоковый рак или онкология Педжета.
Симптомы заболевания
В зависимости от того, на какой стадии находится инвазивный рак молочной железы, или инвазивный рак неспецифического типа, их симптомы могут проявляться по-разному. До того момента пока рак не выходит за границы своей изначальной структуры многие женщины в принципе не обращают на него внимание. Некоторые могут жаловаться на дискомфорт в момент касания молочных желез. Признаки морфологического типа на ранних стадиях инвазивного рака диагностировать крайне сложно. Только после того как опухоль начнет расти, появятся явные симптомы в виде:
Когда обращаться к специалисту
Инвазивный рак, как понятно из всего вышесказанного, очень сложно определить на первых стадиях. Однако женщины должны знать при появлении первых симптомов им следует идти к специалисту.
Сегодня диагностировать инвазивный рак молочной железы или инвазивный рак неспецифического типа могут опытные специалисты онкоцентра София, который расположен в центре Москвы.
Стадии заболевания
Врачи выделяют несколько стадий инвазивного рака.
Инвазивный рак шейки матки как развивается болезнь
Рак матки по статистике находится на втором месте по распространенности после рака молочных желез. Данное заболевание может иметь как неинвазивную так инвазивную форму. При этом переход от одного этапа болезни к другому может происходить очень долго.
В основном инвазивный рак шейки матки, как и инвазивный плоскоклеточный рак, встречается у женщин старше 40 лет. Фактором развития заболевания могут быть разные обстоятельства, в том числе он может развитья на фоне других болезней, например:
Какая бы ни была причина возникновения инвазивного плоскоклеточного рака или другого типа онкологии в онкоцентре София всегда готовы помочь людям с их проблемами. Здесь проводят эффективное лечение инвазивного рака.
Симптомы инвазивного рака матки
Среди симптомов данного заболевания доктора отмечают следующие факторы:
Все эти признаки повод пойти к врачу. В онкоцентре София квалифицированные специалисты проведут необходимые обследования, применяя самое современное диагностическое оборудование. В случае выявления патологии здесь предложат лучшее лечение инвазивного рака. Также специалисты смогут сделать прогноз по инвазивному раку для конкретного пациента. Найти центр можно в центральном округе Москвы.
Диагностирование рака
Сегодня диагностирование онкологии находится на очень высоком уровне. Благодаря современным технологиям врачи могут выявлять болезнь на ранних стадиях и проводить терапию. Среди средств, которые применяют специалисты, следует отметить:
А также многие другие аппараты.
Онкоцентр София располагается в ЦАО Москвы по адресу: 2-й Тверской-Ямской переулок, дом 10, метро «Маяковская». Записаться на прием можно через форму обратной связи или по телефону +7 (495) 995-00-34.