Липинильная инверсия что это такое
Липинильная инверсия что это такое
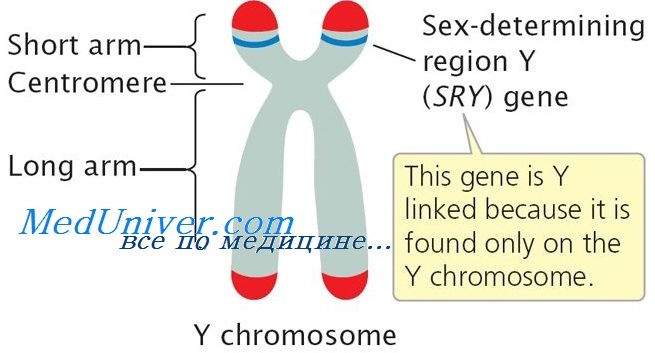
Этиология и встречаемость инверсии пола. Инверсия пола — панэтническое и генетически разнородное заболевание. Среди пациентов с полной гонадной дисгенезией наиболее частые причины инверсии пола — точковые мутации, делеции или транслокации гена SRY.
Приблизительно 80% мужчин 46,ХХ с полной дисгенезией гонад имеют транслокацию SRY на Х-хромосому, и 20-30% женщин 46,XY с полной дисгенезией гонад имеют мутацию или делецию гена SRY. Встречаемость мужчин 46,ХХ и женщин 46,XY составляет примерно 1 на 20 000.
Патогенез инверсии пола
SRY — связанный с ДНК белок, изменяющий структуру хроматина, изгибая ДНК. Эта связь и изменение свойств ДНК указывают, что белок SRY регулирует экспрессию генов.
В ходе нормального развития человека SRY необходим для образования мужских половых органов, но для образования женских половых органов его отсутствие не обязательно. Точный механизм влияния SRY на развитие мужских гонад неопределен, хотя некоторые наблюдения указывают, что SRY подавляет отрицательный регулятор развития тестикул.
Мутации в гене SRY, выявляемые у XY-женщин, вызывают потерю его функции. Среди XY-женщин 10-15% имеют делецию SRY (женщины XY, SRY), еще 10-15% имеют точковые мутации в пределах гена. Точковые мутации в гене SRY нарушают связь с ДНК или поворот ДНК.
Нарушение SRY у мужчин XX — транслокация SRY с Yp на Хр (мужчины XX, SRY+; рис. С-36, см. цв. вклейку). В мужском мейозе происходит кроссинговер между псевдоаутосомными регионами Хр и Yp; этот кроссинговер обеспечивает правильное расхождение и соответствие последовательностей в псевдоаутосомных регионах X и Y.
Тем не менее иногда рекомбинация происходит неправильно, захватывая центромеру, что приводит в передаче специфических последовательностей короткого плеча Yp-, включая ген SRY, на короткое плечо Хр.
Кроме SRY, Y-хромосома содержит, по крайней мере, три локуса (локусы факторов азооспермии AZFa, AZFb и AZFc), необходимых для нормального сперматогенеза. Отсутствие этих локусов, по крайней мере, частично, объясняет бесплодие у мужчин XX, SRY+.
Х-хромосома также содержит несколько локусов, необходимых для функционирования яичников и женской фертильности. Для развития овоцитов достаточно наличия одной Х-хромосомы, но для использования овоцитов необходимы две Х-хромосомы. В соответствии с этим наблюдением, у женских плодов XY овоциты закладываются, но фолликулы вырождаются еще до рождения или вскоре после него. Следовательно, бесплодие женщин XY объясняется отсутствием второй Х-хромосомы.
Фенотип и развитие инверсии пола
Мужчины XX, SRY+ имеют много признаков синдрома Кляйнфелтера (47,XXY), включая гипогонадизм, азооспермию, гиалиноз семявыносящих канальцев и гинекомастию. Несмотря на сниженный синтез тестостерона, у большинства пациентов пубертат развивается самостоятельно, хотя для достижения полной вирилизации может потребоваться введение тестостерона.
В отличие от пациентов с синдромом Кляйнфелтера, большинство мужчин 46,ХХ имеют нормальный рост, нормальные пропорции скелета, интеллект и меньше психосоциальных проблем. Пациенты с большим участком Yp в Х-хромосоме имеют большее сходство с синдромом Кляйнфелтера.
Женщины XY, SRY- имеют полную дисгенезию гонад, они обычно выше среднего роста для нормальных женщин. Эти пациентки имеют физические характеристики синдрома Тернера, только если делеция SRY связана с обширной делецией Yp. Поскольку у этих пациенток вместо яичников присутствуют только рубчики (полоски соединительной ткани), спонтанно пубертат у них не развивается.
В отличие от полной пенетрантности и сравнительно однородной экспрессивности, наблюдаемых при транслокациях или делециях гена SRY, точковые мутации SRY проявляют как неполную пенетрантность, так и варьирующую экспрессивность. Пациенты с точковыми мутациями в гене SRY обычно имеют полную дисгенезию гонад, рост выше среднего и у них не развиваются вторичные половые признаки.
Тем не менее описано несколько точковых мутаций SRY, связанных с бесплодием (полной дисгенезией гонад) при женском фенотипе и фертильностью при мужском фенотипе в одной и той же семье.
Особенности фенотипических проявлений инверсии пола:
• Возраст начала: пренатальный
• Бесплодие
• Недоразвитие вторичных половых признаков
• Однозначные гениталии
Лечение инверсии пола
У пациентов с полной дисгенезией гонад диагноз инверсии пола обычно устанавливают при расхождении данных УЗИ плода и кариотипа плода, или из-за отсутствия или неполного развития вторичных половых признаков и бесплодия. Доказательство того, что инверсия пола вторична по отношению к аномалии экспрессии SRY, требует демонстрации соответствующего изменения в гене SRY.
Для мужчин XX, SRY+ назначение андрогенов обычно способствует вирилизации, но лечение, предохраняющее от азооспермии, в настоящее время невозможно. Введение дополнительных андрогенов не помогает избежать гинекомастии. Если гинекомастия становится достаточно выраженной, пациентам приходится прибегать к хирургическому лечению.
Для женщин XY, SRY+ и женщин XY с точковыми мутациями гена SRY терапия эстрогенами обычно начинается в возрасте 14-15 лет, чтобы обеспечить развитие вторичных половых признаков. Для вызывания менструаций в схему лечения добавляют прогестерон либо в момент первого вагинального кровотечения, либо через 2 года после начала лечения эстрогенами.
Кроме того, из-за риска развития опухолей гонад, рекомендуется удаление неполноценных яичников после завершения роста скелета.
Как и при всех нарушениях половой дифференцировки или несоответствиях генетического и фенотипического пола, чрезвычайно важны психосоциальная коррекция и консультирование семьи и пациента. Большинство семей и пациентов имеют затруднения в понимании медицинских данных и получении соответствующих психосоциальных установок.
Риски наследования инверсии пола
Неправильная рекомбинация de novo — наиболее частая причина появления мужчин XX, SRY+ и женщин XY SRY_; следовательно, большинство пар с больным ребенком имеет низкий риск повторения у будущих детей. Тем не менее, иногда мужчины XX SRY+ и женщины XY SRY возникают в результате наследуемой делеции SRY или транслокации от отца со сбалансированной транслокацией между Хр и Yp.
Если отец — носитель транслокации, все дети будут или мальчиками XX, SRY+ или девочками XY, SRY-. Поскольку мужчины XX, SRY+ и женщины XY,SRY всегда бесплодны, они не могут передать заболевание потомкам.
Большинство женщин XY с точковыми мутациями в гене SRY имеют новые мутации. Родители больного ребенка, следовательно, обычно имеют низкий риск повторения у будущих детей; тем не менее, поскольку некоторые мутации SRY имеют неполную пенетрантность, здоровые фертильные отцы могут нести мутации SRY, способные вызвать инверсию пола у их детей с генотипом XY.
Пример инверсии пола. Женщина, 37-летняя служащая, беременна первым ребенком. Из-за возрастного риска иметь ребенка с хромосомной аномалией она решила провести амниоцентез, чтобы оценить кариотип плода; результат кариотипа нормальный, 46.ХХ. Тем не менее на 18-й нед гестации при УЗИ обнаружен нормальный плод мужского пола; последующее подробное УЗИ подтвердило мужской пол плода.
Женщина была здорова перед и в течение беременности, без влияния инфекций или лекAPCтв в ходе беременности. Ни она, ни ее партнер не имели в семейном анамнезе случаев неоднозначных половых органов, бесплодия или врожденных пороков.
Повторный хромосомный анализ подтвердил нормальный кариотип 46.ХХ, но методом FISH выявлено присутствие сигнала гена региона половой детерминации Y (SRY) в одной из Х-хромосом. На 38-й нед беременности пациентка без осложнений самостоятельно родила фенотипически нормального ребенка мужского пола.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Что такое липомоделирование?
Головна » Что такое липомоделирование?
Posted at 12:38h in Полезное by Admin
Благодаря пластической хирургии многие женщины и мужчины могут убрать лишнюю жировую ткань. Одним из таких методов коррекции фигуры является липомоделирование. К нему прибегают не только полные люди. А и все те, кто недоволен своей внешностью.
Что такое липомоделирование тела?
Это малотравматичная пластичная операция, позволяющая убрать жир с проблемных участков (талии, поясницы, живота, бедер). И переместить (перекачать) его в места с недостаточным количеством жира. Чаще всего это ягодицы.
Эта процедура объединяет в себе 2 процедуры — липофилинг и липосакцию.
С помощью липомоделирования можно:
Липомоделирование тела не подходит тем людям, кто хочет сбросить вес. Цель операции — создание упругого, тонизированного тела, а не похудение.
Особенности проведения процедуры
Перед коррекцией фигуры пластический хирург проводит консультацию, осмотр. Он изучает анамнез пациента. На основании полученных данных он подбирает подходящий метод липосакции. Далее пациент проходит обследование (анализы в том числе).
Перед липомоделированием хирург делает разметку. Анестезиолог проводит местную или общую анестезию в зависимости от объемов выводимого жира.
После этого он производит забор жировой ткани с проблемных зон путем липосакции. Это делается при помощи специальных канюлей. Откачанный жир затем микропорциями вводится в зоны с недостатком жировой ткани.
После операции места, где совершались проколы, закрываются стерильными пластырями. В течение месяца пациент должен носить компрессионное белье. Оно помогает убрать отечность тканей.
В клинике человек находится не больше 1-3 дней. После его выписывают домой с обязательным соблюдением послеоперационных мероприятий и ограничений.
Окончательный результат можно оценить через 3-4 месяца после вмешательства. В течение этого периода допускается проведение дополнительных коррекций.
Повторные процедуры выполняются по необходимости (например, если после рождения ребенка женщина набрала в весе и хочет убрать жир с проблемных зон).
Преимущества процедуры липомоделирования
Липомоделирование тела является эффективной процедурой, нацеленной на отличный результат:
Показания к липомоделированию тела
Липомоделирование лица проводится при наличии глубоких слезных борозд, складок, морщин. А также при асимметрии лица, его осунувшейся части. После процедуры лицо преображается: разглаживаются морщины и складки, появляются отчетливые формы. Пересаженная жировая ткань создает объем, упругость. Также улучшается качество кожи.
Липомоделирование грудных желез рекомендуется проводить с эстетической целью. Если женщина хочет увеличить объем или подкорректировать форму. Также эта процедура показана женщинам, которые делали коррекцию бюста путем установки силиконовых эндопротезов. Благодаря введению жира границы имплантов сглаживаются, грудь выглядит естественно.
Липомоделирование живота и боков. Многие женщины страдают от жировых отложений на животе и боках. Благодаря липомоделированию теперь легко можно убрать жир с этих зон. И не просто убрать, а использовать его для увеличения объема в других частях тела. Например, откачанным с живота жиром можно заполнить тонкие губы, впалые щеки или маленькую грудь.
Липомоделирование ягодиц позволяет создать объем, улучшить контуры, избавиться от обвислости кожи. Это актуально для тех женщин, у кого кожа обвисает с возрастом. Или для тех, кто резко сбросил вес.
Инверсия пола 46 XY
OMIM 400044
Наша команда профессионалов ответит на ваши вопросы
Инверсия пола, 46,XY
Наличие женского фенотипа при нормальном мужском кариотипе характеризует XY-инверсию пола. Наиболее частой причиной данного нарушения формирования пола является синдром Свайера – это полная или «чистая» дисгенезия гонад при кариотипе 46,XY. Частота XY-дисгенезии гонад составляет 1 на 30000 человек. Больные имеют женский фенотип без признаков двойственности полового развития: феминное телосложение, развитые по женскому типу наружные половые органы, нормально развитую или гипоплазированную матку и маточные (фаллопиевы) трубы. Однако у пациентов с синдромом Свайера практически отсутствуют женские половые железы, которые в данном случае представлены дисгенетичными гонадами, представляющими собой соединительнотканные тяжи (стреки) с небольшими включениями железистой ткани, овариально-подобной стромы без фолликулов. Как правило, диагностирование синдрома Свайера происходит у девочек в пубертатный период, когда у них не происходит нормального полового развития. Причиной обращения к врачу при этом является задержка полового развития и отсутствие начала менструаций, реже наличие злокачественных новообразований, происходящих из дисгенетичных гонад. Так как дисгенетичные гонады подвержены озлокачествлению, показано их удаление в детстве или на момент постановки диагноза XY-дисгенезии гонад. После оперативного лечения пациенткам, как правило, еще в подростковом возрасте назначается заместительная гормональная терапия, чтобы достичь нормального развития вторичных половых признаков и предотвратить развитие остеопороза. У женщин с XY-дисгенезией гонад нет собственных яйцеклеток, однако в некоторых случаях она в состоянии выносить плод, полученный в программе ЭКО при оплодотворении донорской яйцеклетки сперматозоидами супруга.
Инверсия пола, 46,XY тип 1 (OMIM 400044)
Наиболее частой из известных причин «чистой» формы дисгенезии гонад 46,XY являются микроструктурные перестройки Y-хромосомы c утратой гена SRY (Sex-determining region Y), а также точковые мутации данного гена. У 10-15% больных с синдромом Свайера обнаруживают отсутствие локуса SRY. В большинстве случаев это обусловлено утратой фрагмента дистальной части короткого плеча Y-хромосомы (Yp11.3), вследствие X-Y транслокации. Еще у 10-15% пациентов с данным синдромом выявляют мутации гена SRY.
Ген SRY локализован на коротком плече Y хромосомы и кодирует транскрипционный фактор – белок, связывающийся с генами, определяющими развитие пола плода по мужскому типу. Мутации в гене SRY приводят к синтезу функционально неполноценного белка и к нарушению дифференцировки клеток Сертоли и формирования семенных канальцев в развивающихся бипотенциальных гонадах плода, что вызывает дисгенезию гонад и развитие остальных органов половой системы по женскому типу, несмотря на наличие Y-хромосомы в кариотипе.
Инверсия пола, 46,XYтип 2 (OMIM 300018)
Данный тип XY-инверсии пола обусловлен дупликаций гена NR0B1 (DAX-1). Ген NR0B1локализован на коротком плече Х хромосомы (локус Хp21.3). Кодируемый этим геном белок DAX-1 играет важную роль в развитии и функции некоторых органов эндокринной системы, в том числе и половых желез. Еще внутриутробно он контролирует активность генов, участвующих в формировании этих тканей, а в постнатальном периоде DAX-1 регулирует выработку в них гормонов. Белок DAX-1 оказывает дозо-зависимый эффект на органы эндокринной системы. Дупликация гена NR0B1, а также делеция располагающегося рядом с геном NR0B1 локуса, негативно-регулирующего его транскрипцию приводит к XY-инверсии пола, обусловленной XY-дисгенезией гонад часто сочетающейся с нарушением функции надпочечников. Точковые мутации этого гена у пациентов с кариотипом 46,XY вызывают нарушение развития тестикулярной ткани, приводят к дефициту маскулинизации. Мутации в этом гене также вызывают Х-сцепленную гипоплазию надпочечников, как у пациентов с кариотипом 46,ХХ так и 46,XY.
Инверсия пола, 46,XY тип 3 (OMIM 612965)
Инверсия пола, 46,XY тип 4 (OMIM 154230)
Эта форма XY-инверсии пола обусловлена делецией локуса 9p24.3. У пациенток отмечают нормально развитые по женскому типу наружные половые органы, нормально развитую или гипоплазированную матку, при гистологическом исследовании гонад обнаруживают наличие незрелой тестикулярной ткани, содержащей клетки Сертолли, и отсутствие зрелых половых клеток. Инверсия пола у данных пациентов, вероятно, обусловлена потерей одной из копий дозо-чувствительного гена, локализованного в данном локусе. Генами-кандидатами являются DMRT1 и DMRT2.
Инверсия пола, 46,XY тип 5 (OMIM 613080)
Данная аутосомно-рецессивная форма инверсии 46,XY обусловлена наличием мутаций в гене CBX2, расположенного на хромосоме 17 (локус 17q25). В 2009 году Байсон-Лаубер описал случай новорожденной девочки с кариотипом 46,XY, у которой в результате секвенированияв гене CBX2 были обнаружены две мутации (P98L и R443P). В результате исследований у девочки были обнаружены нормально развитые яичники, с наличием овариальной ткани и первичных фолликулов, а также влагалище и матка. Однако возраст еще был слишком мал, чтобы оценить ее фертильность и дальнейшее половое развитие.
Инверсия пола, 46,XY тип 6 (OMIM 613762)
XY-инверсия пола связана с наличием мутации в гетерозиготном состоянии в гене MAP3K1, расположенном в локусе 5q11.2. Пациентки с данной формой дисгенезии гонад имеют высокий рост, который, вероятно, обусловлен избыточной продукцией андрогенов, тяжевидные яичники, гипоплазированную матку, иногда наблюдается клиторомегалия.
Инверсия пола, 46,XY тип 7 (OMIM 233420)
Инверсия пола обусловлена наличием у пациенток мутаций в гомозиготном или компаунд-гетерозиготном состоянии в гене DHH, расположенного в локусе 12q13.12. У нескольких пациенток было описано наличие недоразвитой матки, также присутствовали фаллопиевы трубы и наблюдали полную форму ХY-дисгенезии гонад (тяжевидные гонады, которые часто озлокачествлялись).
Инверсия пола, 46,XYтип 8 (OMIM 614279)
Данный тип XY-инверсии пола обусловлен мутациями гена AKR1C2, лежащего в локусе 10p15, отвечающего за альтернативный путь синтеза дигидротестостерона. Мутации сцепленного с ним гена AKR1C4, который сегрегирует вместе с геном AKR1C2, могут влиять на выраженность фенотипических проявлений.
В Центре Молекулярной Генетики проводится молекулярный анализ ключевых генов, контролирующих дифференцировку пола, в частности выполняется секвенирование генов SRY и NR5A1 (SF1), а также с помощью количественного метода MLPA проводится поиск делеций и дупликаций генов SRY, NR5A1 (SF1), NR0B1 (DAX-1).
Липинильная инверсия что это такое
ФГБУ Эндокринологический научный центр Минздравсоцразвития Российской Федерации
ФГБУ «Эндокринологический научный центр» МЗ РФ, Москва
ФГБУ «Эндокринологический научный центр» Минздрава РФ, Москва
ФГУ Эндокринологический научный центр Минздравсоцразвития Российской Федерации, Москва
ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России, Москва, Россия
ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России, Москва, Россия
Институт детской эндокринологии Эндокринологического научного центра, Москва
Эндокринологический научный центр, Москва
Нарушение формирования пола 46,XY, ассоциированное с мутациями в гене MAP3K1. Описание клинических случаев
Журнал: Проблемы эндокринологии. 2018;64(1): 45-49
ФГБУ Эндокринологический научный центр Минздравсоцразвития Российской Федерации
Причинами нарушения формирования пола (НФП) 46,XY могут быть мутации ряда генов, вовлеченных в процесс дифференцировки гонад. XY-инверсия пола может являться также следствием нарушений на уровне гена митоген-активированной протеинкиназы (MAPK) киназы киназы 1 (MAP3K1) и MAPK-сигнального пути. В последнее десятилетие было доказано участие MAPK-пути в инициации экспрессии гена SRY при формировании мужского гонадного пола у млекопитающих. Роль MAPK-сигнального пути в формировании пола у людей изучена недостаточно. Вероятно, MAP3K1 и MAPK-сигнальный путь являются одним из генетических путей, контролирующих нормальное развитие яичек. В настоящее время в литературе описано несколько семей и спорадических случаев НФП 46,XY вследствие мутаций в гене MAP3K1. Клиническая картина НФП у этих пациентов различна и варьирует от женского фенотипа с правильным строением наружных гениталий до мужского фенотипа с гипоспадией. Мы приводим описания редких клинических случаев нарушений формирования пола 46,XY (семейный случай НФП у единоутробных сестер и спорадический случай) с не описанными ранее мутациями в гене MAP3K1. В статье также кратко анализируется литература по данной патологии.
ФГБУ Эндокринологический научный центр Минздравсоцразвития Российской Федерации
ФГБУ «Эндокринологический научный центр» МЗ РФ, Москва
ФГБУ «Эндокринологический научный центр» Минздрава РФ, Москва
ФГУ Эндокринологический научный центр Минздравсоцразвития Российской Федерации, Москва
ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России, Москва, Россия
ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России, Москва, Россия
Институт детской эндокринологии Эндокринологического научного центра, Москва
Эндокринологический научный центр, Москва
Нарушения формирования пола (НФП) — группа врожденных патологий, сопровождающихся атипичным развитием хромосомного, гонадного и анатомического пола [1]. Формирование мужского пола определяется в первую очередь экспрессией гена SRY на Y-хромосоме, способствующего развитию недифференцированных гонад в тестикулы [2]. Наряду с геном SRY идентифицирован ряд генов и сигнальных путей, участвующих в детерминировании пола и ассоциированных с широким фенотипическим спектром НФП [3]. В недавних исследованиях были выявлены мутации в гене митоген-активированной протеинкиназы (MAPK) киназы киназы 1 (MAP3K1, также известном как MEKK1), которые были связаны с нарушением формирования пола 46, XY [4, 5]. Роль сигнального пути MAPK в определении пола у людей не изучена. Вероятно, MAP3K1 и MAPK-сигнальный путь является одним из генетических путей, контролирующих нормальное развитие яичек. В настоящее время в литературе описано несколько семейных и спорадических случаев НФП 46, XY, обусловленных мутациями в данном гене [4, 5]. Известные случаи НФП 46, XY, ассоциированные с геном MAP3K1, отличаются различной клинической картиной, варьирующей от женского фенотипа с правильным строением наружных гениталий до мужского фенотипа с микропенисом и гипоспадией различной степени.
Клинический случай № 1
Пациентка О. при рождении была зарегистрирована в женском поле и воспитывалась как девочка. По данным медицинской документации, при первичном патронаже была выявлена гипертрофия клитора, однако обследование не проводилось, к эндокринологу не обращались. У пациентки отмечался спонтанный поздний пубертат с нарушенным порядком появления вторичных половых признаков (адренархе в 14 лет, телархе в 17 лет), первичная аменорея. Впервые была обследована по месту жительства в возрасте 16 лет. Был выявлен гипергонадотропный гипогонадизм (ЛГ 23,4 мМе/мл, ФСГ 99,1 мМЕ/мл), кариотип 46, XY.
Девочка была госпитализирована в детское отделение ФГБУ ЭНЦ в возрасте 17 лет. При объективном осмотре отмечался нормальный рост (164,3 см, SDS роста +0,35), половое созревание соответствовало стадии II по Таннеру (В2Р2). Наружные половые органы были сформированы неправильно [клитор гипертрофирован (2,5—3 см) с головкой, слабо развитые кавернозные тела, меатус у основания клитора, скротолабиальный шов расщеплен, вход во влагалище сужен]. Отмечались высокий уровень гонадотропинов [ЛГ 88 Ед/л (2,6—12), ФСГ 104 Ед/л (1,9—11,7)], эстрадиола [70 пмоль/л (97—592)], тестостерона [3,11 нмоль/л (0,1—2,7)]. Показатели дигидроэпиандростендиона-сульфата (ДГЭА-С) и 17-гидроксипрогестерона (17-ОНП) находились в пределах референсных значений [7,52 мкмоль/л (0,92—7,6) и 3,6 нмоль/л (0,1—7,0) соответственно]. При МРТ органов малого таза определялись матка в виде тяжа 2,3×0,9 см и гонады (справа 2×1 см, слева 0,7×1,4 см). Был установлен диагноз: нарушение формирования пола 46, ХУ и рекомендована диагностическая лапароскопия, при которой в малом тазу были обнаружены гипоплазированная двурогая матка, две маточные трубы, дисгенетичные гонады с обеих сторон. При морфологическом исследовании операционного материала в ФГБУ ЭНЦ была верифицирована двусторонняя гонадобластома. При повторном исследовании гистологических препаратов в ФНКЦ ДГОИ им. Д. Рогачева была подтверждена двусторонняя гонадобластома с трансформацией в дисгерминому с правой стороны. Девочка была консультирована онкологом. Учитывая данные КТ органов грудной клетки (очаговых и инфильтративных изменений не выявлено), гистологический тип опухоли и стадию заболевания, химиотерапия не назначалась. Рекомендована непрерывная заместительная терапия женскими половыми гормонами. В последующем проведена феминизирующая пластика наружных гениталий.
Пациентка Б., 13,5 года, единоутробная сестра пациентки О., была обследована в связи с отсутствием спонтанного пубертата и диагностированием НФП 46, XY у старшей сестры (см. рисунок). 
При рождении отмечалось правильное строение наружных гениталий. По данным обследования, проведенного в возрасте 13 лет, был также определен кариотип 46, XY, при УЗИ органов малого таза — аплазия матки и яичников. При клиническом осмотре рост девочки составил 155,9 см (SDS роста = –0,64), половой статус соответствовал стадии I по Таннеру. Наружные половые органы были сформированы по женскому типу. Лабораторно был подтвержден гипергонадотропный гипогонадизм [ЛГ 39,9 Ед/л (2,6—12), ФСГ 137 Ед/л (1,9—11,7), эстрадиола 43,3 пмоль/л (97—592)], отмечался нормальный уровень тестостерона [0,6 нмоль/л (0,1—2,7)]. При МРТ органов малого таза была выявлена матка в виде тяжа, гонады не визуализировались. При диагностической лапароскопии в малом тазу обнаружена гипоплазированная матка, две маточные трубы, гонады в виде стреков. Морфологическое исследование операционного материала верифицировало дисгенезию гонад по овотестикулярному типу.
Обеим пациенткам было проведено молекулярно-генетическое исследование методом высокопроизводительного параллельного секвенирования с использованием разработанной в ФГБУ ЭНЦ панели олигонуклеотидов, предназначенной для анализа 45 генов, ассоциированных с различными формами нарушения формирования пола. У обеих девочек была выявлена гетерозиготная мутация p. C691R в гене MAP3K1. Данная мутация не была прежде описана. У матери пациенток молекулярно-генетическое исследование на данный момент не проведено. Однако учитывая наличие идентичной гетерозиготной мутации MAP3K1 у единоутробных сестер, зачатых от разных отцов, можно сделать вывод, что данная миссенс мутация была унаследована от матери и, вероятно, послужила причиной НФП 46, XY.
Клинический случай № 2
У пациента М. при рождении отмечалось неправильное строение наружных половых органов. При обследовании по месту жительства был определен кариотип 46, ХУ. В гормональном профиле в возрасте 8,5 мес отмечался незначительно повышенный уровень ФСГ (5,28 мМЕ/мл), низкие показатели тестостерона, ЛГ и 17-ОНП. При УЗИ яички лоцировались в мошонке (справа 0,75×0,52 см, слева 0,87×0,59 см). При К.Т. малого таза предстательная железа и семенные пузырьки не визуализировались.
Ребенок впервые был обследован в ФГБУ ЭНЦ в возрасте 11 мес. При осмотре обращало на себя внимание неправильное строение наружных гениталий [яички пальпировались в расщепленной мошонке, искривленный половой член длиной около 3 см, кавернозные тела плотные, головка полового члена сформирована, по дорсальной поверхности — рассекающая борозда полового члена; узкий урогенитальный синус, открывающийся на мошонке (мошоночная форма гипоспадии); половой член за счет искривления утоплен в мошонке]. Отмечались: незначительное повышение уровня ФСГ [3,8 Ед/л (0—2)], низкие показатели тестостерона [(0,17 нмоль/л (0,3—0,6)], ЛГ [0,2 Ед/л (0—1,5) и антимюллерова гормона [12,8 нг/мл (63—132)]. При мультистероидном анализе крови данных за нарушение стероидогенеза не получено. При пробе с хорионическим гонадотропином (4 инъекции по 1000 МЕ) отмечалось повышение уровня тестостерона до 5,7 нмоль/л, что свидетельствовало о нормальном функционировании клеток Лейдига. Ребенку был установлен диагноз: НФП 46, XY, в дальнейшем были проведены пластические операции по устранению искривления полового члена и гипоспадии. При молекулярно-генетическом исследовании (панель генов «нарушение формирования пола») выявлена гетерозиготная мутация с.2858 2872del CAАCААCААCААCАА р.944 948del в гене MAР3К1. Данная мутация также не была ранее описана. Планируется проведение молекулярно-генетического исследования гена MAР3К1 с целью поиска аналогичной делеции.
Обсуждение
MAPK активируются посредством эволюционно консервативного трехкомпонентного сигнального каскада, состоящего из митоген-активированной протеинкиназы киназы киназы-1 (MAP3K1), MAP2K и MAPK [3]. MAPK-сигнальные пути являются ключевыми путями регуляции клеточной пролиферации и дифференцировки [6, 7]. Нарушения в регуляции MAPK-каскада способствуют развитию ряда онкологических заболеваний [8]. Относительно недавно была выявлена ассоциация MAP3K1 с нарушением формирования пола 46, XY, однако роль MAPK-сигнального пути в развитии данной патологии у людей до сих пор не изучена. Экспрессия MAP3K1 наблюдается в эмбриональной гонаде мышей на 11-й день после зачатия, что соответствует стадии формирования гонад, а также на 13-й день после зачатия в канальцах яичек [4]. Роль MAPK-пути в определении пола у млекопитающих была определена посредством идентификации мутаций гена MAP3K4 у мышей, у которых инверсия пола предположительно связана с неспособностью активировать экспрессию гена SRY [9, 10]. Показано, что при отсутствии двух изоформ митоген-активированной протеинкиназы киназы киназы-1 (p38a и p38b) формируется инверсия пола XY, которая также обусловлена нарушениями на уровне экспресии SRY [11]. Таким образом, имеющиеся в литературе данные свидетельствуют об участии MAPK-пути в инициации соответствующей экспрессии SRY при формировании мужского гонадного пола у млекопитающих. У людей взаимосвязь между мутациями в гене MAP3K1 и нарушением формирования пола 46, XY была впервые прослежена при анализе сцепления генов на длинном плече 5 хромосомы у пациентов с НФП из двух семейств и в 11 спорадических случаях [4]. Было идентифицировано 6 мутаций в гене MAP3K1 и проведен их функциональный анализ. Клинические проявления в описанных случаях были различны, начиная от полностью женского фенотипа без вирилизации наружных гениталий до мужчин с микропенисом и/или с гипоспадией. Различный фенотип при одной и той же мутации отмечался и среди пациентов в пределах одной семьи. В другом исследовании у 4 пациентов с НФП 46, XY, преимущественно с мужским фенотипом и разной степенью нарушения развития наружных гениталий, были также выявлены мутации в гене MAP3K1 [5]. При сопоставлении генотипа и фенотипа при одной из идентифицированных миссенс-мутаций было установлено, что у всех пациентов с этой мутацией отмечался мужской фенотип с гипоспадией. Данная миссенс-мутация также ассоциирована с бронхиальной астмой [12]; аномалии развития наружных гениталий ранее не были описаны. Таким образом, ее значимость остается неизвестной.
Интересно, что у нокаутных по MAP3K1 мышей не наблюдается реверсии пола [13, 14]. Эти животные остаются жизнеспособными с сохранной репродуктивной функцией, но со сниженным количеством клеток Лейдига и увеличенной длиной эмбриональных гонад. Поэтому авторы предположили, что MAP3K1 не играет существенной роли при формировании тестикулов у мышей. Это может свидетельствовать о том, что сигнальные пути MAP-киназы у человека и мыши не идентичны [3]. На сегодняшний день роль MAP3K1 в определении пола у людей остается малоизученной. Фенотип полной дисгенезии гонад 46, XY аналогичен фенотипу при мутациях в гене SRY, т. е. мутации MAP3K1 могли бы влиять на ранние стадии формирования яичек.
У наших пациентов с НФП 46, XY при молекулярно-генетическом исследовании на панели, которая включала 45 генов, ассоциированных с различными формами нарушения формирования пола, мутации были найдены только в гене MAP3K1. В описанных нами случаях у пациентов с идентифицированными мутациями в гене MAР3К1 отмечалась различная клиническая картина НФП 46, XY, характеризующаяся разной степенью дифференцировки гонад и формирования наружных гениталий. В первой представленной нами семье предполагается наследование гетерозиготной мутации от матери, что характерно для семей с НФП 46, XY вследствие мутаций гена MAP3K1 [4]. Выявленные гетерозиготные мутации прежде в литературе не были описаны. С целью подтверждения их патологической значимости планируется проведение молекулярно-генетического исследования родителям пациентов.
Заключение
Причиной нарушения формирования пола 46, XY может служить патология целого ряда генов, вовлеченных в процесс дифференцировки гонад. Участие гена MAP3K1 и MAP-киназного сигнального пути в развитии НФП было установлено относительно недавно и в настоящее время недостаточно изучено. Клинические проявления у пациентов с 46, XY НФП, предположительно обусловленных мутациями в гене MAP3K1, отличаются выраженной гетерогенностью. Данных о значимой корреляции генотипических и фенотипических особенностей в литературе нет. Учитывая вероятность вовлечения MAP3K1 и MAPK-сигнального пути в процесс нормального развития яичек, необходимо дальнейшее изучение патологической значимости мутаций данного гена в развитии различной клинической картины НФП 46, XY.
Источники финансирования. Молекулярно-генетическое исследование на панель генов «нарушение формирования пола» выполнено при содействии Фонда поддержки и развития филантропии «КАФ». Авторы декларируют отсутствие иных явных и потенциальных конфликтов интересов, о которых необходимо сообщить.
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи. Получены письменные информированные согласия пациентов на публикацию представленных медицинских данных в этом журнале.