Литий что это за металл
Литий металл. Свойства лития. Применение лития
Описание и свойства лития
Литий – элемент, с отношением к первой группе, во втором периоде таблицы, его атомный номер – 3. Формула лития — Li2O. Элемент открыли в 1817 г., был произведён только 1825 г. Название дословно переводится как «камень».
Литий – это металл, с щелочными свойствами, серебристого цвета, обладающий выраженными пластичными свойствами. Легко поддаётся обработке. Характерен наиболее большой температурой плавления, это 180,54º С, кипения — 1340º С и низкой плотностью по сравнению с остальными металлами щелочного ряда. Его плотность ниже плотности воды. Это позволяет ему оставаться на плаву на водной поверхности и даже в керосине.
Атом лития своими небольшими размерами позволяет металлу выказывать определённые свойства. Смешение с натрием происходит только в определённой температуре,а с цезием, рубидием и кадмием, он не смешиваться вовсе. Остальные металлы этого ряда подобными свойствами не обладают.
Не смотря на то, что литий это металл с щелочных свойств, он наименее активный из всех прочих, и с кислородом не взаимодействует, с сухим тоже. Поэтому хранить его в керосине, защищая от взаимодействия с кислородной средой, как это делается с другим щелочным металлам, нет необходимости.
К тому же это бесполезно – на практике он всё равно всплывёт на поверхность. Поэтому его можно спокойно хранить на открытом воздухе длительное время, не опасаясь, что в нём произойдут нежелательные изменения.
При достаточной влажности происходит реакция с азотом и другими газами, растворёнными в воздухе. Превращения зависят от свойств контактирующего агента (газа). Может образоваться гидроксид, карбонат или нитрит лития. В процессе нагревания в кислородной среде образуется оксид лития Li2O.
Определить литий несложно – оказавшись в открытом пламени, он окрашивает его своеобразными красными оттенками. Самовоспламеняется при 300º С. Следует быть осторожным при этих процессах, так как продукты его горения раздражающе действуют на оболочки дыхательных путей, а также глаза. Также он может вызвать ожоги, попадая на мокрую кожу.
Реакция на воду спокойная, при неё образуется гидроксид лития и водород. Также характерны реакции с этилом, водородом, и аммиаком. Реакция на серу происходит при 130º С, с образованием сульфидов. На углерод реагирует при 200º С, в полном вакууме, во время этого образуется ацетиленид. Растворяясь в аммиаке, образует раствор синеватого цвета.
При необходимости длительного хранения литий хранится в отдельных коробках из жести, погружённый в петролинейный эфир или парафин.
Месторождения и добыча лития
Литий представитель литофильных фрагментов ионного происхождения, из них можно отметить цезий, калий и рубидий. К основным минералам, содержащим литий, относятся пироксен, сподумен, слюда и лепидолит. Помимо его нахождения в самостоятельно образованных минералах, его можно обнаружить на месте калия в сторонних соединениях.
Образование лития происходит на почве редкометальных гранитных интрузий, в литиеносных пегматитах или гидротермальных месторождениях, которые помимо лития, в комплексе с вольфрамом, висмутом, оловом и т.д. Наиболее высокая концентрация лития, присуща породам онгонитам – гранитам, содержащих большое количество воды и фтористых образований.
В определённом количестве литий содержит вода в сильносолёных озёрах. Его месторождения имеются в Бразилии, Аргентине, Чили, Канаде, США, Конго, Швеции, Испании, Афганистане, Китае, и Австралии. А также в России, где половина залежей содержащих этот элемент, находится в Мурманской области.
Применение лития
Литий применяется в изготовлении керамики и стеклянной продукции, источников напряжения, горюче-смазочных материалов и полимеров, а также в металлургической промышленности и фармацевтике.
Нередко для устройства требуется мощный и ёмкий аккумулятор. Литий наиболее подходящая составляющая для его изготовления. Если для начинки используется литий, батарея прослужит гораздо дольше. Можно отметить, например, литий-ионный тип подзаряжающихся батарей.
Купить аккумуляторы литийного типа можно двух типов. Разница заключается в используемых электролитах. Литий-ионный аккумулятор – содержит электролит гелевого типа. Модель используется для питания большинства портативной электротехники, в частности, сотовых телефонах, ноутбуках, цифровых фотоаппаратах и видеокамерах.
Литий-полимерный аккумулятор – усовершенствованный вариант первого. В виде начинки используется полимер, содержащий литий. Для устройств имеющих большое потребление энергии, более подходит литий-полимерный вариант.
Также литий добавляют в электролиты других типов аккумулирующих устройств, например, щелочного вида. Это значительно повышает их ёмкость и срок эксплуатации.
Идёт этот металл и на медицинские нужды. Доказано, что в небольшом количестве он необходим для нормальной работы организма. Его содержат все внутренние органы. Он участвует во многих обменных процессах и стимулирует иммунитет. Он применяется в препаратах для лечения психологических заболеваний и благотворно сказывается на работе нервной системы.
Цена лития
До 2008 г цена на литий постепенно росли, потом в связи с экономическим кризисом заметно упали. Если в то время цена на килограмм лития составляла порядком 66 долларов, то позже она понизилась с отметки 6,5 тыс. долларов до 5 тыс. долларов за тонну продукта, и после почти не поменялась. Но данные расценки относятся к товару относительно низкого качества.
Прогнозы мирового рынка лития дают определённые надежды на его развитие. Это в основном обусловлено новыми амбициозными проектами в области строения электромобилей, для которых использоваться будут соответственно литиевые аккумуляторы.
С каждым годом этот проект становится всё более реальным, в связи со злободневностью загрязнения окружающей среды выхлопными газами и повышенным спросом на доступные средства передвижения.
Особенно проблема актуальна для развивающихся стран. Но сама технология ещё сырая, в частности, это проблема с хорошими дорогами, и электрическими заправками. Поэтому крупных подвижек на мировом рынке лития в ближайшие годы не предвидится.
Литий: зачем нужен, как добывается и хватит ли его нам?
Так выглядит литийсодержащая руда
Литий — один из критически важных элементов для всей нашей цивилизации. Конечно, когда мы говорим о литии, на ум сразу приходят Li-ion батареи. И действительно, львиная доля добываемого лития уходит на нужды производителей аккумуляторов. Тем не менее, он используется и в других сферах.
Например, в металлургии, как черной, так и цветной, — металл применяется для раскисления и повышения пластичности и прочности сплавов. Также с его помощью производят стекла, которые частично пропускают ультрафиолет, он применяется в керамике. И это если не говорить о ядерной энергетике и атомной технике — его используют для получения трития. Короче, литий в буквальном смысле нарасхват. Под катом — поговорим об аккумуляторах, Tesla, способах добычи лития и его дефиците.
Но главное, конечно, батареи
Да, сейчас большая часть добываемого в мире лития уходит на производство литиевых аккумуляторов. По расчетам, на производство одной батареи для Tesla Model S требуется 63 кг этого металла с 99,5% чистоты.
Теперь давайте подумаем, что будет, если все, абсолютно все автомобили внезапно станут электрическими, с литиевыми батареями. По данным на 2016 год автомобилей в мире было 1,3 млрд. Сейчас, наверное, еще больше, но окей, воспользуемся этими данными четырехлетней давности.
Пусть не все новоявленные электрокары имеют настолько же вместительную батарею, как Tesla, уменьшим вес лития, необходимого для производства, на треть. Получается, что на одну такую батарею необходимо 44,1 кг чистейшего лития. Для наших 1,3 млрд автомобилей нужно 57,33 млрд кг лития. Неплохо, это 57,33 млн тонн лития, и только для нужд автомобильной промышленности.
К 2023 году массовое производство электромобилей стартует на предприятиях Mercedes, BMW, Toyota, Ford, Audi, Porsche, Volvo, Huyndai, Honda. По подсчетам экспертов, эти компании будут производить около 15 млн электрокаров ежегодно, на что потребуется около 100 000 тонн лития в год.
Но ведь не электромобилями едиными. У нас же в ходу миллиарды экземпляров разной техники с аккумуляторами — смартфонов, ноутбуков, планшетов и т.п. Они маленькие, да, но и для них понадобится много лития. Правда, гораздо меньше, чем для батарей электромобилей — на производство батарей для мобильных устройств уходит несколько процентов общемирового производства лития. В 2017 году Apple использовала всего 0,58% общемировых объемов добычи этого металла.
Но есть и другие батареи. Та же Tesla разрабатывает и реализует огромные аккумуляторные системы, которые служат для нивелирования скачков потребления энергии в пиковые часы. В крупном аккумуляторе содержится не менее тонны лития. Пока что производство таких систем не слишком масштабное, но через время все может измениться.
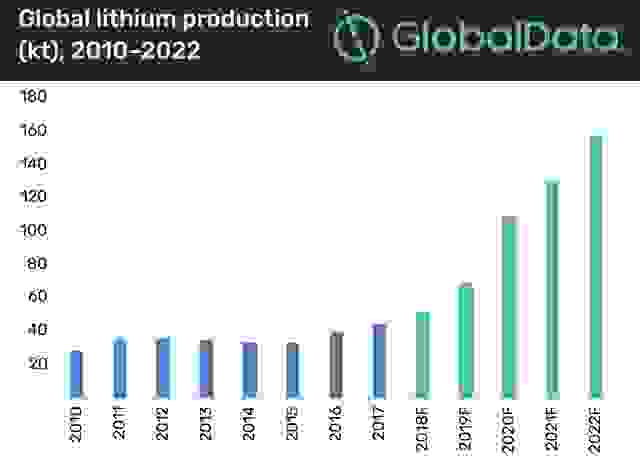
В целом, общемировое потребление лития к 2025 году составит не менее 200 000 тонн этого металла.
А как его добывают и хранят?
Литий — очень активный химически металл, поэтому его добыча ведется несколько отличными от добычи большинства прочих, обычных металлов способами. Есть два способа выделить Li.
Первый — из пегматитовых минералов, которые состоят из кварца, полевого шпата, слюды и других кристаллов. Ранее это был основной источник лития в мире. В Австралии, например, его добывают из сподумена, руды лития, минерала, который относится к пироксенам.
Второй — из глин солончаков. Такие есть в Южной Америке и той же Неваде, о которой говорилось выше. Насыщенные литием рассолы можно «обогащать» при помощи испарителя на солнечной энергии. Затем, после достижения нужной концентрации гидроксида лития, его осаждают, добавляя карбонат натрия и гидроксид кальция. Этот процесс не очень дорогой, но занимает продолжительное время — от 18 до 24 месяцев. Именно такой способ планирует использовать Маск.
У второго способа есть проблемы: при получении лития таким способом литий получает примеси — железо или магний (от магния сложнее всего избавиться). Тем не менее, на солончаковых землях много лития, и это делает второй способ очень привлекательным — от примесей все же можно избавиться.
К слову, солончаки как раз не входят в списки разведанных месторождений, поскольку добыча лития выпариванием солевых растворов — новый метод, который ранее не применялся. Так что вполне может быть, что запасов лития на Земле гораздо больше, чем считается.
Очень много лития в солончаковой пустыне Салар-де-Уюни на юго-западе Боливии. Под твердой коркой находится жидкий рассол с концентрацией лития в 0,3%.
Есть и другие способы, но все они чисто лабораторные. Например, пару лет назад на Хабре публиковалась новость о том, что литий можно добывать из рассолов при помощи металл-органических каркасных мембран.
Они копируют механизм фильтрации — ионную селективность — мембран биологических клеток в живых организмах. Кроме лития, этот способ дает и пресную воду, тоже ценный продукт. Но, к сожалению, ни стоимость, ни возможность масштабирования этого способа не освещены учеными. Да и спустя два года о коммерциализации метода так ничего и не слышно.
Еще литий можно добывать… из литиевых батарей. То есть перерабатывать батареи, получая снова металлический литий и другие необходимые для создания аккумуляторов материалы. Но пока что переработка батарей ведется в малых объемах. Это достаточно сложный и дорогой процесс, так что в ближайшее время вряд ли мы услышим о строительстве крупных заводов по переработке батарей. Да, ученые работают над этим, но все это пока что лишь исследования.
Сколько всего лития на Земле?
Да не так уж и много. Вернее, того, что разведали, относительно немного. В 2019 году глобальные подтвержденные запасы этого металла оценивались в 17 млн тонн. В России — около 900 000 тонн. Если взять потенциально «плодородные» месторождения, то получится около 62 млн тонн. Возможно, геологи разведают новые месторождения, но в любом случае лития на Земле мало.
Два года назад добыто было около 36 000 тонн. При этом 40% металла идет на аккумуляторы, 26% —на производство керамических изделий и стекла, 13% — выпуск смазочных материалов, 7% —металлургию, 4% — системы кондиционирования, 3% — медицина и полимеры.
Основные поставки лития ведутся из Австралии (18,3 тыс. тонн в год), затем Чили (14,1 тыс. тонн в год) и Аргентина (5,5 тыс. тонн в год). В ближайшее время поставщики лития планируют увеличить объемы его добычи и поставки на мировой рынок.
Кстати, компания Tesla, один из крупнейших потребителей лития, получила право на самостоятельную добычу металла в штате Невада, США. Илон Маск заявил, что его компания получила доступ примерно к 10 тыс. акров богатых литием залежей глины в Неваде.
Литий для всех, и пусть никто не уйдет обиженным?
Речь о недалеком будущем, когда понадобится производить гораздо больше литиевых батарей, чем сейчас. Насколько ученые могут судить, на ближайшие несколько лет этого металла хватит всем.
С течением времени компании найдут способ снизить количество лития в батареях — уже сейчас ведутся исследования на эту тему. Скорее всего, добыча лития из рассолов тоже станет наращивать обороты, так что общие объемы металла возрастут, и весьма значительно.
Но что будет через 10-20-30 лет? Сложно сказать. Возможно, «выстрелит» новая технология производства аккумуляторов, предложенная учеными или корпорациями. А может быть, специалисты смогут изменить конструкцию текущих аккумуляторов, значительно сократив количество лития, необходимое для производства одной батареи.
В целом, пока что пути решения проблемы дефицита лития есть, и их немало. Давайте вспомним об этом вопросе лет через 5 и обсудим изменения здесь же, на Хабре. Хотелось бы надеяться, к тому времени не начнутся «литиевые войны», ведь этот металл уже называют «новой нефтью».
Литий
Ли́тий / Lithium (Li), 3
Содержание
История и происхождение названия
Своё название литий получил из-за того, что был обнаружен в «камнях» (греч. λίθος — камень). Первоначально назывался «литион», современное название было предложено Берцелиусом.
Нахождение в природе
Геохимия лития
Основные минералы лития — слюда лепидолит — KLi1,5Al1,5[Si3AlO10] (F, OH)2 и пироксен сподумен — LiAl [Si2O6]. Когда литий не образует самостоятельных минералов, он изоморфно замещает калий в широко распространенных породообразующих минералах.
Месторождения лития приурочены к редкометалльным гранитным интрузиям, в связи с которыми развиваются литиеносные пегматиты или гидротермальные комплексные месторождения, содержащие также олово, вольфрам, висмут и другие металлы. Стоит особо отметить специфические породы онгониты — граниты с магматическим топазом, высоким содержанием фтора и воды, и исключительно высокими концентрациями различных редких элементов, в том числе и лития.
Другой тип месторождений лития — рассолы некоторых сильносоленых озёр.
Месторождения
Получение
В настоящее время для получения металлического лития его природные минералы или разлагают серной кислотой (кислотный способ), или спекают с CaO или CaCO3 (щелочной способ), или обрабатывают K2SO4 (солевой способ), а затем выщелачивают водой. В любом случае из полученного раствора выделяют плохо растворимый карбонат лития Li2CO3, который затем переводят в хлорид LiCl. Электролиз расплава хлорида лития проводят в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
В дальнейшем полученный литий очищают методом вакуумной дистилляции.
Физические свойства
Литий — серебристо-белый металл, мягкий и пластичный, твёрже натрия, но мягче свинца. Его можно обрабатывать прессованием и прокаткой.
При комнатной температуре металлический литий имеет кубическую объёмноцентрированную решётку (координационное число 8), пространственная группа I m3m, параметры ячейки a = 0,35021 нм, Z = 2. Ниже 78 К устойчивой кристаллической формой является гексагональная плотноупакованная структура, в которой каждый атом лития имеет 12 ближайших соседей, расположенных в вершинах кубооктаэдра. Кристаллическая решетка относится к пространственной группе P 63/mmc, параметры a = 0,3111 нм, c = 0,5093 нм, Z = 2.
Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения (180,54 и 1340 °C, соответственно), у него самая низкая плотность при комнатной температуре среди всех металлов (0,533 г/см³, почти в два раза меньше плотности воды).
Маленькие размеры атома лития приводят к появлению особых свойств металла. Например, он смешивается с натрием только при температуре ниже 380 °C и не смешивается с расплавленными калием, рубидием и цезием, в то время как другие па́ры щелочных металлов смешиваются друг с другом в любых соотношениях.
Химические свойства
Литий является щелочным металлом, однако относительно устойчив на воздухе. Литий является наименее активным щелочным металлом, с сухим воздухом (и даже с сухим кислородом) при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранится в керосине (к тому же плотность лития столь мала, что он будет в нём плавать) и может непродолжительное время храниться на воздухе.
Во влажном воздухе медленно реагирует с азотом, находящимся в воздухе, превращаясь в нитрид Li3N, гидроксид LiOH и карбонат Li2CO3. В кислороде при нагревании горит, превращаясь в оксид Li2O. Есть интересная особенность, что в интервале температур от 100 °C до 300 °C литий покрывается плотной оксидной плёнкой, и в дальнейшем не окисляется.
В 1818 немецкий химик Леопольд Гмелин установил, что литий и его соли окрашивают пламя в карминово-красный цвет, это является качественным признаком для определения лития. Температура возгорания находится около 300 °C. Продукты горения раздражают слизистую оболочку носоглотки.
Спокойно, без взрыва и возгорания, реагирует с водой, образуя LiOH и H2. Реагирует также с этиловым спиртом (с образованием алкоголята), с водородом (при 500—700 °C) с образованием гидрида лития, с аммиаком и с галогенами (с иодом — только при нагревании). При 130 °C реагирует с серой с образованием сульфида. В вакууме при температуре выше 200 °C реагирует с углеродом (образуется ацетиленид). При 600—700 °C литий реагирует с кремнием с образованием силицида. Химически растворим в жидком аммиаке (−40 °C), образуется синий раствор.
Длительно литий хранят в петролейном эфире, парафине, газолине и/или минеральном масле в герметически закрытых жестяных коробках. Металлический литий вызывает ожоги при попадании на влажную кожу, слизистые оболочки и в глаза.
Изотопы лития
Природный литий состоит из двух стабильных изотопов: 6 Li (7,5 %) и 7 Li (92,5 %); в некоторых образцах лития изотопное соотношение может быть сильно нарушено вследствие природного или искусственного фракционирования изотопов. Это следует иметь в виду при точных химических опытах с использованием лития или его соединений. У лития известны 7 искусственных радиоактивных изотопов и два ядерных изомера ( 4 Li − 12 Li и 10m1 Li − 10m2 Li соответственно). Наиболее устойчивый из них, 8 Li, имеет период полураспада 0,8403 с. Экзотический изотоп 3 Li (трипротон), по-видимому, не существует как связанная система.
7 Li является одним из немногих изотопов, возникших при первичном нуклеосинтезе (то есть вскоре после Большого Взрыва). Образование элемента лития в звездах возможно по ядерной реакции «скалывания» более тяжелых элементов.
Применение
Термоэлектрические материалы
Сплав сульфида лития и сульфида меди — эффективный полупроводник для термоэлектропреобразователей (ЭДС около 530 мкВ/К).
Химические источники тока
Из лития изготовляют аноды химических источников тока (аккумуляторов, например литий-хлорных аккумуляторов) и гальванических элементов с твёрдым электролитом (например, литий-хромсеребряный, литий-висмутатный, литий-окисномедный, литий-двуокисномарганцевый, литий-иодсвинцовый, литий-иодный, литий-тионилхлоридный, литий-оксидванадиевый, литий-фторомедный, литий-двуокисносерный элементы), работающих на основе неводных жидких и твёрдых электролитов (тетрагидрофуран, пропиленкарбонат, метилформиат, ацетонитрил).
Кобальтат лития и молибдат лития показали лучшие эксплуатационные свойства и энергоёмкость в качестве положительного электрода литиевых аккумуляторов.
Гидроксид лития используется как один из компонентов для приготовления электролита щелочных аккумуляторов. Добавление гидроксида лития к электролиту тяговых железо-никелевых, никель-кадмиевых, никель-цинковых аккумуляторных батарей повышает их срок службы в 3 раза и ёмкость на 21 % (за счёт образования никелатов лития).
Алюминат лития — наиболее эффективный твёрдый электролит (наряду с цезий-бета-глинозёмом).
Ракетное топливо
| Окислитель | Удельная тяга (Р1, сек) | Температура сгорания °С | Плотность топлива г/см³ | Прирост скорости, ΔVид,25, м/сек | Весовое содерж.горючего % |
|---|---|---|---|---|---|
| Фтор | 378,3 сек | 5350 °C | 0,999 | 4642 м/сек | 28 % |
| Тетрафторгидразин | 348,9 сек | 5021 °C | 0,920 | 4082 м/сек | 21,07 % |
| ClF3 | 320,1 сек | 4792 °C | 1,163 | 4275 м/сек | 24 % |
| ClF5 | 334 сек | 4946 °C | 1,128 | 4388 м/сек | 24,2 % |
| Перхлорилфторид | 262,9 сек | 3594 °C | 0,895 | 3028 м/сек | 41 % |
| Окись фтора | 339,8 сек | 4595 °C | 1,097 | 4396 м/сек | 21 % |
| Кислород | 247,1 сек | 3029 °C | 0,688 | 2422 м/сек | 58 % |
| Перекись водорода | 270,5 сек | 2995 °C | 0,966 | 3257 м/сек | 28,98 % |
| N2O4 | 239,7 сек | 3006 °C | 0,795 | 2602 м/сек | 48 % |
| Азотная кислота | 240,2 сек | 3298 °C | 0,853 | 2688 м/сек | 42 % |
Лазерные материалы
Монокристаллы фторида лития используются для изготовления высокоэффективных (КПД 80 %) лазеров на центрах свободной окраски, и для изготовления оптики с широкой спектральной полосой пропускания.
Окислители
Перхлорат лития используют в качестве окислителя.
Дефектоскопия
Сульфат лития используют в дефектоскопии.
Пиротехника
Нитрат лития используют в пиротехнике.
Сплавы
Сплавы лития с серебром и золотом, а также медью являются очень эффективными припоями. Сплавы лития с магнием, скандием, медью, кадмием и алюминием — новые перспективные материалы в авиации и космонавтике. На основе алюмината и силиката лития создана керамика, затвердевающая при комнатной температуре и используемая в военной технике, металлургии, и, в перспективе, в термоядерной энергетике. Огромной прочностью обладает стекло на основе литий-алюминий-силиката, упрочняемого волокнами карбида кремния. Литий очень эффективно упрочняет сплавы свинца и придает им пластичность и стойкость против коррозии.
Электроника
Триборат лития-цезия используется как оптический материал в радиоэлектронике. Кристаллические ниобат лития LiNbO3 и танталат лития LiTaO3 являются нелинейными оптическими материалами и широко применяются в нелинейной оптике, акустооптике и оптоэлектронике. Литий также используется при наполнении осветительных газоразрядных металлогалогеновых ламп.
Металлургия
В чёрной и цветной металлургии литий используется для раскисления и повышения пластичности и прочности сплавов. Литий иногда применяется для восстановления методами металлотермии редких металлов.
Металлургия алюминия
Карбонат лития является важнейшим вспомогательным веществом (добавляется в электролит) при выплавке алюминия, и его потребление растет с каждым годом пропорционально объёму мировой добычи алюминия (расход карбоната лития 2,5-3,5 кг на тонну выплавляемого алюминия [источник не указан 584 дня] ).
Легирование алюминия
Введение лития в систему легирования позволяет получить новые сплавы алюминия с высокой удельной прочностью.
Добавка лития снижает плотность сплава и повышает модуль упругости. При содержании лития до 1,8 % сплав имеет низкое сопротивление коррозии под напряжением, а при 1,9 % сплав не склонен к коррозионному растрескиванию. Увеличение содержания лития до 2,3 % способствует возрастанию вероятности образования рыхлот и трещин. Механические свойства при этом изменяются: пределы прочности и текучести возрастают, а пластические свойства снижаются.
Наиболее известны системы легирования Al-Mg-Li (пример — сплав 1420, применяемый для изготовления конструкций летательных аппаратов) и Al-Cu-Li (пример — сплав 1460, применяемый для изготовления емкостей для сжиженных газов).
Ядерная энергетика
Изотопы 6 Li и 7 Li обладают разными ядерными свойствами (сечение поглощения тепловых нейтронов, продукты реакций) и сфера их применения различна. Гафниат лития входит в состав специальной эмали, предназначенной для захоронения высокоактивных ядерных отходов, содержащих плутоний.
Литий-6 (термояд)
Применяется в термоядерной энергетике.
При облучении нуклида 6 Li тепловыми нейтронами получается радиоактивный тритий 3 H:
Благодаря этому литий-6 может применяться как замена радиоактивного, нестабильного и неудобного в обращении трития как в военных (термоядерное оружие), так и в мирных (управляемый термоядерный синтез) целях. В термоядерном оружии обычно применяется дейтерид лития-6 6 LiD.
Перспективно также использование лития-6 для получения гелия-3 (через тритий) с целью дальнейшего использования в дейтерий-гелиевых термоядерных реакторах.
Литий-7 (теплоноситель)
Применяется в ядерных реакторах, использующих реакции с участием тяжёлых элементов, таких как уран, торий или плутоний.
Благодаря очень высокой удельной теплоёмкости и низкому сечению захвата тепловых нейтронов, жидкий литий-7 (часто в виде сплава с натрием или цезием) служит эффективным теплоносителем. Фторид лития-7 в сплаве с фторидом бериллия (66 % LiF + 34 % BeF2) носит название «флайб» (FLiBe) и применяется как высокоэффективный теплоноситель и растворитель фторидов урана и тория в высокотемпературных жидкосолевых реакторах, и для производства трития.
Сушка газов
Высокогигроскопичные бромид LiBr и хлорид лития LiCl применяются для осушения воздуха и других газов.
Медицина
Соли лития обладают нормотимическими и другими лечебными свойствами. Поэтому они находят применение в медицине.
Смазочные материалы
Стеарат лития («литиевое мыло») используется в качестве высокотемпературной смазки. См.: литол.
Регенерация кислорода в автономных аппаратах
Гидроксид лития LiOH, пероксид Li2O2 и супероксид LiO2 применяются для очистки воздуха от углекислого газа; при этом последние два соединения реагируют с выделением кислорода (например, 4LiO2 + 2CO2 → 2Li2CO3 + 3O2), благодаря чему они используются в изолирующих противогазах, в патронах для очистки воздуха на подлодках, на пилотируемых космических аппаратах и т. д.
Силикатная промышленность
Литий и его соединения широко применяют в силикатной промышленности для изготовления специальных сортов стекла и покрытия фарфоровых изделий.
Прочие области применения
Соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).