Ложная тромбоцитопения что это
Тромбоцитопения
Нормальный гемостаз
Эффективный и быстрый механизм для остановки кровотечения в месте повреждения кровеносного сосуда очень важен для выживания. Термин «гемостаз» охватывает процессы, которые предотвращают кровотечение, когда кровеносный сосуд поврежден, и в то же время поддерживают кровь в сосудах в жидком состоянии.
Основные компоненты гемостаза:
— факторы коагуляции— белки, в основном вырабатываемые в печени и участвующие в каскаде коагуляции;
— тромбоциты— клеточные элементы крови, концентрирующиеся и формирующие процесс агрегации в области повреждения и образующие первичный тромб;
— фибринолитические факторы— ферменты, участвующие в лизисе сгустка крови после процессов заживления и регенерации поврежденных тканей;
— ингибиторы— факторы коагуляции, которые помогают локализовать сгусток в месте повреждения и препятствуют развитию генерализации процесса тромбообразования в сосудах всего организма;
— клетки эндотелия сосудов— выстилающие внутреннюю поверхность сосуда эпителиальные клетки. В неповрежденном состоянии сосудов и тканей они обеспечивают нормальный ток крови, в случае травматизации последних они генерируют выработку биологически активных веществ: факторов коагуляции и фибринолиза.
Все эти компоненты должны быть сбалансированы и находиться под жестким контролем.
— сосудистый ответ— сужение поврежденного кровеносного сосуда;
— тромбоциты— образование тромбоцитарного тромба (первоначальный гемостаз);
— коагуляция— матрица фибрина стабилизирует тромб;
— фибринолиз— предотвращает чрезмерный прирост тромба и проводит его возможную ликвидацию.
Тромбоциты
a-гранулы содержат: гликопротеины (фибронектин, фибриноген, фактор Виллебранда), белки, связывающие гепарин (фактор 4 тромбоцитов регулирует проницаемость сосудов, выход кальция из костей, хемотаксис нейтрофилов и эозинофилов, нейтрализует гепарин), b-тромбоглобулин; факторы роста (тромбоцитарный фактор роста, трансформирующий фактор роста b); факторы свертывания и тромбоспондин (тромбоспондин усиливает адгезию и агрегацию тромбоцитов; тромбопластин, фактор V, GMP-140— белок семейства селектинов, рецептор адгезии). На внутренней поверхности мембраны имеются рецепторы для факторов свертывания.
d-гранулы (плотные гранулы, или тельца)— немногочисленные (до пяти) мембранные пузырьки диаметром 250—300 нм с плотным матриксом, который иногда располагается в них эксцентрично. Матрикс содержит АДФ, АТФ, Са2+, Mg2+, пирофосфат, гистамин, серотонин. Последний не синтезируется тромбоцитами, а поглощается ими из крови.
l-гранулы или азурофильные гранулы— мелкие (диаметр 200–250 нм) пузырьки, содержащие ферменты. Рассматриваются как лизосомы.
Плазмолемма тромбоцитов покрыта снаружи толстым (от 50 до 150–200нм) слоем гликокаликса с высоким содержанием гликозаминогликанов и гликопротеинов. Она содержит многочисленные рецепторы, опосредующие действие веществ, активирующих и ингибирующих функции тромбоцитов, обусловливающие их прикрепление (адгезию) к эндотелию сосудов и агрегацию (склеивание друг с другом). Наиболее важными из них в функциональном отношении являются рецепторные гликопротеины I (субъединицы Ia, Ib, Ic), II (субъединицы IIа, IIb), III (субъединицы IIIа, IIIb), IV, V, рецепторы к АДФ, адреналину, тромбину, фактору Ха, фактору агрегации тромбоцитов, коллагену, которые обусловливают адгезивные и агрегационные функции тромбоцитов.
Функции гликопротеинов. Iа— рецептор адгезии (прилипание, приклеивание) тромбоцитов к коллагену субэндотелия. Комплекс «Ib— фактор свертывания крови IX» обеспечивает рецепцию фактора Виллебранда, что необходимо для адгезии пластинок на поврежденный субэндотелий. Iс, взаимодействуя с адгезивным белком субэндотелия фибронектином, обеспечивает адгезию пластинки к субэндотелию. IIа и IIb необходимы для всех видов агрегации тромбоцитов. IIIа с гликопротеином IIb образуют Са2+-зависимый комплекс, связывающий на тромбоцитах фибриноген, что обеспечивает дальнейшую агрегацию тромбоцитов и ретракцию (сокращение) сгустка. V— гидролизуется тромбином, поддерживает агрегацию тромбоцитов. Недостаток в мембране тромбоцитов различных субъединиц гликопротеинов I–V вызывает повышенную кровоточивость.
Гиаломер содержит две системы трубочек (канальцев) и большую часть элементов цитоскелета. При соприкосновении с поверхностью, отличающейся по своим свойствам от эндотелия, тромбоцит активируется, распластывается и у него появляется до 10 зазубрин и отростков, которые могут в 5–10 раз превышать диаметр тромбоцита. Наличие этих отростков важно для остановки кровотечения.
Формы тромбоцитов: юные, зрелые, старые, дегенеративные и гигантские.
Функции тромбоцитов. Процесс транс-формации активированных тромбо-цитов в устойчивый тромб является единым процессом, который можно разделить на четыре этапа: адгезию, агрегацию, уплотнение и секрецию. В инертном виде тромбоциты не слипаются со стенкой сосуда. При повреждении сосудистой стенки происходит выброс субэндотелиальных продуктов, таких как коллаген. Тромбоциты адгезируются с коллагеном и формируют гемостатически эффективный тромб. Это взаимодействие может быть инициировано фактором Виллебранда. Привлечение большего числа происходит при тромбоцито-тромбоцитарном контакте, который инициируется в основном через фибриногеновый рецептор, GPIIb-IIIa. Адгезивный процесс приводит к секреции содержимого гранул, превращая неплотно соединенное скопление тромбоцитов в однородную массу. Секреция содержимого гранул вызывается сигналом, прошедшим сквозь мембрану тромбоцита, с последующим притоком и высвобождением кальция. Содержимое гранул имеет высокую концентрацию внутри тромба и находится близко к поверхности первичного тромба, что обусловливает нормальный процесс коагуляции на поверхности тромбоцита. Это является основой для начала формирования фибринового сгустка— фазы вторичного гемостаза. Затем вступают АДФ и тромбоксан А2. Тромбоксан А2 формируется в результате внутриклеточного метаболизма арахидоновой кислоты, которая окисляется циклооксигеназой в эндопероксиды. Эндопероксиды затем подвергаются воздействию тромбоксанового фермента, и в результате образуется тромбоксан А2. Тромбоксан А2 в жидком состоянии является потенциальным инициатором агрегации тромбоцитов.
Классификация дефектов гемостаза:
1. Тромбоцитопения— уменьшение числа тромбоцитов.
2. Тромбоцитопатия— нарушение функции тромбоцитов.
3. Патология коагуляционного гемостаза— нарушение концентрации факторов свертывания и их функциональной активности.
4. Вазопатия— патология кровеносных сосудов.
Тромбоцитопении— это группа заболеваний и синдромов, объединенных общим признаком: наличием геморрагического синдрома, развивающегося в результате снижения числа кровяных пластинок в периферической крови менее 150 ґ 109/л. Тромбоцитопения может выступать в качестве самостоятельного заболевания (первичная) либо симптома других болезней (вторичная).
Механизмы развития тромбоцитопений могут быть различными.
1. Недостаточное образование тромбоцитов может быть следствием угнетения пролиферации клеток костного мозга при наличии:
— наследственных заболеваний: конституционной панцитопении (апластическая анемия Фанкони) и амегакариоцитарной тромбоцитопении с другими врожденными пороками;
— приобретенной патологии: инфильтрации костного мозга (лейкоз, метастазы, миелофиброз, туберкулез), а также при апластической анемии, мегалобластной анемии.
2. Уменьшение количества тромбоцитов:
— приеме миелосупрессивных медикаментов (цитостатики);
— приеме таких препаратов: тиазидные диуретики, эстрогены, интерферон;
— пароксизмальной ночной гемоглобинурии;
3. Повышенное разрушение тромбоцитов:
— врожденные неиммунные причины: преэклампсия у матери, инфекции;
— врожденные иммунные причины: идиопатическая тромбоцитопеническая пурпура (у матери), медикаменты;
— приобретенные неиммунные причины: инфекции, синдром диссеминированного внутрисосудистого свертывания крови (ДВС-синдром), медикаменты, гемолитико-уремический синдром;
— приобретенные иммунные причины: ауто- и аллоантитела.
Аутоантитела: системная красная волчанка, неходжкинская лимфома, инфекции, медикаменты (хинин, гепарин), идиопатические.
Аллоантитела: посттрансфузионная пурпура, акушерские осложнения.
4. Депонирование тромбоцитов:
— гиперспленизм. Большинство факторов способствуют тромбоцитопении при спленомегалии путем «объединения» тромбоцитов в селезенке. При спленомегалии до 90 % тромбоцитов могут депонироваться в селезенке, в то время как нормой является 1/3 от их общей массы;
5. Повышенное потребление кровяных пластинок развивается в результате потери тромбоцитов:
Клиническая картина
Характерным проявлением снижения количества тромбоцитов является геморрагический диатез петехиально-пятнистого типа. Характерно появление на коже и слизистых оболочках мелких безболезненных, без признаков воспаления мелкоточечных геморрагических высыпаний— петехий и/илипятнистых (диаметром около 1–2 см), ненапряженных, не расслаивающих ткани геморрагий— синячков. Появление петехий и синячков легко провоцируется минимальным травмированием микрососудов— трением одежды, легкими ушибами, инъекциями. Кроме того, при этом типе кровоточивости могут возникать повторные носовые кровотечения (эпистаксис), кровотечения из желудочно-кишечного тракта, метроррагии, гематурия. Наиболее тяжелыми последствиями геморрагического диатеза петехиально-пятнистого типа являются кровоизлияния в сетчатку глаз с потерей зрения и кровоизлияния в головной мозг и его оболочки.
Диагностика
1. Было ли у вас когда-нибудь кровотечение:
— после экстракции зуба;
— спонтанное носовое кровотечение;
— какое проводилось лечение;
— у женщин— выраженость менструального кровотечения.
2. Имели ли вы похожие на кровотечение проблемы?
3. Возникал ли у вас геморрагический диатез на коже? Какое лечение вы получали?
4. Какие медикаменты принимали вообще?
5. Наличие других болезней:
— инфекции (ВИЧ, гепатит C).
При обследовании пациента необходимо обратить внимание на следующие критерии:
— стадии геморрагических диатезов— новые, несколько дней назад;
— локализация— кожа, слизистые оболочки.
Лабораторная диагностика. Нормальное содержание тромбоцитов 150—400 ґґ 109/л. PLT обнаруживается автоматизированными кровяными панелями.
Если содержание тромбоцитов Время кровотечения. Принцип метода заключается в измерении длительности кровотечения из ранки на коже мочки уха, мякоти ногтевой фаланги пальца руки или верхней трети ладонной поверхности предплечья, наносимой автоматическим ланцетом, обычным плоским или скарификатором. Описаны варианты тестов, при проведении которых учитывается не только длительность кровотечения, но и объем теряемой крови. Ориентировочно он может быть оценен по количеству и величине пятен крови на фильтровальной бумаге, которой промокают выступающие капли крови.
— Метод Дюке— определяется длительность кровотечения из поверхностных микрососудов мочки уха после нарушения их целостности с помощью плоского ланцета или скарификатора. Нормальные величины: 2–5 мин (не более).
— Метод Айви: определяется длительность кровотечения из надрезов кожи ладонной поверхности предплечья после наложения манжетки. Рассчитывают среднее время кровотечения по трем ранкам.
Клиническое значение: время кровотечения удлиняется при выраженных тромбоцитопениях, болезни Виллебранда, тяжелых формах некоторых тромбоцитопатий. При нарушениях свертываемости крови (гемофилиях) оно обычно остается нормальным или удлиняется лишь слегка. Может быть удлинено при тяжелых формах тромбогеморрагического синдрома и значительной гепаринемии.
Функциональные тромбоцитарные тесты
1. Агрегация тромбоцитов.
2. Адгезия тромбоцитов.
3. Реакция тромбоцитов.
4. Антитела к тромбоцитам.
Скрининговые тесты и показатели для оценки гемостаза
1. Количество тромбоцитов.
2. Время кровотечения.
3. Активированное частично тромбопластиновое время (свертывания).
4. Протромбиновое время (свертывания).
5. Если причина тромбоцитопении неизвестна— анализ костного мозга (цитология, гистология).
Лечение тромбоцитопениив зависимостиот причины заболевания
Недостаточность витамина B12 и/или фолиевой кислоты— соответствующий курс терапии.
Медикаментозно индуцированная тромбоцитопения— прекратить прием препаратов, которые ее вызвали.
Переливания тромбоцитов в зависимости от риска геморрагических осложнений при тромбоцитопении: пациентам с гематологическими и онкологическими болезнями, если количество тромбоцитов 10–20 ґ 109/л; при наличии нескольких факторов риска— количество тромбоцитов должно быть >> 40 ґ 109/л.
Современные направления в лечении иммунных форм тромбоцитопении— внутривенное введение иммуноглобулина. Эффект наступает быстрее, чем при лечении глюкокортикоидами, однако он длится всего лишь 3–4 недели. Из группы внутривенных иммуноглобулинов в Украине зарегистрирован cандаглобулин. Механизм действия препарата обусловлен способностью иммуноглобулина занимать место антитромбоцитарных антител на рецепторах тромбоцитов, что способствует уменьшению повреждающего действия антител на тромбоциты.
— неэффективность терапии на протяжении 3–6 месяцев: некупируемый геморрагический синдром или его возобновление на фоне снижения дозы глюкокортикоидов;
— количество тромбоцитов 10 ґ 109/л при отсутствии геморрагического синдрома;
— отсутствие тенденции при количестве кровяных пластинок менее 30 ґ 109/л к росту на протяжении 3 месяцев при активномлечении.
При неэффективности проводимой терапии применяют цитостатики (винкристин, циклофосфамид, азатиоприн и т.д.) на протяжении 2–3–5 месяцев в комбинации с глюкокортикоидами. Эффект наступает через 1,5–2 месяца, после чего кортикостероиды постепенно отменяют.
Современные методы лечения тромбоцитопении
Тромбопоэтин— эндогенный цитокин, вызывающий мегакариоцитарний рост и образование тромбоцитов. Специфически связывается TПO-рецептором и играет центральную роль в выживании и пролиферации гемопоэтических клеток-предшественников.
Nplate (ромиплостим) является протеином, стимулирующим тромбопоэз— пептид-Fc-синтетаза, который активизирует внутриклеточные транскрипционные пути прироста и созревания в костном мозге кости мегакариоцитов, приводящие к увеличению числа тромбоцитов через рецепторы TПO, механизм, аналогичный эндогенному TПO.
Nplate особо показан для лечения тромбоцитопении у больных хронической иммунной (идиопатической) тромбоцитопенической пурпурой, которые имеют недостаточный ответ на кортикостероиды, иммуноглобулины или спленэктомию.
Рекомендованная начальная доза препарата составляет 1 мкг/кг еженедельно в подкожных инъекциях, затем регулируют еженедельную дозу, пока количество тромбоцитов не достигнет ≥ 50 ґ 109/л, по мере необходимости для сокращения риска кровотечения.
При тромбоцитопении очень важным является выяснение причины или болезни, которая ее вызвала. В связи с большим количеством причин диагностика заболевания является сложной.
Лечение тромбоцитопении проводят в зависимости от причины ее возникновения.
Ложная тромбоцитопения что это
И.Г. Бакулин, Л.Н. Белоусова, Л.С. Евдокимова
ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России, Санкт-Петербург
Введение
Принято считать, что диагностика и лечение тромбоцитопении (ТП) находятся в сфере профессиональной компетенции специалиста-гематолога. Вместе с тем к настоящему моменту накоплена масса данных, свидетельствующих о снижении числа тромбоцитов при различных патологических состояниях. Это объясняет необходимость более широкого обсуждения данной проблематики среди врачей различных клинических специальностей.
Общие положения
Термин «тромбоцитопения» обычно используют при уровне тромбоцитов ниже 100,0×109/л, хотя нормальным уровнем тромбоцитов принято считать таковой в пределах от 150,0×109/л до 450,0×109/л [1]. Поэтому ряд экспертов выделяют латентную ТП при уровне тромбоцитов от 100,0×109/л до 150,0×109/л [2]. Выделение латентной ТП, на наш взгляд, обоснованно с практической точки зрения. С одной стороны, такая клиническая ситуация требует динамического наблюдения за уровнем тромбоцитов независимо от причины, с другой – при числе тромбоцитов 100,0×109/л и более полностью обеспечивается гемостаз, что, как указывается в большинстве имеющихся руководств, безопасно в контексте риска развития кровотечений [3] и что позволяет проводить различные оперативные вмешательства, в т.ч. и родоразрешение, при указанном уровне тромбоцитов.
Более того, концентрация тромбоцитов от 100×109/л до 50×109/л, протекающая без спонтанного геморрагического синдрома, может также считаться безопасной. В случаях появления признаков кровоточивости при указанном числе тромбоцитов следует искать дополнительный фактор, провоцирующий геморрагический синдром, или учитывать наличие сосудистой патологии, например, у пациентов преклонного возраста. Существующие подходы указывают, что коррекцию ТП следует проводить при числе тромбоцитов от 50×109/л до 30×109/л только при наличии геморрагических проявлений. Критическим для развития опасных для жизни геморрагических проявлений является содержание тромбоцитов ниже 10,0×109/л. Пациенты с таким уровнем ТП нуждаются в безотлагательной терапии независимо от степени клинических проявлений геморрагического синдрома [3, 4].
Этиопатогенез ТП
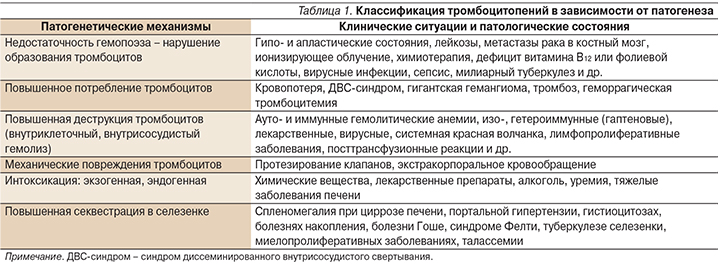
Говоря о ТП, следует подчеркнуть разнообразие приводящих к ней патогенетических механизмов и еще большее количество патологических состояний, при которых данные патогенетические механизмы реализуются [5]. Выделяют два основных механизма патогенеза ТП (табл. 1): нарушение образования тромбоцитов и повышенное их разрушение.
Диагностические алгоритмы при ТП
При выявлении у пациента ТП весьма важен детальный анализ истории заболевания, в частности установление предшествовавших развитию ТП факторов: бактериальная или вирусная инфекция, в т.ч. и вирусные гепатиты; вакцинация или применение лекарственных препаратов; пребывание в странах с риском заражения инфекционными заболеваниями (малярия, риккетсиоз, лихорадка Денге и др.); употребление алкогольных и хинин-содержащих напитков; варикозная болезнь, тромбозы, сердечно-сосудистая патология и ее терапия антикоагулянтами и дезагрегантами; наличие сопутствующих заболеваний, особенно аутоиммунных, инфекционных или опухолевых, протекающих с ТП, ДВС-синдромом; трансфузии; пересадка органов в анамнезе; беременность; наличие и длительность кровотечений после хирургических вмешательств.
В семейном анамнезе обязательно уточнить наличие болезни системы кроветворения у родственников.
При проведении объективного исследования следует активно выявлять такие симптомы, как гипо- или гипертермия, снижение массы тела, симптомы интоксикации, гепато- и спленомегалия, лимфаденопатия, патология молочных желез, сердца, вен нижних конечностей, а также врожденные аномалии. Все эти данные не специфичны.
Лабораторно-инструментальная диагностика включает несколько направлений. В клиническом анализе крови обязательны оптический подсчет числа тромбоцитов и оценка морфологии тромбоцитов (микроформы и гигантские тромбоциты), при этом следует помнить, что при наличии агрегатов тромбоцитов для исключения «ложной» ТП при использовании консерванта ЭДТА (этилендиаминтетраацетат кальция-натрия) необходим повторный анализ (используется пробирка с цитратом натрия). Всем пациентам проводится ультразвуковое исследование или компьютерная томография (КТ) органов брюшной полости и забрюшинного пространства, рентгенография или КТ органов грудной клетки, а также обследование для исключения онкологических заболеваний. Принимая во внимание, что идиопатическая тромбоцитопеническая пурпура (ИТП) – диагноз исключения, спектр используемых лабораторных тестов достаточно широк (табл. 2), по своей диагностической значимости их подразделяют на обязательные, потенциально полезные и тесты с недоказанной информативностью.
Принципы лечения ИТП
В лечении ИТП выделяют несколько линий терапии. На первом этапе используются гормоны (преднизолон, дексаметазон) и специфический иммуноглобулин. К терапии второй линии относят спленэктомию и стимуляторы тромбопоэза (миметики тромбопоэтина). Ритуксимаб и другие препараты с иммуносупрессивным действием (азатиоприн, циклофосфамид, циклоспорин А, винкристин, винбластин) рассматриваются как средство резерва (третья линия терапии) [4].
ТП в гастроэнтерологии
Принимая во внимание множественность причин ТП, необходимо проводить исключение заболеваний, которые могут в клинической картине иметь снижение уровня тромбоцитов; в практике врача-гастроэнтеролога это прежде всего H. pylori-ассоциированные заболевания и поражения печени различного генеза.
В 1998 г. А. Gasbarrini и соавт. опубликовали в журнале «Ланцет» статью «Regression of autoimmune thrombocytopenia after eradication of Helicobacter pylori», положившую начало новому направлению в изучении хеликобактериоза, сопутствующих с ним состояний, а также более тесному взаимодействию врачей двух клинических специальностей, а именно гатроэнтерологов и гематологов [6]. Ранее было показано, что аутоиммунные реакции посредством перекрестной мимикрии между антигенами системы Lewis эпителиальных клеток желудка и H. pylori могут играть определенную роль в хеликобактер-индуцированном повреждении слизистой оболочки; моноклональные анти-H. pylori-антитела вступают в реакции взаимодействия с тканями вне желудочно-кишечного тракта, а именно с эпителиоцитами протоков слюнных желез и почечных канальцев [7]; поликлональные анти-H. pylori-антитела взаимодействуют с капиллярами почечных клубочков, что может приводить к мембранозной нефропатии [8]. Опираясь на данные предшествовавших исследований, в частности на результаты наблюдений [9] о купировании проявлений болезни Шенлейн–Геноха после успешно проведенной эрадикационной терапии, А. Gasbarrini и соавт. предположили патофизиологическую связь между ИТП и хронической инфекцией H. pylori. Они описали повышение уровня тромбоцитов у всех 8 пациентов ИТП, получивших эрадикационную терапию, при этом уровень тромбоцитов у 3 человек, такой терапии не получавших, оставался неизменным.
К настоящему времени опубликована масса работ, систематических обзоров, исследовавших взаимосвязь ИТП и H. pylori, механизмы развития данной взаимосвязи, выявляющих предикторы положительного ответа на эрадикационную терапию.
Предложено несколько гипотез механизмов, с помощью которых H. pylori вызывает развитие ИТП. Считается, что образуются перекрестно-реактивные антитела, взаимодействующие как с компонентами H. pylori, так и с поверхностными антигенами тромбоцитов посредством молекулярной мимикрии. Итальянские ученые во главе с R. Scandellari показали, что заражение штаммами H. pylori, экспрессирующими CagA (cytotoxin-associated gene A), может быть причиной хронических случаев ИТП. По данным проведенного ими исследования, увеличение числа тромбоцитов после эрадикационной терапии наблюдалось у 43% пациентов после 6 месяцев наблюдения. Пациенты были сопоставимыми по всем основным клиническим признакам, за исключением одного: сывороточные антитела к CagA присутствовали у 83% пациентов, ответивших на терапию, и только у 12,5% не ответивших (p=0,026). Авторы пришли к выводу, что антибиотикотерапия H. pylori-инфекции может приводить к исчезновению иммунных перекрестно реагирующих антител и, следовательно, может рассматриваться как путь терапии пациентов с ИТП, особенно для тех лиц, у которых выявляются антитела к CagA [10]. Впоследствии, опираясь на данные, полученные R. Scandellari и соавт., а также принимая во внимание тот факт, что почти все CagA-положительные штаммы H. pylori также экспрессируют вакуолизирующий токсин, группа исследователей во главе с N. Figura предположили существование молекулярной мимикрии некоторых тромбоцитарных пептидов с вакуолизирующим цитотоксином А H. pylori. В частности, компонент тромбоцитов, связывающий домен рецептора 289 аминокислот для фактора фон Виллебранда (GP1b-тромбоцит), показал определенное структурное сходство с VacA- H. pylori [11]. M. Michel и соавт. [12] также исследовали гипотезу молекулярной мимикрии и обнаружили, что тромбоциты инфицированных H. pylori-пациентов ИТП, обладающие способностью реагировать с GPIIb/IIIa или GPIb, не могут распознавать антигены H. pylori. С другой стороны, T. Takahashi и соавт. [13] сообщили, что тромбоциты пациентов с ИТП, инфицированных H. pylori, «распознавали» CagA при реакции иммуноблоттинга, а тромбоциты пациентов, инфицированных H. pylori, но без ИТП – нет. Y. Bai и соавт. изучили перекрестное взаимодействие моноклонального антитела против уреазы В хеликобактера с поверхностным гликопротеином тромбоцитов GPIIb/IIIa и предположили, что иммунный ответ на UreB может участвовать в патогенезе ИТП [14]. Все эти данные свидетельствуют о том, что перекрестно реагирующие антитела против H. pylori могут присутствовать у пациентов с ИТП, но их патогенетическая роль до конца не ясна.
В качестве еще одного механизма рассматривается тот факт, что хроническая инфекция H. pylori может неспецифически воздействовать на иммунную систему хозяина, стимулируя приобретенные иммунные ответы через выработку Т- и В-аутоантител. Японские исследователи S. Yamanishi и соавт. [15] показали, что уреаза H. pylori способна инициировать аутоиммунные реакции путем активации В1-клеток, однако это не объясняет развития специфичного для гликопротеинов тромбоцитов при ИТП аутоиммунного ответа. Более того, в работе R. Pellicano и соавт. показано отсутствие различий в продукции неспецифических аутоантител (антинуклеарных, антимикросомальных, антигладкомышечных) при ИТП у лиц с H. pylori и без них [16].
M. Kuwana и соавт. [17] предложили модель «патогенной петли» (a «pathogenic loop» model): появление антитромбоцитарных аутоантител у больных ИТП. Речь идет о том, что макрофаги ретикулоэндотелиальной системы «захватывают» тромбоциты через Fcγ-рецепторы и «передают» тромбоцитарные антигены (гликопротеиды) на Т-клетки (CD4+), которые в свою очередь, будучи активированными, стимулируют В-клетки на выработку антитромбоцитарных антител, связывающихся в результате с циркулирующими тромбоцитами, тем самым замыкая «патогенную петлю». После успешной эрадикации H. pylori антитромбоцитарные антитела удаляются [18], следовательно, «патогенная петля» остановлена. M. Kuwana и соавт., проведя проспективное исследование, показали повышенную фагоцитарную способность и низкие уровни экспрессии ингибирующего FcγRIIB в циркулирующих моноцитах у пациентов ИТП, инфицированных H. pylori, у H. pylori-негативных пациентов подобные изменения не выявлены. В случае успешной эрадикации наблюдалось подавление фенотипа активированного моноцита, затем уменьшался уровень антитромбоцитарных аутоантител и возрастало число тромбоцитов. Таким образом, H. pylori могут модулировать баланс Fcγ-рецепторов моноцитов/макрофагов в пользу активации рецепторов Fcγ [17, 19].
Факторы, прогнозирующие положительное влияние эрадикационной терапии на течение ИТП, а именно на возрастание числа тромбоцитов, достаточно широко исследованы. Наиболее часто выявляемый благоприятный предиктор – более короткий анамнез ИТП [20, 25, 26], но в других исследованиях этой связи не находят [27–29]. Некоторые исследователи сообщают о значительном положительном эффекте эрадикации H. pylori у пациентов с легкой ТП, но у пациентов с тяжелой ТП был отмечен слабый ответ на эрадикацию [30]. Такие клинические характеристики, как возраст менее 65 лет при диагностике ИТП [25], более высокий исходный уровень тромбоцитов [25], отсутствие предшествовавшей терапии кортикостероидами [27], отсутствие сопутствующей терапии кортикостероидами [31, 32] и отсутствие предшествовавшей терапии для ИТП [25], также рассматриваются как факторы, прогнозирующие положительную «реакцию» тромбоцитов на лечение, однако сведения об их достоверности еще более противоречивы. В нескольких исследованиях изучалась генетическая предрасположенность к реакции тромбоцитов на антихеликобактерную терапию; в частности, показана ассоциация между гаплотипами HLA-DQB1*03 и более высокой вероятностью положительного ответа тромбоцитов [21]. Установлено, что одиночные нуклеотидные полиморфизмы в генах фактора некроза опухоли β и ингибитора Fcγ-рецептора IIВ (FcγRIIB) полезны для прогнозирования реакции ТП на эрадикационную терапию [32, 33]. Обнаружено, что наличие антитромбоцитарно специфичных анти-GPIb аутоантител предсказывает устойчивость к эрадикационной терапии H. pylori [17]. Противоречивы сведения о влиянии антител к CagA на прогноз повышения уровня тромбоцитов: исследование, проведенное в Италии, показало, что пациенты с ИТП и антителами к CagA чаще, чем пациенты без них, положительно реагируют на эрадикационную терапию [10], но исследование, проведенное в Японии, этого наблюдения не подтвердило [26]. R. Sato и соавт. [34] произвели оценку потенциальной связи ответа тромбоцитов на эрадикацию H. pylori с данными фиброэзофагогастродуоденоскопии и результатами гистологического исследования биоптатов желудка: выраженное воспаление и признаки атрофии в теле желудка расценены как предикторы благоприятного результата. Таким образом, и генетический фон, и бактериальные факторы, регулирующие уровень воспалительного ответа на инфекцию H. pylori, могут использоваться в целях прогнозирования успешности эрадикационной терапии для лечения ТП.
Несмотря на внушающие оптимизм данные исследований, ряд ученых сомневаются в наличии причинно-следственной связи между ИТП и инфекцией H. pylori, и, соответственно, влиянии эрадикационной терапии на число тромбоцитов. Так, результаты работы, проведенной A.D. Samson и соавт. [35], говорят об отсутствии существенных различий между H. pylori-позитивными и H. pylori-негативными пациентами в отношении числа тромбоцитов. Исследователи из Малайзии [36] сообщили о низкой распространенности инфекции H. pylori у пациентов с ИТП и отсутствии какого-либо значительного эффекта эрадикации H. pylori на число тромбоцитов.
ТП является распространенным гематологическим расстройством у пациентов с хроническим заболеванием печени [2, 37]. Распространенность ТП варьируется в зависимости от ряда факторов, таких как популяция пациентов и степень тяжести основного заболевания печени, а степень ТП служит ранним прогностическим маркером (индекс APRI – Aspartate-aminotransferase-to-Platelet Ratio Index), позволяющим делать предварительную оценку по вопросу наличия выраженного фиброза печени, не прибегая к биопсии [38]. Встречаемость ТП среди пациентов с циррозом печени достигает 80% [39].
Генез ТП при заболеваниях печени мультифакториален. Патофизиология ТП при хроническом заболевании печени уже давно [40] связана с гипотезой гиперспленизма, когда портальная гипертензия вызывает объединение и секвестрование всех корпускулярных элементов крови, преимущественно тромбоцитов, в расширенной и перегруженной селезенке. Пересадка печени нормализует ТП и уменьшает гиперспленизм [41].
Нарушение образования тромбоцитов при заболеваниях печени также связано со снижением активности и уровня тромбопоэтина – основного цитокина, продуцирующегося печенью и оказывающего воздействие на все стадии дифференцировки мегакариоцитов и синтеза тромбоцитов.
Помимо влияния на гемопоэтические клетки существует предположение о связывании тромбопоэтина непосредственно с циркулирующими в сосудистом русле тромбоцитами, что приводит к повышению их функциональной активности [42]. Снижение тромбопоэтинсинтетической функции печени приводит к уменьшению тромбопоэза в костном мозге и, следовательно, к ТП в периферической крови. Восстановление адекватной тромбопоэтинной продукции после трансплантации печени приводит к скорейшему восстановлению производства тромбоцитов [43].
Подавление образования тромбоцитов в костном мозге может быть вызвано алкоголем, одним из частых этиологических факторов заболевания печени. Алкоголь-индуцированная ТП обусловлена прямым токсическим эффектом алкоголя на мегакариоциты, что приводит к снижению производства, времени выживания и функции тромбоцитов [44, 45]. Ряд лекарственных средств, используемых в терапии заболеваний печени (азатиоприн, β-лактамные антибиотики и фторхинолоны, интерферон), потенциально могут вызывать лекарственно-индуцированную ТП, оказывая как прямое миелосупрессивное действие, так и иммуноопосредованное разрушение тромбоцитов. До недавнего времени схемы лечения пациентов с HCV (Hepatitis C Virus) включали интерферон, частым побочным эффектом которого является дозозависимая ТП, интерферон-индуцированная миелотоксичность и цитопения становились частой причиной прекращения терапии [2, 46].
Еще одним доказанным патогенетическим механизмом развития ТП являются аутоиммунные нарушения. Среди пациентов с хроническими заболеваниями печени различной этиологии до 64% имеют антитромбоцитарные антитела, которые в основном направлены против комплекса гликопротеина IIb-IX [47]. Наиболее часто иммуно-опосредованная ТП встречается при HCV, бактериальных и лекарственных поражениях печени. Аутоиммунные заболевания печени (аутоиммунный гепатит и первичный билиарный холангит – ПБХ) часто ассоциируются с другими аутоиммунными состояниями. Около 50% пациентов с ПБХ страдают по меньшей мере одним дополнительным аутоиммунным заболеванием, которое может включать ИТП [48].
Некоторые этиологические факторы поражения печени имеют собственные механизмы, влияющие на уровень тромбоцитов. Так, было показано, что HCV-инфекция может приводить к появлению ТП у пациента до появления стадии цирроза и гиперспленизма. Более 20 лет назад появились работы, свидетельствующие об ассоциации HCV и ТП [49–51]. До 30% пациентов с ИТП без признаков прогрессирующего заболевания печени серопозитивные по HCV [52]. Хроническая инфекция HCV может приводить к ТП с помощью различных механизмов [53], один из которых – прямое подавление костномозгового кроветворения [54]. Пациенты с HCV демонстрируют депрессию тромбоцитов даже в отсутствие спленомегалии [55] и нормализации уровня тромбоцитов после успешного лечения инфекции [56]. Известно, что хроническая HCV-инфекция связана с множеством аутоиммунных нарушений, около 40% пациентов с HCV-инфекцией имеют по меньшей мере одно иммуноопосредованное внепеченочное проявление в течение их болезни [57, 58]. Снижение уровня тромбоцитов при HCV коррелирует с тяжестью заболевания и сопровождается увеличением титров антитромбоцитарных Ig [49, 55]. Кроме того, HCV может напрямую взаимодействовать с тромбоцитами для связывания мембран тромбоцитов через множественные рецепторы клеточной поверхности, что в конечном итоге приводит к фагоцитозу тромбоцитов с антителом и ускоренному разрушению тромбоцитов ретикулоэндотелиальной системой [59].
Связывание HCV с тромбоцитами также может индуцировать образование антигенов на поверхности тромбоцитов или изменять свойства гликопродеидной мембраны тромбоцитов, что способствует формированию аутоантител, таких как GPIIb/IIIa, и последующему развитию ТП [60]. Наконец, HCV тесно связан с криоглобулинемией, а криоглобулины могут играть роль в формировании иммунных комплексов и развитии ТП [61].
Заключение
ТП представляет собой сложное и многофакторное явление, нередко встречающееся в практике врача-гастроэнтеролога. Глубокое понимание патофизиологии ТП в зависимости от причины ее возникновения имеет решающее значение при выборе стратегий лечения. Информированность специалистов о механизмах развития ТП при заболеваниях пищеварительной системы будет способствовать повышению успешности терапии.
Литература
1. Provan D., Stasi R., Newland A.S., Blanchette V.S., Bolton-Maggs P., Bussel J.B., et al. International consensus report on the investigation and management of primary immune thrombocytopenia. Blood. 2010;115(2):168–86.
2. Бакулин И.Г., Шарабанов А.С., Моляренко Е.В., Яковлева Е.В. Тромбоцитопении у больных хроническим гепатитом С. Экспериментальная и клиническая гастроэнтерология. 2010;5:52–60.
3. George J.N. Platelets. Lancet. 2000;355:1531–39.
4. Национальные клинические рекомендации по диагностике и лечению идиопатической тромбоцитопенической пурпуры (первичной иммунной тромбоцитопении) у взрослых. М., 2016. 55 с.
5. Луговская С.А., Морозова В.Т., Почтарь М.Е., Долгов В.В. Лабораторная гематология. М., 2006. 223 с.
6. Gasbarrini A., Franceschi F., Tartaglione R., Landolfi R., Pola P., Gasbarrini G. Regression of autoimmune thrombocytopenia after eradication of Helicobacter pylori. Lancet. 1998;352:878.
7. Ko G.H., Part H.B., Shin M.K., et al. Monoclonal antibodies against Helicobacter pylori cross-react with human tissue. Helicobacter. 1997;4:210–15.
8. Nagachima R., Maeda K., Yuda F., Kudo K., Saitoh M.,Takahashi T. Helicobacter pylori antigen in the glomeruli of patients with membranous nephropathy. Virchows Arch. 1997;431:235–39.
9. Machet L., Vaillant L., Machet M.C., Buchler M., Lorette G. Schonlein-Henoch purpura associated with gastric Helicobacter pylori infection. Dermatology. 1997;194:86.
10. Scandellari R., Allemand E., Vettore S., Plebani M., Randi M.L., Fabris F. Platelet response to Helicobacter pylori eradication therapy in adult chronic idiopathic thrombocytopenic purpura seems to be related to the presence of anticytotoxin-associated gene A antibodies. Blood Coagul. Fibrinolysis. 2009;20:108–13.
11. Figura N., Franceschi F., Santucci A., Bernardini G., Gasbarrini G., Gasbarrini A. Extragastric Manifestations of Helicobacter pylori Infection. Helicobacter. 2010;15(1):60–8.
12. Michel M., Khellaf M., Desforges L., Lee K., Schaeffer A., Godeau B., Bierling P.. Autoimmune thrombocytopenic Purpura and Helicobacter pylori infection. Arch. Intern. Med. 2002;162:1033–36.
13. Takahashi T., Yujiri T., Shinohara K., Inoue Y., Sato Y., Fujii Y., Okubo M., Zaitsu Y., Ariyoshi K., Nakamura Y., et al. Molecular mimicry by Helicobacter pylori CagA protein may be involved in the pathogenesis of H. pylori-associated chronic idiopathic thrombocytopenic purpura. Br. J. Haematol. 2004;124:91–6.
14. Bai Y., Wang Z., Bai X., Yu Z., Cao L., Zhang W., et al. Cross-reaction of antibody against Helicobacter pyloriurease B with platelet glycoprotein IIIa and its significance in the pathogenesis of immune thrombocytopenic purpura. Int. J. Hematol. 2009;89:142–49.
15. Yamanishi S., Iizumi T., Watanabe E., Shimizu M., Kamiya S., Nagata K., Kumagai Y., Fukunaga Y., Takahashi H. Implications for induction of autoimmunity via activation of B-1 cells by Helicobacter pylori urease. Infect. Immun. 2006;74:248–56.
16. Pellicano R., Touscoz G.A., Smedile A., Berrutti M., Saracco G., Repici A., Ponzetto A., Rizzetto M. Prevalence of non-organ-specific autoantibodies in patients suffering from duodenal ulcer with and without Helicobacter pylori infection. Dig. Dis. Sci. 2004;49:395–98.
17. Kuwana M. Helicobacter pylori-associated immune thrombocytopenia: clinical features and pathogenic mechanisms. World J. Gastroenterol. 2014;20:714–23.
18. Asahi A., Kuwana M., Suzuki H., Hibi T., Kawakami Y., Ikeda Y. Effects of a Helicobacter pylori eradication regimen on anti-platelet autoantibody response in infected and uninfected patients with idiopathic thrombocytopenic purpura. Haematologica. 2006;91:1436–37.
19. Wu Z., Zhou J., Prsoon P., Wei X., Liu X., Peng B. Low expression of FCGRIIB in macrophages of immune thrombocytopenia-affected individuals. Int. J. Hematol. 2012;96:588–93.
20. Fujimura K. Kuwana M., Kurata Y., Imamura M., Harada H., Sakamaki H., Teramura M., Koda K., Nomura S., Sugihara S., et al. Is eradication therapy useful as the first line of treatment in Helicobacter pylori-positive idiopathic thrombocytopenic purpura? Analysis of 207 eradicated chronic ITP cases in Japan. Int. J. Hematol. 2005;81:162–68.
21. Veneri D., De Matteis G., Solero P., Federici F., Zanuso C., Guizzardi E., Arena S., Gaio M., Pontiero P., Ricetti M.M., et al. Analysis of B- and T-cell clonality and HLA class II alleles in patients with idiopathic thrombocytopenic purpura: correlation with Helicobacter pylori infection and response to eradication treatment. Platelets. 2005;16:307–11.
22. Satoh T., Pandey J.P., Okazaki Y., Asahi A., Kawakami Y., Ikeda Y., Kuwana M. Single nucleotide polymorphism of interleukin-1beta associated with Helicobacter pylori infection in immune thrombocytopenic purpura. Tissue Antigens. 2009;73:353–57.
23. Hashino S., Mori A., Suzuki S., Izumiyama K., Kahata K., Yonezumi M., Chiba K., Kondo T., Ota S., Toyashima N., et al. Platelet recovery in patients with idiopathic thrombocytopenic purpura after eradication of Helicobacter pylori. Int. J. Hematol. 2003;77:188–91.
24. Nomura S., Inami N., Kanazawa S. The effects of Helicobacter pylori eradication on chemokine production in patients with immune thrombocytopenic purpura. Eur. J. Haematol. 2004;72:304–5.
25. Stasi R., Rossi Z., Stipa E., Amadori S., Newland A.C., Provan D. Helicobacter pylori eradication in the management of patients with idiopathic thrombocytopenic purpura. Am. J. Med. 2005;118:414–419.
26. Kodama M., Kitadai Y., Ito M., Kai H., Masuda H., Tanaka S., Yoshihara M., Fujimura K., Chayama K.. Immune response to CagA protein is associated with improved platelet count after Helicobacter pylori eradication in patients with idiopathic thrombocytopenic purpura. Helicobacter. 2007;12:36–42.
27. Ando K., Shimamoto T., Tauchi T., Ito Y., Kuriyama Y., Gotoh A., Miyazawa K., Kimura Y., Kawai T., Ohyashiki K. Can eradication therapy for Helicobacter pylori really improve the thrombocytopenia in idiopathic thrombocytopenic purpura? Our experience and a literature review. Int. J. Hematol. 2003;77:239–44.
28. Inaba T., Mizuno M., Take S., Suwaki K., Honda T., Kawai K., Fujita M., Tamura T., Yokota K., Oguma K., et al. Eradication of Helicobacter pylori increases platelet count in patients with idiopathic thrombocytopenic purpura in Japan. Eur. J. Clin. Invest. 2005;35:214–19.
29. Emilia G., Luppi M., Zucchini P., Morselli M., Potenza L., Forghieri F., Volzone F., Jovic G., Leonardi G., Donelli A., et al. Helicobacter pylori infection and chronic immune thrombocytopenic purpura: long-term results of bacterium eradication and association with bacterium virulence profiles. Blood. 2007;110:3833–41.
30. Payandeh M., Raeisi D., Sohrabi N., Zare M.E., Kansestani A.N., Keshavarz N., Gholami S., Hashemian A.H. Poor platelet count response to Helicobacter pylori eradication in patients with severe idiopathic thrombocytopenic purpura. Int. J. Hematol. Oncol. Stem. Cell. Res. 2013;7:9–14.
31. Sato R., Murakami K., Watanabe K., Okimoto T., Miyajima H., Ogata M., Ohtsuka E., Kodama M., Saburi Y., Fujioka T., et al. Effect of Helicobacter pylori eradication on platelet recovery in patients with chronic idiopathic thrombocytopenic purpura. Arch. Intern. Med. 2004;164:1904–907.
32. Suzuki T., Matsushima M., Shirakura K., Koike J., Masui A., Takagi A., Shirasugi Y., Ogawa Y., Shirai T., Mine T. Association of inflammatory cytokine gene polymorphisms with platelet recovery in idiopathic thrombocytopenic purpura patients after the eradication of Helicobacter pylori. Digestion. 2008;77:73–8.
33. Satoh T., Miyazaki K., Shimohira A., Amano N., Okazaki Y., Nishimoto T., Akahoshi T., Munekata S., Kanoh Y., Ikeda Y., et al. Fcγ receptor IIB gene polymorphism in adult Japanese patients with primary immune thrombocytopenia. Blood. 2013;122:1991–92.
34. Sato R., Murakami K., Okimoto T., Watanabe K., Kodama M., Fujioka T. Development of corpus atrophic gastritis may be associated with Helicobacter pylori-related idiopathic thrombocytopenic purpura. J. Gastroenterol. 2011;46:991–97.
35. Samson A.D., Schipperus M.R., Langers A.M., Dekkers O.M. Helicobacter pylori infection is not correlated with subclinical thrombocytopenia: A cross-sectional study. Platelets. 2014;25:221–23.
36. Gan G.G., Norfaizal A.L., Bee P.C., Chin E.F., Habibah A.H., Goh K.L. Helicobacter pylori infection in chronic immune thrombocytopenic purpura patients in Malaysia. Med. J. Malaysia. 2013;68:231–33.
37. Peck-Radosavljevic, M. Thrombocytopenia in chronic liver disease. Liver International. 2017;37:778–93.
38. Wai C.-T., Greenson J.K., Fontana R.J., Kalbfleisch J.D., Marrero J.A., Conjeevaram H.S., Lok A.S.-F. A Simple Noninvasive Index Can Predict Both Significant Fibrosis and Cirrhosis in Patients With Chronic Hepatitis C. Hepatology. 2003;2(38):518–36.
39. Qamar A.A., Grace N.D., Groszmann R.J., et al. Incidence, prevalence, and clinical significance of abnormal hematologic indices in compensated cirrhosis. Clin. Gastroenterol. Hepatol. 2009;7:689–95.
40. Aster R.H. Pooling of platelets in the spleen: role in the pathogenesis of “hypersplenic” thrombocytopenia. J. Clin. Invest. 1966;45:645–57.
41. Borel Rinkes I.H., Van der Hoop A.G., Hesselink E.J., et al. Does auxiliary heterotopic liver transplantation reverse hypersplenism and portal hypertension? Gastroenterology. 1991;100:1126–28.
42. Бакулин И.Г., Пузин С.Н., Сандлер Ю.Г. и др. Медико-социальное значение тромбоцитопении у больных хроническими заболеваниями печени. Вестник всероссийского общества специалистов по медико-социальной экспертизе, реабилитации и реабилитационной индустрии. 2011;2:73–80.
43. Mitchell O., Feldman D.M., Diakow M., Sigal S.H. The pathophysiology of thrombocytopenia in chronic liver disease. Hepatic Medicine: Evidence and Research. 2016;8:39–50.
44. Lindenbaum J., Lieber C.S. Hematologic effects of alcohol in man in the absence of nutritional deficiency. N. Engl. J. Med. 1969;281(7):333–38.
45. Ballard H.S. Hematological complications of alcoholism. Alcohol. Clin. Exp. Res. 1989;13:706–20.
46. Yamane A., Nakamura T., Suzuki H., et al. Interferon-alpha 2b-induced thrombocytopenia is caused by inhibition of platelet production but not proliferation and endomitosis in human megakaryocytes. Blood. 2008;112(3):542–50.
47. Pereira J., Accatino L., Alfaro J., et al. Platelet autoantibodies in patients with chronic liver disease. Am. J. Hematol. 1995;50(3):173–78.
48. Bassendine M.F., Collins J.D., Stephenson J., et al. Platelet associated immunoglobulins in primary biliary cirrhosis: a cause of thrombocytopenia? Gut. 1985;26(10):1074–79.
49. Nagamine T., Ohtuka T., Takehara K., et al. Thrombocytopenia associated with hepatitis C viral infection. J. Hepatol. 1996;24(2):135–40.
50. Pivetti S., Novarino A., Merico F., Bertero T., Brunetto M.R., Bonino F., Caligaris-Cappio F. High prevalence of autoimmune phenomena in hepatitis C virus antibody positive patients with lymphoproliferative and connective disorders. Br. J. Haematol.1996;95:204–11.
51. Pollock J.L. Extrahepatic manifestations of hepatitis C virus infection. Ann. Int. Med.1996;125:345.
52. Pawlotsky J.M., Bouvier M., Fromont P., et al. Hepatitis C virus infection and autoimmune thrombocytopenic purpura. J. Hepatol. 1995;23(6):635–39.
53. Weksler B.B. Review article: the pathophysiology of thrombocytopenia in hepatitis C virus infection and chronic liver disease. Aliment. Pharmacol. Ther. 2007;26(Suppl. 1):13–9.
54. Wang C.S., Yao W.J., Wang S.T., et al. Strong association of hepatitis C virus (HCV) infection and thrombocytopenia: implications from a survey of a community with hyperendemic HCV infection. Clin. Infect. Dis. 2004;39(6):790–96.
55. Bordin G., Ballare M., Zigrossi P., et al. A laboratory and thrombokinetic study of HCV-associated thrombocytopenia: a direct role of HCV in bone marrow exhaustion? Clin. Exp. Rheumatol. 1995;13(Suppl. 13):39–43.
56. Garcia-Suarez J., Burgaleta C., Hernanz N., et al. HCV-associated thrombocytopenia: clinical characteristics and platelet response after recombinant alpha2b-interferon therapy. Br. J. Haematol. 2000;110(1):98–103.
57. Mayo M.J. Extrahepatic manifestations of hepatitis C infection. Am. J. Med. Sci. 2003;325(3):135–48.
58. Ramos-Casals М., Zignego А., Ferri С., et al. Evidence-based recommendations on the management of extrahepatic manifestations of chronic hepatitis C virus infection. J. Hepatology. 2017;66:1282–99.
59. Hamaia S., Li C., Allain J.P. The dynamics of hepatitis C virus binding to platelets and 2 mononuclear cell lines. Blood. 2001;98(8):2293–300.
60. Panzer S., Seel E. Is there an increased frequency of autoimmune thrombocytopenia in hepatitis C infection? A review. Wien. Med. Wochenschr. 2003;153(19–20):417–20.
61. Misiani R., Bellavita P., Fenili D., et al. Hepatitis C virus infection in patients with essential mixed cryoglobulinemia. Ann. Intern. Med. 1992;117(7):573–77.
/ukr/8/1.jpg)
/ukr/9/3.jpg)
/ukr/9/1.jpg)
/ukr/9/2.jpg)
/ukr/9/4.jpg)
/ukr/10/1.jpg)
/ukr/10/2.jpg)