Как доказать что оксид амфотерный
Как доказать что оксид амфотерный
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
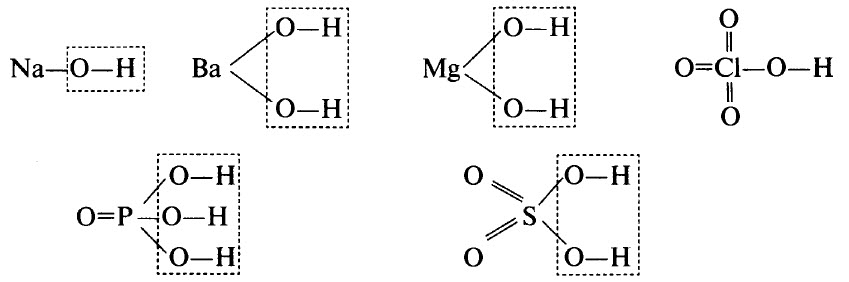
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н + = Al 3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
В образовавшейся соли алюминий образует анион AlO2 – (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4] – :
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока по химии для 8 класса «Амфотерные оксиды и гидроксиды». Выберите дальнейшее действие:
Урок №46. Амфотерные оксиды и гидроксиды
Кислотный остаток (А)
со щелочами проявляет кислотные свойства:
со щелочами проявляет кислотные свойства:
со щелочами проявляет кислотные свойства:
со щелочами проявляет кислотные свойства:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
2Al(OH) 3 + 3SO 3 = Al 2 (SO 4 ) 3 + 3H 2 O
Al 2 O 3 + 3H 2 SO 4 = Al 2 (SO 4 ) 3 + 3H 2 O
2Al(OH) 3 + Na 2 O = 2NaAlO 2 + 3H 2 O
Al 2 O 3 + 2NaOH = t°C = 2NaAlO 2 + H 2 O (при сплавлении)
Если реакция протекает в водном растворе: Al(OH) 3 + NaOH = Na[Al(OH) 4 ]
здесь AlO 2 (I) – одновалентный кислотный остаток метаалюминат
Zn(OH) 2 + SO 3 = ZnSO 4 + H 2 O
ZnO + H 2 SO 4 = H 2 O + ZnSO 4
Zn(OH) 2 + Na 2 O = Na 2 ZnO 2 + H 2 O
Zn(OH) 2 + 2NaOH = Na 2 [Zn(OH) 4 ]
ZnO + 2NaOH = Na 2 ZnO 2 + H 2 O
здесь ZnO 2 (II) – двухвалентный кислотный остаток цинкат.
Оксиды и гидроксиды, которые способны реагировать и с кислотами, и со щелочами, называют амфотерными.
Химические элементы, которым соответствуют амфотерные оксиды и гидроксиды, обладают переходными химическими свойствами, не относящимися ни к металлам, ни к неметаллам, их называют амфотерными.
Амфотерность (от греч. Аmphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие. Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например,
Амфотерные гидроксиды практически нерастворимы в воде. Они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых валентность металла III, IV иногда II.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ГИДРОКСИДОВ
(нерастворимы в воде)
1.Реагируют с кислотами: Zn(OH) 2 + 2HCl = ZnCl 2 + 2H 2 O
2.Реагируют со щелочами: Zn(OH) 2 + 2NaOH = Na 2 [Zn(OH) 4 ]
ПРИМЕНЕНИЕ
Из всех амфотерных гидроксидов наибольшее применение находит гидроксид алюминия:
· лекарственные препараты, приготовленные на основе гидроксида алюминия, врач назначает при нарушении кислотно-щелочного баланса в пищеварительном тракте;
· в качестве антипирена (средства для подавления способности гореть) вещество вводят в состав пластмасс и красок;
· путём разложения гидроксида алюминия в металлургии получают оксид алюминия (глинозём) — сырьё для получения металлического алюминия.
Товары, в производстве которых используется гидроксид алюминия: лекарственный препарат «Алмагель» и металлургический глинозём
Гидроксид цинка в промышленности служит сырьём для получения различных соединений этого металла, в основном — солей.
Химия, Биология, подготовка к ГИА и ЕГЭ
Амфотерные соединения
Автор статьи — Саид Лутфуллин
Химия – это всегда единство противоположностей.
Посмотрите на периодическую систему.
Некоторые элементы (почти все металлы, проявляющие степени окисления +1 и +2) образуют основные оксиды и гидроксиды. Например, калий образует оксид K2O, и гидроксид KOH. Они проявляют основные свойства, например взаимодействуют с кислотами.
K2O + HCl → KCl + H2O
Некоторые элементы (большинство неметаллов и металлы со степенями окисления +5, +6, +7) образуют кислотные оксиды и гидроксиды. Кислотные гидроксиды – это кислородсодержащие кислоты, их называют гидроксидами, потому что в строении есть гидроксильная группа, например, сера образует кислотный оксид SO3 и кислотный гидроксид H2SO4 (серную кислоту):
Такие соединения проявляют кислотные свойства, например они реагируют с основаниями:
H2SO4 + 2KOH → K2SO4 + 2H2O
А есть элементы, образующие такие оксиды и гидроксиды, которые проявляют и кислотные, и основные свойства. Это явление называется амфотерностью. Таким оксидам и гидроксидам и будет приковано наше внимание в этой статье. Все амфотерные оксиды и гидроксиды — твердые вещества, нерастворимые в воде.
Для начала, как определить является ли оксид или гидроксид амфотерным? Есть правило, немного условное, но все-таки пользоваться им можно:
Амфотерные гидроксиды и оксиды образуются металлами, в степенях окисления +3 и +4, например (Al2O3, Al(OH)3, Fe2O3, Fe(OH)3)
И четыре исключения: металлы Zn, Be, Pb, Sn образуют следующие оксиды и гидроксиды: ZnO, Zn(OH)2, BeO, Be(OH)2, PbO, Pb(OH)2, SnO, Sn(OH)2, в которых проявляют степень окисления +2, но не смотря на это, эти соединения проявляют амфотерные свойства.
Примеры решения задач. Пример 1. Докажите, что оксид свинца (II) имеет амфотерный характер.
Пример 1. Докажите, что оксид свинца (II) имеет амфотерный характер.
Р е ш е н и е. Для доказательства амфотерного характера любого оксида (или гидроксида) необходимо привести уравнения химических реакций, в которых эти соединения проявляют основные и кислотные свойства.
1) Основные свойства оксида свинца (II) можно проиллюстрировать на примере взаимодействия РbО с веществами, имеющими кислотный характер, т.е. с кислотой и кислотным оксидом: РbО + 2НNO3 = Pb(NO3)2 + Н2О
2) Кислотные свойства оксида свинца (II) можно продемонстрировать с помощью реакций взаимодействия РbО со щелочами и с основными оксидами:
Таким образом, РbО является амфотерным оксидом, так как он проявляет и основные, и кислотные свойства.
Пример 2. Напишите уравнения всех возможных реакций между следующими веществами, взятыми попарно: оксид калия, оксид фосфора (V), гидроксид натрия, серная кислота, гидросульфат натрия, гидроксид бериллия.
Р е ш е н и е. 1) Устанавливаем принадлежность каждого из этих веществ к определенному классу неорганических соединений: К2О – основный оксид, Р2О5 – кислотный оксид, NaOH – основание (щелочь), H2SO4 – кислота, NaHSO4 – кислая соль, Ве(ОН)2 – амфотерный гидроксид.
2) Используя сведения о химических свойствах оксидов, гидроксидов и солей, напишем уравнения реакций между представителями этих классов соединений.
Основный оксид К2О может взаимодействовать с кислотным оксидом, кислотой и амфотерным гидроксидом: 3К2О + 2Р2О5 = 2К3РО4
Кислотный оксид Р2О5 может взаимодействовать с основным оксидом, основанием и амфотерным гидроксидом:
Основный гидроксид NaOH реагирует с кислотным оксидом, кислотой, амфотерным гидроксидом и кислой солью:
Амфотерный гидроксид Ве(ОН)2 ( или H2BeО2) реагирует с основным оксидом, основанием, кислотным оксидом и кислотой :
Амфотерный гидроксид Ве(ОН)2 при взаимодействии с основным оксидом и щелочью проявляет свойства кислоты H2BeО2:
Амфотерный гидроксид Ве(ОН)2 при взаимодействии с кислотным оксидом и кислотой проявляет основные свойства.
Кислая соль NaHSO4 реагирует с основным оксидом и основанием:
Следовательно, из всех приведенных веществ попарно не взаимодействуют только К2О и NaOH, поскольку основные оксиды не вступают в реакции с основаниями.
Пример 3. Объясните закономерность в изменении кислотно-основных свойств гидроксидов элементов третьего периода Периодической системы
Д.И. Менделеева в их высших степенях окисления.
3) Место разрыва химической связи в гидроксиде Э−О−Н зависит от положения элемента в Периодической системе, что и определяет относительную прочность связи между Э−О и О−Н. Силы притяжения между противоположно заряженными частицами тем значительнее, чем больше заряд каждой из них и меньше радиус.
4) Записываем формулы гидроксидов элементов третьего периода Периодической системы в их высших степенях окисления (высшая степень окисления атома элемента соответствует номеру группы):
5) Сравниваем относительную прочность связей Э−O и О−Н у высших гидроксидов третьего периода, учитывая, что при переходе от Na к CI наблюдается уменьшение радиуса атома. Благодаря своим малым размерам ион водорода Н + в NaOH и Mg(OH)2 сильнее взаимодействует с кислородом, чем ион металла. Вследствие этого менее прочными оказываются связи Na−О и Mg−О, поэтому NaOH и Mg(OH)2 являются основаниями. В результате дальнейшего увеличения заряда и уменьшения радиуса атома при переходе к А1 связи А1−О и О−Н становятся близки по прочности, и А1(ОН)3 является типичным амфотерным гидроксидом. Наконец, у последних четырех соединений вследствие еще большего увеличения заряда и уменьшения радиуса атомов заметно увеличивается прочность связи Э−О и уменьшается прочность связи О−Н, поэтому гидроксиды H2SiO3, HNO3, H2SO4 и НСlO4 являются кислотами.
1.5.Элементы химической термодинамики и термохимии
Химическая термодинамика – это часть термодинамики, рассматривающая превращения энергии и работы при химических реакциях. Термохимия– раздел химической термодинамики в приложении к тепловым эффектам химических реакций.
Тепловой эффект химической реакции – это количество теплоты, которое выделяется или поглощается при реакции. При этом происходит изменении внутренней энергии системы (U)–суммы кинетической и потенциальной энергий всех частиц, составляющих систему: ∆U = U2 – U1 (U1 – начальное состояние системы, U2 – конечное состояние системы).
В соответствии с первым законом термодинамики (законом сохранения энергии) изменение внутренней энергии закрытой системы определяется количеством теплоты Q,полученной системой из окружающей среды, и работой A, произведенной системой над окружающей средой:
∆U = Q – A, (1)
где A = P ∆V – механическая работа расширения.
Для изобарных процессов (Р = const, ∆V ≠ 0) в термодинамике вводится новая функция энтальпия H = U + PVи Q определяется как изменение энтальпии
∆H = H2 – H1:
где ∆H – тепловой эффект химической реакции при P = const.
Реакции, протекающие с выделением теплоты, называются экзотермическими. В экзотермических реакциях внутренняя энергия и энтальпия системы уменьшаются, ∆H 0.
В основе термохимических расчетов лежит закон Гесса:тепловой эффект химической реакции зависит только от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути реакции, т.е. числа промежуточных стадий. Закон Гесса констатирует тот факт, что U и Hявляются функциями состояния системы,т.е. их изменение (∆U и ∆H) зависит только от начального и конечного состояния системы.
Следствие из закона Гесса:
Тепловой эффект химической реакции равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ:
(конечное состояние (начальное состояние
∆H 0 f,298 – стандартная энтальпия образования вещества, кДж/моль.
Стандартная энтальпия образования вещества (∆H 0 f,298) – это тепловой эффект образования одного моля данного вещества из простых веществ в стандартных условиях (Т = 298К, Р = 1 атм.). Значения ∆H 0 f, 298 приводятся в справочной литературе (см. табл. 2). Для простых веществ ∆H 0 f, 298 = 0.
Наблюдения показывают, что самопроизвольно, т.е. без затраты работы извне, могут идти как экзотермические, так и эндотермические реакции, если последние сопровождаются увеличением неупорядоченности системы (например, реакции, в которых из твердых веществ образуются газообразные вещества).
Степень неупорядоченности системы выражается термодинамической величиной – энтропией S. Чем выше неупорядоченность системы, тем больше ее энтропия. S также, как U и H, является функцией состояния системы. Для вычисления изменения энтропии (∆S =S2 – S1) в химических реакциях используют следствие из закона Гесса:
где ∆S 0 298 – изменение энтропии реакции при стандартных условиях, Дж/моль;
ν и ν′ – стехиометрические коэффициенты в уравнении реакции;
S 0 298 – стандартная энтропия вещества, Дж/моль∙К.
Известны абсолютные значения энтропии веществ, они приводятся в справочной литературе (см. табл. 2).
Термодинамическая величина, связанная с энтальпией и энтропией, называется энергией Гиббса (изобарно-изотермическим потенциалом) и обозначается буквой G:
G = H – T∙S.В изобарно-изотермических условиях
∆G = ∆H – T×∆S (5)
Величина ∆G является критерием направления и предела самопроизвольного протекания химических реакций в закрытых системах при Р,Т= const:∆G ≤ 0.
Если ∆G 0, то самопроизвольно протекает обратная реакция (G2 > G1); если ∆G = 0, то система находится в состоянии равновесия, при котором G = Gmin. Так как G является функцией состояния системы, то для стандартных условий изменение энергии Гиббса химической реакции ∆G 0 298 рассчитывается следующим образом:
∆G 0 f, 298 – стандартная энергия Гиббса образования вещества, кДж/моль.
Стандартная энергия Гиббса образования вещества (∆G 0 f, 298)– это изменение энергии Гиббса при реакции образования одного моля вещества из простых веществ при стандартных условиях. Значения ∆G 0 f,298 – это справочные данные, для простых веществ ∆G 0 f, 298 = 0 (см. табл. 2). Для расчета ∆G при температуре, отличающейся от стандартной (Т ≠ 298К), используется соотношение:
где ∆H 0 298 – тепловой эффект химической реакции при стандартных условиях, энтальпийный фактор; ∆S 0 298 – изменение энтропии химической реакции при стандартных условиях; T∆S 0 298 – энтропийный фактор.
Знак и величина ∆G, а, следовательно, и возможность самопроизвольного протекания процесса при заданных температуре и давлении зависят от соотношения энтальпийного и энтропийного факторов.
Дата добавления: 2015-01-29 ; просмотров: 31 ; Нарушение авторских прав
Как определить тип оксида?
В заданиях ЕГЭ есть такие вопросы, где требуется определить тип оксида. Прежде всего, следует запомнить четыре типа оксидов:
Основные, кислотные и амфотерные оксиды часто также объединяют в группу солеобразующих оксидов.
Не вдаваясь в теоретические подробности, изложу пошаговый алгоритм определения типа оксида.
Первое — определите: оксид металла перед вами или оксид неметалла.
Второе — установив, какой оксид металла или неметалла перед вами, определите степень окисления элемента в нем и воспользуйтесь таблицей ниже. Естественно, правила отнесения оксидов в этой таблице нужно выучить. Поначалу можно решать задания, подглядывая в нее, но ваша цель ее запомнить, так как на экзамене никаких источников информации, кроме таблицы Д.И. Менделеева, таблицы растворимости и ряда активности металлов, у вас не будет.
1) Степень окисления неметалла +1 или +2
Вывод: оксид несолеобразующий
Исключение: Cl2O не относится к несолеобразующим оксидам
1) Степень окисления металла равна +1, +2
Вывод: оксид металла основный
Исключение: BeO, ZnO, SnO и PbO не относятся к основным оксидам!!
2) Степень окисления больше либо равна +3
Вывод: оксид кислотный
Исключение: Cl2O относится к кислотным оксидам, несмотря на степень окисления хлора +1
2) Степень окисления металла +3, +4,
Вывод: оксид амфотерный.
Исключение: BeO, ZnO, SnO и PbO амфотерны, несмотря на степень окисления +2 у металлов
3) Степень окисления металла +5,+6,+7
Вывод: оксид кислотный.
Примеры:
Задание: определите тип оксида MgO.
Решение: MgO является оксидом металла, при этом степень окисления металла в нем +2. Все оксиды металлов в степени окисления +1 и +2 основны, кроме оксида бериллия или цинка.
Ответ: MgO – основный оксид.
Задание: определите тип оксида Mn2O7
Решение: Mn2O7 – оксид металла, и степень окисления металла в этом оксиде равна +7. Оксиды металлов в высоких степенях окисления (+5,+6,+7) относятся к кислотным.
Ответ: Mn2O7 – кислотный оксид
Задание: определите тип оксида Cr2O3.
Решение: Cr2O3 – оксид металла, и степень окисления металла в этом оксиде равна +3. Оксиды металлов в степенях окисления +3 и +4 относятся к амфотерным.
Ответ: Cr2O3 – амфотерный оксид.
Задание: определите тип оксида N2O.
Решение: N2O – оксид неметалла, и степень окисления неметалла в этом оксиде равна +1. Оксиды неметаллов в степенях окисления +1 и +2 относятся к несолеобразующим.
Ответ: N2O – несолеобразующий оксид.
Задание: определите тип оксида BeO.
Решение: оксид бериллия, а также оксид цинка являются исключениями. Несмотря на степень окисления металлов в них, равную +2, они амфотерны.
Ответ: BeO – амфотерный оксид.
С химическими свойствами оксидов можно ознакомиться здесь