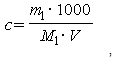Коэффициент поправки раствора равен 1 2 это значит что раствор
Рабочие растворы, их приготовление. Установочные (исходные) вещества. Поправочный коэффициент
Рабочие растворы, или титранты, получают растворением точной навески (точно взвешенного вещества) хорошо очищенного исходного вещества в определенном объеме воды в мерной колбе и доводят водой до метки. Такие растворы можно приготовить только в том случае, если первичный стандарт, т.е. вещество, из которого готовят такой раствор, отвечает целому ряду требований: имеет хорошо известный состав, точно отвечающий химической формуле; устойчиво при хранении; легко растворяется в воде; обладает большой молярной массой (чем больше масса моля данного исходного вещества, тем меньше ошибка при взвешивании). Лишь немногие вещества удовлетворяют или почти удовлетворяют этим требованиям, и поэтому число веществ, пригодных в качестве первичных стандартов, ограничено.
Например, растворы НСl, H2SO4, HNO3 нельзя приготовить из точных навесок, так как эти исходные вещества содержат некоторое количество воды. Растворы NaOH или КОН поглощают СО2 и воду из воздуха, и их растворы также нельзя приготовить из точных навесок. Растворы этих веществ готовят приблизительно, а затем приготовленные растворы стандартизируют, т.е. устанавливают концентрацию точно. Эти растворы называются вторичными стандартами. Для их стандартизации применяют первичные стандарты. В качестве первичных стандартов используется декагидрат тетрабората натрия Na2B4O7 • 10Н2О, оксалат натрия Na2C2O4, дихромат калия К2Сr2O7 и др.
Для приготовления рабочих растворов применяются также стандарт-титры, или фиксаналы. Это стеклянные ампулы, которые содержат точно известное количество вещества. Содержимое ампулы количественно переносят в мерную колбу на 1 л, после чего растворяют вещество и доводят объем водой до метки. Фиксаналы выпускаются промышленностью.
Иногда для выражения точной концентрации рабочего раствора пользуются так называемым поправочным коэффициентом К. Поправочный коэффициент равен отношению экспериментально найденной точной молярной концентрации эквивалента C1(1/zX) рабочего раствора к предполагаемой молярной концентрации эквивалента C2(1/zX).
Поправочный коэффициент показывает, на какое число следует умножить объем раствора предполагаемой молярной концентрации эквивалента, чтобы получить его точную концентрацию. Например, имеется приблизительно 0,1 н. раствор, для которого К = 1,146. Тогда точное значение нормальности раствора равно: 0,1 • 1,146 = 0,1146 н.
Это означает, что 0,1 н. раствор НСl при К = 1,146 в 1,146раз более концентрирован, чем 0,1 н. раствор. Следовательно, 1мл данного раствора соответствует 1,146мл 0,1 н. раствора. Если известна навеска растворенного х.ч. вещества и объем раствора, то поправка может быть вычислена из отношения:
К = Точно взятая навеска вещества
Рассчитанная навеска вещества
Пример. Из 1,340 г х.ч. NaCl приготовлено 200 мл раствора. Вычислите поправку этого раствора к 0,1 н. раствору.
Решение.В 200 мл 0,1 н. раствора NaCl должно содержаться:
58,45 • 0,1 • 200 / 1000 = 1,169 г
К = 1,340 / 1,169 = 1,146.
Если рабочий раствор приготовлен точно заданной концентрации из фиксанала или по точно взятой навеске, то К = 1.
Поправочный коэффициент очень удобен при серийных определениях.
Дата добавления: 2014-11-13 ; просмотров: 75 ; Нарушение авторских прав
СТАНДАРТИЗАЦИЯ ТИТРОВАННЫХ РАСТВОРОВ
После приготовления проводят стандартизацию титрованных растворов. Под стандартизацией титрованного раствора понимают процесс нахождения точной концентрации активного реагента в растворе.
Согласно ГФ концентрацию титрованных растворов устанавливают с помощью специальных установочных веществ (первичных стандартов) – исходных стандартных веществ. Их обозначают буквами РО (реактив основной). Исходные стандартные вещества(первичные стандарты) – вещества высокой чистоты. Согласно указаниям ОФС «Титрованные растворы» их готовят из реактивов, подвергая дополнительной очистке (сублимируют, перекристаллизовывают).
В основе стандартизации лежит стехиометрическое взаимодействие титранта и первичного стандартного вещества.
Вещества, используемые в качестве первичных стандартов, должны иметь:
– состав, точно соответствующий формуле;
– высокую чистоту (строгая стехиометричность состава);
– устойчивость на воздухе при комнатной температуре (не должны изменяться при хранении);
– отсутствие гигроскопической влаги (должны быть негигроскопичными);
– по возможности большую молярную массу эквивалента для обеспечения минимальной погрешности взвешивания;
Согласно ОФС «Титрованные растворы» в качестве исходных стандартных веществ (реактивов основных (РО); первичных стандартов) для установки концентрации титрованных растворов в титриметрическом анализе используют:
– калия бромат (РО) KBrO3;
– натрия карбонат безводный (РО) Na2CO3;
– натрия хлорид (РО) NaСl;
Нередко для стандартизации титрованных растворов используют вторичные стандарты, содержание активного компонента в которых находят с помощью первичных стандартов.
В качестве вторичных стандартов при стандартизации титрованных растворов согласно ГФ выступают титрованные растворы с установленной концентрацией, которые стехиометрически взаимодействуют со стандартизуемым титрованным раствором.
Например, стандартизацию титрованных растворов аммония тиоцианата (аммония роданида) согласно ГФ следует проводить, используя в качестве вторичного стандарта титрованные растворы серебра нитрата.
Для стандартизации заполняют бюретку приготовленным титрованным раствором и титруют точно отмеренный объем стандартного титрованного раствора (вторичный стандарт) или точную навеску исходного стандартного вещества (реактив основной (РО); первичный стандарт). В ряде случаев при стандартизации точно отмеренный объем приготовленного титрованного раствора титруют стандартным титрованным раствором (вторичный стандарт).
Точку конца титрования (ТКТ) при стандартизации приготовленного титрованного раствора определяют тем же методом, которым она будет устанавливаться в методике количественного определения анализируемого ЛС согласно НД – по индикатору, методом потенциометрии, амперометрии и др. При стандартизации титрованного раствора должен быть использован тот же состав среды, в котором он будет использоваться.
Способ приготовления титрованного раствора, методика стандартизации, установочное вещество, температурный режим, скорость титрования (при необходимости), защита от воздействия окружающей среды (титрование в атмосфере инертного газа и др.), способ расчета концентрации и поправочного коэффициента (К) титрованного раствора приводится в статье на титрованный раствор соответствующего наименования в ОФС «Титрованные растворы».
Согласно ГОСТу для расчета концентрации приготовленного титрованного раствора в ГФ приведены 2 способа:
– по навеске химически чистого вещества (первичный стандарт);
– по титрованному раствору известной концентрации (вторичный стандарт).
На основании найденной истинной концентрации рассчитывают поправочный коэффициент к молярной концентрации (К) приготовленного титрованного раствора, который характеризует точность приготовления титрованного раствора.
Поправочный коэффициент показывает отношение реально полученной (экспериментально установленной) концентрации титрованного раствора к теоретически заданной или отношение его истинного и теоретического титров:
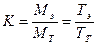
где Мэ, Мт – соответственно экспериментально установленная и теоретическая концентрация стандартизуемого титрованного раствора, М (моль/л); Тэ, Тт – соответственно истинное и теоретическое содержание растворенного вещества в стандартизуемом титрованном растворе, мг/мл.
Для обеспечения точности измерения молярной концентрации и поправочного коэффициента используют калиброванную посуду. При определении поправочного коэффициента проводят не менее трех параллельных титрований. Титрование ведут в конических колбах вместимостью 250 мл.
Если результаты титрования отличаются друг от друга менее чем на 0,05 мл, то для расчета К берут среднее арифметическое из полученных результатов. Если расхождения между отдельными титрованиями превышает 0,05 мл, то титрование повторяют до тех пор, пока не будут получены сходимые результаты.
Расхождение между коэффициентами поправки по каждой навеске установочного вещества (первичного стандарта) или по каждому объему раствора установочного вещества (вторичный стандарт) не должны превышать 0,001. Относительная погрешность определения поправочного коэффициента не должна превышать ±0,2%. Для этого следует титровать не менее 20,0-30,0 мл раствора (0,05·100/25 = 0,2%) и пользоваться мерными колбами и пипетками, предварительно проверенными на точность калибровки. Точность приготовления титрованных растворов является необходимым условием высокой точности титриметрических способов количественного определения фармацевтических субстанций и лекарственных средств.
Поправочный коэффициент нужно определять при 20 0 С. При этой же температуре рекомендуется проводить количественное определение титриметрическими методами с помощью титрованных растворов. Если титрованные растворы применяют при других температурах, то коэффициент поправки устанавливают при соответствующей температуре и используют температурную поправку.
Если титрованный раствор устойчив, соблюдены условия хранения и нет других указаний в НД, то коэффициент поправки проверяют один раз в месяц. В случае изменения титра титрованного раствора в процессе хранения под действием различных факторов окружающей среды (например, реактив Фишера, раствор иодмонохлорида, раствор иода), то согласно НД каждый раз перед применением заново определяют его титр (реактив Фишера) или параллельно проводят контрольный опыт на титрованный раствор.
Поправочный коэффициент согласно ГФ должен укладываться в интервал 0,9–1,1(т.е. отличаться от заданной концентрации не более чемна ±10%). В случаях, когда значения поправочных коэффициентов не укладываются в указанные пределы, растворы необходимо укрепить или разбавить.
Для РАЗБАВЛЕНИЯ титрованных растворов (поправочный коэффициент К больше 1,1) нужно добавить растворитель, рассчитав его объем по формуле:
где V – объем растворителя, который нужно добавить для доведения поправочного коэффициента (К) до нормы, мл; W – заданный для приготовления объем титрованного раствора, мл; Wi – объем приготовленного титрованного раствора, израсходованный при установлении концентрации, мл.
Результат умножения соответствует количеству растворителя в мл, которое нужно прибавить к приготовленному раствору для доведения поправочного коэффициента (К) до требуемого значения.
ПРИМЕР:Поправочный коэффициент 500 мл 0,1 М раствора натрия гидроксида равен 1,15. Приведите расчет доведения поправочного коэффициента (К) до нормы.
РЕШЕНИЕ: Так как поправочный коэффициент (К) больше 1,10, то раствор следует разбавить, добавив воду в количестве:
ЗАКЛЮЧЕНИЕ: Раствор следует разбавить, добавив 75 мл воды.
Для УКРЕПЛЕНИЯ титрованного раствора (поправочный коэффициент К меньше 0,9) нужно добавить вещество, рассчитав его количество по формуле:
где а– количество вещества, которое нужно добавить для доведения поправочного коэффициента до нормы, г; m– навеска вещества, взятая для приготовления заданного объема титрованного раствора, г.
ПРИМЕР:2000 мл 0,1 М раствора натрия гидроксида (Mr 40,0) приготовлены из навески массой 8,0 г (m). Поправочный коэффициент полученного раствора равен 0,85 (К). Приведите расчет доведения поправочного коэффициента (К) до нормы.
РЕШЕНИЕ: Раствор следует укрепить (поправочный коэффициент (К) меньше 1,0), добавив натрия гидроксид в количестве:
ЗАКЛЮЧЕНИЕ: Раствор следует укрепить, добавив 1,2 г натрия гидроксида.
После добавления рассчитанного количества растворителя или исходного вещества проводят повторное (трехкратное) определение поправочного коэффициента. При соответствии поправочного коэффициента (К) требованиям ГФ титрованный раствор готов к употреблению.
Титрованные растворы, более разбавленные, чем представленные в ОФС «Титрованные растворы» (0,05; 0,02; 0,01; 0,001М), готовят непосредственно перед использованием путем разведения водой, свободной от углерода диоксида. При этом поправочные коэффициенты титрованных растворов для кислотно-основного и осадительного титрования, полученных путем разбавления более концентрированных исходных титрованных растворов, используют такие же, как и у исходных растворов.
Поправочные коэффициенты титрованных растворов для окислительно-восстановительного титрования, полученных путем разбавления более концентрированных исходных титрованных растворов, устанавливают заново.
Титрованные растворы готовят и хранят в стеклянных бутылках, склянках с тубусом, растворы щелочей – в полиэтиленовых бутылках, плотно закрытых пробками. Склянки с тубусом или бутыли для титрованных растворов светочувствительных веществ должны быть темного стекла или окрашены черным лаком.
Титрованные растворы следует тщательно оберегать от потери влаги и от разбавления водой, так как при этом изменяется их титр. Титрованные растворы хранят в помещениях при комнатной температуре в местах, защищенных от попадания прямых солнечных лучей, возможно дальше от источников тепла. При необходимости титрованные растворы защищают от воздействия углерода диоксида и влаги воздуха. При появлении капель испарившейся жидкости в верхней части бутылей с титрованным раствором бутыли необходимо тщательно взболтать. Титрованные растворы, в которых при хранении появились хлопья или осадок, применять нельзя.
На склянках с титрованными растворами должно быть указано название раствора, заданная молярная концентрация, коэффициент поправки, применяемый индикатор, дата (число, месяц, год) и температура установления поправочного коэффициента. Согласно ГОСТу допускается вместо заданной молярной концентрации и коэффициента поправки указывать значение точной молярной концентрации с четырьмя значащими цифрами после запятой.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
ГОСТ 25794.1-83. Реактивы. Методы приготовления титрованных растворов для кислотно-основного титрования
Срок действия с 1 июля 1984 г.
Настоящий стандарт распространяется на реактивы и устанавливает методы приготовления следующих титрованных растворов для кислотно-основного титрования и проверки их молярных концентраций:
кислота серная, растворы молярных концентраций:
1. Общие указания
1.1. Титрованные растворы предназначены для титриметрических определений и содержат в определенном объеме точно известные количества активного вещества.
За основу расчетов при приготовлении и проверке титрованных растворов взято понятие «молярная масса эквивалента». Числовое значение молярной массы эквивалента равно числовому значению ранее применявшегося грамм-эквивалента.
1.2. При приготовлении титрованных растворов должны соблюдаться требования ГОСТ 27025-86.
При взвешивании применяют лабораторные весы общего назначения типов ВЛР-200 г и ВЛКТ-500 г-М или ВЛЭ-200 г.
Допускается применение других средств измерения с метрологическими характеристиками и оборудования с техническими характеристиками не хуже, а также реактивов по качеству не ниже указанных.
1.4. Для приготовления растворов гидроокисей используют дистиллированную воду, не содержащую углекислоты, приготовленную по ГОСТ 4517-87. Для приготовления других растворов и при титровании используют дистиллированную воду по ГОСТ 6709-72.
При приготовлении больших объемов титрованных растворов твердые вещества взвешивают на весах ВЛКТ-1000 и концентрированные растворы отмеряют цилиндром.
1.6. Приготовленные титрованные растворы тщательно перемешивают.
1.7. Определение точной молярной концентрации вещества в растворе
1.7.1. Точную молярную концентрацию (с) 
1.7.2. Точную молярную концентрацию (с) 
Точная молярная концентрация вещества в растворе выражается четырьмя значащими цифрами после запятой.
1.8. Определение коэффициента поправки
Коэффициент поправки (К) определяют по установочным веществам или их растворам.
1.8.1. При применении установочного вещества коэффициент поправки вычисляют по формуле
— заданная молярная концентрация вещества в растворе, моль/дм 3 ;
1.8.2. При применении раствора установочного вещества (заданная молярная концентрация обоих растворов одинаковая) коэффициент поправки вычисляют по формуле
1.9. При установлении коэффициента поправки необходимо применять калиброванную мерную посуду, гарантирующую требуемую точность измерения (приложение 2).
Воду добавляют цилиндром (ГОСТ 1770-74).
1.10. Для установления коэффициента поправки используют не менее трех навесок установочного вещества, взвешивая их (результат взвешивания в граммах записывают с точностью до четвертого знака). Необходимые массы навесок указаны в пунктах при определении коэффициентов поправки.
1.11. Коэффициент поправки вычисляют с точностью до четвертого десятичного знака по каждой навеске установочного вещества или по каждому объему раствора установочного вещества. Расхождения между коэффициентами не должны превышать 0,001. Из вычисленных значений коэффициентов берут среднее арифметическое. Это значение коэффициента поправки должно быть равным 
1.12. Коэффициент поправки рекомендуется устанавливать при 20°С, при этой же температуре применяют титрованные растворы.
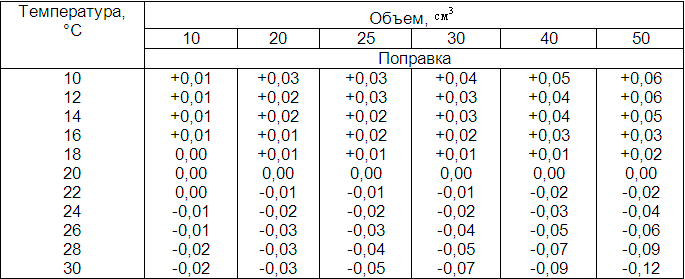
Если коэффициент поправки устанавливают и раствор применяют при других температурах, то вводят температурную поправку (см. табл. 1, 2 приложения 1).
1.13. Коэффициент поправки проверяют один раз в месяц, если раствор устойчив, соблюдены условия хранения, указанные в п. 1.17, и нет других указаний.
1.14. Допускается готовить растворы точной молярной концентрации, для которых коэффициент поправки не определяют. В этом случае навеску специально подготовленного установочного вещества или ГСО 1-го разряда для титрометрии взвешивают (результат взвешивания записывают в граммах с точностью до четвертого десятичного знака) и приготовление проводят в калиброванной мерной посуде.
1.15. Если титрованный раствор применяют для потенциометрического титрования, коэффициент поправки устанавливают потенциометрически в условиях проведения анализа.
Склянки с тубусом или бутылки для растворов веществ, разлагающихся под действием света, должны быть из темного стекла или покрашены черным лаком.
1.17. Титрованные растворы хранят в помещениях при комнатной температуре в местах, защищенных от попадания прямых солнечных лучей.
1.18. На склянках с тубусом или бутылках с титрованным раствором указывают: название раствора, заданную молярную концентрацию, коэффициент поправки, применяемый индикатор, дату (число, месяц, год) и температуру установления коэффициента поправки.
Допускается вместо заданной молярной концентрации и коэффициента поправки указывать значение точной молярной концентрации с четырьмя значащими цифрами после запятой. При потенциометрическом титровании вместо индикатора приводят указание о применении потенциометрического метода.
1.19. Титрованные растворы, в которых при хранении появились хлопья или осадок, не должны применяться.
1.20. Титрованные растворы меньшей молярной концентрации вещества, чем указано в настоящем стандарте, готовят из титрованных растворов большей молярной концентрации соответствующим разбавлением водой, не содержащей углекислоты, если нет других указаний. Коэффициент поправки титрованного раствора большей молярной концентрации переносится на раствор меньшей молярной концентрации с учетом разбавления в калиброванной мерной посуде.
Разбавленные титрованные растворы применяют свежеприготовленными.
2. Приготовление титрованных растворов
2.1. Кислоты серная и соляная, растворы молярных концентраций: с 
2.1.1. Реактивы и растворы
Вода дистиллированная по ГОСТ 6709-72.
Барий хлористый по ГОСТ 4108-72, раствор с массовой долей 20%.
Кислота серная по ГОСТ 4204-77.
Фенолфталеин (индикатор) по ТУ 6-09-5360-87, спиртовой раствор с массовой долей 0,1%.
Метиловый оранжевый (индикатор) по ТУ 6-09-5171-84, раствор с массовой долей 0,1%.
Метиловый красный (индикатор) по ТУ 6-09-5169-84, спиртовой раствор с массовой долей 0,1%.
Смешанный кислотно-основной индикатор (метиловый красный и метиленовый голубой).
Натрий бромид по ТУ 6-09-5331-87.
Натрий тетраборнокислый 10-водный по ГОСТ 4199-76, препарат с массовой долей основного вещества 
Натрий хлористый по ГОСТ 4233-77.
Натрий углекислый по ГОСТ 83-79, предварительно прокаленный; готовят по п. 2.1.1.2.
Поглотитель химический известковый ХП-И по ГОСТ 6755-88 или известь натронная.
Спирт этиловый ректификованный технический по ГОСТ 18300-87.
2.1.1.1. Приготовление 10-водного тетраборнокислого натрия
2.1.1.2. Приготовление безводного углекислого натрия
Прокаленный препарат переносят в банку с пришлифованной пробкой и сохраняют в эксикаторе с известковым химическим поглотителем ХП-И. Массовая доля основного вещества должна быть 
2.1.2. Приготовление растворов кислот
Растворы кислот готовят разбавлением соответствующих концентрированных кислот. Для приготовления 1 дм 3 раствора берут объемы серной и соляной кислот, указанные в табл. 1, 2.
Таблица 1
Таблица 2
2.1.3. Определение коэффициента поправки
2.1.3.1. Определение коэффициента поправки по безводному углекислому натрию
Формула 
В зависимости от молярной концентрации приготовленного раствора кислоты навески безводного углекислого натрия взвешивают в закрытом стаканчике для взвешивания в соответствии с табл. 3.
Навеску помещают в коническую колбу, прибавляют 40 см 3 воды, добавляют 3-4 капли раствора смешанного индикатора и титруют из бюретки раствором кислоты до перехода зеленой окраски раствора в красно-фиолетовую (для растворов массовой концентрации 0,1 моль/дм 3 переход наблюдается на фоне молочного стекла).
Таблица 3
Затем раствор нагревают, кипятят 2-3 мин для удаления углекислоты и после охлаждения продолжают титрование до перехода вновь появившейся окраски раствора в красно-фиолетовую.
Допускается применять в качестве индикатора метиловый оранжевый, при этом окраска раствора переходит из желтой в оранжевую.
2.1.3.2. Определение коэффициента поправки по 10-водному тетраборнокислому натрию (для раствора молярной концентрации 0,1 моль/дм 3 )
Формула 
2.1.4. Растворы кислот, которые хранятся продолжительное время, могут увеличивать свою молярную концентрацию за счет испарения воды. При наличии на стенках склянки с тубусом или бутылки капель воды раствор перед применением необходимо взбалтывать.
2.2.1. Реактивы и растворы.
Вода дистиллированная по ГОСТ 6709-72.
Калий йодноватокислый по ГОСТ 8504-71, препарат с массовой долей основного вещества 
Кислота серная по ГОСТ 4204-77, растворы молярных концентраций: с 
кислота соляная по ГОСТ 3118-77, растворы молярных концентраций с (HCl) = 1 моль/дм 3 (1 н.); 0,5 моль/дм 3 (0,5 н.); 0,1 моль/дм 3 (0,1 н.).
Метиловый оранжевый (индикатор) по ТУ 6-09-5171-84, раствор с массовой долей 0,1%.
Фенолфталеин (индикатор) по ТУ 6-09-5360-87, спиртовой раствор с массовой долей 1%.
Смешанный кислотно-основной индикатор (метиловый красный и метиленовый голубой).
Натрия гидроокись по ГОСТ 4328-77.
Кислота янтарная по ГОСТ 6341-75, препарат с массовой долей основного вещества 

Калий гидрофталат (калий фталевокислый кислый).
Спирт этиловый ректификованный технический по ГОСТ 18300-87.
2.2.2. Приготовление растворов
250 г гидроокиси натрия растворяют в фарфоровом (ГОСТ 9147-80) или фторопластовом стакане в 250 см 3 воды. После охлаждения раствора до комнатной температуры его переносят в стеклянный или полиэтиленовый сосуд, закрывают резиновой или полиэтиленовой пробкой и в течение 2-3 недель выдерживают до полного осаждения углекислого натрия, не растворимого в растворе гидроокиси натрия указанной концентрации.
Для приготовления 1 дм 3 раствора гидроокиси натрия берут объемы концентрированного раствора, соответствующие массам гидроокиси натрия в граммах, указанным в табл. 4.
Таблица 4
Раствор концентрации 1 моль/дм 3 хранят в полиэтиленовой или стеклянной склянке с тубусом и бутылке, парафинированной внутри.
2.2.3. Определение коэффициента поправки
2.2.3.1. Определение коэффициента поправки по соляной или серной кислоте
Раствор гидроокиси натрия с коэффициентом поправки, определенным по соляной или серной кислоте, рекомендуется применять при титровании сильных минеральных кислот.
2.2.3.2. Определение коэффициента поправки по калию йодноватокислому кислому (для раствора молярной концентрации 0,1 моль/дм 3 (0,1 н.)
Формула 
Раствор гидроокиси натрия с коэффициентом поправки, определенным по кислому йодноватокислому калию, рекомендуется применять при титровании сильных минеральных кислот.
2.2.3.3. Определение коэффициента поправки по янтарной кислоте
Формула 
В зависимости от молярной концентрации приготовленного раствора гидрокиси натрия навески янтарной кислоты взвешивают в стаканчике для взвешивания в соответствии с табл. 5.
Таблица 5
Раствор гидроокиси натрия с коэффициентом поправки, определенным по янтарной кислоте, рекомендуется применять при титровании органических кислот и слабых минеральных кислот.
2.2.3.4. Допускается определять коэффициент поправки по кислому фталевокислому калию с применением фенолфталеина в качестве индикатора или ГСО 1-го разряда N 2216-81.
Приложение 1
Таблица 1
Приведение объемов титрованных растворов при данной температуре к объемам при 20°С (для 1000 см3)
Таблица 2
Поправки объемов разбавленных растворов при разных температурах
Табл. 2 пользуются при работе с растворами концентрации 0,1 моль/дм 3 или более разбавленными.
Приложение 2
Калибровка мерной посуды
1. Общие указания
1.2. Перед проведением калибровки мерную посуду тщательно моют. Пипетки и бюретки не сушат, а мерные колбы ополаскивают этиловым спиртом или ацетоном и сушат на воздухе.
1.4. Для взвешивания применяют стаканчики для взвешивания (ГОСТ 25336-82) или конические колбы (с пробками) с взаимозаменяемым конусом (ГОСТ 25336-82).
1.5. При калибровке мерной колбы и пипетки взвешивание проводят «методом замещения» с использованием свинцовой дроби.
1.6. Для калибровки применяют дистиллированную воду известной температуры.
2. Реактивы
Ацетон по ГОСТ 2603-79.
Вода дистиллированная по ГОСТ 6709-72.
Дробь охотничья, спортивная и картечь по ГОСТ 7837-76 (дробь свинцовая).
Спирт этиловый ректификованный технический по ГОСТ 18300-87.
3. Калибровка мерной колбы
Сухую мерную колбу помещают на правую чашку весов и взвешивают. На левую чашку весов ставят стакан и добавляют свинцовую дробь до уравновешивания. Колбу снимают и на ее место ставят разновесы до достижения положения равновесия. (Для одночашечных весов «метод замещения» применять необязательно).
Осторожно наполняют колбу водой до метки. Окончательную установку уровня воды в колбе до метки проводят прибавлением (или удалением) нескольких капель воды при помощи стеклянной трубочки с оттянутым концом (или тонкой пипеткой) так, чтобы нижний край мениска воды касался верхнего края метки на колбе. Колбу с водой помещают на правую чашку весов, на левую чашку помещают стакан. Снова уравновешивают чашки добавлением свинцовой дроби. Колбу с водой снимают и ставят разновесы до достижения положения равновесия. Разность результатов двух взвешиваний соответствует массе воды, находящейся в колбе при данной температуре.
Операцию заполнения колбы водой и ее взвешивания повторяют три раза и вычисляют среднее арифметическое трех значений.
Истинный объем 
где 

4. Калибровка пипетки
Наполняют пипетку водой. Для этого нижний ее конец опускают в сосуд с водой и осторожным всасыванием наполняют пипетку на несколько миллиметров выше отметки. Верхнее отверстие закрывают указательным пальцем. Наполненную пипетку приподнимают над водой и, удерживая вертикально, устанавливают отметку на уровне глаз так, чтобы круговая линия отметки казалась прямой. Сверху пипетку протирают фильтровальной бумагой. Затем слегка приподнимают палец, закрывающий верхнее отверстие, избыток воды медленно сливают из пипетки до тех пор, пока нижний край мениска не коснется отметки. Если при этом на кончике пипетки появится капля, ее снимают, касаясь кончиком пипетки стенки сосуда. Переносят содержимое пипетки в предварительно взвешенный стаканчик для взвешивания или коническую колбу. Во время сливания воды пипетку держат в вертикальном положении. После окончания сливания прикасаются нижним концом пипетки к внутренней стенке стаканчика для взвешивания или конической колбы, закрывают крышкой или пробкой и взвешивают. Все операции взвешивания проводят как при калибровке мерной колбы.
По разности результатов взвешиваний определяют массу воды, вылитой из пипетки при данной температуре. Операцию заполнения пипетки водой и взвешивание повторяют три раза и берут среднее арифметическое трех значений.
Вычисление истинного объема пипетки проводят по формуле, приведенной в п. 3.
5. Калибровка бюретки
Для калибровки бюретку устанавливают в вертикальном положении, заполняют водой выше верхней отметки (нулевое деление), предварительно заполнив нижний оттянутый конец бюретки выше крана (следя за тем, чтобы не было пузырьков воздуха). Устанавливают уровень воды на нулевом делении так, чтобы нижний край мениска касался нулевой отметки, удаляют висящую на кончике бюретки каплю. Под бюретку устанавливают предварительно взвешенный стаканчик для взвешивания или коническую колбу и сливают определенный объем воды со скоростью около 10 см 3/ мин. Все операции взвешивания проводят, как при калибровке мерной колбы.
По разности результатов взвешиваний определяют массу воды, отмеренной в бюретке между делениями при данной температуре. Калибровку проводят для всех интервалов, начиная от нулевой отметки, как указано выше.
Операцию сливания и взвешивания отмеренного объема воды проводят три раза и берут среднее арифметическое трех значений.
Поправку объема бюретки 

где 

Для получения истинного объема, отмеренного по бюретке, к номинальной вместимости прибавляют (или вычитают, в зависимости от ее знака) найденную поправку.