Ксеноперикардиальная заплата что такое
Ксеноперикардиальная заплата что такое
Чувашский государственный университет им. И.Н. Ульянова, Вторая городская больница, Чебоксары
ФГБУ Российский научный центр хирургии РАМН им. акад. Б.В. Петровского, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Протезирование одной створки аортального клапана ксеноперикардом
Журнал: Кардиология и сердечно-сосудистая хирургия. 2012;5(3): 79-81
Иванов В. А., Евсеев Е. П., Домнин В. В., Федулова С. В. Протезирование одной створки аортального клапана ксеноперикардом. Кардиология и сердечно-сосудистая хирургия. 2012;5(3):79-81.
Ivanov V A, Evseev E P, Domnin V V, Fedulova S V. Replacement of single aortal valve cusp using xenopericardium. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2012;5(3):79-81.
Чувашский государственный университет им. И.Н. Ульянова, Вторая городская больница, Чебоксары
Чувашский государственный университет им. И.Н. Ульянова, Вторая городская больница, Чебоксары
ФГБУ Российский научный центр хирургии РАМН им. акад. Б.В. Петровского, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
При аортальных пороках патологические изменения зачастую ограничиваются поражением только одной из створок аортального клапана (АК), вызывая при этом выраженные гемодинамические нарушения. Как правило, причиной этого является инфекционный эндокардит, который приводит к разрушению или появлению перфорации в одной из створок АК, а две оставшиеся остаются практически неизмененными. В результате эти изменения приводят к аортальной недостаточности. Изолированный кальциноз одной из створок встречается значительно реже и приводит к ограничению ее подвижности и как следствие — к стенозу АК. В этих случаях всегда встает вопрос, нужно ли заменять клапан искусственным протезом или возможно выполнение пластической операции на пораженной створке.
Мы хотим привести пример успешной замены одной из створок АК ксеноперикардом при сочетанном поражении митрального и аортального клапанов у больного с инфекционным эндокардитом.
Больной А., 62 лет, поступил в отделение хирургии пороков сердца 06.06.11 с диагнозом: инфекционный эндокардит в стадии ремиссии, аортальная недостаточность IV степени, узкое фиброзное кольцо АК, митральная недостаточность IV степени. Из анамнеза известно, что в июне 2010 г. после пневмонии у больного развился инфекционный эндокардит. На фоне антибактериальной терапии в течение 2 мес удалось добиться ремиссии заболевания и нормализации температуры тела. Однако при контрольной эхокардиографии (ЭхоКГ) по месту жительства были выявлены митральная регургитация II—III степени и аортальная регургитация I—II степени. В дальнейшем состояние постепенно ухудшалось. В течение последнего месяца появилась выраженная одышка при незначительной физической нагрузке и в покое.
При обследовании в отделении на электрокардиограмме (ЭКГ) определялись синусовый ритм, частота сердечных сокращений (ЧСС) 74 уд/мин, электрическая ось сердца отклонена влево, блокада передней левой ветви пучка Гиса, атриовентрикулярная блокада I степени, гипертрофия левого предсердия и левого желудочка (ЛЖ). Фонокардиография выявила среднеамплитудный мезосистолический шум на верхушке, среднеамплитудный высокочастотный протодиастолический шум в третьем межреберье слева, среднеамплитудный протодиастолический шум и низкоамплитудный ромбовидный систолический шум во втором межреберье справа. При холтеровском мониторировании ЭКГ обнаружены частые эпизоды полной поперечной блокады с минимальной ЧСС 36 уд/мин на фоне атриовентрикулярной блокады I степени. При рентгенографическом исследовании выявлены увеличение размеров сердца за счет обоих предсердий и ЛЖ, венозный тип сердечного застоя в малом круге кровообращения. По данным коронарографии гемодинамически значимые стенозы в коронарном русле отсутствовали.
С учетом того, что у больного имелись изолированное поражение некоронарной створки и узкое фиброзное кольцо, было решено ограничить вмешательство на АК заменой только одной измененной створки ксеноперикардом. Изменения же на МК не позволяли сделать пластическую операцию, в связи с чем принято решение о замене его искусственным протезом.
Операция выполнена 15.06.11 в условиях искусственного кровообращения и фармакохолодовой кардиоплегии. Доступ к сердцу осуществляли через продольную срединную стернотомию. Подключение аппарата искусственного кровообращения выполнено по схеме аорта—полые вены. Использована системная гипотермия с охлаждением больного до 30 °С. При ревизии МК обнаружен выраженный пролапс обеих створок, фиброзно измененные створки с включениями кальция. Задняя створка МК сохранена и плицирована к фиброзному кольцу, передняя створка отсечена от фиброзного кольца и перемещена к задней створке, после чего имплантирован протез МИКС-29. При ревизии АК выявлено изолированное поражение некоронарной створки, при том что клапан трехстворчатый. В теле некоронарной створки обнаружено отверстие размером 1,0×0,4 см, края створки изъедены, явные признаки перенесенного эндокардита. Две другие створки с небольшим краевым фиброзом. Пораженная створка иссечена. Из заплаты телячьего ксеноперикарда выкроена новая створка с помощью специального шаблона, подобранного исходя из межкомиссурального расстояния. Размер шаблонов рассчитывали по формуле, описанной ранее [1]. Ксеноперикардиальная створка фиксирована к фиброзному кольцу непрерывным швом нитью пролен 4/0 и дополнительно укреплена в комиссурах швами на прокладках. Визуально и при проведении гидравлической пробы коаптация створок хорошая. Схематическое изображение протезирования створки аортального клапана приведено на рисунке. 
Обсуждение
Пластические операции на АК с использованием перикарда имеют большую историю. В начале использовали полоски необработанного аутоперикарда для увеличения площади створок [4, 9]. В конце 60-х годов прошлого века выполнены первые операции по полной замене створок или одной из створок аутоперикардом [2, 6]. Результаты этих операций были неутешительными. Практически у всех пациентов имелась выраженная регургитация на АК, а сами створки подвергались кальцификации. В результате этих одиночных неудовлетворительных попыток реконструкции АК перикардом о ней практически забыли, и развитие шло в сторону разработки новых видов протезов. Новое развитие операции по увеличению или протезированию створок получили в середине 80-х годов прошлого столетия [3, 5, 10]. Авторы чаще использовали ксеноперикард, а в дальнейшем и аутоперикард, обработанные глутаральдегидом. Это позволило добиться лучших результатов по долговечности и уменьшению вероятности кальцификации створок [3, 5].
Показания и противопоказания к операции по замене створок ксеноперикардом такие же, как при замене клапана биопротезом. Преимущества перед протезами в том, что можно менять по отдельности каждую из пораженных створок или заменить весь клапан, при этом площадь отверстия нового клапана выгодно отличается за счет отсутствия каркаса [3]. Это очень важно при наличии узкого фиброзного кольца АК.
В представленном случае мы использовали замену одной створки АК в сочетании с протезированием МК, что нивелировало такие преимущества биопротезирования, как отсутствие приема антикоагулянтов. Причина данного выбора была в том, что у больного имелось узкое фиброзное кольцо АК, и имплантация второго протеза малого диаметра или дополнительное расширение корня аорты могло значительно увеличить риск, связанный с операцией. Известно, что протезирование второго клапана увеличивает послеоперационную летальность (с 5 до 12,5%), а также риск развития послеоперационных осложнений [7, 8].
Операция достаточно проста в исполнении. Очень важным является правильный расчет размера новой створки. Мы в своей практике используем расчет размера створки в зависимости от межкомиссурального расстояния [1]. Перед тем как выполнить эту операцию, мы провели экспериментальную работу по замене 1, 2 или 3 створок АК ксеноперикардом на свиных сердцах. Аортальные комплексы с «неостворками» были испытаны на экспериментальном стенде. В результате испытаний получены хорошие результаты надежности и отличные гидродинамические свойства новых клапанов. На основании этой работы также были изготовлены шаблоны для выкраивания створок из ксеноперикарда.
Надеемся в дальнейшем шире применять операцию по замене створок АК ксеноперикардом у пациентов с показаниями к биопротезированию, особенно у больных с узким фиброзным кольцом и у пожилых пациентов.
Ксеноперикардиальная заплата что такое
Неспособность сухожилий и связок к полноценному закрытию формирующихся в результате травмы дефектов послужила толчком для поиска материалов, которые могли бы выполнить эту задачу. Использование в качестве пластического материала с целью замещения имеющихся дефектов сухожильно-связочного аппарата аутотрансплантатами приводит к снижению или полному выключению из функции донорской мышцы [GroutsA. et. al., 2000; VictrupL. et. al., 2005].
Общепризнанным является мнение о том, что наилучшими трансплантатами соответствующих тканей являются ткани, взятые из локусов организма реципиента – аутотрансплантаты. При застарелых повреждениях, когда выполнение шва затруднительно, сухожильная пластика остается порой единственным способом восстановления функции сухожилия. Ограниченность в количестве аутотрансплантатов побуждает к поиску новых материалов с качествами, наиболее приближенными к пласцируемым участкам сухожильно-свя зочного аппарата.
Перикард животных (телят) успешно применяется в клинической практике с 1960 года. В последнее время ксеноперикард как биологический материал находит все более широкое применение в клинических и экспериментальных разработках в кардиохирургии [Gupta M. etal., 2002; Manukyan H., 2007]. Несмотря на впечатляющие успехи экспериментальных и клинических исследований по применению ксеноперикарда как биопротеза, ряд принципиальных вопросов нуждается в дальнейшем изучении [Барсегян А.А., 2005].
Целью настоящего исследования являлась оценка возможности применения модифицированного ксеноперикарда для пластики сухожилий и связок человека.
Задачи исследования. Исследовать механические и биологические и морфологические изменения предлагаемого пластического биоматериал на основе модифицированного ксеноперикарда для пластики поврежденных сухожилий и связок.
Внедрить в клиническую практику методики хирургических вмешательств, применяемых при лечении повреждений сухожильно-связочного аппарата.
Материалы и методы исследования
В исследованиях использовались ксеноперикардиальные пластины ООО «КАРДИОПЛАНТ» (г. Пенза). Перикард телят. Модифицированный ксеноперикард представляет собой пластины различного, заданного размера и формы, ограниченные только предельными размерами исходного биологического материала. Пластины имеют гладкую (серозную) и ворсинчатую (фиброзную) поверхности. Серозная поверхность ксеноперикарда макроскопически выглядит гладкой и скользящей наощупь. Фиброзная поверхность ксеноперикарда – шероховатая ворсистая. Толщина пластин варьировалась от 0,5 до 1,5 мм. Пластины представлены волокнитым компонентом, лишенным антигенной структуры (рис. 1).
Рис. 1. Ксеноперикадиальная пластина производства ООО «Кардиоплант»
В эксперименте по замещению дефекта ахиллова сухожилия выполнено 16 имплантаций у 8-ми кроликов. Выведение животных из опыта на 1, 2, 3, 6 и 12 месяц. Морфологическое исследование материала, полученного в эксперименте, производилось посредством программ «Axiovision» и «ImageTool v.3.0» на микрофотографиях проводили подсчет следующих элементов:
– количество нейтрофильных лейкоцитов; лимфоцитов; фибробластов; фиброцитов;
– относительную площадь соединительной ткани;
– относительную площадь новообразованных сосудов микроциркуляторного русла.
Был проведен ряд экспериментов по исследованию сравнительной механической прочности на разрыв сухожилия человека и ксеноперикарда. Из образцов сформированы две группы: в первой группе сравнивались механическая прочность на разрыв с сухожилиями мышц сгибателей пальцев кисти, во второй – на прорезывание с шовным материалом – по 10 шт.
В отделении биомеханики на базе образовательно-научного института наноструктур и биосистем Саратовского государственного университет имени Н.Г. Чернышевского были проведены экспериментальные сравнительные полициклические испытания прочностных характеристик нового биоматериала. Исследовались: предельные прочность и удлинение (растяжимость), модуль упругости, жесткость (модуль Юнга). Все определяемые количественные показатели, а также паспортная часть собирались в виде базы данных с использованием прикладных программ. Статистическая обработка данных проводилась с помощью пакета прикладных компьютерных программ BLUEHILL-3 INSTRON.
Проведены эксперименты по исследованию сравнительной механической прочности человеческого сухожилия и ксеноперикарда.
Исследование проводили на разрывных машинах INSTRON-3342 и INSTRON-5944 BIO PULS с заданной постоянной скоростью 50 мм/мин (рис. 2)
По окончании испытаний машина высчитывала окончательный график средних значений «нагрузки – растяжения» и средние значения измеряемых параметров (разрывная нагрузка, предел прочности, растяжимость и модуль Юнга) (табл. 1). В первой серии сравнивались механические свойства сухожилия и ксеноперикарда.
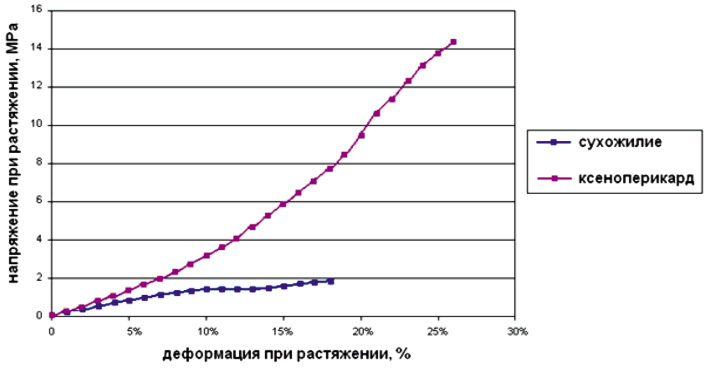
Образцы ксеноперикарда в 5 раз превосходят показатели по механической прочности образцов сухожилий 31.07/155,3 Н. Это явление может быть объяснено различием структуры расположения колагеновых волокон в сухожилии и ксеноперикарде. Таким образом, исходя из принципов доказательной медицины, полученные результаты позволяют считать обоснованным возможность использования модифицированного ксеноперикарда для пластики сухожильно-связочного аппарата.
Результаты исследования и их обсуждение
Результаты исследования гистологических срезов препарата выявили следующее.
К концу первого месяца эксперимента в тканевом ложе трансплантата отмечаются выраженные пролиферативные процессы. Биоматериал трансплантата имеет однородную структуру, по наружной поверхностиинфильтрирован лимфоцитами и гистиоцитами (рис. 4).
Рис. 3. Результаты исследования образцов сухожилия кисти человека и ксеноперикарда при максимальной нагрузке
Сравнительные данные механических свойств сухожилия и ксеноперикарда. Напряжение при растяжении, мах нагрузка
Напряжение при растяжении мах нагрузка, МПа
Медицинские интернет-конференции
Языки
Изучение свойств ксеноперикардиальной пластины, обработанной модифицированным химико-ферментативным методом
Калмин О.В., Венедиктов А.А.*, Никишин Д.В., Живаева Л.В.*
Резюме
Цель: разработка метода химико-ферментативной обработки ксеноперикарда с целью получения нового материала с низкой биорезорбцией. Методы. Материалом исследования были образцы ксеноперикарда, обработанные стандартным и модифицированным химико-ферментативными методами. Часть образцов ксеноперикарда подвергали исследованию механических свойств. Другая часть образцов имплантировалась экспериментальным животным. Сроки имплантации составили 2 недели, 1 и 2 месяца. После выведения животных из эксперимента производилось гистологическое исследование образцов. Результаты. Установлено, что ксеноперикардиальная пластина, обработанная модифицированным методом, обладает более высоким модулем упругости, большей прочностью и меньшей растяжимостью, в отличие от материала, обработанным запатентованным химико-ферментативным методом. Повышение прочности и упругости, но снижение растяжимости образцов экспериментальной группы связано с обработкой глутаровым альдегидом в более высокой концентрации. В связи с этим биодеградация и биоинтеграция в образцах, подвергшихся стандартной обработке, активно выявляются уже в конце первого месяца после имплантации, в отличие от ксеноперикарда, обработанного модифицированным способом, у которого данные процессы проявляются к концу второго месяца. Заключение. Изучение деформативно-прочностных свойств и микроморфологии ксеноперикардиальной пластины на разных этапах эксперимента подтверждает, что модернизированный метод химико-ферментативной обработки ксеноперикарда позволяет создать биоматериал, обладающий лучшими упруго-эластическими характеристиками и характеризующийся более низкой скоростью биорезорбции и замещения собственной соединительной тканью реципиента.
Ключевые слова
Введение
О.В. Калмин – ФГБОУ ВПО Пензенский государственный университет Минобрнауки России, кафедра анатомии человека, заведующий кафедрой, доктор медицинских наук, профессор; А.А. Венедиктов – Общество с ограниченной ответственностью «Кардиоплант»; Д В. Никишин – ФГБОУ ВПО Пензенский государственный университет Минобрнауки России, кафедра анатомии человека, доцент, кандидат медицинских наук; Л.В. Живаева – Общество с ограниченной ответственностью «Кардиоплант».
На современном этапе развития в реконструктивной медицине одной из наиболее актуальных является проблема подбора материалов для проведения реконструктивных хирургических манипуляций.
Хорошо известно, что «идеальный» трансплантат должен отвечать следующим требованиям: не приводить к воспалительной реакции; не оказывать токсического и иммуногенного действия; должен сохранять заявленные свойства как на этапе хранения, так и в организме, в который он был имплантирован; обладать способностью к физиологической деградации с образованием безопасных продуктов распада; обладать необходимой скоростью деградации, соответствующей процессам образования новой соединительной ткани; давать возможность нанесения биологически активных веществ на его поверхность; должен обладать эффективной и универсальной возможностью стерилизации; иметь длительные сроки хранения.
Наиболее часто в клинической медицине для трансплантации используют следующие основные виды материалов: аутотрансплантаты, аллотрансплантаты и синтетические материалы.
Аутотрансплантаты – это собственные ткани организма пациента. Этот материал имеет значительный плюс, он высоко биосовместим, но при проведении хирургических манипуляций с его использованием врачу приходится забирать материал и, как следствие, травмировать пациента, что увеличивает период реабилитации пациента 1.
Аллотрансплантаты – это ткани и органы, взятые от донора (человека). В качестве донора может выступать трупный материал. Данный материал труднодоступен, т.к. в Российской Федерации практически отсутствуют банки с алломатериалами. При этом такой материал может нести в себе риск заражения различными инфекциями, что является недопустимым в клинической медицине 4.
Синтетические материалы широко распространены в практической медицине, имеют относительно небольшую стоимость, но обладают малым уровнем биоинтеграции и довольно часто отторгаются [8, 9].
Ксенотрансплантаты – это ткани и органы, которые взяты от животных. Их использование началось еще в конце XX века, однако они редко использовались из-за несовершенной методики изготовления ксеноматериала: оставшиеся в материале клетки запускали иммунный ответ, что способствовало отторжению имплантатов.
Основной причиной антигенности являются клетки ксеноматериала, а также глизоамингликаны. Именно поэтому в процессе подготовки необходимо разрушить клетки и вывести их из материала. Суть наиболее распространенного метода обработки ксеноперикарда, использующегося на данный момент (Патент на изобретение РФ № 2197818 от 28.10.2008 г.), состоит в том, что фермент разрушает носители антигенности, а вследствие обработки ткани гипертоническими растворами хлорида натрия фрагменты клеток удаляются из материала. При этом волокна соединительной ткани остаются незатронутыми и сохраняют свою структуру, а дальнейшая обработка глутаровым альдегидом превращает ткань ксеноматериала в биополимер. Однако данный метод не лишен недостатков и требует дальнейшего развития и оптимизации.
Целью настоящего исследования явилась разработка метода химико-ферментативной обработки ксеноперикарда с целью получения нового материала с низкой биорезорбцией.
Материал и методы
Взятие ксеноперикарда производилось не позднее 20 минут с момента забоя животного. Полученный перикард погружался в физиологический раствор и доставлялся в лабораторию для дальнейшей обработки. Образцы были разделены на 2 группы: опытную и контрольную. В каждой группе исследовалось по 20 образцов ксеноперикарда.
Контрольная группа была обработана стандартным методом (Патент РФ № 2197818 от 28.10.2008 г.). Опытную группу образцов ксеноперикарда подвергали действию протеолитического фермента при различных режимах: изменяли время обработки, концентрацию протеолитического фермента, температуру при обработке, уровень рН, а также концентрацию сшивающего агента, в качестве которого служил раствор глутарового альдегида. Подобная модель ткани, будучи относительно «сильно зашитой», в теории должна обладать пониженной скоростью биоразложения. В конце обработки ксеноперикарда проводился гистологический контроль материала на наличие клеточных элементов и сохранность коллагеновых и эластических волокон ксеноперикарда.
На половине образцов из каждой группы изучали деформативно-прочностные свойства биоматериала. Исследование проводили на испытательной машине INSTRON-5944 BIO PULS, при этом изучались: максимальная нагрузка, максимальная относительная деформация, модуль упругости, напряжение при растяжении при максимальной нагрузке. Во время измерений образцы смачивались в физиологическом растворе.
Оставшиеся 10 образцов из каждой группы имплантировали экспериментальным животным. При проведении эксперимента соблюдались положения Европейской Конвенции по защите экспериментальных животных (1986 г.). В качестве экспериментальных животных выступали белые крысы породы Wistar массой до 260 г. Экспериментальных животных содержали на обычной диете. Экспериментальную модель создавали путем имплантации образцов материалов животным под кожу в область межлопаточного пространства. Операция проводилась в условиях стерильности под масочным эфирным наркозом. Подкожные полости формировали тупым способом с помощью стерильного шпателя. Разрез ушивали рассасывающейся нитью. Срок имплантации составил 2 недели, 1 месяц и 2 месяца. По истечении сроков образцы из каждой экспериментальной группы извлекали и производили гистологический анализ материала. Образцы тканей фиксировали в нейтральном 10%-ном формалине, проводили через батарею спиртов возрастающей концентрации и заливали в парафин. Парафиновые срезы толщиной 5-7 мкм окрашивали гематоксилином-эозином и по методу Вейгерта-Ван-Гизона. Используя микроскоп с цифровой фото насадкой, разрешением 7 мегапикселей с каждого гистологического препарата было получено по три фотографии. На микрофотографиях изучали: состояние коллагеновых и эластических волокон; наличие и характер клеточных элементов; наличие новообразованных кровеносных сосудов; явления биоинтеграции и биодеградации; наличие и степень воспалительной реакции.
Результаты
Исследование деформативно-прочностных свойств. Исследование выявило, что образцы ксеноперикардиальной пластины, обработанные запатентованным и экспериментальным методами, имеют различные деформативно-прочностные свойства (табл. 1).
Модуль упругости (модуль Юнга) пластин ксеноперикарда экспериментальной группы был выше в 1,52 раза, чем в контрольной группе. Наоборот, максимальная относительная деформация образцов экспериментальной группы была ниже в 1,32 раза по сравнению с контрольной. Образцы экспериментальной группы обладали более значительной прочностью по сравнению с контрольной группой, прошедшей запатентованную обработку (в 1,36 раза). Повышение прочности и упругости, но снижение растяжимости образцов экспериментальной группы связано с обработкой глутаровым альдегидом в более высокой концентрации. В результате такой обработки происходит образование большего количества поперечных сшивок между коллагеновыми волокнами. Вследствие этого коллагеновая сеть становилась более плотной, а весь ксеноматериал становится более прочным и упругим, но менее растяжимым.
Значение напряжения при максимальной нагрузке в контрольной группе незначительно отличалось от аналогичного показателя экспериментальной группы. Следовательно, такой вид модификации ксеноперикардиальной пластины не оказывает сильного влияния на распределение сил между волокнами при приложении нагрузки в виде одноосного растяжения.
Микроскопическое исследование.
1. Обработка ксеноперикарда стандартным методом. При гистологическом исследовании контрольных образцов ксеноперикарда, прошедших стандартную обработку, было установлено, что при окраске гематоксилином и эозином клеточные элементы не выявлялись; при окраске по методу Вейгерта-Ван-Гизона, несмотря на обработку ксеноперикарда агрессивными веществами и разрушение клеточных элементов, состояние эластических и коллагеновых волокон оставалось без изменений.
При исследовании ксеноперикарда на 14-е сутки после имплантации при окраске гематоксилином и эозином отмечались было установлено, что в 2 образцах имелась слабо выраженная лимфогистиоцитарная инфильтрация (в среднем на 2/3 от общей толщины ксеноперикардиальной пластины) с включением эпителиоидных клеток и клеток фибропластического ряда, в 1 образце – умеренно выраженная лимфогистиоцитарная инфильтрация. Вокруг имплантированных образцов ксеноперикарда сохранялась умеренная клеточная инфильтрация, наблюдалось образование грануляционной ткани с единичными новообразованными сосудами (рис. 1).
Рис. 1. Контрольные образцы ксеноперикарда (а – ксеноперикард, обработанный стандартным методом, окраска гематоксилином-эозином, х200; б – ксеноперикард, обработанный стандартным методом, окраска по Вейгерту-Ван-Гизону, х400; в – ксеноперикард, обработанный модифицированным методом, окраска гематоксилином-эозином, х200; г – ксеноперикард, обработанный модифицированным методом, окраска по Вейгерту-Ван-Гизону, х400)
При анализе гистологических препаратов, окрашенных по Вейгерту-Ван-Гизону, выявлено частичное разрушение коллагеновых и эластических волокон, что свидетельствует об активных процессах биодеградации исследуемого фрагмента ксеноперикарда.
К концу первого месяца эксперимента в местах прилегания трансплантата к тканям реципиента отмечались выраженные пролиферативные процессы. Ксеноперикардиальная пластина имела однородную структуру, по наружной поверхности была инфильтрирована лимфоцитами и гистиоцитами. Пластина была окружена выраженным инфильтрационным валом. В составе клеточного инфильтрата встречались плазматические клетки, лимфоциты, гистиоциты, клетки фибробластического ряда. В области контакта с материалом преобладают лимфоциты и гистиоциты, на периферии грануляционного вала – пролиферирующие фибробласты и очаги новообразованного коллагена. В зоне вокруг ксеноперикарда определялись новообразованные кровеносные сосуды. При окраске по Вейгерту-Ван-Гизону выявлялись формирующиеся собственные коллагеновые и эластические волокна.
Через 2 месяца после начала эксперимента на поверхности материала отмечались явления биодеградации. Было обнаружено практически полное врастание собственной соединительной ткани и новообразованных сосудов, значительное уменьшение количества лимфоцитов и макрофагов в инфильтрате. Фибробласты активно синтезировали соединительнотканный каркас вокруг трансплантата. При окраске по Вейгерту-Ван-Гизону определялось большое количество новообразованных собственных коллагеновых и эластических волокон. Подобные изменения свидетельствовали об активном процессе биодеградации ксеноперикардиальной пластины и интеграции в нее собственной соединительной ткани с дальнейшим полным замещением имплантата (рис. 2).
Рис. 2. Ксеноперикард, обработанный стандартным методом, (а – 14-е сутки, окраска гематоксилином-эозином, х200, б – 14-е сутки, окраска по Вейгерту-Ван-Гизону, х400; в – 30-е сутки, окраска гематоксилином-эозином, х200; г – 30-е сутки, окраска по Вейгерту-Ван-Гизону, х400; д – 60-е сутки, окраска гематоксилином-эозином, х200; е – 60-е сутки, окраска по Вейгерту-Ван-Гизону, х400)
2. Обработка ксеноперикарда модифицированным методом. При гистологическом исследовании контрольных образцов ксеноперикарда, обработанных модифицированным методом, было выявлено, что при окраске гематоксилином-эозином клеточные элементы не выявлялись; при окраске по Вейгерту-Ван-Гизону состояние эластических волокон и коллагеновых волокон оставалось без изменений, но они имели более рыхлое пространственное расположение.
При гистологическом исследовании ксеноперикарда на 14-е сутки в образцах при окраске гематоксилином-эозином выявлялась умеренная лимфогистиоцитарная инфильтрация: в одном образце отмечались процессы инкапсуляции, в остальных образцах лейкоциты проникали на 1/3 от общей толщины пластины.
При анализе препаратов, окрашенных по Вейгерту-Ван-Гизону, отмечалось частичное разрушение коллагеновых и эластических волокон на всю глубину лимфогистиоцитарной инфильтрации, а в толще ксеноперикардиальной пластины наблюдались коллагеновые и эластические волокна без изменений, что говорит о слабо активных процессах биодеградации исследуемого объекта.
К концу 1-го месяца эксперимента в тканевом ложе трансплантата отмечаются выраженные пролиферативные процессы. Материал трансплантата имел однородную структуру, по поверхности был инфильтрирован лимфоцитами и гистиоцитами. Трансплантат был окружен выраженным инфильтрационным валом. В составе клеточного инфильтрата выявлялись лимфоциты, гистиоциты, плазматические клетки, клетки фибробластического ряда. В области контакта собственных тканей с материалом имплантата преобладали лимфоциты и гистиоциты, по периферии грануляционного вала – пролиферирующие фибробласты и очаги новообразованного коллагена. В реактивной зоне вокруг ксеноперикарда выявлялись новообразованные кровеносные сосуды. При окраске по Вейгерту-Ван-Гизону были найдены формирующиеся собственные коллагеновые и эластические волокна.
Через 60 суток обнаруживались явления биодеградации материала на наружной его поверхности, было выявлено практически полное прорастание в пластину собственной соединительной ткани и новообразованных сосудов. Отмечалось значительное уменьшение количества лимфоцитов и макрофагов в воспалительном инфильтрате. Пролиферирующие фибробласты активно формировали соединительнотканный каркас вокруг трансплантата.
При окраске по Вейгерту-Ван-Гизону выявлялось значительное количество собственных коллагеновых и эластических волокон. Выявленные тканевые изменения подтверждали наличие активного процесса биодеградации ксеноперикарда и интеграции в него собственной соединительной ткани с последующим замещением ксеноперикарда (рис. 3).
Рис. 3. Ксеноперикард, обработанный модифицированным методом (а – 14-е сутки, окраска гематоксилином-эозином, х200; б – 14-е сутки, окраска по Вейгерту-Ван-Гизону, х400; в – 30-е сутки, окраска гематоксилином-эозином, х200; г – 30-е сутки, окраска по Вейгерту-Ван-Гизону, х400; д – 60-е сутки, окраска гематоксилином-эозином, х200; е – 60-е сутки, окраска по Вейгерту-Ван-Гизону, х400)
Обсуждение
Полученные в ходе проведенных экспериментальных исследований данные показывают, что ксеноперикардиальная пластина, обработанная модифицированным методом, обладает более высоким модулем упругости, большей прочностью и меньшей растяжимостью, в отличие от материала, обработанным запатентованным химико-ферментативным методом, меньше деформируется. Повышение прочности и упругости, но снижение растяжимости образцов экспериментальной группы связано с обработкой глутаровым альдегидом в более высокой концентрации. В результате такой обработки происходит образование большего количества поперечных сшивок между коллагеновыми волокнами.
В связи с этим биодеградация и биоинтеграция в образцах, подвергшихся стандартной обработке, активно выявляются уже в конце первого месяца после имплантации, в отличие от ксеноперикарда, обработанного модифицированным способом, у которого данные процессы проявляются к концу второго месяца. Полученные данные подтверждают довольно высокую эффективность применения модифицированной ксеноперикардиальной пластины в реконструктивных операциях, когда необходимо длительное сохранение механической прочности трансплантата.
Заключение
Изучение деформативно-прочностных свойств и микроморфологии ксеноперикардиальной пластины на разных этапах эксперимента подтверждает, что модернизированный метод химико-ферментативной обработки ксеноперикарда позволяет создать биоматериал, обладающий лучшими упруго-эластическими характеристиками и характеризующийся более низкой скоростью биорезорбции и замещения собственной соединительной тканью реципиента. Результаты исследования позволяют предположить большую эффективность применения ксеноперикардиального имплантата, обработанного модифицированным методом, для восстановления соединительной ткани реципиента. Эти ксеноперикардиальные пластины могут применяться как самостоятельный пластический материал для использования в реконструктивных операциях, требующих имплантаты с указанными свойствами, так и в качестве матрицы для нанесения стволовых клеток, используемых в генной инженерии.
Конфликт интересов. Работа выполнена в рамках приоритетного направления научно-исследовательской деятельности Пензенского государственного университета на 2011-2015 годы № 4 «Биомедицинский кластер».
Литература
Таблицы
Таблица 1. Деформативно-прочностные свойства ксеноперикарда
Модуль упругости (МПа)
Максимальная нагрузка (Н)
Напряжение при растяжении при максимальной нагрузке (МПа)