Лепрозорий что это такое простыми словами в медицине
ЛЕПРОЗОРИЙ
Лепрозорий (позднелат. leprosus прокаженный)— лечебно-профилактическое учреждение, осуществляющее профилактику и лечение больных лепрой.
Лепрозории возникли как приюты для пожизненного содержания больных лепрой. Это было обусловлено существующим представлением о возможности легкой передачи лепры от больных здоровым лицам, а также стремлением удалить из общества инвалидов, представлявших на поздних стадиях развития болезни тягостное зрелище.
Представление о чрезвычайной контагиозности лепры сказалось и на размещении Лепрозориев — они находились в стороне от путей сообщения, населенных пунктов, при этом учитывалось даже преобладающее направление ветров.
Одними из наиболее древних были Лепрозории на территории Армении. Сохранились сведения о Лепрозории, открытом в 260—270 гг. в местности, называвшейся Арбенут. Появление Лепрозориев в Европе (Греция, Италия) относится ко 2 в. Первый Лепрозорий во Франции был открыт в 460 г. Наибольшее количество Л. в странах Европы было в 12—13 вв. В этот период Л., как правило, принадлежали ордену св. Лазаря (главой ордена мог быть избран только больной лепрой). К концу 17 в. Л. в ряде стран Европы (Франция, Италия и др.) были ликвидированы, а немногочисленные больные помещены в общие б-цы.
В России первый Л. возник в 18 в. около г. Черкасска на Дону. В конце 19 в. лепрозории-приюты были созданы в Сибири, на Северном Кавказе, под Астраханью, в г. Риге, около Петербурга, а также в Узбекистане. Созданные в дореволюционный период на благотворительных началах Л. даже отдаленно не напоминали мед. учреждения и влачили жалкое существование. Открывая 22/IV 1926 г. первое Всесоюзное совещание по борьбе с лепрой, нарком здравоохранения Н. А. Семашко отметил, что «в лице лепрозориев мы получили от старого режима слишком тяжелое наследие». В 1923 г. Л. были взяты на государственный бюджет (10 Л. мощностью 625 коек). В дальнейшем были предприняты меры по укреплению их материальной базы, кадров, расширению коечного фонда, превращению Л. в современные мед. учреждения. В последующем благодаря успешной борьбе с лепрой (см.) в СССР ряд Л. был ликвидирован.
В странах с высокой заболеваемостью лепрой (развивающиеся страны Юго-Восточной Азии, Центральной Африки и др.) наряду с государственными Л., к-рые в ряде стран называют лепрологическими б-цами, противолепрозными диспансерами, санаториями, существуют благотворительные и частные противолепрозные учреждения, а также различного рода поселения и кооперативы больных лепрой. В Африке больные лепрой зачастую поселяются около б-ц общего типа, образуя «лечебные поселки». Роль Л. как мест пожизненной изоляции больных лепрой сохранялась вплоть до середины 20 в., пока в практику лечения не были внедрены эффективные химиотерапевтические средства сульфонового ряда, открывшие новую эру в борьбе с лепрой, коренным образом изменившие роль Л. В нек-рых странах Л. ликвидированы, лечение больных начинается в амбулаторных условиях, а больных открытыми формами лепры (лепроматозной и погранично-лепроматозной) на короткий срок (до 3 мес.) госпитализируют в специальные отделения при инфекционных, туберкулезных, дерматологических или общих б-цах. Сохранившиеся Л., кроме лечения больных-бактериовыделителей, выполняют роль домов инвалидов и домов престарелых для лиц, не имеющих родственников или утерявших связь с ними.
Одним из наиболее известных является Карвилльский лепрозорий (США), располагающий не только хорошей лечебной базой, но и являющийся крупным научным центром.
Л. в СССР выполняют следующие основные задачи: 1) проведение активной профилактики лепры; 2) стационарное лечение больных лепрой; 3) организация рационального трудового, бытового и сан. режима для больных; 4) организация амбулаторного лечения больных лепрой по месту их жительства, диспансерное наблюдение за ними; 5) проведение научно-исследовательской работы по лепре. Л. находится в ведении мин-ва здравоохранения соответствующей союзной или автономной республики, областного (краевого) отдела здравоохранения и финансируется органом здравоохранения по подчиненности; является самостоятельным бюджетным учреждением.
В лепрозории создаются следующие подразделения: эпидемиологический отдел; стационар; изолятор; отделение для инвалидов, нуждающихся в уходе; амбулатория (поликлиника); физиотерапевтический кабинет; операционная; рентгенкабинет; лаборатории — клинико-диагностическая, патоморфологическая; кабинеты специалистов (офтальмолога, стоматолога, оториноларинголога и др.); аптека; лечебно-производственные, трудовые мастерские (см.); хозяйственные службы; клуб с кинозалом и комнатами для занятий художественной самодеятельностью, для проведения культурно-массовой работы среди больных, библиотека, спортивные площадки. При нек-рых Л. создаются детские дома для здоровых детей, родившихся у больных родителей. В случае рождения ребенка в Лепрозорий его на период вскармливания грудным молоком оставляют с больной матерью при условии регулярного и полноценного лечения ее противолепрозными препаратами; в дальнейшем до выписки матери из Л. ребенок передается на воспитание родственникам или в детский дом.
Библиогр. Оганесян Л. А. История медицины в Армении, ч. 1, с. 187, Ереван, 1946; Проказа и борьба с нею в СССР, под ред. В. И. Кедровского и др., М., 1927; Распознавание и профилактика лепры, под ред. И. Н. Переводчикова и В. Ф. Шубина, М., 1957; Решетилло Д. Ф. Проказа, Спб., 1904; Торсуeв Н. А. Лепрозории Западной Европы в средние века, Учен. зап. Ин-та по изучению лепры, № 6 (11), с. 134, Астрахань, 1970; Brown J. А. К. The role of leprosaria and treatment villages in mass campaigns in tropical Africa, Int. J. Leprosy, v. 28, p. 1, 1960; Faget G. H. а. o. The promin treatment of leprosy, ibid., v. 11, p. 52, 1943; Magnussen L. N. The role of the leprosarium, ibid., v. 36, p. 213, 1968; Virchow R. Zur Geschichte des Aussatzer und der Spitaler, besonders in Deutschland, Virchows Arch. path. Anat., Bd 18, S. 273, 1860.
Значение слова «лепрозорий»
[От лат. leprosus — прокаженный]
Источник (печатная версия): Словарь русского языка: В 4-х т. / РАН, Ин-т лингвистич. исследований; Под ред. А. П. Евгеньевой. — 4-е изд., стер. — М.: Рус. яз.; Полиграфресурсы, 1999; (электронная версия): Фундаментальная электронная библиотека
Лепрозории организуют в эндемичных зонах и обычно в сельской местности. В состав лепрозория входят стационар, амбулатория и эпидемиологический отдел. Больным предоставляются жилые дома, они имеют подсобные хозяйства для занятий сельскохозяйственными работами и различными ремёслами. В зависимости от типа и тяжести заболевания больные пребывают в лепрозории от нескольких месяцев до нескольких лет. Обслуживающий персонал обычно проживает также на территории лепрозория в зоне, условно отделённой (например, зелёными насаждениями) от зоны проживания больных.
В развитых странах на сегодняшний день не практикуется помещение больных в лепрозории.
Во Франции прокажённых обязали жить в специальных домах — лепрозориях. На основании указа 503 года на протяжении всего периода Средневековья составлялись «правила» поведения прокаженного и его родственников. Вот одно из них: «Как только болезнь обнаруживалась, человека отводили в религиозный трибунал, который… осуждал его на смерть». Что это означало? Несчастного отводили в церковь, где всё было приготовлено для похорон. Больного клали в гроб, служили заупокойную службу, относили на кладбище, опускали в могилу и сбрасывали на него несколько лопат земли со словами: «Ты не живой, ты мёртвый для всех нас». После этого больного вытаскивали из могилы и отвозили в лепрозорий. Навсегда. Больше он никогда не возвращался домой, в семью. Для всех он был мёртв.
ЛЕПРОЗО’РИЙ, я, м. [от латин. lepra — проказа] (мед.). Больница, убежище для прокаженных.
Источник: «Толковый словарь русского языка» под редакцией Д. Н. Ушакова (1935-1940); (электронная версия): Фундаментальная электронная библиотека
лепрозо́рий
1. мед. закрытое поселение, куда направляют на лечение и проживание больных лепрой (проказой)
2. специализированное лечебно-профилактическое учреждение, занимающееся выявлением, изоляцией и лечением больных проказой
Делаем Карту слов лучше вместе

Спасибо! Я стал чуточку лучше понимать мир эмоций.
Вопрос: громоздить — это что-то нейтральное, положительное или отрицательное?
Это страшное слово «лепрозорий»: что известно о проказе в XXI веке и почему ее до сих пор трудно вылечить
Болезнь Хансена, больше известная как проказа или лепра, на протяжении нескольких тысячелетий пугала людей своей непредсказуемостью и загадочностью. Лишь в конце XIX века норвежский ученый Герхард Хансен, сам того не подозревая, открыл бактерию, которая способна проникать в человеческий организм через слизистые оболочки и спустя годы вызывать страшные последствия — поражения кожи, уродливые изменения конечностей и даже их утрату. Без должного лечения лепра приводила к гниению человеческого тела заживо в течение долгих лет, обрекая зараженного на десятки лет, проведенные в изоляции от общества, — в лепрозориях. В ХХ веке появились первые препараты и курсы лечения, а последствия заболевания ученые научились минимизировать. Несмотря на это, болезнь до сих пор уносит тысячи жизней, особенно в странах Африки и Южной Америки. «Хайтек» рассказывает, что такое лепра и как современного человека оберегают от лепрозория.
Читайте «Хайтек» в
Всемирный день борьбы с лепрой отмечается 30 января как напоминание о существовании болезни с многовековой историей. Проказа не исчезла вместе со средневековой антисанитарией: по данным ВОЗ, число новых заболевших в 2016 году — 173 358 человек. Больше всего случаев заражения — в Африке и Азии, но риск не стремится к нулю и в развитых странах.
Гоните его, насмехайтесь над ним
История лепры, ленивой смерти, скорбной и крымской болезни — все это названия одного и того же заболевания — началась еще до нашей эры. Первые упоминания о лепре относятся к 1550 году до нашей эры, когда похожая на нее симптоматика появляется в «Египетском папирусе». О кожном заболевании, меняющем внешний вид зараженного, писал Гиппократ, правда, возможно, путая его с псориазом.
Описание проказы встречается и в многочисленных отрывках Библии, причем как в Новом, так и в Ветхом завете. Для христиан и иудеев проказа — божья кара за неправедное поведение, поэтому больные подвергались дополнительному порицанию. Церковные отцы Григорий Великий и Исидор Севильский писали о прокаженных как о еретиках. У простолюдинов проказа стала синонимом наказания за распутство и похотливость.
Болезнь Хансена (то же, что и лепра — «Хайтек») разрушала социальную жизнь человека. Заболевшие подвергались остракизму, изгонялись из поселений и оповещали жителей о приближении с помощью колокольчика. Болезнь считалась наследственной: на изгнание были обречены и дети прокаженного.
Эпидемии лепры случались периодически, как и вспышки других инфекций. Рост заболеваемости был зафиксирован в XII–XIII веках, в эпоху крестовых походов. Во Франции насчитывалось около 2 тыс. лепрозориев, в то время как в Англии и Шотландии — 220 для размещения примерно 1,5 млн человек.
Сегодня стратегия борьбы с лепрой запрещает травлю на законодательном уровне. Тем не менее, из-за низкой осведомленности людей больные до сих пор подвергаются травле и остракизму. В России всего четыре учреждения занимаются конкретно болезнью Хансена: НИИ по изучению лепры в Астрахани, Сергиево-Посадский филиал Государственного научного центра дерматовенерологии, Терский лепрозорий в Ставрополье и лепрозорий Краснодарского края.
Портрет «проказливой» болезни
Лепру считали наказанием грешников, которое в корне меняло внешний вид человека. Уродливая внешность — только самый яркий и финальный симптом болезни Хансена. Первый симптом всех больных — онемение и потеря чувствительности к температурным изменениям, отсутствие ощущения жара или холода. Дальше пораженные участки лишаются ощущений легкого касания, боли и, наконец, сильного надавливания. Дальше сценарии болезни расходятся: у лепры три основных типа, для каждого из которых свойственны разные симптомы.
Mycobacterium leprae — тип бактерии с высоким содержанием гуанина и цитозина, вызывающий хроническое гранулематозное заболевание — лепру. Это единственная известная бактерия, которая поражает нервную ткань организма.
Даже исключив из круга общения зараженных людей, нельзя быть уверенным в безопасности. Бактерия-возбудитель может передаваться не только респираторным путем, но и через воздействие насекомых, зараженную почву или воду. Хотя у ученых нет законченного списка распространителей заболевания, большинство точно признает воздушно-капиллярный путь передачи.
Возбудители лепры появляются в организме с помощью слизистых оболочек, попадая в нервные окончания, кровеносную и лимфатическую системы. На этом этапе не происходит видимых изменений кожных покровов или организма вообще.
У людей, заразившихся от одного и того же источника, в одинаковых условиях могут развиться разные формы лепры с разными последствиями. Это значит, что вирулентность, то есть сумма болезнетворных свойств микроба, не влияет на характер болезни.
M. leprae выживает в человеческом организме в течение нескольких часов или дней, и затем либо приживается, либо сталкивается с иммунной защитой организма.
Иммунитет человека не дает проказе прижиться в организме. Даже в эндемичных районах заболевания скорость распространения лепры минимальна, а болезнь редко прогрессирует до клинических уровней при наличии необходимого лечения.
Диагностика лепры
Из-за долгого инкубационного периода заболевания, от 9 месяцев до 20 лет, раньше проказа оставалась незамеченной вплоть до появления явной симптоматики. Сегодня для диагностики формы заболевания есть несколько действенных, но довольно трудоемких способов.
При любом из видов диагностики медиками учитываются нахождение в эндемичном районе, контакты с больными, данные непосредственного осмотра: наличие и длительность кожных высыпаний, признаки нарушения работы нервных окончаний.
Открытие доктора Хансена
Норвежец Герхард Хенрик Армауэр Хансен был первым человеком, обнаружившим микроб, вызывающий проказу. Бактерия Mycobacterium leprae была открыта им в 1873 году с помощью микроскопа. Хотя способы лечения заболевания оставались неизвестными, открытие возбудителя принесло облегчение больным и их родственникам: найденная естественная причина прекратила гонения на прокаженных и их детей.
Герхард Хансен — норвежский врач, известный открытием и идентификацией бактерии Mycobacterium leprae в 1873 году как агента, вызывающего лепру.
Проказа до Хансена в основном рассматривалась в качестве наследственной или же имеющей миазматическое происхождение болезни. На основе эпидемиологических исследований Хансен сделал вывод, что проказа является болезнью с конкретной причиной.
В феврале 1873 года Герхард Хансен, рассматривая материал больного под микроскопом, внезапно увидел в клетках крохотные палочки. Он объявил об обнаружении Mycobacterium leprae в тканях всех больных, хотя не распознал их как бактерии, — и получил незначительную поддержку.
В 1879 году молодой немецкий ученый Альберт Нейссер приехал в Берген, чтобы изучить болезнь проказы. Хансен передал ему образцы тканей. Нейссер успешно окрасил бактерии и объявил о своих выводах в 1880 году, заявив, что обнаружил организм, вызывающий заболевание, без упоминания Хансена. Это привело к серьезному спору о приоритете в открытии бациллы проказы.
Благодаря усилиям Хансена в 1879 году было запрещено свободное передвижение больных проказой по стране, а в 1885 году он добился принятия закона, предусматривающего обязательную изоляцию больных лепрой в стационарах или на дому и систематические медосмотры лиц, контактировавших с больными. Эта система показала такую эффективность, что послужила основой для законодательства многих европейских стран в отношении больных лепрой.
Коллеги не поддержали доктора и не поняли важности его открытия. Впрочем, и сам Хансен не распознал микроб как бактерию, а потому не получил поддержки научного сообщества. Кроме того, изучение Mycobacterium leprae затруднялось особенностями роста на питательных средах: в отличие от похожей по свойствам туберкулезной палочки, бактерия лепры не росла в питательном растворе чашки Петри.
Лепру лечили практически народными методами вплоть до 40-х годов XX века. Больным назначались инъекции масла из ореха чаульмугры. Процедура была крайне неприятной и доставляла большие страдания больным. При этом полезность метода ставилась под сомнение. Ситуация изменилась в 1941 году, когда сульфоновый препарат промин был впервые использован в качестве лекарства.
Тест промина прошел в Центре заболеваний имени Дж. Лонга в Карвилле, штат Луизиана. Появившись в 1921 году, Центр стал местом исследования лепры и борьбы с ней.
В 50-х на рынке появились препарат дапсон, который предложил доктор Р. Г. Кокрейн из Карвилла. Сначала такое лечение давало прекрасные результаты, но вскоре Mycrobacterium leprae адаптировался к лечению. Это была одна из немногих мутаций генома: в 2013 году учеными из Тюбингенского университета было доказано, что за тысячу лет бактерия практически не изменилась. Такая «консервативность» бактерии позволила практически полностью минимизировать процент заболеваний после ее появления.
Современное лечение лепры
Спустя десятилетие стагнации в исследованиях в 70-х на Мальте провели первый успешный опыт лечение болезни Хансена полихимиотерапией: комбинированным мультидраговым лечением, сочетающим в себе курс из нескольких препаратов. В 1981 году ВОЗ создала рекомендованный список препаратов для лечения мультибацилярной лепры: дапсон, рифампицин и клофазимин. Больные с олигобацилярнной формой заболевания принимают только рифампицин и дапсон. Монотерапия лепры неприемлема. Лечение только одним препаратом из списка делает бактерии резистентными. Они приобретают сопротивляемость, а воздействие лепры на организм усугубляется.
Каждое из лекарств выполняет собственную функцию в комплексном лечении. Дапсон прекращает размножение бактерий и замедляет ферментативную реакцию двух дигидрофолатов, ключевых ферментов биосинтеза M. leprae. Рифампицин уничтожает бактерии и блокирует синтез РНК. Загадочное действие оказывает клофазимин — не до конца изученное антибактериальное свойство препарата, скорее всего, блокирует матричные функции ДНК и дает результаты на дапсонрезистентных формах M. leprae.
В 1997 году ВОЗ установила продолжительность курса лечения лепры: от шести месяцев до года. Рецидивы заболевания минимальны, и лепру называют почти побежденной болезнью. Исследование перешло на новый этап: разработку вакцины, которая предупредит развитие болезни или сможет прекращать ее долгий инкубационный период.
Иллюзия панацеи не должна обманывать
Если схема лечения продумана и работает, а количество больных по всему миру не превышает 11 млн человек, то проблема почти решена. Тем не менее, российские лепрозории существуют до сих пор, а количество заражений остается стабильным. Почему это происходит и зачем люди продолжают изучать лепру?
Комбинированная терапия не исключает развития резистентности, а сами пациенты, не всегда переезжающие в лепрозории, могут нарушать курс приема препаратов из-за его длительности и комплексности. Кроме того, нестабильный клофазимин в России не зарегистрирован, поэтому лечение проходит только по схеме олигобацилярнной формы заболевания. Сегодня в Астрахани разрабатываются лекарственные аналоги и новые схемы терапии, менее продолжительные и более эффективные.
Диагностика и профилактика лепры важна еще и потому, что человечество живет в эпоху глобализации. Европейские мигранты приезжают из высокоэндемичных стран Африки и Южной Америки, и единственная гарантия здоровья без специального обследования — отсутствие явных признаков заболевания. В России въезжающие в страну обязаны проходить медицинское освидетельствование, но проработанной методики этой процедуры пока нет. Тем более, можно ли игнорировать болезнь, которая до сих пор уносит жизни в Южной Азии и Африке? Это вопрос этики, который определяет стратегии развитии медицины развитых стран. Лепра для европейца стала кошмаром из прошлого, но пренебрежение заболеванием в настоящем может привести к плачевному повторению эпидемий Средневековья.
Современный взгляд на лепру
В статье отражены современные представления о лепре, представлены современные данные литературы, посвященные вопросам эпидемиологии заболевания, особенностям клинической картины, диагностики, дифференциальной диагностики и лечения дерматоза.
The article summarizes information about the disease leprosy. Data of the literature on epidemiology of the disease, the features of the clinical picture, diagnosis, differential diagnosis and treatment of the dermatosis are presented.
Лепра (проказа, болезнь Хансена) — хроническое инфекционное заболевание из группы микобактериозов, характеризующееся продолжительным инкубационным периодом и рецидивирующим течением. Заболевание носит системный характер и поражает производные эктодермы — кожные покровы, слизистые оболочки и периферическую нервную систему. В настоящее время, несмотря на применение эффективной схемы антибиотикотерапии и устранение угрозы эпидемии лепры, по всему миру продолжают ежегодно выявляться новые случаи заболевания, поэтому перспектива полной ликвидации болезни ставится под сомнение [1–3].
Распространенность лепры в мире стабильно снижается из года в год. Согласно данным ВОЗ, количество новых случаев, каждый год выявляемых во всем мире, уменьшилось с 763 000 в 2001 г. до 249 000 в 2008 г. [1]. В 2013 г. было выявлено 215 656 новых случаев заболевания, в 2014 г. — 213 899, в 2015 г. — 211 973 [2, 3].
Глобальная статистика свидетельствует о том, что 96% (203 600 человек) новых случаев заражения лепрой были выявлены в 22 государствах (таких как Индия, Бразилия, Ангола, Конго, Судан, Эфиопия и др.). На долю других стран приходятся оставшиеся 4% [3].
Одной из шести стран мира с наиболее высокой распространенностью лепры является Бразилия, где ежегодно диагностируется более 30 000 новых случаев заболевания. В 2014 г. распространенность лепры в Бразилии составила 1,27 случая на 10 000 жителей. Уровень распространенности дерматоза по стране неравномерен: помимо эндемичных по лепре регионов существуют и такие, в которых отмечается низкий уровень распространенности лепры [4].
Значимую роль в распространении заболевания играет миграция населения. В Европе большинство случаев лепры регистрируются у беженцев из других государств. Так, из 168 случаев заболевания лепрой, зарегистрированных в 2013 г. в Испании, 40 (24,6%) больных выявлены среди коренных жителей Испании, 128 (76,2%) — среди проживающих в стране мигрантов, главным образом из Бразилии, Парагвая и Боливии [5]. В Италии количество больных лепрой среди коренного населения в период с 1990 по 2009 г. составило 12 человек, среди мигрантов — 159 больных [6]. Во Франции в 2009 и 2010 гг. выявлено 39 новых случаев болезни, из них 7 (18%) наблюдались у пациентов французского происхождения [7]. В Дании в период с 1980 по 2010 г. выявлено 15 случаев болезни, из них 87% являлись мигрантами из Южной и Юго-Восточной Азии [8].
В России эндемичным регионом по лепре является Астраханская область. За последние десятилетия больные лепрой были выявлены и в других субъектах Российской Федерации: в Сибири, на Северном Кавказе и Дальнем Востоке [9, 10]. Однако стоит отметить, что, благодаря внедрению в практику целого комплекса противолепрозных мероприятий, заболеваемость лепрой в России носит устойчивый спорадический характер. В 2015 г. на учете состояло 240 больных, из них в Астраханской области — 135 [10].
Возбудителями лепры являются Mycobacterium leprae (M. leprae) и Mycobacterium lepromatosis (M. lepromatosis). M. leprae была впервые открыта норвежским врачом Герхардом Хансеном в 1873 г. [11]. Данный микроорганизм относится к семейству Mycobacteriaceae и является кислото- и спиртоустойчивой бактерией, которая представляет из себя грамположительную прямую или изогнутую палочку длиной 1–7 мкм и диаметром 0,2–0,5 мкм [12]. M. leprae может длительное время сохранять жизнеспособность при низких температурах и высушивании. Данному микроорганизму свойственен крайне медленный рост, который зачастую не характерен для бактерий (одно деление продолжается приблизительно 12 суток) [12]. Возбудитель заболевания является облигатным внутриклеточным паразитом. M. leprae способна продолжительно персистировать в макрофагах человека, что обеспечивается взаимодействием различных механизмов (антигенная изменчивость и пр.). Именно поэтому пациенты, выписанные из лепрозориев на амбулаторное лечение с персистирующими формами лепры, могут быть источником заражения [9].
В 2008 г. был открыт второй возбудитель лепры — M. lepromatosis, который, в отличие от M. leprae, является некислотоустойчивой бактерией и вызывает преимущественно тяжелый диффузный лепроматозный тип лепры [13, 14].
От других инфекционных заболеваний лепру отличает длительный инкубационный период, который варьирует от 2–3 месяцев до 50 лет (в среднем составляя 4–6 лет) [11].
Общепризнан воздушно-капельный путь передачи инфекционных агентов, однако не исключаются другие пути заражения — через укусы кровососущих насекомых и поврежденные кожные покровы. Лепра является малоконтагиозным заболеванием. Заражение микобактериями лепры происходит в результате длительного тесного общения с больным, не получающим лечения, вследствие сенсибилизации, нарастающей при повторяющихся контактах, снижения сопротивляемости организма (в результате неполноценного питания, тяжелых физических нагрузок, частых простудных заболеваний, алкоголизма и других интоксикаций) и иммуногенетической восприимчивости [11].
На восприимчивость к лепре оказывают влияние различные наборы генов, в том числе системы антигена лейкоцитов человека (HLA). В настоящее время изучаются изменения в генах-кандидатах, участвующих в ответной реакции организма хозяина на инфекционный агент. Исследования геномного сканирования выявили связывающие пики для лепры в областях хромосом 6p21, 17q22, 20p13 и 10p13 [15, 17].
Устойчивость к заражению M. leprae обеспечивается, с одной стороны, низкой вирулентностью M. leprae, с другой — индивидуальными особенностями врожденного иммунитета. Важную роль в поддержании врожденного иммунитета играет целостность эпителия, секрет желез и поверхностный иммуноглобулин A (IgA). Кроме того, уничтожать микобактерии, независимо от активации адаптивного иммунитета, могут NK-клетки, цитотоксические Т-лимфоциты и активированные макрофаги. При заражении регулирование воспалительных цитокинов и хемокинов приводит к пролиферации либо Т-хелперов 1-го типа (Th1), либо Т-хелперов 2-го (Th2) типа, что способствует активации клеточного или гуморального звена иммунитета, что определяет клиническую форму заболевания [16, 17].
Клеточный иммунитет неэффективен в отношении предотвращения развития заболевания у лиц с туберкулоидной формой лепры. Гуморальный иммунитет у лиц с лепроматозной формой заболевания, ответственный за продуцирование IgM против PGL-1 (фенольный гликолипид-1), не обеспечивает защиту и не предотвращает диссеминацию бактерий [17].
Исследования in situ фенотипа Т-лимфоцитов с использованием иммуногистохимических методов с моноклональными антителами демонстрируют преобладание Т-хелперов (CD4+) при туберкулоидной форме лепры, с соотношением CD4/CD8 2:1 (такое же соотношение обнаружено в крови). Соотношение клетки памяти/интактные Т-клетки — 1:1 в крови и 14:1 в очагах поражений. Это означает, что клетки CD4+ при туберкулоидных поражениях экспрессируют фенотип Т-клеток памяти (CD45R0+). При лепроматозных поражениях преобладает популяция TCD8+ лимфоцитов с отношением CD4/CD8, равным 0,6:1, независимо от соотношения в крови, половина CD4+ клеток принадлежит к подклассу T-интактных клеток. Большинство CD8+ клеток принадлежат к CD28-фенотипу, что указывает на то, что они являются T-супрессорными клетками, тогда как T-цитотоксические клетки (CD28+) преобладают при туберкулоидных поражениях [16, 17]. Было отмечено, что клетки CD4+ (фенотип Т-клеток памяти) связываются с макрофагами в центре туберкулоидной гранулемы, а клетки CD8+ — это окружающая его манжета. В лепроматозных гранулемах CD8+ клетки (T-супрессорный фенотип) смешаны с макрофагами и CD4+ клетками. Подклассами CD4+ и CD8+ продуцируются различные виды цитокинов. Клоны клеток CD4+ от пациентов с туберкулоидной формой вырабатывают высокие уровни интерферона гамма (ИФН-γ), интерлейкина-2 (ИЛ-2) и фактора некроза опухоли альфа (ФНО-α) [17]. Данные клоны (TCD4+ клетки, Th1-паттерн) усиливают клеточно-опосредованный иммунитет и снижают пролиферацию M. leprae. Клоны клеток CD8+ от больных лепрой продуцируют высокие уровни супрессорных цитокинов макрофагальной активности, ИЛ-4, ИЛ-5 и ИЛ-10, а также низкие уровни ИФН-γ [17]. Учитывая структуру секреции цитокинов T-супрессорных клеток, в частности ИЛ-4, эти клеточные клоны были названы TCD8+ клетками, Th2-паттерном. Они способствуют стимуляции B-лимфоцитов, повышающих гуморальный иммунный ответ, и вызывают продуцирование антител, обеспечивающих восприимчивость человека к развитию болезни [16, 17].
Высокий уровень ФНО-α в сыворотке крови у пациентов с туберкулоидной формой лепры свидетельствует об участии данного цитокина в деструкции M. leprae и образовании гранулемы. ФНО-α участвует в иммунной защите посредством активации макрофагов, однако гиперпродукция ФНО-α и его взаимодействие с ИФН-γ способствуют повреждению тканей и формированию узловатой лепрозной эритемы (ENL) [17].
При лепроматозной форме лепры наблюдается повышенный уровень трансформирующего фактора роста бета (ТФР-β), отсутствующего при туберкулоидной форме и проявляющегося в небольшом количестве при пограничной форме лепры. ТФР-β подавляет активацию макрофагов, что ингибирует продуцирование ФНО-α и ИФН-γ, способствуя персистенции инфекции [17].
О механизмах трансмиссии лепры известно, что микобактерии проникают в клетки эндотелия и оседают в Шванновских клетках нервов кожи, к которым имеют тропизм, где в дальнейшем происходит долговременный период их адаптации и размножения. Остается неизвестным, как колонизация Шванновских клеток микобактериями лепры приводит к распространению инфекции в другие ткани [18]. Нейронный тропизм M. leprae обусловлен его связыванием с областью G на мостике молекулы ламинина альфа-2, а альфа-дистрогликан служит рецептором для M. leprae на Шванновских клетках [18].
В работе Masaki и соавт. (2013), в исследовании in vitro и in vivo с использованием мышей, определялось взаимодействие M. leprae со Шванновскими клетками. Исследование показало, что M. leprae изменяют дифференцировку Шванновских клеток до клеток-предшественников [19]. Клеточная перестройка приводит к снижению регуляции Шванновской клеточной линии Sox10 [19]. Таким образом, M. leprae способствуют распространению инфекционного процесса через два механизма: прямая дифференцировка Шванновских клеток в мезенхимальные ткани и образование гранулемаподобных структур, которые выделяют бактерионесущие макрофаги [19]. Исследование расширяет понимание о пластичности зрелых клеток и демонстрирует свойства M. leprae, приводящих к перестройке взрослых клеток в стволовые [18]. Распространение инфекции путем дифференцировки Шванновских клеток возможно при их инфицировании большим количеством M. leprae. Методология, используемая на мышах, у которых нет Т-клеток, упрощает воспалительное микроокружение в преимущественно макрофаги [19]. Данная работа описывает перспективную in vitro модель для объяснения патогенеза M. leprae, но необходимы подробные исследования, прежде чем экстраполировать выводы на течение инфекционного процесса в организме человека [18].
Существует две классификации лепры: мадридская классификация, принятая в 1953 г., а также ее последующая модификация, предложенная Д. С. Ридли и В. Джоплингом в 1973 г. [11].
Согласно мадридской классификации выделяют два полярных типа лепры: туберкулоидный и лепроматозный и два промежуточных типа: недифференцированный и пограничный (диморфный) [11].
В классификации Ридли–Джоплинга выделяют три типа лепры — недифференцированный (I — Indeterminate), туберкулоидный (Tuberculoidtype — TT) и лепроматозный (Lepromatoustype — LL). Лепроматозный и туберкулоидный типы являются полярными. Кроме того, различают субполярные и пограничные группы заболевания. Классификация Ридли–Джоплинга не нашла широкого применения ввиду сложности, поэтому в практической деятельности различают лепроматозный и туберкулоидный тип лепры, а также пограничный тип, который в дальнейшем может трансформироваться в одну из первых двух форм [20].
Клинические проявления заболевания определяются типом лепрозного процесса. Туберкулоидная форма лепры протекает более доброкачественно по сравнению с лепроматозной формой. При туберкулоидном типе поражаются преимущественно кожа и периферическая нервная система; внутренние органы поражаются реже. Поражение кожных покровов характеризуется резко очерченными депигментированными пятнами, напоминающими проявления витилиго, либо асимметричными яркими красновато-синюшными пятнами с бледным центром и плоскими полигональными фиолетовыми узелками по периферии. Узелки зачастую сливаются с формированием несколько возвышающегося валика шириной около 2–3 см («бордюрные элементы»). По мере увеличения бляшек центральная часть ее становится депигментированной и атрофичной. Размеры бляшек могут варьировать от одного до десятков сантиметров в диаметре. В некоторых случаях при туберкулоидной форме на коже образуются саркоидоподобные бугорки до одного сантиметра в диаметре, красновато-бурого цвета, с тенденцией к группировке. Поражение придатков кожи характеризуется выпадением волос и нарушением потоотделения в области пораженных участков [11]. Для туберкулоидного типа лепры характерно раннее поражение периферической нервной системы с формированием расстройств чувствительности (болевой, температурной и тактильной). Полиневриты при туберкулоидной форме характеризуются более благоприятным течением, чем полиневриты при лепроматозной форме [11].
Описаны случаи редкой формы туберкулоидной лепры с изменениями периферических нервов по типу «теннисной ракетки», клинически проявляющейся в виде утолщения ветви нерва, выходящего из туберкулоидной гранулемы. Оно возникает в результате повреждения кожных нервов, вызванного образованием гранулем, и приводит к локальной болезненности или нарушению чувствительности [21, 22].
Лепроматозный тип лепры является более тяжелой формой заболевания, при которой наблюдается поражение кожных покровов, нервной системы, слизистых оболочек и внутренних органов. Характерным признаком поражения кожи является появление многочисленных симметрично расположенных мелких красноватых пятен с фиолетовым оттенком [11]. С течением времени их цвет меняется на буроватый или медный. Локальная чувствительность в области высыпаний на ранних стадиях болезни не нарушается [23]. Постепенно на разгибательной поверхности конечностей и лице формируются массивная инфильтрация. Инфильтраты, локализующиеся на лице в области лба, надбровных дуг, носа и щек, приводят к нарушению мимики и обезображиванию черт лица (формируется так называемая «морда льва», facies leonina). Очаги поражения могут сопровождаться выпадением волос, гипо- или ангидрозом [8]. В процесс вовлекается также подкожная жировая клетчатка с образованием узлов — лепром, представляющих буроватого цвета бугорки размерами от 2 мм до 2 см, плотной консистенции, с лоснящейся поверхностью. Бугорки имеют тенденцию к изъязвлению и чаще всего локализуются на лице, в области мочек ушных раковин, на коже конечностей, ягодиц и спины [11].
При лепроматозном типе лепры поражается как периферическая, так и центральная нервная система с развитием невротических расстройств, реже — психозов и поражений по типу невритов и полиневритов. В большинстве случаев поражаются лучевые, малоберцовые и большие ушные нервы: они утолщаются и становятся доступными для пальпации. В последующем развиваются двигательные и трофические расстройства, а также нарушения чувствительности. Больным свойственны невралгии, гиперестезии, парестезии, неадекватное или замедленное реагирование на раздражение, аналгезия. На фоне трофических нарушений развивается процесс мутиляции кистей и стоп. Поражение внутренних органов характеризуется неспецифическими изменениями в печени, легких, селезенке и нарушением функции некоторых желез внутренней секреции [11].
Описана редкая форма лепроматозного типа лепры, проявляющаяся бородавчатым кератозом [23]. На сегодняшний день было зарегистрировано только 25 случаев такой формы болезни [24].
При недифференцированной форме лепры специфические высыпания отсутствуют. Для данной формы характерно появление небольшого количества бледных пятен различной величины с нечеткими границами, а также поражение периферической нервной системы по типу полиневрита. Как правило, выявить возбудителя у этой категории лиц удается крайне редко [11].
При развитии обострений лепрозного процесса форма заболевания может меняться. Несмотря на множество клинических проявлений лепры, окончательная постановка диагноза не всегда является простой задачей, так как отсутствуют патогномоничные клинические признаки заболевания [25].
При диагностике лепры учитывают данные эпидемиологического анамнеза (пребывание в эндемичном регионе, контакты с больными лепрой), объективного осмотра (обращают внимание на характер и длительность существования высыпаний, наличие признаков нарушений периферической иннервации).
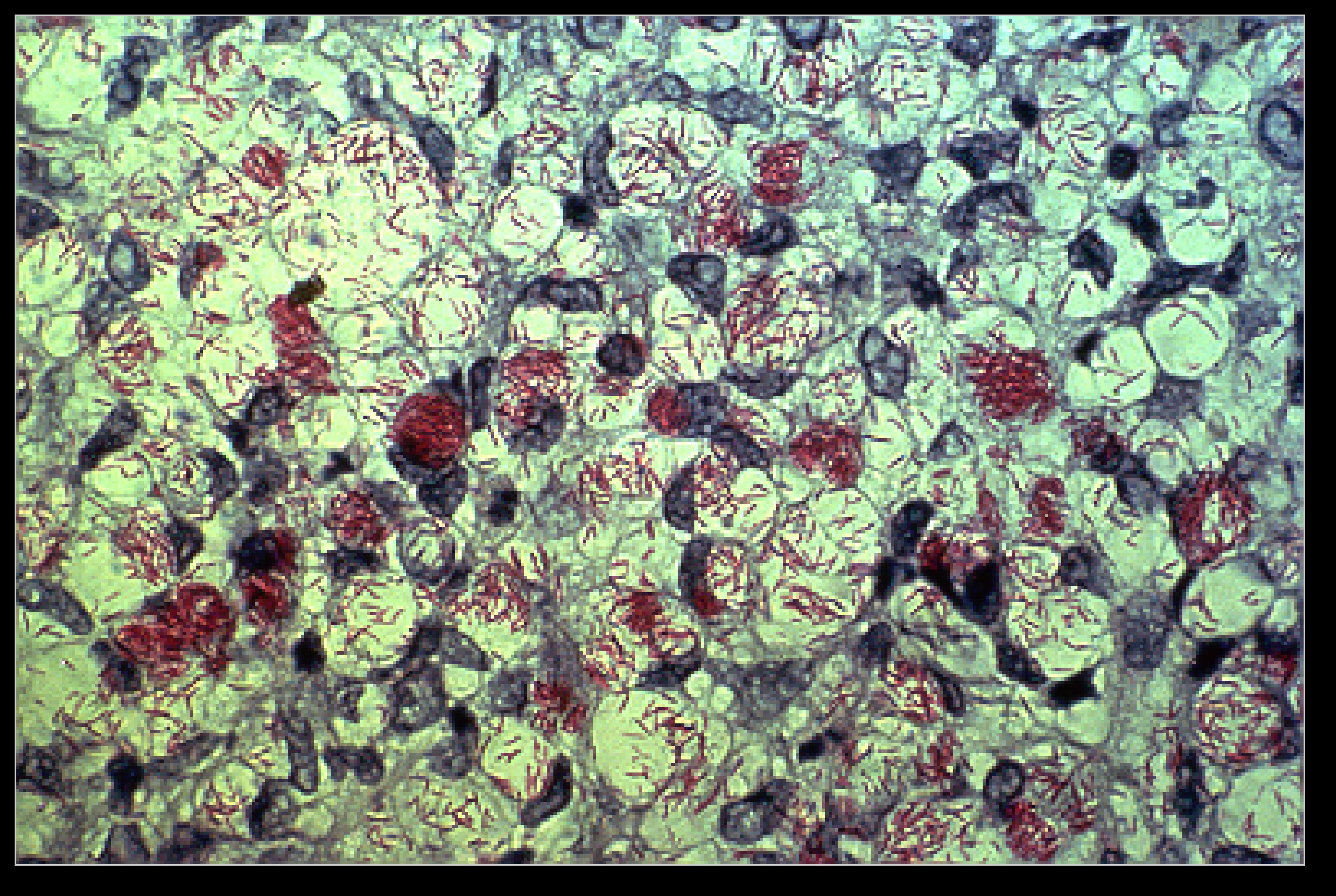
Общепринятым лабораторным методом диагностики лепры считается бактериоскопическое исследование. Соскобы для исследования берут с очагов поражения на коже и слизистой оболочке носа путем легкого поскабливания. Мазок помещают на предметное стекло и окрашивают по Цилю–Нильсену. Также исследуют пунктат из бедренных или паховых лимфатических узлов. Однако бактериоскопическое исследование имеет очень низкую чувствительность, особенно у больных с промежуточной или туберкулоидной формой поражения [26].
Лепроминовая реакция (проба Митсуды) является показателем способности хозяина поддерживать в своем организме клеточный иммунитет к M. leprae. Проба Митсуды не всегда является достоверной, так как у 10% здоровых по лепре людей может наблюдаться отрицательная реакция. Ограничивают применение лепроминового теста и технические трудности, связанные с получением лепромина и его внутрикожным введением [11].
Для серологической диагностики лепры применяют реакцию связывания комплемента и реакцию непрямой гемагглютинации. Однако невозможно однозначно трактовать полученные в ходе серологической диагностики результаты, вследствие наличия антигенной персистенции, и при отсутствии клинических проявлений болезни могут обнаруживаться так называемые «следовые» антитела [9, 27].
Наиболее чувствительным методом диагностики, позволяющим определять M. leprae, является полимеразная цепная реакция (ПЦР). ПЦР на данный момент считается наиболее перспективной из прямых диагностических методик и применяется для диагностики любого типа лепры [10, 18]. Преимуществом ПЦР являются неинвазивность и простота получения клинического материала, что предоставляет возможность проведения скрининга большого количества образцов при обследовании пациентов в высокоэндемичных по этому заболеванию регионах. Применение ПЦР позволяет усовершенствовать диагностику лепры и выявлять заболевание на ранней стадии [26].
Используемые в настоящее время традиционные методы диагностики, такие как лепроминовая проба и бактериоскопическое исследование, не всегда позволяют подтвердить диагноз лепры на ранних стадиях заболевания. При этом эффективность лечебных и профилактических мероприятий определяется возможностью ранней диагностики заболевания. В мире постоянно регистрируются новые случаи лепры, поэтому актуальным вопросом остается разработка и внедрение новых, более точных, методов диагностики, которые стали бы доступными для широкого использования и позволили с высокой степенью достоверности диагностировать лепру на ранних стадиях развития заболевания.
Лечение заболевания стандартизовано ВОЗ в 1981 г. [28]. Комбинированная лекарственная терапия включает в себя использование трех основных препаратов: дапсон, рифампицин и клофазимин [28].
Дапсон — бактериостатический препарат, действующий как конкурентный ингибитор ферментов дигидрофолатсинтетазы и дигидрофолатредуктазы, которые являются ключевыми ферментами путей биосинтеза фолатов в микобактериях лепры [28].
Рифампицин — оказывает в отношении M. leprae бактерицидное действие. Является селективным ингибитором ДНК-зависимой РНК-полимеразы и блокирует синтез РНК [29].
Клофазимин — жирорастворимый кристаллический краситель красноватого цвета с бактериостатическим и противовоспалительным свойствами. Механизм антибактериального действия клофазимина изучен недостаточно. Вероятно, он связан с блокировкой матричной функции ДНК, повышением фагоцитарной активности макрофагов и синтеза лизосомальных ферментов [28]. Клофазимин и рифампицин обладают эффективностью в отношении дапсонрезистентных микроорганизмов.
В 1997 г. ВОЗ была установлена продолжительность курса лечения: 6 месяцев для мультибациллярных форм лепры и 12 месяцев для олигобациллярных. Дапсон назначается в дозировке 100 мг для взрослых один раз в день, рифампицин в дозировке 600 мг один раз в месяц, клофазимин в дозировке 300 мг один раз в месяц. Для лечения детей применяются более низкие дозы препаратов [28]. В случае невозможности применения одного или двух препаратов из вышеперечисленных существуют схемы лечения с применением фторхинолонов, которые также показали свою эффективность в отношении M. leprae [30].
Выявление источников заражения и выполнение назначенного курса комбинированной лекарственной терапии считаются главными принципами стратегии последующего снижения распространенности лепры [3]. Однако комбинированная лекарственная терапия не исключает возможность развития резистентности к противолепрозным препаратам. Ввиду длительности терапии нередко пациенты не соблюдают схему лечения. Из трех препаратов, входящих в состав схем комбинированной лекарственной терапии, на территории Российской Федерации зарегистрированы только два — дапсон и рифампицин, что осложняет применение стандартизированных схем терапии [28]. Актуальными представляются разработка отечественных аналогов лекарственных препаратов, совершенствование существующих методов терапии и поиск новых схем лечения, которые позволили бы уменьшить длительность терапии и повысить тем самым приверженность пациентов к лечению, а также снизить резистентность к противолепрозным препаратам.
Своевременная диагностика лепры, профилактика распространения лепры беженцами и вынужденными переселенцами, особенно из высокоэндемичных государств (Бангладеш, Филиппинские острова, Индия, Ангола, Бразилия, Шри-Ланка и др.), являются серьезной и актуальной проблемой для мирового здравоохранения, одной из приоритетных задач при осуществлении контроля над здоровьем иностранных граждан и лиц без гражданства, въезжающих на территорию страны. В Российской Федерации, в соответствии с существующим порядком, установленным на законодательном уровне, для контроля над распространением заболеваний среди населения, нерезидентам Российской Федерации необходимо пройти медицинское освидетельствование в медицинских организациях. Однако данная процедура освидетельствования осложнена отсутствием комплексной методологической платформы.
Таким образом, несмотря на снижение распространенности лепры, представляется актуальным усиление контроля за обязательным обследованием на лепру прибывающих в страну иностранных граждан, разработка отечественных аналогов лекарственных препаратов и поиск новых схем лечения больных лепрой.
Литература
* ФГБОУ ДПО РМАНПО МЗ РФ, Москва
** ФГБУ ГНЦДК МЗ РФ, Москва
Современный взгляд на лепру/ А. А. Кубанов, Т. В. Абрамова, Е. К. Мураховская, В. А. Ласачко
Для цитирования: Лечащий врач № 5/2018; Номера страниц в выпуске: 48-52
Теги: микобактериозы, заболевания кожи, поражение эктодермы, антибиотикотерапия