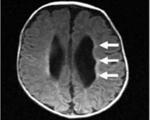
Лейкомаляция головного мозга у детей что это
Перивентрикулярная лейкомаляция
Перивентрикулярная лейкомаляция — это гипоксически-ишемическая энцефалопатия, характеризующаяся поражением белого вещества головного мозга новорожденных. Состояние чаще возникает у недоношенных, провоцируется патологиями течения беременности и родов, неадекватной респираторной поддержкой в постнатальном периоде. Заболевание проявляется мышечной дистонией, судорожным синдромом, задержкой психомоторного развития. Для диагностики болезни назначается КТ или МРТ мозга, ЭЭГ, допплерография церебральных сосудов. Лечение лейкомаляции включает медикаменты (нейропротекторы, инфузионные растворы, антиконвульсанты), индивидуальный комплекс физиотерапии, массажа, ЛФК.
МКБ-10
Общие сведения
По разным данным, перивентрикулярная лейкомаляция (ПВЛ) встречается у 4,8-9% младенцев, причем среди больных преобладают недоношенные новорожденные (78%). Наибольшая вероятность появления болезни у детей, родившихся на сроке 27-32 недели. По данным аутопсии умерших младенцев, признаки ПВЛ регистрируются чаще — у 50-75%. Заболевание имеет большую значимость в детской неврологии, поскольку может вызывать тяжелые отдаленные последствия, считается ведущей причиной ДЦП.
Причины
Основной этиологический фактор перивентрикулярной лейкомаляции — внутриутробная гипоксия, которая выступает следствием осложнений протекания беременности, материнских факторов риска либо негативного экзогенного воздействия. Также состояние может возникать при перинатальной гипоксии, которая развивается во время родов, в первые дни жизни младенца (при синдроме дыхательных расстройств, врожденных аномалиях сердца и легких, неонатальном сепсисе).
В группе риска наибольшую по численности категорию составляют недоношенные младенцы. Зачастую лейкомаляция выявляется у детей, которое были рождены от матерей с сахарным диабетом, хронической анемией, гипертиреозом либо страдавших от преэклампсии и эклампсии. Состояние возникает при выполнении экстренного кесарева сечения, неадекватном родовспоможении (травмирующие акушерские пособия). Высокая частота лейкомаляции (до 22%) отмечается при сочетании длительного безводного периода с хориоамнионитом у матери.
Патогенез
Поражение головного мозга связано со снижением кровотока в церебральных сосудах, недостаточным поступлением кислорода и питательных ингредиентов. Перивентрикулярная область наиболее чувствительна к этим изменениям, что обусловлено особенностями кровоснабжения, несовершенством процессов ауторегуляции, нейроонтогенетическими особенностями головного мозга у младенцев.
Недоношенные намного чаще страдают лейкомаляцией, поскольку у них на фоне гипоксии не увеличивается церебральный кровоток, как это бывает у рожденных в срок младенцев. В результате этого резко уменьшается кровоток в зоне между вентрикулофугальными и вентрикулопетальными артериями, быстро формируется гиперкапния и ацидоз. Расстройства микроциркуляции проявляются стазом, тромбозом, вне- и внутриклеточным отеком белого вещества.
При перивентрикулярной лейкомаляции в конечном итоге происходит некроз отельных участков мозгового вещества, образование кист, избыточное накопление медиаторов воспаления. Поскольку на 28-32 неделях в норме происходит активная миелинизация белого вещества, а в условиях гипоксии этот процесс не может происходить, недоношенные новорожденные впоследствии имеют серьезные органические поражения ЦНС.
Формирование ПВЛ возможно не только при недостатке кислорода, но и при гипероксии — при проведении ИВЛ, оказании других видов респираторной поддержки. При избыточном поступлении кислорода повышается рН крови в мозговой ткани, что вызывает рефлекторный спазм сосудов, затруднение венозного оттока. Также кислород активизирует процессы свободнорадикального церебрального повреждения.
Симптомы
Как правило, перивентрикулярная лейкомаляция формируется антенатально или на протяжении первых часов после рождения ребенка, поэтому начальные признаки заметны уже в родильном доме, особенно если младенец рожден недоношенным. При обширном повреждении белого вещества происходят нарушения сознания по типу летаргии или комы, однако возможна обратная симптоматика — повышенная возбудимость, оживление безусловных рефлексов, судорожный синдром.
Типичным проявлением патологии являются изменения тонуса мышц. На первом месяце жизни преобладает слабость мускулатуры ног в сочетании с нормальным формированием мышц верхних конечностей. У недоношенных новорожденных часто отмечается тотальная мышечная гипотония. Такие нарушения сохраняются в среднем до 6 месяцев, после чего они сменяются спастическими явлениями — повышением тонуса мускулатуры нижних конечностей, оживлением коленных рефлексов.
Течение перивентрикулярной лейкомаляции имеет неравномерный характер: периоды обострения симптоматики сменяются «мнимым благополучием», когда ребенок развивается относительно нормально. Затем происходит задержка формирования моторных навыков, развиваются различные сенсорные нарушения, дизартрия. 66% детей, особенно недоношенные, страдают от снижения остроты зрения вплоть до полной слепоты вследствие атрофии зрительных нервов.
Осложнения
Перивентрикулярные поражения белого вещества — крайне тяжелое состояние. Недоношенные дети с ПВЛ умирают в 50% случаев еще в период новорожденности, у выживших обычно наступает инвалидность с полной дезадаптацией. Пациенты с длительно сохраняющимся судорожными приступами в 85% случаев имеют грубую задержку психомоторного развития. У перенесших ПВЛ в будущем в 1,5 раза чаще встречаются фебрильные судороги, в 27 раз чаще формируется эпилепсия.
При множественных кистах в перивентрикулярной зоне у 80-97% больных (чаще — недоношенных) возникает детский церебральный паралич (ДЦП), который сопровождается глубоким психоречевым отставанием. Развитие заболевания связано с повреждением центральной части внутренней капсулы, средне- и заднелобных сегментов белого вещества полушарий. Также лейкомаляция вызывает микроцефалию (у 42% пациентов), нейросенсорную тугоухость (у 28% больных).
Диагностика
Постановка правильного диагноза в неонатальном периоде затруднена, что объясняется полиморфностью клинической картины, отсутствием патогномоничных симптомов. При физикальном осмотре выявляется асимметрия мышечного тонуса, патологическое усиление рефлексов, на более поздних этапах — спастическая диплегия. Особую настороженность следует проявлять в отношении детей, родившихся недоношенными. В план обследования новорожденных с подозрением на ПВЛ включаются:
Лечение перивентрикулярной лейкомаляции
Терапия перивентрикулярной лейкомаляции представляет собой сложную задачу, учитывая необратимый характер повреждений белого вещества, частое сочетание гипоксически-ишемической энцефалопатии с поражениями других систем организма у недоношенных. Медикаментозное лечение подбирается на основе ведущих синдромов болезни и включает следующие группы препаратов:
Учитывая высокую частоту резидуальных неврологических явлений, рекомендовано восстановительное лечение. Чтобы улучшить двигательные способности, назначаются курсы массажа, физиотерапии, лечебной физкультуры. Для развития речевых навыков требуются коррекционные занятия у логопеда, дефектолога. Детям с поражением органов чувств нужна помощь тифлопедагога, сурдопедагога. Пациентам с ДЦП необходимы специальные ходунки, костыли, инвалидные коляски.
Прогноз и профилактика
В большинстве случаев лейкомаляция отличается неблагоприятным течением, отличается высоким уровнем смертности во время младенчества. Для выживших детей прогноз напрямую зависит от тяжести органического дефекта перивентрикулярной зоны, своевременности и полноты проведенного лечения. Профилактика ПВЛ включает рациональное ведение беременности, предупреждение родового травматизма, соблюдение протоколов при респираторной поддержке в роддоме, усиленный контроль за развитием недоношенных.
Лейкомаляция головного мозга у детей что это
Наиболее распространенным гипоксически-ишемическим повреждением у недоношенных новорожденных является перивентрикулярная лейкомаляция (ПВЛ). Miller et al. (2000) сообщали об этом состоянии у доношенных детей. Термин ввели Banker и Larroche в 1962 г. в отношении размягчения (malacia) белого (leicos) вещества. Большинство детей в их исследовании были рождены после 28 недели гестации и на момент смерти были в возрасте нескольких недель. Аноксические эпизоды были зарегистрированы во всех случаях.
При патологоанатомическом исследовании встречались двусторонние, хотя необязательно симметричные, коагуляционные некрозы, примыкающие к наружному углу боковых желудочков. В последние годы классическая картина распознается реже и в работе Paneth et al. (1990) только 3 из 15 новорожденных с некрозами белого вещества имели классические изменения при ПВЛ. В настоящее время (Volpe, 2008) принято различать преимущественно очаговый тип повреждения белого вещества — с кистозными образованиями, ограниченными областью угла и затылочным рогом, вовлекающими в процесс зрительную лучистость, иногда распространяясь кпереди в область лобно-теменного белого вещества, и более диффузный тип, который сейчас чаще называют лейкоэнцефалопатией или повреждением перивентрикулярного белого вещества (periventricular white matter injury — PWMI), реже — ПВЛ (Leviton и Gilles, 1984, Back, 2006).
В то время как эволюция в кисты, хорошо различимые при ультразвуковом сканировании черепа, является отличительным признаком очагового типа, более диффузные изменения интенсивности сигнала МРТ являются информативным показателем для диагностики диффузных патологических изменений белого вещества (Counsell et al, 2003).
Кистозная перивентрикулярная лейкомаляция (к-ПВЛ) была впервые диагностирована с использованием краниальной ультрасонографии в 1982 г. (Hill et al., 1982а). По данным прежних патологических исследований, примерно 25% повреждений носили геморрагический характер (Levene et al., 1983). Как было отмечено, заболеваемость к-ПВЛ за последнее десятилетие снизилась (Hamrick et al., 2004) с 5-10% до менее 1% в некоторых центрах.
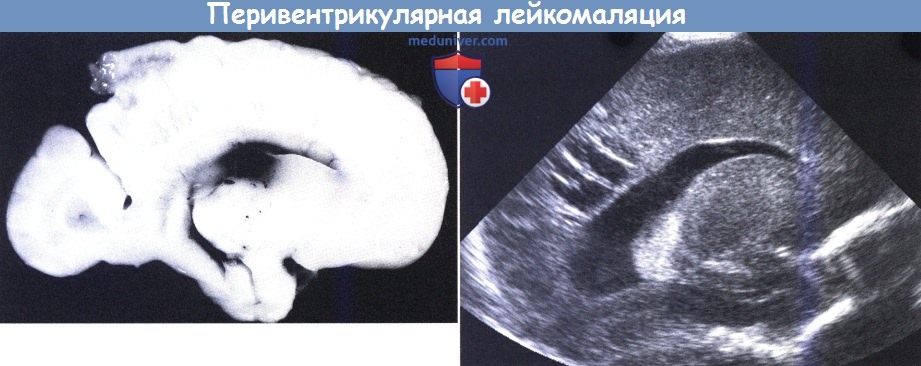
Новорожденный с гестационным сроком 28 недель (масса при рождении 945 г),
умерший в возрасте двух недель: многочисленные мелкие полости в перивентрикулярной области (с разрешения J-C Larroche, Maternite Port Royal, Paris).
Ультразвуковое сканирование другого ребенка, сагиттальная проекция: множественные полости около полостей желудочков.
а) Сопоставления с нейровизуализацией. Начальные изменения, видимые при ультразвуковом исследовании, представляют собой участки повышенной перивентрикулярной эхогенности (ПВЭ), которые относятся к очень субъективным находкам. Некоторые предлагают измерять ПВЭ при сравнении их с эхогенностью сосудистого сплетения. Учитывается продолжительность ПВЭ, при длительном присутствии возрастает вероятность, что они указывают на среднюю степень ПВЛ. Кроме того, может помочь определение гомогенности ПВЭ. В случаях неоднородности («пестрой» ПВЭ), наиболее вероятно повреждение белого вещества, а пестрые участки чаще коррелируют с небольшими петехиальными кровоизлияниями на MPT (Sie et al, 2000b, Childs et al, 2001). ПВЛ можно разделить на 4 подгруппы (de Vries et al, 1992a). Стадия I дополнительно может быть разделена на две подгруппы, (а) гомогенные, и (б) негомогенные (пестрые) перивентрикулярные эхогенности (ПВЭ).
Несколько исследований с применением МРТ показали, что имеется невыраженная корреляция между перивентрикулярной эхогенности (ПВЭ) и изменениями интенсивности сигнала в белом веществе (Maalouf et al., 2001, Debillon et al., 2003, Miller et al., 2003, Inder et al, 2003a). Раннюю ПВЭ можно было бы соотнести с диффузным сигналом сверхвысокой интенсивности (Diffuse excessive high signal intensity—DEHSI), который выявляется на Т2-взвешенных спин-эхо последовательностях у 70% недоношенных детей в приблизительном эквиваленте зрелого возраста. Измерение коэффициента диффузии (the apparent diffusion coefficient — ADC) подтвердило, что этот показатель действительно отражает повреждение белого вещества (Counsell et al., 2003).
У небольшого количества младенцев очаги перивентрикулярной эхогенности (ПВЭ) постепенно превратились в локализованные или более обширные кисты. Чем меньше и чем более ограниченна киста, тем больше времени требуется для ее развития. Мелкие кисты могут остаться не выявленными. Более 50% небольших кист впервые выявляли при еженедельном ультразвуковом исследовании после 28 дней (Pierrat et al., 2001, de Vries et al., 2004). Более чем у половины детей маленькие кисты разрешались к 40 неделям постконцептуального возраста, приводя к легкому расширению желудочков (вентрикуломегалии) в некоторых, но не во всех случаях. С уменьшением длительности вентиляции новорожденных и возрастанием числа пациентов большинство младенцев переводят в районные стационары до развития кистозных изменений и возвращают для наблюдения в клинику в 40 и более недель постконцептуального возраста.
Если ультразвуковое исследование не проводится в местных больницах, кисты могут оставаться не диагностированными, что, вероятно, является основной причиной плохой репутации краниального УЗИ как предиктора церебрального паралича (de Vries et al., 2004). В улучшении наблюдения за детьми группы риска по развитию кист МРТ, как было показано, может быть перспективным. Inder et al. (1999b) впервые продемонстрировали обширные изменения на ДВ-МРТ, предшествовавшие развитию кист. Получены немногисленные данные об очень ограниченном количестве детей с ПВЭ, обследованных на ранней стадии этого тяжелого расстройства (Bozzao et al., 2003).
Кисты, даже обширные, могут разрешаться от нескольких недель до месяцев, и МРТ играет главную роль в определении распространенности повреждений белого вещества на этапе позднего неонатального периода. Классическая картина в периоде младенчества может быть представлена в виде неравномерного расширения боковых желудочков, различной степени утраты белого вещества, извилин, прилегающих к желудочковым стенкам, задержки миелинизации и перивентрикулярного глиоза (Byrne et al., 1990, Truwit et al., 1992).
de Vries et al. (1993) обнаружили хорошую степень корреляции между тяжестью патологии при ультразвуковом исследовании новорожденных и глиозными изменениями на МРТ, в период младенчества. Современные технологии, использующие диффузионо-тензорное изображение (ДТИ), позволяют выполнить диффузионнотензорную трактографию (ДТТ) и таким образом отображать и подсчитывать белое вещество пирамидального тракта недоношенных новорожденных (Miller et al., 2002, Berman et al., 2005, Partridge et al., 2005). Counsell et al. (2006) указали на существенно повышенный радиальный коэффициент диффузии в задней части внутренней капсулы и утолщении мозолистого тела, а также значительно повышенный радиальный и аксиальный коэффициент диффузии в белом веществе семиовального центра, в белом веществе лобной, перивентрикулярной и затылочной областей. Эти данные, полученные Counsell et al. (2006), позволяют предположить, что DEHSI при стандартном МРТ отражает патологические изменения олигодендроцитов и/или аксонов белого вещества.
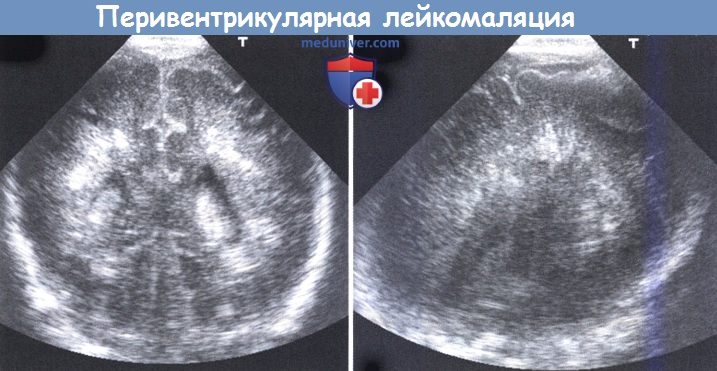
Ультразвуковое исследование полости черепа, выполненное на первый день: (слева) коронарный вид через передний родничок, и (справа) парасагиттальное сканирование через задний родничок.
На обоих изображениях видны «пятнистые» плотные эхогенности. 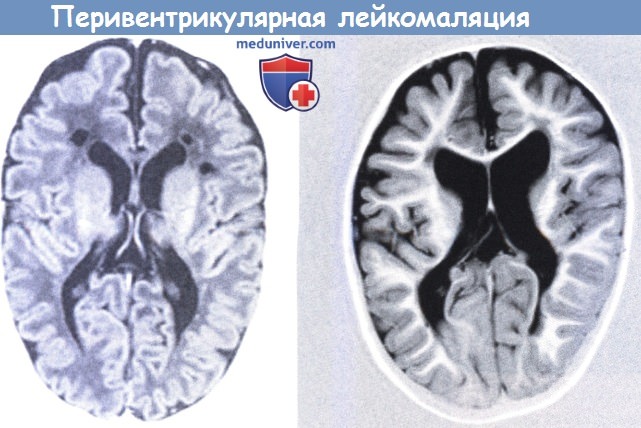
Кисты хорошо видны при ранней МРТ (левое), в то время при поздней МРТ выявлена угловатая желудочковая дилятация и тяжелая атрофия белого вещества.
б) Патогенез. Патогенез ПВЛ многофакторный и менее понятен, чем при кровоизлиянии в герминативный матрикс и внутрижелудочковом кровоизлиянии (КГМ-ВЖК). Первоначально это состояние связывали с гипоперфузией пограничных зон в белом веществе, но исследования с использованием непрерывного измерения кровяного давления до сих пор не в состоянии определить гипотензию как независимый фактор риска для повреждения белого вещества (Trounce et al., 1988, Watkins et al., 1989, Dammann et al., 2002). Тяжелая гипокапния, которая приводит к снижению мозгового кровотока, в нескольких исследованиях была выделена в качестве самостоятельного фактора риска для развития ПВЛ (Calvert et al., 1987, Greisen et al., 1987, Graziani et al., 1992, Fujimoto et al., 1994, Wiswell et al., 1996, Okumura et al., 2001, Shankaran et al., 2006). У детей с развитием ПВЛ было обнаружено заметное снижение как мозгового кровотока, так и доставки кислорода к мозгу (Pryds, 1994).
Результаты ближней инфракрасной спектроскопии (БИС), Tsuji et al. (2000) подтвердили дисфункцию церебральной ауторегуляции у 17 из 32 недоношенных детей; у 9 из них развились тяжелые внутричерепные повреждения по сравнению только с 2 из 15 с неизмененной ауторегуляцией.
В нескольких интересных исследованиях была обнаружена связь между восходящей внутриматочной инфекцией, продукцией воспалительных цитокинов и повреждением белого вещества (Leviton и Gilles, 1984, Bejar et al., 1988, Murphy etal., 1995, Perlman et al., 1996, Verma et al., 1997, Yoon et al., 1997, Minagawa et al., 2002). В недавнем обзоре (Leviton et al., 2005) выдвинута гипотеза, что поражение белого вещества возникает в результате взаимного усиления врожденной и приобретенной иммунных систем. При мета-анализе была установлена связь между хориоамнионитом и церебральным параличом, и хориоамнионит был выделен в качестве фактора риска как для церебрального паралича (КР 1,9; 95% ДИ 1,5-2,5), так и для ПВЛ (КР 2,6; 95% ДИ 1,7-3,9) (Wu и Colford, 2000). Yanowitz et al. (2002) смогли показать взаимосвязь между хориоамнионитом, повышенным уровнем ИЛ-1 р и ИЛ-6, а также снижением среднего и диастолического давления крови после рождения.
Уязвимость также зависит от степени зрелости белого вещества, называемой Back et al. (2001) «окном уязвимости развития». Они предположили важность гипоксически-ишемического/токсического повреждения метаболически активной олигодендроглии (Oka et al., 1993). На пике развития ПВЛ преимущественно представлены поздние предшественники олигодендроцитов. Кроме этого, Oka et al. указывали на то, что глютамат чрезвычайно токсичен в отношении дифференцирующейся олигодендроглии.
Редактор: Искандер Милевски. Дата публикации: 25.11.2018
Клиника, диагностика, прогноз, осложнения перивентрикулярной лейкомаляции
Клиника, диагностика, прогноз, осложнения перивентрикулярной лейкомаляции
Таким образом, основные клинические симптомы ПЛ в раннем периоде — это: 1) снижение тонуса нижних конечностей, 2) возрастание тонуса в шейных разгибателях, 3) приступы апноэ и брадикардии, 4) гипервозбудимость, 5) псевдобульбарный паралич с бледностью конечностей и 6) судороги.
При электроэнцефалографическом (ЭЭГ) исследовании в начальной стадии у многих детей обнаруживается пароксизмальная активность и депрессия ЭЭГ. Данные ЭЭГ используются для прогноза последствий ПЛ. В то же время специфичность проявлений ПЛ на ЭЭГ низкая (в том числе на амплитудной интегрированной ЭЭГ).
Наибольшее распространение в диагностике ПЛ получило нейросонографическое исследование (НСГ), которое выполняют через большой родничок в 2-х плоскостях — коронарной и сагиттальной. Смена угла наклона датчика позволяет оценить структуру головного мозга в различных его отделах и выявить различные повреждения. ПЛ относят к группе ишемических поражений перивентрикулярных областей боковых желудочков мозга. На месте ранее выявляемых очагов уплотнения в последующем образуются эхосвободные кистозные образования. Такие изменения называют «кистозной ПЛ». Средний срок образования кист составляет 19 дней с момента рождения. Наиболее выраженные эхографические проявления ПЛ наблюдались на 3—5 дни жизни, причем повышенная эхоген- ность стойко сохранялась до 10 дня, а в последующем формировались единичные или множественные кисты перивентрикулярных областей мозга (Валид М. А. и соавт., 2005). При НСГ-исследовании глубоко недоношенных детей (менее 1500 г) ПЛ обнаруживалась у 31,9 % детей. Авторы обнаруживали в зависимости от стадии процесса следующие изменения: участки повышенной зхоплотности, кисты (локализованные и распространенные, вентрикуломегалию и церебральную атрофию
Имеется классификация степеней тяжести ПЛ, основанная на данных нейросонографии (см. выше). Особую трудность представляет диагностика ПЛ в острой фазе, поскольку ореол повышенной перивентрнкулярной эхоплотности в норме присутствует у недоношенных новорожденных. Эти изменения могут исчезать в течение 2—3 недель после рождения и свидетельствовать о каких-либо нарушениях кровообращения в перивентрикулярных областях мозга.
Оценивая результаты нейросонографического исследования (НСГ). следует иметь в виду, что, во-первых, повышенная эхоплот- ность — не синоним ПЛ, что это могут быть очаги умеренного отека мозга, телэнцефалической лейкоэнцефалопатии, астроглиоза, перивентрикулярного геморрагического инфаркта, энцефалита и других патологических процессов. Тем более что в 85 % случаев ПЛ 1-й степени тяжести наблюдается полное выздоровление, что сомнительно при понимании ПЛ как процесса с обязательными некрозами мозговой ткани. Абсолютно справедливо замечание А. Б. Пальчика и Н. П. Шабалова (2000),что «исследователь видит зоны повышенной или пониженной эхогенности, а не «отек», «ишемию», «кровоизлияние», «сгусток», «кальцификат», «лейкомаляцию» и т. д.; на основании данных нейросонографии он может лишь предположить о причинах и сути измененной эхогенности». Во-вторых, сомнительно относить все случаи 4-й степени ПЛ с распространенными поражениями бе-лого вещества полуовальных центров к истинной ПЛ. Такие поражения более характерны для мультикистозной энцефаломаляции или так называемой «комплексной ПЛ», а не ПЛ с характерными именно перивентрикулярными очагами. Полагаю, что требуется усовершенствование нейросонографической классификации ПЛ. Нейросонография позволила сделать прорыв в диагностику ПЛ, популяризировать данное поражение как одно из наиболее изученных. Вместе с тем необходимо комплексное изучение других пора жений головного мозга, чтобы не заниматься гипердиагностикой ПЛ и не относить любые поражения в белом веществе больших полушарий к ПЛ.
При так называемой «некистозной» форме ПЛ НСГ-исследование может быть отрицательным в 50—70 % случаев, поэтому целесообразно проведение неоднократных исследований (динамическое сканирование). Это повышает диагностическую информативность НСГ при ПЛ.
Особенно много заблуждений возникает при оценке «кист» и «псевдокист» белого вещества мозга, которые специалисты УЗИ не дифференцируют между собой. Поэтому обнаруженные кисты у новорожденных первых дней жизни ошибочно относят к ПЛ, возникшей антенатально. ПЛ — это в основном постнатальный процесс, а в первые дни жизни могут обнаруживаться псевдокисты, представляющие собой порок развития головного мозга, а не истинные кисты. Псевдокисты не имеют никакого отношения к ПЛ, хотя могут сочетаться с ПЛ.
В своих исследованиях я обнаружил высокую частоту поражений зрительной лучистости и рекомендовал для диагностики ПЛ «более тщательное исследование функции зрения». Отрадно, что такие исследования в настоящее время появились. Выявлено, что у детей с ПЛ в 100 % случаев наблюдаются офтальмологические осложнения. У 80,3 % детей с ПЛ обнаруживается синдром расширенной экскавации диска зрительного нерва, свидетельствующий о транссинаптической нейрональной дегенерации и ретроградной дегенерации аксонов. Поскольку очаги ПЛ в основном двусторонние, постольку в подавляющем большинстве случаев (93,4 %) обнаруживаются билатеральные поражения диска зрительного нерва. Выявлялись и другие офтальмологические нарушения: деформация диска зрительного нерва, его атрофия, гипоплазия и др. Следует отметить, что распшрения экскавации зрительного нерва могут обнаруживаться и при других патологических процессах головного мозга, если они затрагивают зрительную лучистость и стриарную кору. Ранняя диагностика офтальмологической патологии у новорожденных с ПЛ позволяет назначить своевременное лечение, избежать значительной зрительной депривации и назначить более эффективную функциональную реабилитацию.
Для диагностики и прогноза формирования ПЛ в настоящее время рекомендуют исследование в сыворотке крови мозгового нейротрофического фактора (BDNF) и специфического белка астроцитарной глии S-100. Повышение концентрации S-100 с высокой достоверностью позволяет прогнозировать развитие тяжелых структурных повреждений мозга, особенно при сочетании ПЛ с ВЖК, когда наблюдалось превышение показателей нормы в 10—12 раз. У новорожденных с ПЛ уровень сывороточной концентрации BDNF низкий.
Прогноз ПЛ. По моим и литературным данным, при ПЛ поражаются прежде всего кортико-спинальный тракт, зрительная и слуховая лучистости. Следствием ПЛ являются 1) ДЦП (чаще спастическая диплегия, при тяжелых поражениях квадриплегия), 2) задержка психомоторного развития, и 3) нарушения зрения (нарушения фиксации, нистагм, страбизм и др.). Могут нарушаться функции слуха. По данным О. Н. Малиновской и соавт. (2005), исходом ПЛ являются: 1) выздоровление (19,5 %), 2) детский церебральный паралич (ДЦП) (80,5 %), 3) судорожный синдром и эпилепсия (37,5 %) и 4) задержка психоречевого развития (66 %). Все дети с задержкой развития страдали ДЦП, причем чем значительнее двигательные нарушения, тем грубее нарушения психоречевого развития. У всех детей с 3 и 4 степенями тяжести по данным
НСГ развивался ДЦП. Такой исход как выздоровление может вызвать возражения, так как самое минимальное повреждение головного мозга при ПЛ сопровождается разрушением нервных волокон, их ретроградной дегенерацией, астроглиозом и др. Надо полагать, что не все случаи ПЛ по данным НСГ-исследования представляют случаи истинной ПЛ. В то же время такие последствия, как эпилепсия, вероятно, связаны с поражениями корковых структур и су- бикулюма гиппокампа, которые весьма чувствительны к гипоксии. Надо дифференцировать между собой последствия ПЛ и последствия других сопутствующих поражений головного мозга, что представляет трудную задачу.
По данным J. Volpe (2003), 10 % выживших глубоко недоношенных детей (массой до 1500 г) с ПЛ страдают ДЦП, а 50 % в дальнейшем имеют психомоторные нарушения.
При ДЦП по данным НСГ определяют 5 основных типов нарушений: ПЛ (33,1 %), постгеморрагическую порэнцефалию, аномалии развития, кортикальную и субкортикальную атрофию, повреждения базальных ганглиев (Гайнетдинова Д. Д., 2001). ПЛ и ДЦП — это разные нозологические единицы. По моим данным, после перенесенной ПЛ формируются кисты в белом веществе мозга с характерным преобладанием в определенных отделах мозга (см. топографию), в той или иной степени атрофируется белое вещество, а при тяжелой степени поражения гипоплазируются мозолистое тело, кора больших полушарий и расширяются боковые желудочки (возникает вентрикуломегалия).
Считают, что ДЦП формируется у всех детей с ПЛ, не удерживающих голову к 6 мес. скорригированного возраста. Причем от степени тяжести ПЛ зависит прогноз неврологических нарушений. При ПЛ 1 степени все дети самостоятельно передвигались, при ПЛ 2-й степени передвигались самостоятельно или с поддержкой 80 % детей, а при 3-й степени — только 15 % детей передвигались самостоятельно, а 45 % больных не передвигались и не могли сидеть самостоятельно.
Для профилактики ПЛ рекомендуется антенатальная диагностика хориоамнионитов с последующим введением матери на 24-31 неделях беременности бетаметазона, положительно влияющего на защитную реакцию плода при воспалении. Важно предупреждать преждевременные роды, не употреблять наркотики (кокаин), диагностировать внутриутробные инфекции, предупреждать пролонгированную гипокарбию при искусственной вентиляции легких и т. д.
Многие исследовали указывают на роль фактора некроза опухоли (ФНО) в развитии ПЛ (вызывает артериальную гипотензию, усиливает интраваскулярную коагуляцию, способствует гибели олигодендроцитов и т. д.). В то же время кортикостероиды блокируют продукцию ФНО астроцитами и снижают его активность, что позволяет считать обоснованным их применение при лечении и профилактике ПЛ. Однако имеются данные, что раннее введение дексаметазона у недоношенных детей при СДР коррелирует с развитием ПЛ. При ранней терапии дексаметазоном в первые три дня жизни возрастает частота неврологических осложнений и ДЦП. Поэтому рекомендуется использовать этот препарат после 2-й недели жизни или применять альтернативные препараты (будесонид, пулимикорт) и ингаляционные стероиды (флутиказон, беклометазон).
У детей, находящихся на ИВЛ, очень важно контролировать газы крови, поскольку доказано, что гипероксия, гиперкапния и ацидоз являются факторами риска развития ПЛ. Терапевтические мероприятия при ПЛ во многом сходны с мерами при лечении «гипоксически-ишемической энцефалопатии». Это введение антиоксидантов, ингибиторов образования кислородных радикалов, блокаторов кальциевых каналов и антагонистов кальция и т. д. Целесообразно применение и давно известной кранио-церебральной гипотермии (охлаждение головки), способствующей замедлению обменных процессов в головном мозге и снижающей риск ишемиче- ских его поражений.
В терапии ПЛ важно использовать препараты, улучшающие мозговое кровообращение (винпоцетин, стугерон, ницерголин) и ноотропы (пирацетам). При респираторном дистресс-синдроме целесообразно назначение препаратов сурфактанта, уменьшающих тяжесть дыхательных расстройств и уменьшающих потребность в ИВЛ, а тем самым снижающих риск возникновения новых очагов ПЛ. В терапии ДЦП, возникших вследствие ПЛ, рекомендуется использование церебролизина (Гайнетдинова Д Д., 2001), обладающего антикласто- генной и антиоксидантной активностью. Все разработки по лечению церебральной ишемии и гипоксически-ишемической энцефалопатии 3-й степени целесообразно применять и при лечении ПЛ.