Лейкопатия у детей что это
Прогрессирующая многоочаговая лейкоэнцефалопатия
Прогрессирующая многоочаговая лейкоэнцефалопатия (син.: прогрессирующая субкортикальная энцефалопатия, PML) является демиелинизирующей болезнью ЦНС, вызванной реактивацией вируса JC (JCV) у иммуннологически скомпрометированных пациентов, включая пациентов после трансплантации, со злокачественными новообразованиями системы кроветворения или СПИДом. С созданием и совершенствованием высокоактивной антиретровирусной терапии (ВААРТ) заболеваемость и распространенность прогрессирующей многоочаговой лейкоэнцефалопатии уменьшились в несколько раз. Тем не менее патология продолжает встречаться и должна рассматриваться в качестве одного из дифференциальных диагнозов при симптомах поражения ЦНС у ВИЧ инфицированных пациентов.
Недавно, о развитии прогрессирующей многоочаговой лейкоэнцефалопатии сообщалось у пациентов с аутоиммуннными болезнями, у которых проводилась иммуносупрессивная терапия. Несмотря на прекращение иммуносупрессии.
Патогенез (что происходит?) во время Прогрессирующей многоочаговой лейкоэнцефалопатии:
В полушариях большого мозга, мозговом стволе и мозжечке обнаруживают множественные очаги демиелинизации с максимальной плотностью на границе между белым и серым веществом. В основном поражаются олигодендроглиоциты.
Симптомы Прогрессирующей многоочаговой лейкоэнцефалопатии:
Течение и прогноз
Обычно трудно установить момент начала заболевания, особенно если оно развивается на фоне тяжёлого соматического недуга. Течение прогрессирующее, заканчивается летальным исходом. Может протекать остро, приводя к смерти в течение 1 мес.
Диагностика Прогрессирующей многоочаговой лейкоэнцефалопатии:
При ЭЭГ практически всегда выявляется локальное или генерализованное замедление ритма, иногда еще до появления изменений при КТ.
Спинномозговая жидкость чаще не изменена, иногда слегка повышена концентрация белка или IgG, менее чем у четверти больных выявляется цитоз, преимущественно лимфоцитарный и не превышающий 25 в мкл.
При обнаружении олигоклональных иммуноглобулинов, выраженного цитоза, наличия нейтрофилов либо эритроцитов в С спинномозговой жидкости необходимо исключить рассеянный склероз, острый геморрагический лейкоэнцефалит, СПИД-дементный синдром и ВИЧ-миелопатию, менингоэнцефалит, вызванный вирусом varicella-zoster, постинфекционный и поствакцинальный энцефаломиелит.
Окончательный диагноз ставится на основании биопсии или аутопсии. В ткани мозга можно выявить антигены вируса JC (иммуноцитохимически) и ДНК вируса (методами флюоресцентной гибридизации in situ или ПЦР), но они обнаруживаются в ткани мозга и у здоровых людей. Около 80-90% людей среднего возраста имеют антитела к вирусу JC. Он может находиться в мозге или других тканях в латентном состоянии и реактивироваться при ослаблении иммунитета. С другой стороны, возможно развитие прогрессирующей многоочаговой лейкоэнцефалопатии у лиц с ослабленным иммунитетом при первом контакте с вирусом; об этом свидетельствует тот факт, что 10-20% больных на момент установления диагноза серонегативны.
Новые данные в этом отношении могут быть получены при широком применении ПЦР.
Лечение Прогрессирующей многоочаговой лейкоэнцефалопатии:
Общее согласие относительно терапии прогрессирующей многоочаговой лейкоэнцефалопатии пока еще не достигнуто.
Появлялись отдельные сообщения о стабилизации и даже улучшении состояния при лечении цитарабином в/в или интратекально в комбинации с интерфероном а либо без него. Однако проведенное Национальным институтом здоровья кооперированное испытание не подтвердило эффективности цитарабина в сочетании с антиретровирусными препаратами (по сравнению с лечением только антиретровирусными препаратами) при прогрессирующей мультифокальной лейкоэнцефалопатии на фоне ВИЧ-инфекции.
Цидофовир, обладающей анти-JCV активностью in vitro, является наиболее эффективной терапией полиомавирусной болезни у мышей. Несколько сообщений предположили его потенциальную терапевтическую выгоду, принимая во внимание, что другие сообщения не показали клинической эффективности.
Поскольку прогрессирующая многоочаговая лейкоэнцефалопатия скорее является последствием реактивации JCV, чем острой инфекции, в идеале, лекарственное средство должно предотвращать повторную инфекцию глиальных клеток. Недавно, Atwood с коллегами продемонстрировали, что JCV использует серотониновый рецептор 5HT2A, чтобы инфицировать глиальные клетки человека. Антидепрессант миртазапин, который является антагонистом 5HT2A, способен пересекать гематоэнцефалический барьер, связывать существенное количество рецепторов 5HT2A и блокировать репликацию JCV in vitro.
К каким докторам следует обращаться если у Вас Прогрессирующая многоочаговая лейкоэнцефалопатия:
Лейкопатия у детей что это
Установление причины острой перинатальной гипоксии у детей вызывает большие трудности [1], вследствие которых в детском возрасте в 20-30 % случаев проходят под другими ошибочными диагнозами [3, 4].
Перинатальная гипоксия, повреждая цито-хемо-ангио-архитектонику нервной системы, приводит к полиорганным нарушениям, влияющим на адаптацию организма, степень тяжести и прогноз течения заболевания [1, 2].
Применяемые в клинической практике методы лечения постгипоксических изменений головного мозга у новорожденных, без учета анатомо-физиологических, возрастных особенностей детского организма.
Цель исследования – изучение клинических особенностей последствии постгипоксических изменений головного мозга у новорожденных.
Материалы и методы исследования
Методом ультразвуковой диагностики изучены нейросонографические признаки перинатальной постгипоксической энцефалопатии (ППЭ), выявлены клинические особенности постгипоксических повреждений головного мозга у новорожденных.
Изучены клинические особенности и результаты обследования головного мозга у 240 новорожденных с постгипоксическими повреждениями головного мозга.
Данная патология требует помимо клинико-неврологического обследования, эхоэнцефалографии, нейросонографии, исчерпывающих методик исследования: компьютерной томографии, магнитно-резонансной томографии, электроэнцефалографии, реоэнцефалографии, допплеросонографии, церебральной ангиографии.
В клинической практике используется адаптированная Международная Классификация Болезней X пересмотра, 2000 г.
Всем детям проведен дифференцированный комплекс консервативно-восстановительной терапии, адаптированный к особенностям возраста ребенка и нюансам морфологического субстрата в остром и реабилитационном периодах.
Результаты исследования и их обсуждение
Среди 240 новорожденных по срокам гестации преобладали доношенные дети 132 (55 %), недоношенные дети составили 108 (45 %). Изучение течения беременности выявило в 100 % случаев наличие патологического фактора – в 15 % случаев установлена патология плода: хроническая фетоплацентарная недостаточность, маловодие, в 85 % – патология матери: анемия, острые вирусные заболевания, гипертония, хронические заболевания.
Хроническая гипоксия плода, выявлена у 40 % беременных женщин. Среди новорожденных: 65 % дети (6-8 баллов по шкале Апгар) – в состоянии легкой степени тяжести асфиксии, дети средней степени тяжести и тяжелые составили соответственно 35 %.
Больные поступали в клинику в сроки от 1 часа до 9 суток от начала заболевания. До 60 % больных поступили из непрофильных клиник – обычных инфекционных больниц, после консультации невропатологов. Причиной поздней диагностики, является недостаточная осведомленность врачебного персонала об постгипоксических изменений головного мозга у новорожденных, сложность диагностики и необходимость дифференцировки с целой группой различных состояний.
У большинства детей в кругу семьи родственники страдали разнообразными цереброваскулярными заболеваниями и переносили инсульты головного мозга. У детей старшего возраста отмечались фоновые заболевания неврологического характера с элементами метеозависимости, протекавшие с обширной группой субъективных жалоб, эпизодами транзиторных нарушений мозгового кровообращения в прединсультном периоде.
При нейросонографических исследовании выявлены:
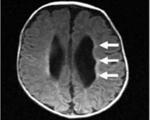
– перивентрикулярные кровоизлияния (ПВК) – 96 (40 %), с дилятацией желудочковой системы (гидроцефалией) – 48 (20 %), с ишемией подкорковых ядер – 24 (10 %);
– диффузные изменения мозговой ткани: отек мозговой паренхимы (36) и перивентрикулярная (субкортикальной) ишемия мозга (70).
Особенностью при УЗИ головного мозга острого периода ППЭ у 240 новорожденных являлось преобладание перивентрикулярной ишемии мозговой ткани (преимущественно у недоношенных новорожденных), с внутрижелудочковыми кровоизлияниями (преимущественно у доношенных новорожденных) и с отеком мозговой ткани (преимущественно у доношенных детей). Перивентрикулярная ишемия мозговой ткани – признак функциональной незрелости мозга [3,4] выявлялась и у недоношенных новорожденных, и у доношенных детей (15 %), что является проявлением нарушения мозгового кровообращения.
Отечность и ишемия мозговой ткани у детей с перенесенной гипоксией головного мозга, впервые появлялась именно в течение нескольких суток жизни.
Этиологическими факторами перинатальных поражений нервной системы у новорожденных явились: асфиксия у 75 % детей, у 10 % – инфекции, 8 % – эндокринные воздействия и 7 % – травма.
В острый период перинатальных поражений нервной системы у новорожденных чаще всего встречались следующие клинические синдромы:
– с повышенной нейрорефлекторной возбудимостью – 70 детей из 206 (34 %),
– в 2 раза реже встречались дети с синдромом общего угнетения – 17,5 %,
– в 7 раз реже – судорожный синдром (4,8 %).
У детей с церебральной ишемией в клинике преобладали синдромы возбуждения ЦНС, признаки внутричерепной гипертензии и угнетения ЦНС.
Среди новорожденных с внутричерепными кровоизлияниями в остром периоде ППЭ преобладали дети с ВЖК 2 степени (перивентрикулярными кровоизлияниями 2-3 степени) с доминированием в клинике признаков внутричерепной гипертензии, в том числе у 30 % пациентов – с развитием гидроцефального синдрома (у недоношенных новорожденных), а у 25 % детей – с симптомами угнетения ЦНС (у доношенных новорожденных).
У 25 % детей с ВЖК 2 степени выявлялся судорожный синдром (только у доношенных новорожденных).
Факт выявления клинических синдромов у части детей с отсутствием ультразвуковой патологии головного мозга во всех периодах перинатальной постгипоксической энцефалопатии (преимущественно в возрасте 1-3 месяца жизни), указывает на наличие нарушений мозговой гемодинамики как у новорожденных, подтвергшихся гипоксии, так и в более позднем возрасте.
При соотношении детей с ПВК различной степени тяжести встречались легкие формы патологии – 55 % детей с ПВК 1-2 степени.
Сочетанные формы патологии (ПВК и ишемии подкорковых ядер, гидроцефалии и ишемии подкорковых ядер) впервые выявлялся у детей 1-3 месяцев жизни (55 %), у 90 (37,5 %) детей – данная патология появлялась в возрасте от 4 до 9 месяцев, реже 18 (7,5 %) – в возрасте 6-30 дней.
Изучение обратного развития нейросонографических признаков ППЭ позволили установить, что компенсация патологии при образовании ее в остром периоде ППЭ (1 мес. жизни) составляет лишь 35 %, в раннем восстановительном периоде (1-3 мес. жизни) увеличивается почти в два раза – 75 %, а в позднем восстановительном периоде (4 мес.-З года жизни) сокращается до 31,4 %. Из 240 новорожденных с различными повреждениями нервной системы у 70 (27,5 %) компенсации патологии в дальнейшем не произошло.
Нейросонография является ценным методом диагностики постгипоксической патологии головного мозга у новорожденных, позволяющим вследствии неинвазивности, отсутствию лучевой нагрузки, возможности многократного исследования (мониторирование), не требуют специальной подготовки пациентов, выявлять сроки появления нейросонографических признаков ППЭ: ПВК, гидроцефалию, ишемические изменения мозговой ткани и подкорковых ядер, отечность мозговой паренхимы и их сочетания.
Профилактика перинатальной энцефалопатии заключается в возможной минимизации факторов риска при беременности, прежде всего в отказе матери от употребления потенциально опасных для ребенка веществ.
При соблюдении этих условий исключить перинатальную энцефалопатию, полностью нельзя. Своевременное лечение гарантирует полное выздоровление 20-30 % детей.
У остальных возможна незначительная мозговая дисфункция, вегето-сосудистая дистония, временная генерализация гидроцефального синдрома. В случае запоздалого диагностирования и лечебных процедур не исключены тяжелые исходы (ДЦП, эпилепсия, стойкое поражение ЦНС и прочие заболевания мозга), требующие очень серьезного долгого и дорогостоящего лечения [5].
Эти данные позволяет неонатологам, невропатологам и педиатрам более точно оценивать динамику постгипоксических изменений головного мозга у новорожденных и детей первых трех лет жизни, компенсаторные возможности и адаптационные резервы детского организма.
Прогрессирующая сосудистая лейкоэнцефалопатия (I67.3)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Примечание. Из данной подрубрики исключена «Субкортикальная сосудистая деменция (F01.2).
Этиология и патогенез
Описаны семейные случаи заболевания с началом до 40 лет, без артериальной гипертензии. Более чем в 80% случаев болезнь дебютирует в возрастном промежутке от 50 до 70 лет.
Страдают также и более крупные артерии диаметром до 500 мкм, и все микроциркуляторное русло.
Эпидемиология
Болезнь (энцефалопатия) Бинсвангера встречается довольно часто. По данным клинико-компьютерно-томографического исследования, она составляет около 1/3 всех случаев сосудистой деменции.
Возраст. Более чем в 80% случаев болезнь дебютирует в возрастном промежутке от 50 до 70 лет.
Факторы и группы риска
Клиническая картина
Cимптомы, течение
Клиническая картина болезни Бинсвангера характеризуется прогрессирующими когнитивными нарушениями, нарушениями функции ходьбы и тазовыми расстройствами. На последнем этапе заболевания клиническая картина представлена слабоумием, полной беспомощностью больных (не ходят, не обслуживают себя, не контролируют функцию тазовых органов).
Картина слабоумия может значительно варьироваться по степени тяжести и особенностям симптоматики.
В целом для болезни Бинсвангера характерно неуклонно-прогредиентное течение, но возможны и периоды длительной стабилизации. Причинами слабоумия в этих случаях считаются разобщение корково-подкорковых связей, наступающее в результате поражения подкоркового белого вещества, а также дисфункция базальных ганглиев и таламуса.
Изменение походки на начальных стадиях болезни Бинсвангера заключаются в следующем: походка шаркающая или семенящая, мелкими шажками, «магнитная» (ноги как бы прилипают к полу). На следующей стадии она становится «осторожной», увеличивается опорная площадь стояния, распадается автоматизм ходьбы (диспраксия или апраксия ходьбы) и все более включается произвольный контроль за ходьбой – походка такого больного напоминает походку здорового человека, оказавшегося на ледяном поле.
Основные характеристики лобной диспраксии ходьбы, связанной с дезавтоматизацией ходьбы, следующие:
• замедление ходьбы;
• укорочение шага;
• затруднение в начале ходьбы (инициация ходьбы);
• неустойчивость при поворотах (постуральная дисфункция);
• расширение базы опоры;
• снижение длины шагов.
Для нарушения тазовых функций при болезни Бинсвангера характерно развитие «гиперактивности» («гиперрефлекторности») мочевого пузыря, что проявляется повышенной сократительной активностью детрузора. Гиперактивность мочевого пузыря характеризуется: учащенным мочеиспусканием; императивными позывами на мочеиспускание, которые по мере прогрессирования заболевания переходят в случаи императивного недержания мочи.
Двигательные нарушения могут также характеризоваться (помимо нарушения ходьбы): другой экстрапирамидной патологией в виде паркинсоноподобной симптоматики, а также легкими или умеренными центральными моно- или гемипарезами, часто быстро регрессирующими (регресс очаговой двигательной симптоматики становится неполным по мере прогрессирования заболевания). Характерен псевдобульбарный синдром.
Эмоционально-волевые нарушения представлены астеническим, неврозоподобным или астено-депрессивным синдром. По мере прогрессирования заболевания на первый план выходят не астения и депрессия, а нарастание эмоционального оскудения, сужение круга интересов и спонтанности.
В критериях подчеркивается, что у пациента должны отсутствовать множественные или двухсторонние корковые очаги по данным КТ и МРТ, и тяжелая деменция.
Диагностика
Осложнения
Транзиторные ишемические атаки (ТИА, преходящие нарушения мозгового кровообращения) характеризуются кратковременными симптомами локальной ишемии мозга.
ТИА обычно связаны с гемодинамической недостаточностью, возникающей при выраженном атеросклеротическом стенозе сонных или позвоночных артерий в их дистальных ветвях или артериальной эмболией.
В большинстве случаев транзиторные ишемические атаки разрешаются в течение 5-20 минут.
Клиническое значение ТИА состоит в том, что они служат предвестниками не только инсульта, но и инфаркта миокарда и представляют собой сигналы опасности, требующие от врача быстрых действий. Больных с ТИА необходимо госпитализировать в инсультное отделение для наблюдения, всестороннего обследования и проведения профилактики ишемического инсульта.
ТИА часто проявляются при снижении АД, физической нагрузке, натуживании, приеме пищи; при этом очаговые неврологические симптомы нередко проявляются на фоне предобморочного состояния, иногда по нескольку раз в день. Больные часто жалуются на предобморочное состояние, головокружение, нарушения зрения, слабость в конечностях, тошноту и рвоту, нарушения памяти, шум в ушах, нарушения чувствительности, неожиданную утрату равновесия.
Ишемический инсульт возникает в результате критического снижения или прекращения кровоснабжения участка мозга с последующим развитием очага некроза мозговой ткани.
Внутримозговое кровоизлияние возникает в результате разрыва патологически измененных сосудов мозга, приводящего к кровоизлияниям.
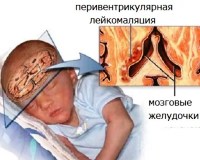
Перивентрикулярная лейкомаляция
Перивентрикулярная лейкомаляция — это гипоксически-ишемическая энцефалопатия, характеризующаяся поражением белого вещества головного мозга новорожденных. Состояние чаще возникает у недоношенных, провоцируется патологиями течения беременности и родов, неадекватной респираторной поддержкой в постнатальном периоде. Заболевание проявляется мышечной дистонией, судорожным синдромом, задержкой психомоторного развития. Для диагностики болезни назначается КТ или МРТ мозга, ЭЭГ, допплерография церебральных сосудов. Лечение лейкомаляции включает медикаменты (нейропротекторы, инфузионные растворы, антиконвульсанты), индивидуальный комплекс физиотерапии, массажа, ЛФК.
МКБ-10
Общие сведения
По разным данным, перивентрикулярная лейкомаляция (ПВЛ) встречается у 4,8-9% младенцев, причем среди больных преобладают недоношенные новорожденные (78%). Наибольшая вероятность появления болезни у детей, родившихся на сроке 27-32 недели. По данным аутопсии умерших младенцев, признаки ПВЛ регистрируются чаще — у 50-75%. Заболевание имеет большую значимость в детской неврологии, поскольку может вызывать тяжелые отдаленные последствия, считается ведущей причиной ДЦП.
Причины
Основной этиологический фактор перивентрикулярной лейкомаляции — внутриутробная гипоксия, которая выступает следствием осложнений протекания беременности, материнских факторов риска либо негативного экзогенного воздействия. Также состояние может возникать при перинатальной гипоксии, которая развивается во время родов, в первые дни жизни младенца (при синдроме дыхательных расстройств, врожденных аномалиях сердца и легких, неонатальном сепсисе).
В группе риска наибольшую по численности категорию составляют недоношенные младенцы. Зачастую лейкомаляция выявляется у детей, которое были рождены от матерей с сахарным диабетом, хронической анемией, гипертиреозом либо страдавших от преэклампсии и эклампсии. Состояние возникает при выполнении экстренного кесарева сечения, неадекватном родовспоможении (травмирующие акушерские пособия). Высокая частота лейкомаляции (до 22%) отмечается при сочетании длительного безводного периода с хориоамнионитом у матери.
Патогенез
Поражение головного мозга связано со снижением кровотока в церебральных сосудах, недостаточным поступлением кислорода и питательных ингредиентов. Перивентрикулярная область наиболее чувствительна к этим изменениям, что обусловлено особенностями кровоснабжения, несовершенством процессов ауторегуляции, нейроонтогенетическими особенностями головного мозга у младенцев.
Недоношенные намного чаще страдают лейкомаляцией, поскольку у них на фоне гипоксии не увеличивается церебральный кровоток, как это бывает у рожденных в срок младенцев. В результате этого резко уменьшается кровоток в зоне между вентрикулофугальными и вентрикулопетальными артериями, быстро формируется гиперкапния и ацидоз. Расстройства микроциркуляции проявляются стазом, тромбозом, вне- и внутриклеточным отеком белого вещества.
При перивентрикулярной лейкомаляции в конечном итоге происходит некроз отельных участков мозгового вещества, образование кист, избыточное накопление медиаторов воспаления. Поскольку на 28-32 неделях в норме происходит активная миелинизация белого вещества, а в условиях гипоксии этот процесс не может происходить, недоношенные новорожденные впоследствии имеют серьезные органические поражения ЦНС.
Формирование ПВЛ возможно не только при недостатке кислорода, но и при гипероксии — при проведении ИВЛ, оказании других видов респираторной поддержки. При избыточном поступлении кислорода повышается рН крови в мозговой ткани, что вызывает рефлекторный спазм сосудов, затруднение венозного оттока. Также кислород активизирует процессы свободнорадикального церебрального повреждения.
Симптомы
Как правило, перивентрикулярная лейкомаляция формируется антенатально или на протяжении первых часов после рождения ребенка, поэтому начальные признаки заметны уже в родильном доме, особенно если младенец рожден недоношенным. При обширном повреждении белого вещества происходят нарушения сознания по типу летаргии или комы, однако возможна обратная симптоматика — повышенная возбудимость, оживление безусловных рефлексов, судорожный синдром.
Типичным проявлением патологии являются изменения тонуса мышц. На первом месяце жизни преобладает слабость мускулатуры ног в сочетании с нормальным формированием мышц верхних конечностей. У недоношенных новорожденных часто отмечается тотальная мышечная гипотония. Такие нарушения сохраняются в среднем до 6 месяцев, после чего они сменяются спастическими явлениями — повышением тонуса мускулатуры нижних конечностей, оживлением коленных рефлексов.
Течение перивентрикулярной лейкомаляции имеет неравномерный характер: периоды обострения симптоматики сменяются «мнимым благополучием», когда ребенок развивается относительно нормально. Затем происходит задержка формирования моторных навыков, развиваются различные сенсорные нарушения, дизартрия. 66% детей, особенно недоношенные, страдают от снижения остроты зрения вплоть до полной слепоты вследствие атрофии зрительных нервов.
Осложнения
Перивентрикулярные поражения белого вещества — крайне тяжелое состояние. Недоношенные дети с ПВЛ умирают в 50% случаев еще в период новорожденности, у выживших обычно наступает инвалидность с полной дезадаптацией. Пациенты с длительно сохраняющимся судорожными приступами в 85% случаев имеют грубую задержку психомоторного развития. У перенесших ПВЛ в будущем в 1,5 раза чаще встречаются фебрильные судороги, в 27 раз чаще формируется эпилепсия.
При множественных кистах в перивентрикулярной зоне у 80-97% больных (чаще — недоношенных) возникает детский церебральный паралич (ДЦП), который сопровождается глубоким психоречевым отставанием. Развитие заболевания связано с повреждением центральной части внутренней капсулы, средне- и заднелобных сегментов белого вещества полушарий. Также лейкомаляция вызывает микроцефалию (у 42% пациентов), нейросенсорную тугоухость (у 28% больных).
Диагностика
Постановка правильного диагноза в неонатальном периоде затруднена, что объясняется полиморфностью клинической картины, отсутствием патогномоничных симптомов. При физикальном осмотре выявляется асимметрия мышечного тонуса, патологическое усиление рефлексов, на более поздних этапах — спастическая диплегия. Особую настороженность следует проявлять в отношении детей, родившихся недоношенными. В план обследования новорожденных с подозрением на ПВЛ включаются:
Лечение перивентрикулярной лейкомаляции
Терапия перивентрикулярной лейкомаляции представляет собой сложную задачу, учитывая необратимый характер повреждений белого вещества, частое сочетание гипоксически-ишемической энцефалопатии с поражениями других систем организма у недоношенных. Медикаментозное лечение подбирается на основе ведущих синдромов болезни и включает следующие группы препаратов:
Учитывая высокую частоту резидуальных неврологических явлений, рекомендовано восстановительное лечение. Чтобы улучшить двигательные способности, назначаются курсы массажа, физиотерапии, лечебной физкультуры. Для развития речевых навыков требуются коррекционные занятия у логопеда, дефектолога. Детям с поражением органов чувств нужна помощь тифлопедагога, сурдопедагога. Пациентам с ДЦП необходимы специальные ходунки, костыли, инвалидные коляски.
Прогноз и профилактика
В большинстве случаев лейкомаляция отличается неблагоприятным течением, отличается высоким уровнем смертности во время младенчества. Для выживших детей прогноз напрямую зависит от тяжести органического дефекта перивентрикулярной зоны, своевременности и полноты проведенного лечения. Профилактика ПВЛ включает рациональное ведение беременности, предупреждение родового травматизма, соблюдение протоколов при респираторной поддержке в роддоме, усиленный контроль за развитием недоношенных.