Лимфодинамика движение чем заканчивается патология
Хроническая ЛИМФОВЕНОЗНАЯ НЕДОСТАТОЧНОСТЬ нижних конечностей и лимфосцинтиграфия
Отеки нижних конечностей наблюдаются при посттромбофлебитическом синдроме у 80-100% больных в зависимости от формы заболевания. Согласно классификации В. С. Савельева, различают отечную, отечно-варикозную, варикозно-трофическую или трофическу
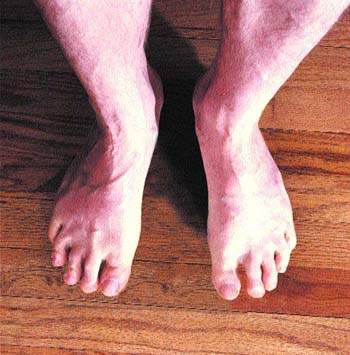 |
Отеки нижних конечностей наблюдаются при посттромбофлебитическом синдроме у 80-100% больных в зависимости от формы заболевания. Согласно классификации В. С. Савельева, различают отечную, отечно-варикозную, варикозно-трофическую или трофическую формы заболевания. Главное внимание при изучении отеков у больных с посттромбофлебитическим синдромом уделялось венозной гипертензии нижних конечностей. С этой позиции рассматривались клапанная недостаточность вен [3], диффузия воды и протеинов в тканях на микроциркуляторном уровне [1, 8], венозная гипертензионная микроангиопатия [14].
Нарушения лимфооттока в нижних конечностях при тромбофлебитическом синдроме изучены в меньшей степени. Основные работы выполнены с помощью рентгенолимфографии. Показано, что на лимфограмме у больного с этим синдромом наблюдаются расширение или, наоборот, сужение и извитость магистральных лимфатических сосудов, плохое контрастирование или отсутствие клапанного аппарата в лимфатических сосудах, их сегментарная облитерация, выраженная сеть патологических коллатералей, множественные анастомозы между лимфатическими сосудами, расширенная сеть лимфатических сосудов кожи, депонирование контрастного вещества с образованием лакун, особенно в области язв и тромбов, регургитация лимфы по лимфатическим сосудам, увеличение или, наоборот, уменьшение размеров паховых лимфатических узлов [2, 4, 9]. Выявлено также замедление эвакуации и изменение характера ресорбции радионуклидных препаратов на стопе.
В настоящей работе представлены результаты дальнейшего изучения основных форм отеков при посттромбофлебитическом синдроме. Наряду с изменениями в венах исследовались нарушения лимфооттока из нижних конечностей с помощью радионуклидной лимфосцинтиграфии.
Всего обследовано 218 больных (190 женщин и 28 мужчин) в возрасте 21 — 75 лет.
Стойкий лимфостаз нижних конечностей имел место у 50% больных с посттромбофлебитическим синдромом, как правило, при отечной и отечно-варикозной формах заболевания. При варикозно-трофической форме синдрома выраженный лимфостаз голеней и стоп встречался крайне редко. Лимфостаза нижних конечностей у больных трофической формой синдрома не наблюдалось. Все больные были прооперированы. У всех установлена реканализованная форма посттромбофлебитического синдрома.
Изучение состояния просвета вен и состоятельности клапанного аппарата поверхностных и глубоких вен нижних конечностей мы выполняли с помощью ультразвукового исследования, используя цветное допплеровское картирование потока крови и анализ спектра допплеровского сдвига частот.
Лимфоотток из нижних конечностей изучался с помощью функциональной радионуклидной лимфосцинтиграфии. Большинство авторов [15, 16] применяли этот метод для обследования больных с лимфедемой нижних конечностей. Лимфостазы при заболеваниях вен нижних конечностей изучены недостаточно.
Метод функциональной радионуклидной лимфосцинтиграфии основан на способности меченых коллоидных частиц после их подкожного введения в ткани поступать в лимфатические сосуды и узлы, которые являются региональными для зон инъекции радиофармакологического препарата. Для исследования применяли препарат лимфоцис, меченый 99m Tc (фирмы “Sorin”, Франция) в количестве 185 МБк в объеме 0,2-0,5 мл. Исследования проводили в гамма-камере. При положении больного лежа на спине радиофармакологический препарат вводили подкожно в первые межпальцевые промежутки стоп. В течение 5 мин после введения препарата больной находился в состоянии мышечного покоя. В это время наблюдали прохождение препарата по лимфатической системе голеней. Через 5 мин проводили трехминутную нагрузку (сгибание-разгибание стоп). После физической нагрузки у части больных отмечалось изменение характера продвижения радиофармакологического препарата на уровне коленных суставов и бедер. После достижения препаратом уровня паховых складок пациенту предлагали походить в течение 40 мин, после чего делали статические снимки области голеней, бедер, таза, печени.
Полученные данные свидетельствуют о том, что при отечных формах посттромбофлебитического синдрома отеки далеко не у всех больных можно объяснить регургитацией крови по магистральным венам, как считалось ранее [4].
При анализе результатов функциональной радионуклидной сцинтиграфии использовались следующие показатели.
1. Тип движения радиофармакологического препарата на сцинтиграмме. При этом различали: магистральное движение по лимфатическим коллекторам (у 25% больных); диффузное движение препарата по интерстицию мягких тканей (15%); смешанное заполнение, при котором отмечали продвижение препарата по магистральным лимфатическим сосудам и диффузную его эвакуацию (60%).
Диффузное движение радиофармакологического препарата на функциональной радионуклидной лимфосцинтиграмме — значимый симптом для определения отека мягких тканей. Он может быть использован, в частности, для диагностики скрытых отеков (латентная стадия лимфостаза), когда клинические данные вызывают сомнение.
2. Скорость движения радиофармакологического препарата (визуализация лимфатических путей голеней по всей длине продолжается в среднем 10 — 15 мин).
3. Характер контрастирования при функциональной радионуклидной лимфосцинтиграфии паховых и подвздошных лимфатических узлов.
Увеличение лимфатических узлов, уменьшение или отсутствие их изображения давали информацию о морфологических изменениях лимфатической системы как на преимущественно пораженной, так и на относительно здоровой конечности.
Исследования показали, что патогенез отеков при выраженном лимфостазе у больных с отечными формами посттромбофлебитического синдрома не может быть полностью объяснен рефлюксом крови по магистральным венам нижних конечностей. Так, у 70 из 81 больного с отечной формой заболевания при одностороннем поражении недостаточность клапанов глубоких вен была выражена в одинаковой степени как на больной, так и на относительно здоровой конечности. При отечно-варикозной форме синдрома недостаточность клапанов глубоких вен была одинаковой на больной и на здоровой конечностях у 38 из 77 больных, а при варикозно-трофической форме у 40 из 60. Следовательно, при отечных формах посттромбофлебитического синдрома рефлюкс крови по магистральным венам далеко не во всех случаях играет ведущую роль при стойких лимфатических отеках. Это нашло подтверждение и в других исследованиях [11]. С помощью ретроградной подколенной флебографии среди больных, страдавших обычным варикозным расширением вен, авторы выявили рефлюкс в системе подколенной вены у 71,1%, из них резко выраженный у 12%, причем лимфостаз у этих больных отсутствовал. Аналогичная закономерность наблюдается также у многих больных с варикозно-трофической формой посттромбофлебитического синдрома, у которых, несмотря на грубые анатомические изменения клапанного аппарата магистральных вен, выраженный лимфостаз нижних конечностей отсутствует.
Основное значение в патогенезе лимфостаза принадлежит нарушению лимфооттока, которое при посттромбофлебитическом синдроме осложняет заболевания периферических вен [10].
Из 218 больных лишь у 44 сохранился естественный для человека чисто магистральный тип движения радиофармакологического препарата, причем во всех случаях контрастирование лимфатических сосудов и регионарных лимфатических узлов было усилено вследствие хронического динамического застоя лимфы. У 121 больного наряду с движением препарата по магистральным лимфатическим путям отмечалось его диффузное перемещение по интерстицию. Предполагается, что диффузное заполнение происходит вследствие распространения радиофармакологического препарата по расширенной сети мельчайших лимфатических сосудов. Не исключено также прямое диффундирование радиофармакологического препарата при отеках по интерстицию из депо препарата на стопе (эффект растекания чернильного пятна по промокательной бумаге).
Наряду с характером продвижения радиофармакологического препарата на голенях, важное значение имела также скорость его распространения в проксимальном направлении. Оказалось, что этот параметр имел определенное прогностическое значение. У 62 больных с ускоренным движением препарата (3-6 мин) после операции на венах с лимфодренирующим вмешательством отмечался стойкий хороший результат. Рецидивов отека у этих больных не было на протяжении всего периода наблюдения (3-4 лет). Наоборот, при замедленной скорости движения препарата (20 мин и более) наблюдался хороший эффект в ближайшем послеоперационном периоде и рецидив отека в отдаленные сроки.
У больных со средней скоростью движения радиофармакологического препарата по голени (10-15 мин) непосредственные результаты после операции не были столь отчетливы, как у пациентов с ускоренным движением препарата. У 56% больных были отмечены рецидивы отеков разной интенсивности. Сложилось предварительное мнение, что скорость движения препарата определяется состоянием насосной функции лимфатических капилляров больной конечности.
Наиболее важным показателем анатомической проходимости путей лимфооттока было изображение подвздошных лимфатических узлов. У всех больных контрастирование подвздошных лимфатических узлов преимущественно на больной конечности было в разной степени снижено по сравнению с относительно здоровой конечностью. У 50 больных контрастирование подвздошных лимфатических узлов на стороне больной конечности отсутствовало, а на стороне здоровой конечности было удовлетворительным. Менее показательной оказалась функциональная радионуклидная лимфосцинтиграфия паховых лимфатических узлов. Из 218 больных у 143 включение радиофармакологического препарата в паховые лимфатические узлы на стороне поражения было снижено по сравнению со здоровой стороной. У 26 больных накопление препарата в паховых лимфатических узлах на стороне больной конечности было интенсивнее, чем на здоровой. У 49 больных паховые лимфатические узлы контрастировались симметрично на больной и здоровой стороне.
Клинически отеки классифицировали как проходящие, частично проходящие и не проходящие. При проходящих отеках избыточная величина окружности на уровне лодыжек по сравнению с относительно здоровой конечностью не превышала 1,5–2,5 см. При этой форме отеки возникали к концу рабочего дня и за ночь исчезали. Отечная жидкость у таких больных содержала относительно мало белка, по нашим данным, не более 15-20 г/л, что соответствует норме содержания белка в лимфе нижних конечностей [12].
Проходящие отеки хорошо поддавались лечению с помощью регулярной эластичной компрессии (бинты, чулки, колготы) и после операции на венах уменьшались, у большинства больных исчезая полностью. Проходящие отеки наблюдались преимущественно при варикозно-трофической форме посттромбофлебитического синдрома. Больные с проходящими, то есть преимущественно флебогенными, отеками в данное исследование не вошли. Частично проходящие отеки характерны для отечной и отечно-варикозной форм заболевания. При варикозно-трофической форме отеки этого типа встречались редко. У таких больных избыточная окружность голени в дистальных отделах достигала 4-5 см и более. Достаточно длительный постельный режим (до трех суток и более) приводил к частичному уменьшению отека: рассасывалась лишь так называемая “подвижная” водянистая часть отека. При этом периметр голени в относительно легких случаях уменьшался на 50-60%, в более тяжелых лишь на 10-15%. Основная, “стойкая”, не проходящая часть отека оставалась, несмотря на соблюдение больными постельного режима, компрессионную терапию и наружное дренирование. Содержание белка в тканевой жидкости после рассасывания проходящей части отека составляло 32-35 г/л, что соответствует данным литературы [12, 13].
Полученные результаты подтвердили, что при посттромбофлебитическом синдроме частично проходящие отеки образуются не только из-за венозной гипертензии, но и в результате затруднения лимфооттока, вызванного нарушением проходимости магистральных лимфатических сосудов и регионарных лимфатических узлов. Лимфостаз все более осложняет венозную недостаточность при посттромбофлебитическом синдроме нижних конечностей. Чем больше содержится в тканевой жидкости белка, тем более нарастает отек вследствие задержки воды в мягких тканях. При нарастании отека слабеет насосная функция лимфатических капилляров, одновременно снижается резорбционная способность кровеносных капилляров [17]. Отеки постепенно приобретают стойкий характер. Декомпенсация оттока тканевой жидкости развивается на протяжении ряда лет, иногда десятилетий.
При несвоевременном лечении отеки становятся постоянными. Клинически отеки приобретают черты лимфедемы (слоновости). У таких больных во время операций на конечностях отмечали гипертрофию подкожного жирового слоя (толщина его до 6-7 см). Избыточный жир располагался циркулярно, главным образом в дистальных сегментах голени. Жировые дольки патологически увеличивались до 3-3,5 см в диаметре.
В особенно тяжелых случаях в области лодыжечного сегмента наблюдали прогрессирующий фиброз межтканевых перегородок; у таких больных жировая ткань приобретала мелкодольчатое строение и крошилась, когда до нее дотрагивались. При отсутствии своевременного лечения к 50-60 годам у больных возникали тяжелые инвалидизирующие осложнения: грубо нарушался внешний вид голени и стопы, у некоторых пациентов возникала чрезкожная лимфорея, хронический дерматоз, вспышки рожистого воспаления, на голени появлялись обширные глубокие трофические язвы.
При хирургическом лечении отечных форм посттромбофлебитического синдрома одновременно производили операции на венах и лимфодренирующее вмешательство: формирование лимфовенозных анастомозов, фенестрацию фасции голени, наружное дренирование и липосакцию.
Итак, при посттромбофлебитическом синдроме имеют место три формы отека нижних конечностей: проходящие, частично проходящие и не проходящие. Проходящие отеки возникают в результате флебостаза. Они исчезают после операций на венах и последующей консервативной терапии. Причиной частично проходящих и непроходящих отеков является венозная недостаточность, осложненная нарастающим лимфостазом в результате нарушения проходимости магистральных лимфатических путей, паховых и, особенно, подвздошных лимфатических узлов, угнетения насосной функции лимфатических капилляров.
Полученные с помощью лимфосцинтиграфии данные помогают уточнить диагноз лимфостаза, установить уровень и протяженность блока лимфатической системы, степень нарушения ее функции, определить показания к проведению лимфодренирующих вмешательств при операциях на венах, выбрать наиболее целесообразный способ дренирования лимфы и прогнозировать результаты хирургического лечения.
Лимфодинамика движение чем заканчивается патология
3. Методы исследования лимфы:
— исследование биохимического состава лимфы.
4. Диагностика морфофункциональных нарушений в лимфатической системе:
5. Методы исследования лимфатических узлов:
— изучение моторной функции лимфатического узла;
Согласно другой классификации [3], имеющей прикладное значение для практической медицины, следует выделять общеклинические и специальные методы диагностики. Общеклинические методы исследования лимфатического русла нижних конечностей до сих пор имеют важнейшее значение для судьбы пациента. Именно после обследования с применением этих методов, врач любой специальности должен заподозрить нарушения лимфооттока и направить пациента к специалисту для проведения специального обследования. Основу общеклинических методов диагностики составляют анамнез, объективное исследование, антропометрия и лабораторные исследования.
Значение специальных методов исследования с учетом особенностей строения и функции лимфатической системы особенно велико [3, 6]. Специальные методы необходимы для уточнения диагноза, топической диагностики нарушений лимфооттока, оценки состояния лимфатических сосудов и узлов, определения показаний к различным способам лечения, в том числе к тому или иному виду хирургических вмешательств [2, 3, 7, 8].
Все специальные методы можно разделить на неинвазивные (дуплексное сканирование, компьютерная томография, реовазография и пр.) и инвазивные (лимфо- и флебография, лимфосцинтиграфия, биопсия). Знание этих методов имеет принципиальное значение для определения последовательности их применения. Начинать обследование нужно с помощью неинвазивных методик, а инвазивные применять лишь в целях уточнения принципиальных для выбора тактики лечения особенностей течения заболевания [2, 3]. При обследовании пациентов с нарушением периферического лимфообращения необходимо изучение периферического кровообращения и центральной гемодинамики, нарушений водно-электролитного обмена, функции почек, состояния органов малого таза. Только такой комплексный подход к диагностике позволит правильно поставить диагноз и выбрать патогенетически обоснованную тактику лечения.
Специальные неинвазивные методы диагностики
Неинвазивные методы обследования, как правило, являются способами косвенной оценки лимфооттока. Эти методы используются для определения выраженности патологического процесса, явившегося причиной нарушений лимфодренажа в конечностях [6, 7]. Они не специфичны для лимфатической системы, однако их применение часто бывает необходимым для выбора адекватного лечения и оценки его эффективности.
Одним из простых способов оценки выраженности отека является измерение окружности конечности на ее различных уровнях. Следует использовать неэластичную рулетку с удерживаемой лентой. Измерения обычно проводятся для верхней конечности — на кисти, на уровне нижней, средней и верхней трети предплечья и плеча; для нижней конечности — на стопе, на верхней, нижней и средней трети бедра и голени. Известен вариант измерения окружности конечности через определенные интервалы, например 10 см [6, 9, 10].
Более сложным методом оценки отека является волюметрия — определение объема конечностей по количеству вытесненной жидкости с использованием градуированной емкости с водой, в которую погружается конечность. Объем конечности может определяться либо прямым измерением, либо взвешиванием перемещенной воды [11, 12]. Метод громоздкий, требует специального помещения, соответствующей емкости для воды в виде цилиндра. У пациентов с выраженными отеками, с ограниченной подвижностью конечности, воспалительными изменениями кожи применение этого способа становится проблематичным.
Объем конечности можно рассчитать математическим методом усеченных конусов или цилиндров [5, 6, 10]. Сущность способа заключается в измерении окружности конечности на разных уровнях с определенным интервалом в 2 или 3 см. Далее по определенной формуле рассчитывается объем сегмента конечности между соседними уровнями измерений. Для определения общего объема конечности необходимо сложить объемы всех сегментов. Точность этого способа зависит от соблюдения четких правил измерения лентой, что не всегда возможно при деформирующем отеке.
Современным способом измерения объема является оптико-электронная перометрия при помощи Pero-systems [12]. Данный аппарат представляет собой рамку, на двух сторонах которой расположены светоизлучающие диоды, а на противоположных сторонах — сенсорные датчики. Конечность пациента помещается в рамку, которая медленно на штативе перемещается вдоль конечности от дистального отдела до проксимального, а затем обратно. Полученная информация объемного и кругового изображения конечности проходит обработку компьютерной программой [12—14]. Высокая точность результатов перометрии позволяет применять ее не только в клинической практике, но и в подборе и изготовлении компрессионного трикотажа.
О выраженности отека и фиброза тканей конечности можно судить по данным тонометрии, позволяющей объективно оценить увеличение (уменьшение) тургора кожи и подкожной жировой клетчатки [15—17]. Метод основан на измерении механического усилия, развиваемого тканью при надавливании на нее металлического стержня с цилиндрической головкой, совершающей возвратно-поступательные погружения с частотой 0,06 Гц. Созданы различные варианты тонометров, позволяющих определять эластичность как поверхностных, так и глубоких тканей [18].
В определении состояния мягких тканей пораженной конечности оптимальными являются неинвазивные визуализационные методы. Они дают возможность наблюдать изменения тканей непосредственно, а не судить о выраженности патологического процесса по косвенным критериям [6]. К визуализационным методам относятся рентгенография, КТ, МРТ, ультрасонография.
Опыт ультразвукового сканирования конечностей демонстрирует высокую диагностическую ценность и достоверность метода в диагностике патоморфологических изменений мягких тканей конечности при развитии лимфедемы [2, 6, 8]. Метод позволяет определить толщину и увеличение эхогенности кожи, подкожной клетчатки, фасции по мере прогрессирования их фибросклеротических изменений, характер распределения отечной жидкости в конечности в виде образования полостей в подкожной клетчатке [19, 20]. Описана возможность дифференциальной диагностики лимфедемы и липедемы с помощью УЗИ мягких тканей конечности. Ультразвуковое сканирование дает возможность неинвазивно оценить поверхностно расположенные лимфатические узлы. С достаточной достоверностью можно определить форму узла, толщину и эхоструктуру коркового и медуллярного слоев, характер васкуляризации, наличие либо отсутствие экстракапсулярных изменений [6].
Исследование с помощью КТ с большей степенью визуализации позволяет оценить состояние и толщину различных слоев мягких тканей (кожи, подкожной клетчатки, фасции, мышц), распространение лимфы по длине конечности и в подфасциальные пространства, объективизировать степень отека, характер и локализацию фиброзных изменений в коже и подкожной клетчатке [2, 5, 7]. При этом можно получить абсолютные количественные данные о плотности тканей на любом уровне и участке конечности по шкале Хаунсфилда (HU). Особое значение имеет количественное определение степени уплотнения мягких тканей конечности. В норме показатель плотности подкожной жировой клетчатки по шкале Хаунсфилда варьирует от –150 до –50 HU. Сравнение данных этого показателя с результатами, полученными у пациентов с различными клиническими проявлениями лимфедемы, позволяет разработать количественные критерии, имеющие значение для уточнения стадии заболевания. Так, для I стадии заболевания характерными являются колебания показателя плотности мягких тканей в пределах от –140 до –110 HU. У пациентов со II стадией лимфедемы отмечается возрастание плотности подкожной клетчатки от –110 до –80 HU. При III стадии заболевания, которая клинически проявляется плотным постоянным отеком, показатель плотности варьирует от –80 до –50 HU. Это соответствует фиброзной перестройке мягких тканей приблизительно в объеме 60—90%. При IV стадии показатель плотности ниже –50 HU и у большинства пациентов имеет положительное значение, что свидетельствует о полном и выраженном замещении подкожной клетчатки грубой соединительной тканью [21].
МРТ включает возможности КТ, но бесспорным ее преимуществом является то, что изображение тканей можно получать в различных плоскостях (в том числе и в неортогоналъных), манипулируя ориентацией градиентов магнитного поля. Кроме того, МРТ дает более четкую и детализированную картину (отсутствует эффект визуального слияния структур и тканей, близких по плотности) и позволяет распознавать и оценивать степень и распространенность патологических изменений, поскольку основу МР-сигнала составляет именно сигнал от ядер водорода, основная масса которых в организме человека содержится в молекулах воды и жира [2, 6, 22, 23].
На Т1-взвешенном изображении (как и на Т2-взвешенном) подкожная жировая клетчатка визуализируется в виде достаточно ярких локусов. В сравнении с нормальной жировой тканью содержащие жидкость образования и отечная ткань на Т2-взвешенном изображении имеет вид ярких, с высоким МР-сигналом локусов (чем больше жидкости, тем выше интенсивность); на Тл-взвешенных изображениях, наоборот, эти же образования будут темными (чем больше жидкости, тем более темными). Фиброзная ткань имеет темный цвет на обоих изображениях [6].
МРТ обеспечивает полипроекционность визуализации и отличный тканевый контраст лимфатических узлов во взаимосвязи с окружающей жировой клетчаткой и близлежащими органами (по сравнению с другими методами визуализации). При этом возможна идентификация структур органов, их патологических изменений. МРТ — уникальный метод неинвазивной визуализации в диагностике лимфедемы. Его можно использовать как для дифференциального диагноза и определения тяжести лимфедемы, так и для последующей оценки результатов проводимого лечения [22, 23].
Специальные инвазивные методы диагностики
Старейшим методом исследования лимфатических сосудов является их визуализация при вивисекции путем введения красящих средств, таких как тушь, трипановый синий, конго красный. В клинической практике используется метод непрямой цветовой лимфографии, или хромолимфографии [3, 6, 24]. При его выполнении витальный краситель (метиленовый синий, синий Эванса, индигокармин) вводится внутрикожно с дальнейшим наблюдением за его распространением по поверхностным лимфатическим сосудам. В норме, в месте введения красителя, образуется довольно четко ограниченное синее пятно диаметром 1,5—2,0 см, от которого в проксимальном направлении визуализируются лимфатические сосуды. Распространение красителя в виде чернильного пятна или заполнение внутрикожной капиллярной сети на большой площади, как правило, свидетельствуют о серьезных нарушениях лимфообращения, возможной облитерации или аплазии лимфатических сосудов. Следует заметить, что хромолимфография используется как подготовительный этап при рентгеноконтрастной лимфографии (или лимфосцинтиграфии), а также для определения лимфатического сосуда при эндолимфатическом введении лекарственных препаратов [3].
Разновидностью цветовой лимфографии является флюоресцентный метод исследования лимфатических сосудов [25]. Он основан на субэпидермальной микроигольной инъекции флюоресцирующего вещества (FITC-декстрана) с последующей флюоресцентной микроскопией [26, 27]. Флюоресцентная микролимфография — атравматичный метод, позволяющий визуализировать поверхностную сеть лимфатических сосудов кожи, достаточно достоверно подтверждает диагноз и стадию лимфедемы, способствует дифференциальной диагностике с другими формами отека конечности.
Одним из современных средств, используемых для флюоресцентной микролимфографии в последние годы, является индоцианин зеленый, распространение которого в лимфатических сосудах регистрируется камерой инфракрасного излучения. Это перспективный путь для изучения лимфатической микроциркуляции и выявления лимфостаза на доклинической стадии [24, 28].
В течение нескольких десятилетий метод прямой рентгеноконтрастной лимфографии, с момента первого его описания J. Kinmonth в 1952 г., считается методом, наиболее достоверно выявляющим признаки органических структурных изменений лимфатических сосудов и узлов различного генеза [2, 3, 6, 24]. Лимфография — инвазивное исследование и должно выполняться при условии строжайшего соблюдения правил асептики.
На лимфограммах оценивают состояние лимфатического русла по традиционным признакам: количеству и диаметру лимфатических сосудов медиального коллектора; прямолинейности их хода; наличию лимфолимфатических анастомозов, сброса в глубокую систему; экстравазации контрастного вещества; заполнению лакун и кожной сети. Для определения состояния сократительного аппарата лимфатических сосудов оценивают их сегментацию на лимфангионы. При этом сегментация в форме веретен или бус свидетельствует о том, что сократительный аппарат сохранил свои функциональные свойства. Если сосуд не сегментирован и имеет форму трубы, это свидетельствует об утрате сократительной способности. Для оценки выраженности патологического процесса следует определять соотношение сегментированных и несегментированных сосудов [3, 6].
В настоящее время у хирургов, занимающихся проблемой лимфатических отеков, сформировалось сдержанное отношение к лимфографии [3, 7]. В большей степени оно объясняется инвазивностью исследования, повреждающим действием контрастного вещества на эндотелий лимфатического сосуда и возможными осложнениями (инфицирование операционной раны, лимфангит и лимфаденит).
Миниинвазивным способом лимфографического исследования является непрямая рентгеноконтрастная лимфография с применением двухмерных неионных контрастных веществ (иотасол, иотролан). Этот способ основан на создании депо рентгеноконтрастного вещества в периферических тканях с последующим выполнением серийных рентгенограмм. Возможность изображения периферических лимфатических сосудов этим простым и атравматичным способом имеет большое значение в диагностике лимфатических отеков [6, 24]. Преимуществами метода являются его атравматичность, простота выполнения и относительная дешевизна. Вместе с тем на ранней стадии лимфатической дисфункции чувствительность метода низкая, лишь 45%. По четкости визуализации лимфатических сосудов метод уступает прямой рентгеноконтрастной лимфографии.
В последнее время в клинической практике внедряется сочетанное применение контрастирования лимфатических сосудов и узлов с магнитно-резонансной или компьютерно-томографической визуализацией [29—32].
Новым перспективным методом исследования лимфатических сосудов является интерстициальная магнитно-резонансная лимфография, основанная на интрадермальной инъекции в качестве контрастного средства гадодиамида или гадобутрола [32—34]. Эта методика обладает большим потенциалом в определении резорбтивной и транспортной функции лимфатической системы. Так, при исследованиях отмечено, что в отличие от венозной системы лимфатические капилляры проявляют выраженную тенденцию к поглощению контраста. Магнитно-резонансная лимфография позволяет визуализировать лимфатические сосуды у пациентов с лимфедемой в динамических исследованиях через 35, 45 и 55 мин после внутрикожной инъекции гадодиамида. Кроме того, 3D-реконструкция полученных результатов значительно улучшает идентификацию лимфатических сосудов и узлов [32].
Проведены исследования диагностических возможностей мультидетекторной компьютерно-томографической лимфографии с использованием интерстициальной инъекции иопамидола для картирования кожного и подкожного путей лимфооттока в сравнении с лимфосцинтиграфией [29]. Предварительные результаты свидетельствуют о высокой достоверности мультидетекторной компьютерно-томографической лимфографии, в отличие от лимфосцинтиграфии с четким и точным контрастированием лимфатических узлов. Появились сообщения об использовании компьютерно-томографической лимфографии не только в диагностических целях, но и для выполнения лечебных манипуляций: пункции, катетеризации и эмболизации лимфатических сосудов.
Развитие радионуклидной диагностики лимфатической системы относится к 1950—1960 гг., когда в экспериментах было установлено повышенное накопление коллоидных меченых частиц в регионарных лимфатических узлах. В настоящее время это исследование считается «золотым стандартом» в обследовании пациентов с лимфатическими отеками конечностей. Лимфосцинтиграфия позволяет выявить ранние нарушения лимфооттока и определить их степень тяжести [2, 6, 24, 35—39].
Метод радионуклидной диагностики состояния лимфатической системы физиологичен, чрезвычайно чувствителен, отражает состояние лимфатической системы (резорбционную способность, скорость лимфотока и лимфодинамику). Метод позволяет определить количественные показатели лимфотока, не вызывает повреждения эндотелия, лимфангита, аллергических реакций, расширения лимфатических сосудов. Кроме того, лимфосцинтиграфия может применяться для дифференциального диагноза лимфатических отеков, для контроля консервативного лечения до и после операции. Радиофармпрепарат, оптимальный для лимфосцинтиграфии, должен иметь частицы размером 10—50 нм. Выведение из тканей частиц большего размера затруднено, что может приводить к радиационному поражению, а частицы менее 4 нм способны проникать в кровеносное русло. В основном нашли применение коллоид 198Au, альбумин 131I или 111In, а в последнее время — наноколлоид 99 m Tc [35, 37, 38].
Выделяют статическую и динамическую лимфосцинтиграфию. Первый метод позволяет оценить морфологическое состояние лимфатических сосудов, а второй — определить выраженность дисфункции лимфатической системы. При статической лимфосцинтиграфии применяется следующая методика. В I межпальцевой промежуток обеих стоп подкожно вводится радиофармпрепарат (Тс-коллоид, Лимфоцис) активностью 30—50 мБк в объеме 0,2—0,3 мл. С использованием гамма-камеры выполняют исследования через 5, 10, 30 мин и 3 ч после введения радиофармпрепарата. При динамической лимфосцинтиграфии используются упражнения, способствующие быстрому распространению радиофармпрепарата: сгибательно—разгибательные движения в голеностопном (лучезапястном) суставе с частотой 30 раз в минуту [6].
При анализе лимфосцинтиграмм оценивают депо радиофармпрепарата в зоне инъекции и пути транспорта лимфы до паховых лимфатических узлов. Определяют своевременность и интенсивность контрастирования путей транспорта лимфы, степень их проницаемости, количество функционирующих сосудов, наличие коллатерального лимфотока и кожного рефлюкса, время наступления и симметричность фиксации радиофармпрепарата в паховых лимфатических узлах. Также оценивают форму, размеры, симметричность и интенсивность изображения лимфатических узлов.
При нормальном лимфооттоке уже через 3—5 мин визуализируются лимфатические сосуды голени, а через 10—15 мин — паховые лимфатические узлы. У пациентов с лимфедемой выявляется диффузное распространение радиофармпрепарата, что свидетельствует о повышенной проницаемости сосудов. При начальных стадиях заболевания наблюдаются асимметрия и замедление свечения над зоной лимфатических коллекторов и узлов. При выраженных формах заболевания определяется ско-пление радиофармпрепарата в области его введения с отсутствием накопления в паховых лимфатических узлах. У пациентов с вторичной лимфедемой часто наблюдается изменение формы лимфатических узлов с задержкой поступления в них радиофармпрепарата. Это обусловлено воспалительными и дегенеративными процессами.
При стандартной лимфосцинтиграфии невозможно визуализировать изолированно глубокие и поверхностные лимфатические коллекторы и ретроградный лимфоток по ним, оценить состояние клапанного аппарата глубоких и поверхностных лимфатических коллекторов нижних конечностей. В Институте клинической и экспериментальной лимфологии СО РАМН разработан новый метод функциональной диагностики нарушений лимфооттока нижних конечностей — лимфосцинтиграфия с динамической визуализацией ретроградного лимфотока нижних конечностей [6].
При данном методе исследования на область верхней трети голени и нижней трети бедра накладываются манжеты с давлением 100 мм рт.ст., которое позволяет выключить из лимфотока поверхностные лимфатические коллекторы. Радиофармпрепарат вводится на заднелатеральной поверхности верхней трети голени, над манжетой под собственную фасцию в объеме 0,3 мл. Исследование выполняется в три этапа — в покое с наложенными манжетами, в покое после снятия манжет и после физической нагрузки. На первом этапе оценивается как резорбтивная функция глубоких лимфатических коллекторов по скорости элиминации радиофармпрепарата, так и наличие ретроградного лимфотока и состояние клапанного аппарата лимфатических коллекторов голени. На втором этапе манжеты снимают и оценивают включение поверхностных лимфатических коллекторов в лимфоток нижней конечности, наличие ретроградного лимфотока и состояние клапанного аппарата поверхностных лимфатических коллекторов голени. После второго этапа исследования пациенту предлагается часовая физическая нагрузка (ходьба). На третьем этапе определяется резорбтивная функция глубоких и поверхностных лимфатических коллекторов нижней конечности, ретроградный лимфоток, состояние клапанного аппарата глубоких и поверхностных лимфатических коллекторов голени после физической нагрузки [6].
Исследования последних лет показали, что в обеспечении лимфооттока основное значение имеет активность всех лимфангионов лимфатической системы. Поэтому оценка сохранности сократительного аппарата лимфангиона и его функции представляется крайне важной для определения степени нарушения лимфообращения в конечностях и требует в отдельных клинических наблюдениях проведения морфологических исследований. С этой целью предлагается выполнение биопсии лимфатических сосудов с последующей регистрацией моторики, а также световой и электронной микроскопией биоптата. Биопсию выполняют инцизионным способом, совмещая ее чаще всего с лимфангиографией [2, 7].
Другим способом оценки сократительного аппарата лимфангионов является методика прямой регистрации биотоков, вызываемых фазными сокращениями лимфатических сосудов. В операционной ране пара микроэлектродов накладываются непосредственно на отпрепарированный сосуд. Полученные импульсы усиливаются и регистрируются на самописце. Эта технология может использоваться для интраоперационной оценки состояния сократительной способности лимфатических и кровеносных сосудов в целях прогнозирования исхода оперативного вмешательства, например наложения лимфовенозного соустья [6].
Функциональные методы диагностики
Учитывая тесную взаимосвязь кровеносной и лимфатической систем, в обследовании пациентов с лимфедемой определенное место отводят методам функциональной оценки состояния кровообращения конечностей.
Тепловидение является одним из методов ранней диагностики изменений гемолимфоциркуляции. Абсолютная безопасность и простота данного метода позволяют применять его для оценки выраженности патологического процесса [3]. Для пациентов с лимфедемой нижних конечностей характерно появление гипертермии в проекции паховых лимфатических узлов, тотальное уменьшение термопрофиля всей конечности за счет отека мягких тканей и в связи с этим снижение суммарного инфракрасного излучения пораженной конечности. Однако в местах с сегментарным скоплением внеклеточной жидкости на термограммах возможна локальная гипертермия с термопрофилем в диапазоне от 37,23 до 39,45 °С.
Реовазографическое исследование, имеющее многолетнюю историю применения, является косвенным методом оценки кровообращения в конечностях. Метод основан на регистрации электропроводимости тканей, в основе которой лежат изменения сопротивления, обусловленные состоянием кровообращения в конечности. Оцениваются степень, динамика и характер кровенаполнения исследуемого участка тела. Одним из способов этого метода, представляюшего интерес при обследовании пациентов с лимфедемой, является реолимфовазография, которая заключается в регистрации с помощью реографа и парных электродов пульсовых электроимпедансометрических кривых [6]. Наиболее важными и диагностически значимыми при обследовании пациентов с нарушением лимфодренажной функции конечностей являются следующие параметры реолимфовазографии: скорость и объем лимфооттока, скорость и объем венозного оттока, скорость и объем артериального притока. У пациентов с лимфедемой наблюдается снижение скорости и объема оттока лимфы, и венозной крови при сохранении параметров артериального притока.
Лазерная допплеровская флоуметрия как современный метод оценки микроциркуляции может использоваться для выявления формы лимфедемы нижних конечностей [7]. При помощи лазерной допплеровской флоуметрии выявлены особенности амплитудно-частотных характеристик микроциркуляторного русла кожи нижних конечностей у пациентов с первичной и вторичной лимфедемой. При первичной лимфедеме происходит увеличение вклада активных флаксомоций микрососудов различных диапазонов с одновременным уменьшением влияния пассивных механизмов. При вторичной лимфедеме, обусловленной блоком на уровне лимфатического коллектора или лимфатических узлов, компенсация достигается благодаря уменьшению амплитуды активных вазомоций с увеличением доли ненутритивного кровотока.
Одним из способов оценки выраженности отека тканей при лимфатическом блоке является биоэлектрический способ измерения количества внеклеточной (отечная) и внутриклеточной жидкости. Принцип биоэлектрического анализа основан на зависимости величины электрического сопротивления от структуры биологических тканей, и в частности от объема содержащейся жидкости. Известно, что электрические свойства биологических тканей можно моделировать эквивалентными электрическими схемами. Наиболее широкую известность получила мультичастотная биоимпедансометрия [13, 40]. Данная методика достаточно точно моделирует пассивные электрические свойства биологических объектов и закономерности их изменений в широком интервале частот, а каждый элемент схемы отражает те или иные морфофункциональные особенности биологической ткани. Этот метод также обладает способностью отличать накопление или потерю жидкости. Для медико-биологических исследований большое значение имеет расчет параметров элементов эквивалентной схемы по измеренным электрическим характеристикам биологической ткани. Получаемые данные позволяют сделать вывод о морфологических или физиологических изменениях в исследуемой биологической ткани.
В обследовании пациентов с лимфедемой конечностей — хронического и устойчивого к лечению заболевания особое значение имеет определение рациональной диагностической тактики. В современных условиях миниинвазивность метода диагностики должна разумно сочетаться с достаточно высоким уровнем достоверности его результатов. В клинической практике при первичном обследовании пациентов диагноз должен опираться на данные анамнеза, общеклинического и физикального осмотра. Из специальных методов неинвазивного характера, прежде всего, заслуживают внимания методы визуализации вторичных нарушений лимфообращения, такие как ультрасонография, КТ или МРТ, а также волюметрия и функциональные исследования. Из методов прямой оценки резорбтивно-транспортной функции лимфооттока на первом этапе достаточно хромолимфографии с использованием современных витальных красителей и средств регистрации, а оптимальным является применение лимфосцинтиграфии. Проведение рентгеноконтрастной лимфографии должно быть показанным в случаях, когда для решения о дальнейшем лечении необходима четкая оценка лимфатических сосудов.
В перспективе активная разработка и накопление опыта применения современных визуализационных методов с контрастированием и компьютерным моделированием будет способствовать улучшению результатов диагностики и лечения пациентов с лимфедемой конечностей.
Авторы заявляют об отсутствии конфликта интересов.
Концепция и дизайн исследования — С.К., С.С.