Лимфоидная инфильтрация стромы опухоли молочной железы что это
TILs (опухоль-инфильтрирующие лимфоциты) – важный предиктивный и прогностический фактор для HER2-позитивного и трижды негативного РМЖ
На декабрьской ежегодной конференции по раку молочной железы SABCS 2016 в Сан-Антонио (Техас, США) подчеркнуто, что уровень TILs (опухоль-инфильтрирующих лимфоцитов) – это важный предиктивный и прогностический фактор для HER2-позитивного и трижды негативного рака молочной железы (РМЖ):
1. Luen S. et al. (Abstract S1-08): уровень стромальных TILs коррелирует с увеличением общей выживаемости больных диссеминированным HER2-положительным (HER2+) РМЖ [1, 4].
Уровень TILs коррелирует с увеличением общей выживаемости у больных диссеминированным HER2+ РМЖ [1, 4].
Клиническое исследование WO20698/CLEOPATRA «Рандомизированное двойное слепое плацебо контролируемое клиническое испытание III фазы по оценке эффективности и безопасности применения комбинации пертузумаба с трастузумабом и с доцетакселом по сравнению с комбинацией трастузумаба и доцетаксела у ранее не леченных пациентов с метастатическим HER2+ РМЖ» [3]
Дизайн исследования WO20698/CLEOPATRA:
Критерии включения в исследование WO20698/CLEOPATRA:
Критерии исключения WO20698/CLEOPATRA:
Результаты исследования WO20698/CLEOPATRA:
Уровень стромальных TILs ≥ 60% достоверный предиктор pCR при всех подтипах РМЖ, но коррелирует с повышением безрецидивной выживаемости только у больных HER2+ и трижды негативным РМЖ [2]
В метаанализе (Carsten Denkert et al., 2016), включающем данные 6 неоадъювантных испытаний German Breast Group (GeparDuo, GeparTrio, GeparQuattro, GeparQuinto, GeparSixto, GeparSepto), у 3771 больных местно-распространенным РМЖ оценена корреляция между уровнем TILs и полным патоморфологическим ответом опухоли (pCR), а также между уровнем TILs и показателями выживаемости больных в зависимости от молекулярно-генетического подтипа РМЖ [4].
Результаты:
Лимфоидная инфильтрация стромы опухоли молочной железы что это
You are using an outdated browser. Please upgrade your browser or «>activate Google Chrome Frame to improve your experience.
mun.Chişinău, str. Alba Iulia, 21 карта
(+373) 22 944 944 (+373) 69 944 944
Blvd. Traian 7/1, Chisinau
С практической точки зрения есть смысл разделять представленные факторы по следующим признакам:
Параметры, прогнозирующие наличие микрометастазов
1. Выявление опухолевых клеток в регионарных лимфатических узлах
Было показано, что прогноз определяется не только фактом наличия микрометастазов, но но также их количеством. Согласно современной концепции развития рака молочной железы процесс лимфогенного метастазирования при данном заболевании происходит одновременно, поэтому лимфаденэктомия (с удалениием 1-111 уровней лимфооттока носит не столько лечебный, сколько диагностический характер);
2. Морфологические прогностические маркеры
Давно известно, что некоторые гистологические характеристики опухоли являются важными прогностическими факторами для больных, в частности, без поражения зон регионарного метастазирования. Опухоли так называемых «благоприятных» гистологических форм (тубулярный, слизеобразующий, папиллярный) имеют показатели выживаемости при Т2N0 лучше, чем инвазивный протоковый или дольковый рак меньшего размера.
3. Прогностически благоприятным считают лимфоидную инфильтрацию опухоли, а также гистиоцитоз синусов лимфатических узлов;
4. Более плохим прогнозом отличаются анеуплоидные опухоли, с высоким индексом ДНК и числом клеток в фазе синтеза (более 7-14%).
Параметры, прогнозирующие чувствительность к проводимому лечению
1. Рецепторы к стероидным гормононам
Рецепторы стероидных гормонов- специфические белки, избирательно связывающие соответствующие стероиды после их проникновения в клетку, и опосредующие таким образом их биологические эффекты. Принципиально важным для женского рака молочной железы является присутствие в опухолевой ткани рецепторов к эстрогенам и прогестерону, что с одной стороны, свидетельствует о чувствительности к гормональной терапии, а с другой, говорит о более высокой дифференцировке последней и, соответственно, о ее более низком потенциале метастазирования;
2. Эпидермальные факторы роста
Многочисленными исследованиями было показано, что наличие в опухолевой ткани данных факторов особенно в отсутствии рецепторов к стероидным гормонам, свидетельствует о неблагоприятном прогнозе и о резистентности к проводимой гормонотерапии;
3. HER2neu
Это – уникальный представитель семейства трансмембранных тирозинкиназ, являющийся ключевым звеном передачи митогенных сигналов всех подобных рецепторам эпидермального фактора роста пептидов, совершенно необходим для полноценного функционирования системы в целом. Блокирование его может существенно замедлить или остановить рост опухолей, зависимых от любых стимулов. Созданный недавно препарат Герцептин способен в значительной степени интенсифицировать комбинированное и комплексное лечение в целях увеличения безрецидивного периода. Гиперэкспрессия этого гена прогнозирует слабый ответ на эндокринную терапию, и, наоборот, говорит о чувствительности опухоли к химиотерапии.
Параметры, прогнозирующие прогресирование и локализацию метастазов
Способность к метастазированию и инвазии- одно из фундаментальных свойств злокачественных опухолей. Разработка этой проблемы только активно начинается. Интенсивные лабораторные исследования показали, что экспрессия специфических факторов роста опухолевых клеток, так называемых протеаз, занимает центральное место во всех этих процессах. Считается, что плазмин, способный уменьшить уровень внеклеточных матричных гликопротеидов, играет решающую роль, как в локальном распространении опухоли, так и в формировании метастазов в отдаленных органах и тканях. Важная роль в разрушении внеклеточного матрикса принадлежит также активатору плазминогена урокиназного типа (uPA). Соответственно подавление активатора плазминогена урокиназного типа на различных уровнях может стать перспективным направлением современной противоопухолевой терапии. Помимо этого, солидными исследованиями показано, что риск развития рецидива или метастазирования даже при ранних стадиях возрастает в 1,5-2 раза, если уровень этих белков превышает пороговый.
В последние годы большое внимание стало уделяться неоангиогенезу, т.е. формированию новых сосудов в злокачественных опухолях. Важнейшим регулятором ангиогенеза является фактор проницаемости сосудов (ФРЭС). Исследованиями последних десятилетий показано, что ФРЭС имеет, по-видимому, существенное значение для прогноза заболевания, а также влияет на чувствительность опухолей к химио-гормонотерапии. Его высокий уровень свидетельствует о неблагоприятном прогнозе, как при раннем, так и при распространенном раке молочной железы.
Из клинических данных известно, что у пременопаузальных больных с низким содержанием рецепторов эстрогенов в первичной опухоли чаще наблюдаются висцеральные метастазы, тогда как у постменопаузальных пациенток с высоким их содержанием чаще развивается поражение костей скелета. Поскольку ежегодно панель биологических маркеров рака молочной железы переоценивается и дополняется новыми данными, существующие сведения, несомненно, со временем будут унифицированы, а некоторые из них, возможно, утратят свое значение.
Лимфоидная инфильтрация стромы опухоли молочной железы что это
Риск смерти больных раком молочной железы снижается, если опухоль инфильтрирована Т-лимфоцитами
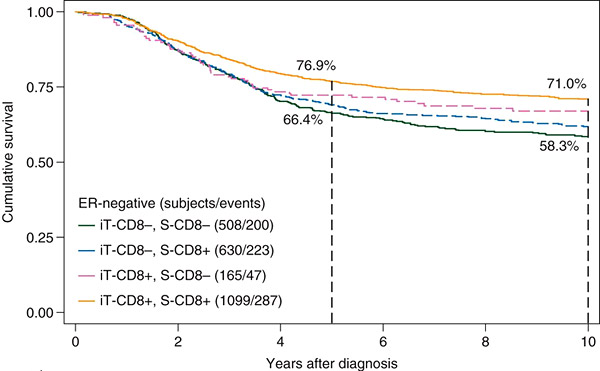
Целью крупнейшего исследования с включением 12.439 пациентов с негативным и позитивным раком молочной железы (РМЖ) по рецепторам эстрогенов (ЭР) было оценить инфильтрацию опухоли Т-лимфоцитами как прогностического и предиктивного маркера выживаемости. К опухоль-инфильтрирующим Т-лимфоцитам относились цитотоксические лимфоциты (CD8+) и регуляторные лимфоциты (FOXP3+), которые определялись методом иммуногистохимии.
У больных с ЭР/HER2-негативным РМЖ инфильтрация опухоли Т-лимфоцитами (iT-CD8+) приводила к снижению риска смерти от болезни на 28%, инфильтрация Т-лимфоцитами стромы (S-CD8+) приводила к значимому снижению риска смерти на 21%. Наилучшие показатели были у пациентов с инфильтрацией как iT-CD8+, так и S-CD8+ (см. график). Эффективность лечения антрациклинами в исследовании National Epirubicin Adjuvant Trial была достоверно лучше у пациентов с инфильтрацией опухоли Т-лимфоцитами (HR=0,54) по сравнению с пациентами, у которых инфильтрации выявлено не было (HR=0,87). У больных с ЭР/HER2-позитивным РМЖ инфильтрация iT-CD8+ достоверно снижала риск смерти на 27%.
Таким образом, авторы делают вывод, что инфильтрация Т-лимфоцитами достоверно снижает относительный риск смерти у всех больных РМЖ вне зависимости от статуса ЭР/HER2. Инфильтрация Т-лимфоцитами может использоваться в дальнейшем при стратификации пациентов и рассматриваться в качестве одного из факторов в молекулярной классификации РМЖ.
Статья опубликована в журнале Annals of Oncology и отмечена главным редактором как «значимая».
Источник: Ali HR et al. Ann Oncol (2014) 25 (8): 1536-1543.
Лимфоидная инфильтрация стромы опухоли молочной железы что это
хирург-онколог, маммолог, кандидат медицинских наук
Ленинградская область, Всеволожский район, пос.Кузьмоловский, Заозерная ул., 2
Врач в третьем поколении. Закончил в 1998 году с отличием Санкт-Петербургскую государственную медицинскую академию им. И.И. Мечникова, после чего сразу же поступил в клиническую ординатуру по хирургии этой же академии. Во время обучения в клинической ординатуре, которую с отличием закончил в 2000 году, получил специализацию по онкологии (1999). Начиная с 1999 года, обучение проводилось на базе Ленинградского областного онкологического диспансера (отделение общей онкологии). С 2000 по 2004 год проходил обучение в аспирантуре и в 2004 году защитил кандидатскую диссертацию на тему «Хирургическое и адъювантное лечение ранних форм рака молочной железы». Имею действительные сертификаты по хирургии (2021) и онкологии (2018), реконструктивной и пластической хирургии (2019). Являюсь лучшим маммологом Санкт-Петербурга 2016 года по версии сайта НаПоправку, лучшим маммологом Санкт-Петербурга в 2020 и 2021 годах по версии Prodoctorov.Ru
Лечу рак молочной железы по федеральным квотам в Клинической больнице Российской академии наук, принимаю и лечу пациентов в клинике онкологических решений ЛУЧ
С 2004 года являюсь главным исследователем и координатором международных клинических исследований по раку молочной железы в Ленинградском областном клиническом онкологическом диспансере, клинике онкологических решений ЛУЧ.
Имею более 10 печатных работ, в том числе в центральной зарубежной печати.
Рабочий телефон +7921 945 33 18
Мобильный телефон +7 921 945 33 18
Телефон администратора +7 981 710 40 41
Субпопуляции интратуморальных лимфоцитов при раке молочной железы
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Реферат. В статье приводятся литературные данные о современном состоянии проблемы иммунологии рака, в частности рака молочной железы. Рассматриваются роль в прогнозе и клиническое значение лимфоцитарной инфильтрации злокачественных опухолей молочной железы.
Ключевые слова: рак молочной железы, иммунология рака, субпопуляции интратуморальных лимфоцитов, прогноз при раке молочной железы, клеточный противоопухолевый иммунитет.
Исследования последних лет показали, что рост большинства злокачественных опухолей сопровождается значительными нарушениями различных звеньев иммунного ответа организма. Проведенные у онкологических больных исследования указывают на снижение количества естественных киллеров, Т–хелперов, функциональной активности Т–лимфоцитов, увеличение количества Т–супрессоров и их функциональной активности.
Установлено, что снижение уровня Т–клеточной инфильтрации опухоли имеет определенную связь с регионарным метастазированием или наличием микрометастазов. Размер опухоли не взаимосвязан с уровнями ее лимфоцитарной инфильтрации. Было доказано, что увеличение количества интратуморальных Т–киллеров является фактором благоприятного прогноза у больных раком молочной железы (РМЖ), преимущественно без регионарного метастазирования [1].
Более того, наибольшее значение имеет инфильтрация опухоли CD8+–лимфоцитами. Установлена связь степени распространенности опухолевого процесса с уровнем CD8+–лимфоцитов. Повышение уровня инфильтрации CD8+–клетками наблюдается чаще у пациентов, не имеющих метастазов в регионарные лимфатические узлы, а снижение их количества более характерно для поздних стадий РМЖ.
Работами сотрудников Университета Калифорнии (США) доказано, что инфильтрация опухолевой ткани РМЖ цитотоксическими лимфоцитами (CD8+) является фактором благоприятного прогноза, а выраженная инфильтрация CD4+–лимфоцитами и макрофагами, напротив, ухудшает прогноз.
Прогностическая роль субпопуляционного состава интратуморальных лимфоцитов при РМЖ также достаточно хорошо известна. При однофакторном анализе главенствующая прогностическая роль принадлежит CD8+–лимфоцитам. В отсутствие выраженной инфильтрации РМЖ CD8+–клетками CD4+–лимфоциты способствуют опухолевой инвазии и развитию отдаленных метастазов РМЖ путем влияния на протуморальную активность опухолеассоциированных макрофагов. Совокупность этих данных позволила предположить, что три клеточных типа – CD4+ и CD8+–лимфоциты, а также CD68+–макрофаги – могут играть главную роль в прогнозе РМЖ. На основании этих данных предложена трехмаркерная иммунная сигнатура для более точной оценки прогноза у больных РМЖ. Иммунный профиль CD68LowCD4LowCD8High характерен для первичного РМЖ, который даже в случаях только хирургического лечения характеризуется высокими показателями общей и безрецидивной выживаемости. Напротив, иммунные ответы CD68HighCD4HighCD8Low соответствуют группе больных с риском развития отдаленных метастазов и сниженной выживаемостью.
Таким образом, на сегодняшний день понятны прогностически благоприятные иммунологические параметры состава интратуморальных лимфоцитов при РМЖ. Актуальной является задача по поиску путей иммунотерапевтического воздействия на субпопуляционный состав интратуморальных лимфоцитов с целью его коррекции и улучшения прогноза у больных. Решению данной актуальной задачи и посвящена наша работа.
Целью данной работы является установление на современном этапе роли количественного состава интратуморальных лимфоцитов, динамики их субпопуляций при проведении иммунокорригирующей терапии РМЖ.
Иммунология рака – это одна из наиболее значимых проблем онкологии. С одной стороны, теоретически здесь все просто: антигенность опухолей доказана давно, и это положение является незыблемым и не подлежащим пересмотру [12]. С другой, на практике все обстоит прямо противоположным образом: иммунокомпетентный организм человека или млекопитающего – носителя опухоли – практически никогда не способен отторгать антигеннесущие опухоли.
Парадокс состоит в том, что организм не способен отторгать антигенные опухоли, а существование антигенспецифических противоопухолевых иммунных ответов является убедительно доказанным и неоспоримым.
За долгую более чем 50–летнюю историю становления и развития учения об иммунологии рака открыты многие фундаментальные иммунологические феномены, расшифрованы механизмы цитотоксического действия лимфоцитов и антител, но практический вклад иммунологии в лечение рака и, в частности РМЖ, все еще остается незначительным.
В последние два года наметился явный прорыв в данной области. Авторитетнейшие фундаментальные американские журналы PNAS (Proceedings of National Academy of Sciences of the USA) и Cancer Discovery опубликовали статьи, доказывающие главенствующую роль иммунной системы человека в прогнозе РМЖ. Открытия эти сделаны при изучении тонких взаимодействий между Т–хелперными (CD4), Т–цитотоксическими (CD8) лимфоцитами и макрофагами, присутствующими в ткани опухоли, т.е. интратуморальными клетками иммунной системы. К аналогичным результатам пришли и российские ученые, убедительно доказавшие важную прогностическую роль количества и качественного состава интратуморальных лимфоцитов, в особенности CD8+ и Т–цитотоксических клеток, в прогнозе РМЖ. Результаты этих работ проливают свет на то, какие клетки иммунной системы являются наиболее важными с точки зрения противоопухолевого иммунитета, и открывают перспективы поиска иммунологических путей воздействия для активации данных клеточных типов.
Большинство авторов расценивали выраженную лимфоидную инфильтрацию опухоли, отмечаемую на морфологическом уровне, как проявление защитных функций организма и показатель более благоприятного прогноза. Однако безоговорочно такую точку зрения принимать, по–видимому, нельзя: необходимо учитывать возраст больных, стадию заболевания, тип лечения и, конечно же, субпопуляционный состав и функциональную активность туморинфильтрирующих лимфоцитов, а также иммунофенотипические особенности опухолевых клеток. Хотя лимфоциты и инфильтрируют многие мышиные и человеческие опухоли, однако спонтанная регрессия опухолей наблюдается редко. Даже относительно значения воспалительных клеток в опухоли или окружающих ее тканях нет единства мнений. Вместе с тем, многие работы продемонстрировали связь повышенных уровней туморинфильтрирующих лимфоцитов с более благоприятным прогнозом.
Однако простое допущение, что накопление лимфоцитов в опухоли является непременно благоприятным для больного, может быть не соответствующим действительности. По данным отечественных и зарубежных авторов, выраженная лимфоидная инфильтрация встречается у 45–70% больных РМЖ. Высокие уровни лимфоцитарной инфильтрации ассоциированы с увеличением выживаемости у больных моложе 40 лет и благоприятным прогнозом у части больных, опухоли которых сильно инфильтрированы макрофагами. По данным Н.С. Чобанян [8], лимфоплазмоцитарная инфильтрация опухоли не оказывает существенного влияния на выживаемость больных, а пациентки молодого возраста при отсутствии инфильтрации вообще имеют более высокие показатели выживаемости.
При лечении местнораспространенного РМЖ применяется комплексный подход, включающий различные виды предоперационного лечения. Поэтому изучение и трактовка характера лимфоидной инфильтрации опухоли у этой категории больных представляют особый клинический интерес. Так, Б.Т. Балынский, Н.А. Володько (1991) показали корреляцию между степенью лимфоплазмоцитарной инфильтрации и благоприятным прогнозом при предоперационной лучевой терапии: чем более выражена инфильтрация, тем выше выживаемость. Ю.В. Федин, В.Д. Ермилова [5] при анализе неоадъювантной химиотерапии установили связь между степенью лимфоидной инфильтрации и клиническим эффектом. Выраженная лимфоидная инфильтрация у больных РМЖ, леченных с эффектом, была отмечена в 43,8% случаев, у больных, леченных без эффекта – в 6,3% случаев. Работами А.А. Субботиной (2006, 2008) также показано, что выраженная инфильтрация опухоли Т–лимфоцитами (CD7+) ассоциируется с большим эффектом неоадъювантной полихимиотерапии – своего рода потенцирование.
Последние исследования свидетельствуют, что тип, а не количество туморинфильтрирующих клеток может быть более важной определяющей для прогноза. Например, инфильтрирующие регуляторные CD4+–клетки могут быть скорее вредными, чем полезными. Эта субпопуляция ТИЛ может нарушать способность хозяина защищаться от опухолевых клеток.
Большинство исследователей сходятся в том, что инфильтрация РМЖ Т–лимфоцитами положительно влияет на прогноз. Вместе с тем, уровни Т–клеточной (CD7+) и макрофагальной инфильтрации (CD163+) не были связаны с метастазированием РМЖ в регионарные лимфатические узлы. Более того, даже при достоверной взаимосвязи с регионарным метастазированием (отрицательная корреляция с индексом N) уровни Т–клеточной инфильтрации РМЖ не оказывали влияния на прогноз. Это объясняется тем, что Т–лимфоциты представляют собой чрезвычайно гетерогенную группу клеток, различающихся по своей функциональной противоопухолевой активности.
Противоопухолевые функции
Т–лимфоцитов
Зрелые Т–лимфоциты включают TCRαβ Т–клетки, экспрессирующие CD4 или CD8, и CD4–/CD8– TCRγδ Т–клетки. Функция Т–клеток определяется экспрессией на их мембране корецепторов CD4 или CD8. Лигандом CD4+–лимфоцитов является β2–домен молекул главного комплекса гистосовместимости (МНС) II класса. Лигандом для CD8+ Т–лимфоцитов является α3–домен молекул МНС I класса. TCRαβ CD8+ Т–клеток ограничен распознаванием антигенов, представляемых молекулами МНС I, а TCRαβ CD4+ Т–клеток – антигенов, презентируемых молекулами МНС II класса.
Важная роль Т–клеток как эффекторов противоопухолевого иммунитета была впервые продемонстрирована на многочисленных мышиных моделях. Опухоли, индуцированные ультрафиолетовым облучением, отторгаются у нормальных мышей, но продолжают расти в случаях отсутствия Т–клеток. Важность Т–клеток в противоопухолевом иммунитете убедительно доказана и у человека. Т–лимфоциты, выделенные из крови или опухоли больных раком, реагируют in vitro с аутологичными опухолевыми клетками. Использование адоптивного переноса размноженных in vitro ТИЛ в комбинации с химиотерапией позволяет получить положительные ответы у 50% больных с агрессивными опухолями поздних стадий. Вместе с тем, общий уровень Т–клеточной инфильтрации опухоли, оцениваемый иммуногистохимически, не влиял на прогноз РМЖ при длительном наблюдении за больными. Значение имела инфильтрация опухоли субпопуляциями Т–лимфоцитов, в первую очередь Т–цитотоксическими (CD8+) клетками. Роль различных Т–клеточных субпопуляций в отторжении опухолей уже длительное время является предметом споров. Большинство исследователей отмечают преобладание Т–клеток над В–клетками в мононуклеарных инфильтратах опухолей молочных желез, причем относительное содержание Т–лимфоцитов колеблется от 49 до 75% клеточного состава. J. Shimokawara и соавт. (1982) показали зависимость Т–клеточной инфильтрации от клинической стадии заболевания. С увеличением распространенности процесса количество Т–клеток уменьшается. Иммунофенотипирование популяций лимфоцитов, инфильтрирующих опухоль, позволило J. Halpern и соавт. (1988) выявить среди них СD5+–клетки. Другим исследователям удалось выделить достаточно большое количество различных субпопуляций лимфоцитов [17].
CD8+ T–клетки в противоопухолевом иммунитете
N. Shijubo и соавт. (1988) показали преобладание в злокачественных опухолях молочной железы субпопуляции цитотоксических/супрессорных СD8+–клеток над хелперами/индукторами СD4+. В то же время C. Balch и соавт. [11] получили противоположные результаты; кроме того, они установили отрицательную корреляционную связь между количеством СD4+– клеток и некоторыми показателями: размером опухоли, клеточным полиморфизмом и числом пораженных лимфоузлов.
Большинство опухолей позитивны по HLA–I, но негативны по HLA II класса, и CD8 ЦТЛ способны убивать опухолевые клетки путем прямого распознавания пептидных антигенов, презентируемых молекулами HLA–I злокачественных клеток. Поэтому первоначально внимание в противоопухолевом иммунитете уделяли преимущественно CD8+ Т–клеткам. То, что CD8 T–клетки являются главными эффекторами против опухолевых клеток, было в дальнейшем подтверждено многочисленными исследованиями на мышиных моделях. Например, для отторжения опухолей, индуцированных ультрафиолетовым облучением, необходимы CD8+ Т–клетки. Удаление CD8+ T–клеток у мышей снижает противоопухолевый иммунный ответ, индуцированный большинством раковых вакцин. Значение CD8+ Т–клеток подтверждено и у больных раком. Исследования по адоптивному переносу стимулированных in vitro CD8+ Т–клеточных линий и CD8+ клонов, специфичных к опухолевым антигенам, показали, что эти клетки, введенные больным, эффективно опосредуют противоопухолевый иммунитет. Иммунизация с использованием либо адъювантов, либо дендритных клеток с чистыми опухолевыми пептидами может приводить к эффективному противоопухолевому иммунитету, который опосредован молекулами МНС I класса. Таким образом, CD8+ Т–клетки, несомненно, являются одним из главных подклассов Т–клеток, эффективно опосредующих противоопухолевый иммунитет.
Хелперная и эффекторная роль
CD4+ Т–клеток
Опухолеспецифичные CD4+ Т–клетки, которые способны распознавать опухолевые антигены, действительно существуют, и данные показывают, что эти Т–клетки мигрируют как в мышиные, так и в человеческие опухоли [16]. Однако возникают сложности в объяснении того, что в ряде случаев накопление CD4+–клеток в опухолевом микроокружении в ходе опухолевой прогрессии отчетливо мешает эффекторной функции CD8+–клеток [10]. В целом фенотип CD4+–клеток, которые препятствуют противоопухолевым ответам, связан с наличием регуляторной функции. CD4+ Т–клетки достаточны для элиминации опухолевых клеток в отсутствие CD8+–клеток в некоторых опухолевых моделях [14], однако в большинстве случаев для эффективного отторжения опухоли необходимы как CD4, так и CD8–клетки [15]. Частично это обусловлено тем, что значительная часть опухолевых клеток экспрессирует только молекулы МНС I класса, но не МНС II класса, что лимитирует прямое распознавание опухоли CD4+ Т–клетками. Более того, преобладающим эффекторным механизмом в опухолевом иммунитете является прямой лизис опухолевых клеток CD8+ ЦТЛ, распознающими МНС I класса. Роль CD4+ Т–клеток в противоопухолевых ответах часто заключается в осуществлении помощи в активации CD8 Т–клеток, ведущей к деструкции опухоли CD8+ цитотоксическими Т–лимфоцитами.
Не подлежит сомнению, что CD4–лимфоциты необходимы для поддержания уровня ЦТЛ как при вирусных инфекциях, так и опухолеспецифических иммунных ответах [13], что частично обусловлено продукцией ИЛ–2.
Как известно, CD4–клетки подразделяются в зависимости от их профиля продукции цитокинов. Тн1–клетки характеризуются продукцией ИФ–γ, а Тн2–клетки – продукцией ИЛ–4, ИЛ–5 и других цитокинов. Тн1–клетки в большей степени стимулируют клеточный иммунитет, а Тн2–клетки – гуморальный. ИФ–γ положительно влияет на процессинг и презентирование антигена, поскольку экспрессия молекул гистосовместимости I и II классов, а также ряда других молекул (например, транспортера, ассоциированного с антигенным презентированием, ТАР) находятся под контролем этого цитокина. Поскольку клеточный иммунный ответ предпочтителен для опухолевой деструкции, предполагают, что Тн1–ответ благоприятен для противоопухолевого иммунитета. Действительно, установлена связь между генерацией Тн1–ответа и более сильным противоопухолевым иммунитетом [9]. Более того, считают, что Тн1–ответ необходим для противоопухолевого иммунитета, а Тн2–цитокины его снижают. Существует даже концепция, объясняющая неэффективность Т–клеточного иммунитета при опухолях иммунной девиацией, т.е. сдвигом цитокинового профиля от Тн1 к Тн2 при опухолевой прогрессии. Однако убедительно доказано существование опухолеспецифических Тн2–клонов с выраженной противоопухолевой активностью. Предполагают, что в этом случае Тн2–клетки активируют врожденный иммунитет.
CD4+–регуляторные Т–клетки
в опухолевом микроокружении
В ходе опухолевой прогрессии микроокружение опухоли становится местом, где осуществляется баланс между эффекторным и регуляторным ответами. Подкласс Т–клеток, ответственных за регулирование эффекторного иммунного ответа в пределах опухоли, сходен с регуляторными Т–клетками, вовлеченными в аутоиммунитет.
Опухоли обычно развиваются в течение длительного периода времени. В дополнение, главные патофизиологические характеристики злокачественных опухолей – инвазия через естественные тканевые барьеры и метастазирование – часто ассоциированы с разрушением нормальной тканевой архитектуры, и это ведет к возникновению воспалительных ответов. В этом смысле рак очень напоминает хронический воспалительный ответ. В свете этого можно предположить, что противовоспалительные механизмы, которые включаются в начале инвазии, в сочетании с внутренними механизмами, контролирующими злокачественные клетки к продукции цитокинов (например, TGF–β), уравновешивают регуляторную реакцию, способную ингибировать противоопухолевый иммунитет.
Негативная регуляторная роль CD4+ Т–клеток в опухолевом микроокружении хорошо установлена. В некоторых спонтанных опухолевых моделях присутствие CD4+ Т–клеток способствует развитию рака вместо его ингибирования. Аналогичные данные получены при иммунизации антигенспецифичными CD4+ Т–клетками. Деплеция CD4+–клеток отменяет супрессию и индуцирует CD8+ Т–клеточный противоопухолевый иммунитет [10]. Вместе с тем, нельзя забывать и о необходимости Т–клеточной CD4+ помощи для генерации полноценного противоопухолевого иммунного ответа. Все это объясняется существованием функционально различных подклассов CD4+–клеток. Супрессорными функциями в отношении противоопухолевого иммунитета обладают CD4+CD25+–клетки. В ряде работ использовали деплецию CD4+–клеток для усиления противоопухолевого иммунитета. Более специфичная деплеция с помощью анти–CD25 антител существенно усиливает эффективность противоопухолевого иммунитета при соответствующей вакцинации мышей. Трег могут ингибировать начальное примирование CD8+ Т–клеток, некоторые из них распознают опухолевые антигены. Эквивалентом Трег мышей у человека являются CD4+CD25+CD45RO+–клетки, составляющие примерно 6% CD4+– лимфоцитов в крови здоровых взрослых людей. CD4+CD25+–клетки с регуляторными свойствами описаны среди туморинфильтрирующих лимфоцитов при раке легкого, яичников, поджелудочной и молочной желез, желудочно–кишечного тракта и лимфомах. Для проявления супрессорной функции этих клеток в отношении CD4+ эффекторных клеток необходимы антигенспецифическая активация и межклеточные контакты. Присутствие CD4+ Tрег в самой опухоли указывает на то, что они могут ингибировать противоопухолевые Т–клеточные эффекторные ответы.
Естественные киллерные клетки, несомненно, играют значимую роль в противоопухолевом иммунитете в целом и при РМЖ, в частности. У некоторых больных РМЖ отсутствует активность NК–клеток в отношении мишеней К–562. Уровни NK–клеточной активности являются более низкими у женщин с наличием метастазов в регионарные лимфатические узлы (N+) по сравнению с больными без метастазов (N0). NK–клеточная цитотоксичность была значительно более низкой у больных с высокой частотой семейного рака в сравнении с пациентами, у которых рак в семье встречался редко. У женщин с поздними стадиями РМЖ отмечено подавление NK–клеточной цитотоксичности в сравнении со здоровыми женщинами. Подавление NK–клеточной активности может быть важным медиатором ускорения опухолевого роста при стрессе [18]. Существуют данные, что NK–клеточный дефицит усугубляется по мере опухолевой прогрессии и зависит от клинической стадии заболевания.
Тем не менее, роль NК–клеточной активности в контроле РМЖ остается не до конца понятной. По данным 4 методов изучения NK–клеток, их активность у больных РМЖ и у женщин с доброкачественными процессами в молочной железе не различалась. По данным G. Sachs и соавт. (1995), активность LAK–клеток, а не NK–клеток взаимосвязана с количеством регионарных аксиллярных лимфатических узлов, пораженных метастазами у больных РМЖ. Активность NK–клеток (по лизису клеток–мишеней К–562 и MCF–7) не различалась у больных РМЖ и у пациенток с доброкачественными процессами. Однако большее отношение к прогнозу имела активность в отношении клеток MCF–7.
В пуле туморинфильтрирующих лимфоцитов РМЖ NK–клетки составляют небольшую пропорцию. Их функциональная роль не совсем ясна.
Следует отметить, что в настоящее время отношение к роли NК–клеток не столь однозначное. Помимо позитивной роли в противовирусной и противораковой защите эти клетки могут также угнетать CD8+ Т–цитотоксический иммунитет. Установлена регуляторная роль NK–клеток в адаптивном иммунитете. Например, после удаления NK–клеток усиливается антигенная презентация в ходе инфекции вирусом лимфоцитарного хориоменингита. Аналогичным образом удаление NK–клеток улучшает формирование Т–клеток памяти. Активация NK–клеток ведет к продукции ими интерлейкина–10, который способствует вирусиндуцированному подавлению CD8+–клеток. Последние данные свидетельствуют о том, что отсутствие ингибиторного рецептора 2B4 на NK–клетках ведет к редукции вирусспецифического CD8+ Т–клеточного ответа и более длительной персистенции вируса.
В последние 10–15 лет методы иммуногистохимии с применением МКА помогли установить состав иммунокомпетентных клеток, инфильтрирующих РМЖ, и оценить их значение с позиций современных представлений о противоопухолевом иммунитете.
Проведенные в течение последних 15 лет исследования по изучению состава иммунокомпетентных клеток, инфильтрирующих РМЖ, позволяют со всей определенностью утверждать о необходимости и полезности углубленного изучения субпопуляций интратуморальных лимфоцитов и макрофагов для понимания патогенетических взаимодействий организма и опухоли. Без этих знаний сложно или даже невозможно планировать, проводить и контролировать эффективность тех или иных видов иммунотерапии у больных РМЖ.
Многообразие иммунологических реакций организма на опухоль является базисом для комплексного подхода к иммуногистохимической оценке субпопуляций лимфоцитов в ткани опухоли. Необходимо количественно или полуколичественно оценивать общий уровень лимфоидной инфильтрации на основании экспрессии общелейкоцитарного антигена CD45: выраженная инфильтрация, умеренная, минимальная.
Выраженная Т–клеточная инфильтрация стромы опухоли иммунокомпетентными клетками свидетельствует о том, что опухоль распознается иммунной системой. По–видимому, как и в случаях реакции отторжения трансплантата, формирование лимфоидного вала происходит при участии Т–хелперов (специфических и неспецифических), активно продуцирующих цитокины в ответ на опухолеспецифичные антигены или повреждение тканей. Выраженная реакция туморинфильтрирующих лимфоцитов отнюдь не означает их способности разрушать опухолевую ткань. При исследованиях в иммунофлуоресцентном методе хорошо видны два типа туморинфильтрирующих клеток: в строме и зонах сплошного опухолевого роста. Даже при наличии весьма выраженной инфильтрации Т–лимфоциты могут не проникать в пласт опухолевых клеток. Механизм этого явления еще не до конца понятен. Могут играть роль целостность базальной мембраны, отграничивающей пласт злокачественных эпителиальных клеток, васкуляризация опухолевой паренхимы или какие–то иные причины (в том числе и нарушения функции самих Т–клеток). Так или иначе для успешного осуществления цитотоксического действия необходим контакт между опухолевой клеткой и Т–киллером, а при отсутствии этого контакта осуществление Т–лимфоцитарной цитотоксичности в отношении опухолевых клеток невозможно. В связи с изложенным, предложено наряду с общей инфильтрацией опухолевой ткани оценивать количество и качественный состав туморинфильтрирующих лимфоцитов (ТПЛ). Это разновидность интраэпителиальных лимфоцитов (ИЭЛ), обнаруживаемых в зонах сплошного роста раковых клеток. ТПЛ представляют собой главным образом CD8–позитивные Т–киллеры [1]. Иными словами, иммунофенотипическая характеристика ТПЛ свидетельствует о том, что в зоны сплошного опухолевого роста пенетрируют клетки, которые, согласно современным представлениям, могут являться эффекторами противоопухолевого иммунитета. Количество ТПЛ достоверно взаимосвязано с общим уровнем лимфоидной инфильтрации опухоли, инфильтрацией опухоли Т–клетками и Т–киллерами.
Отражением успешного распознавания опухоли как чужеродной Т–киллерами, пенетрировавшими в опухолевую массу, является активация CD8–позитивных ТПЛ. В этом случае на мембране цитотоксических клеток появляются молекулы HLA–DR, рецептор ИЛ–2 (CD25) и целый ряд других активационных антигенов. Активированные Т–лимфоциты могут пролиферировать и образовывать кластеры в зонах сплошного опухолевого роста, а также вызывать разрушение соседних опухолевых клеток. Все это в совокупности свидетельствует об иммуногистохимическом подтверждении способности Т–лимфоцитов распознавать и элиминировать раковые клетки. Характерным признаком активации ТПЛ является «автономность» этого феномена, его независимость от уровня лимфоидной инфильтрации рака, количества и качественного состава ТПЛ. Подобная особенность легко объяснима с позиций знания взаимодействий между лимфоцитом и клеткой опухоли, Т–клеточным рецептором и комплексом опухолеассоциированного пептида с молекулами HLA–I на мембране раковых клеток.