Лимфоидные элементы в кишечнике что это
Лимфома кишечника
1. Общие сведения
Лимфоциты – один из важнейших иммунных факторов, представляющий собой разновидность белых кровяных телец (лейкоцитов). Основная задача лимфоцитов заключается в запоминании (иммунная память) и уничтожении чужеродных, зараженных, мутировавших клеток, в том числе опухолевых. Повышенный уровень лимфоцитов в крови при отсутствии клинических проявлений инфекции, – или каких-либо иных симптомов, – рассматривается как возможный ранний признак начавшегося онкопроцесса. Однако в некоторых случаях злокачественно увеличивается концентрация самих лимфоцитов; размножаясь хаотично, неудержимо и неадекватно (по отношению к внутренней ситуации в организме), они накапливаются в лимфоузлах и иных органах, что приводит к развитию специфической клинической картины.
Такого рода патология лимфатической системы обозначается собирательным термином «лимфома» и включает группу редких гематологических болезней. Выделяют два гистологически и клинически разных типа лимфом: лимфогранулематоз Ходжкина (составляет не более одного процента в общем объеме регистрируемой онкопатологии) и т.н. неходжкинская лимфома, которая встречается значительно чаще первого типа (около 70% всех злокачественных лимфом).
Лимфома кишечника, таким образом, – одна из разновидностей лимфомы, которая характеризуется патологически быстрым, прогрессирующим накоплением лимфоцитов преимущественно в кишечнике. Со статистической точки зрения, лимфома кишечника встречается реже любых других вариантов локализации, и практически всегда относится к неходжкинскому типу.
2. Причины
Этиопатогенез лимфом, в том числе лимфомы кишечника, к настоящему времени изучен и прояснен недостаточно.
Считается, что предрасполагающим фактором является общая слабость иммунной системы, т.е. больные, например, с ВИЧ/СПИД однозначно попадают в группу риска. Есть также данные о том, что вероятность «запуска» лимфомы значимо повышается при длительном приеме гормонсодержащих препаратов, а также при наличии кишечного паразитоза (отсюда определенная эндемичность заболевания: в беднейших африканских странах его распространенность выше). Кроме того, установлены определенные возрастные и половые тенденции: пик заболеваемости приходится на категорию лиц старше 50 лет, большинство из которых составляют мужчины.
3. Симптомы и диагностика
Клиническая картина формируется многочисленными и, как правило, значительно выраженными симптомами, ни один из которых, однако, не является патогномоничным (однозначно указывающим на данное заболевание). Диагноз «лимфома кишечника» предполагается на основании специфического сочетания таких проявлений, как значительное увеличение и пальпаторная болезненность лимфатических узлов, болевой синдром (обычно усиливающийся в связи с дефекацией и/или приемом пищи), повышение температуры и общее недомогание, разнообразные диспептические явления, гипергидроз. Иногда отмечается примесь крови в каловых массах. Одна из особенностей лимфомы кишечника, отличающая ее от прочих онкозаболеваний, заключается в быстром появлении и нарастании клинически значимых симптомов, что оставляет шанс на раннюю правильную диагностику.
Следует отметить, что лимфомы кишечника широко варьируют в плане агрессивности, темпов роста, конкретной локализации (обычно это тонкий кишечник, реже толстый, очень редко встречается тотальное поражение всего кишечника), гистологических характеристик, а также стадийности в каждом конкретном случае обращения за помощью.
Решающим методом диагностики является биопсия. Некоторые клинические варианты лимфомы кишечника, особенно в запущенных формах, характеризуются крайне неблагоприятным прогнозом, другие (до 50%) считаются излечимыми.
4. Лечение
При установлении и подтверждении диагноза назначается стандартная схема онкологического лечения, как правило, с хирургическим удалением очагов злокачественного скопления лимфоцитов и обязательной последующей химиотерапией. В настоящее время интенсивно и результативно исследуются возможности инновационных методов лечения (иммунотерапия, HIFU-терапия и т.д.), что дает основания для разумного оптимизма в плане перспектив.
Необходимо подчеркнуть, что прогноз при лимфоме кишечника (как и при любых других онкозаболеваниях) критически зависит от своевременности выявления и идентификации патологии, – тем более, что в данном случае ранняя достоверная диагностика вполне возможна. Поэтому при любом сочетании описанных выше симптомов обратиться к врачу следует немедленно.
Лимфоидные элементы в кишечнике что это
Лимфома тонкой кишки принадлежит к числу наиболее распространенных кишечных опухолей у детей моложе 10 лет и также может развиваться у взрослых старше 50 лет. Опухоль поражает преимущественно мужчин (соотношение заболеваемости среди мужчин и женщин составляет 5:1). К развитию опухоли предрасполагают два заболевания. Лимфома кишечника развивается на фоне хронического нелеченого заболевания в брюшной полости.
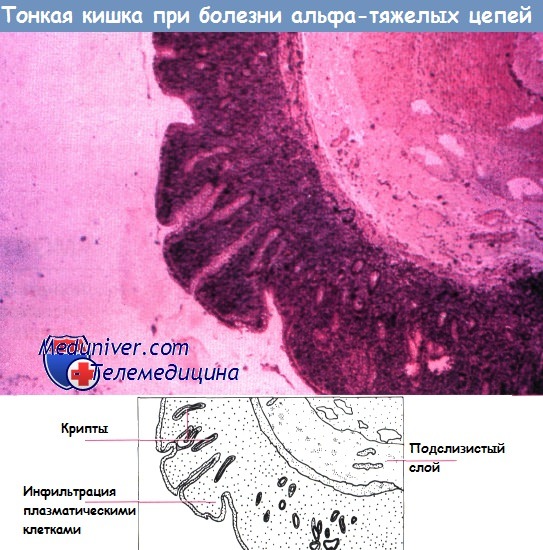
Показано, что при этом возникает Т-клеточная лимфома с обширным поражением кишечника. На Среднем Востоке распространена кишечная лимфома, которая обычно развивается на фоне диффузного пролифератив-ного процесса в тонком кишечнике. Эта патология носит название иммунопролиферативное заболевание тонкого кишечника. При этом заболевании клетки продуцируют повышенное количество тяжелой цепи IgA (болезнь а-цепи). На этой ранней стадии эффективным может оказаться лечение антибиотиками.
В дальнейшем болезнь быстро прогрессирует, и развивается В-клеточная лимфома. С началом развития опухоли в крови перестает обнаруживаться тяжелая цепь иммуноглобулина.
Для кишечных лимфом, развивающихся у населения европейских стран, предрасполагающих заболеваний не выявлено. Опухоль образуется из лимфоидных клеток слизистой кишечника, инвазирует стенку кишки и прорастает в серозную полость. По гистологическим характеристикам многие лим-фомы тонкого кишечника относятся к группе крупноклеточных диффузных лимфом, однако у взрослых некоторые из этих опухолей могут быть малоагрессивными.
Обычно больные жалуются на непроходимость кишечника, которая иногда носит острый характер, и на боли в брюшной области. Часто боли сопровождаются рвотой и запорами. В отдельных редких случаях наблюдается диарея или даже маль-абсорбция. Отмечаются хронические геморрагии, приводящие к железодефицитной анемии. При перфорации кишки развивается типичная картина. Иногда у больных наблюдается асцит обычно хилусной природы, но в отдельных случаях, вызванный обширным внутрибрюшинным распространением лимфомы. При этом может повыситься температура и развиться анемия.
Обычно диагноз ставится на основании лапаротомического или рентгенографического обследования. На рентгенограмме может наблюдаться инфильтрация кишечной стенки, сопровождающаяся образованием язвы. Также видны участки сужения кишки, выше которых расположены области расширения. Лечение НХЛ тонкого кишечника бывает затруднено. Отчасти это связано с тем, что заболевание нередко обнаруживается в стадии, требующей экстренного хирургического вмешательства. Прогноз зависит от результатов операции. В таблице ниже представлена простая классификация стадий развития заболевания, которые непосредственно определяют его прогноз.
Во всех случаях для установления стадии развития лимфомы выполняют рентгенографическое обследование грудной клетки и делают пункцию костного мозга. Во время лапаротомии проводят биопсию печени. При незатронутых брыжеечных лимфатических узлах полная резекция опухоли с максимальной абластикой часто приводит к излечению. Пока не выяснена роль лучевой терапии и адъювантной химиотерапии в лечении таких случаев лимфомы. После полного хирургического удаления малоагрессивной лимфомы можно не проводить дальнейшее лечение.
Чаще сталкиваются со случаями, когда по гистологии опухоль относится к диффузному крупноклеточному типу и поражает регионарные лимфатические узлы. При этом большинство онкологов предпочитает проводить дальнейшее лечение и в последние годы все больше используют комбинированную химиотерапию. Комбинированная химиотерпия может оказаться опасной для больных с не полностью удаленной опухолью, а также при перфорации кишечной стенки, которая произошла в результате распада опухоли. Для таких случаев характерна высокая смертность.
Поэтому иноперабельным больным целесообразно назначать невысокие дозы лекарственных препаратов. При этом за счет более медленной регрессии опухоли достигается постепенное заживление кишечной стенки, и удается избежать гранулоцитопении, которая очень опасна при перфорации. Без применения комбинированной химиотерапии 5-летняя выживаемость больных с диффузными лим-фомами кишки составляет около 20%, а больных с фолликулярными лимфомами — около 50%. Однако эти цифры зависят от стадии болезни.
Обычно, так же как и для лечения диффузной формы НХЛ, в различных схемах используется рецептура, содержащая циклофосфамид, винкристин, доксорубицин и преднизолон. У детей поражение нервной системы наблюдается в редких случаях, и поэтому профилактические лечение у них ЦНС не входит в комплекс обязательных лечебных процедур.
Особую проблему представляет лимфома, развивающаяся на фоне целиакии. Это заболевание принято называть энтеропатической Т-клеточной лимфомой. Лимфома развивается примерно через 7 лет, и даже позже, после того как диагносцирована целиакия. При назначении больным безглютеновой диеты не наблюдается регрессии лимфомы, и обычно у больных в крови не обнаруживаются антитела к глиадину.
Для этой лимфомы характерно распространение по кожным покровам и в легкие. Часто поражается тонкий кишечник, в котором возникают изъязвления, представляющие собой предраковые изменения. По возможности, необходимо проводить хирургическое удаление лимфомы.
В послеоперационном периоде обычно назначают химиотерапию, однако прогноз бывает неблагоприятным из-за проблем с питанием больного, а также из-за высокого риска перфорации стенки кишки и образования геморрагий.
Болезнь а-цепи как причина лимфомы тонкой кишки
Лимфома, развивающаяся на фоне иммунопролиферативного заболевания тонкого кишечника (ИПЗТК), характеризуется трансформацией узелкового инфильтрата слизистой в агрессивную В-клеточную лимфому. Клетки последней секретируют тяжелую а-цепь иммуноглобулина (подкласс I). В недавно проведенных исследованиях показано, что ИПЗТК с самого начала является злокачественной опухолью.
Хотя на ранней стадии под действием антибиотиков ИПЗТК может подвергаться регрессии, при последующей ее трансформации в агрессивную опухоль, лекарственное лечение становится малоэффективным и обычно не дает лечебных результатов.
Лимфоматозный полипоз тонкой кишки
Это редкое заболевание, при котором у людей старше 50 лет в илеоцекальной области образуются полипы. Полипы состоят из центроцитарной опухоли, которая обычно переходит на брыжеечные лимфатические узлы. Для опухоли характерно раннее распространение. При лекарственном лечении может происходить регрессия опухоли, однако, в целом, прогноз неблагоприятный.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Онкология»
Лимфоидные элементы в кишечнике что это
В отличие от тонкой кишки в слепом отделе кишки у людей пожилого возраста, несмотря на аналогичные изменения ее стенки, сохраняются как одиночные лимфоидные узелки, так и узелки, собранные в группы. Однако плотность распределения клеток на стандартной площади среза значительно ниже, по сравнению с аналогичными структурами в периоде расцвета лимфоидной ткани (подростковый и юношеский возраст). В пожилом возрасте в стенках слепого отдела кишки, как и в пейеровой бляшке, во всех зонах лимфоидного узелка возрастает доля плазматических клеток, а также число разрушающихся клеток и макрофагов. Снижается процентное содержание малых лимфоцитов. Однако в слепой кишке пожилых людей, в связи с необходимостью поддержания гуморального иммунитета отмечается некоторое усиление пролиферативной активности лимфоидных структур. О чем свидетельствует увеличение содержания способных к делению клеток и митозов.
Таким образом, возрастной фактор оказывает существенное влияние на структурную организацию самой стенки тонкой и толстой кишок и неблагоприятно сказывается на их лимфоидных образованиях. Это, в свою очередь, приводит к снижению иммунологической активности и защитных функций всего организма. С ослаблением макрофагальной защиты лимфоидных тканей органа, увеличивается количество гранулоцитов и плазматических клеток, что несомненно является проявлением компенсаторной реакции на усиление антигенного воздействия пищевых масс и микрофлоры кишечника. Установлено, что в изучаемые возрастные периоды в тонком отделе кишки такие изменения более выражены, чем в толстой кишке.
Нодулярная лимфоидная гиперплазия (НЛГ)
Нодулярная лимфоидная гиперплазия (НЛГ) ― довольно редкое доброкачественное заболевание, характеризующееся множественными узелками в слизистой оболочке различных отделов желудочно-кишечной трубки: тонкой и толстой кишки, а также желудка.
Распространенность этого заболевания до конца неизвестна, оно достаточно часто встречается у детей до 10 лет, однако иногда может наблюдаться и у взрослых лиц.
Классификация НЛГ
Выделяют две формы заболевания:
1) Фокальная НЛГ ― представлена отдельными очагами, локализованными чаще всего в терминальном отделе подвздошной кишки, прямой кишке и других участках желудочно-кишечного тракта
2) Диффузная НЛГ ― для этой формы характерно вовлечение больших участков желудочно-кишечной трубки (например, вся тонкая кишка).
Этиопатогенез НЛГ
Патогенетические механизмы развития НЛГ до сих пор остаются неясными. Однако существуют несколько теорий, которые отличаются друг от друга в зависимости от того, имеется ли у пациента ассоциированное иммунодефицитное состояние или нет.
Так, если у пациента подтвержден иммунодефицит, то образование узелков в слизистой оболочке может быть результатом скопления предшественников плазматических клеток (неспособных к полноценному созреванию В-лимфоцитов).
НЛГ при отсутствии нарушений иммунодефицита может быть связана с иммунной стимуляцией лимфоидной ткани кишечника. Эта гипотеза предполагает наличие постоянных раздражителей (триггеров) в просвете желудочно-кишечной трубки, чаще всего инфекционного происхождения. Повторяющаяся стимуляция иммунных клеток может привести к возможной гиперплазии лимфоидных фолликулов. Такой механизм может объяснить нередкую ассоциацию лямблиоза и Helicobacter pylori с НЛГ (см.ниже).
Клинические проявления НЛГ
Зачастую НЛГ не имеет никаких симптомов и является случайной находкой во время эндоскопического исследования желудка, толстой и тонкой кишки. Однако некоторые исследователи связывают НЛГ с желудочно-кишечными симптомами, такими как хроническая диарея, боль в животе, желудочно-кишечное кровотечение (оккультное или явное, из прямой кишки) и кишечная непроходимость (очень редко). У части пациентов может отмечаться потеря белка и снижение массы тела.
Насколько велик вклад НЛГ в возникновение симптомов, до сих пор остается неясным. Является ли это состояние первопричиной жалоб или НЛГ ― всего лишь случайная находка у пациента с желудочно-кишечной симптоматикой? Вопросов больше, чем ответов.
Ассоциированные с НЛГ заболевания и состояния
Достаточно часто по сравнению с другими лицами НЛГ выявляется у пациентов с иммунодефицитами. Так, 20% больных, страдающих общим вариабельным иммунодефицитом (ОВИД), имеют НЛГ. ОВИД ― заболевание, характеризующееся снижением уровней иммуноглобулинов различных субклассов (G, A, M), нарушенным иммунным ответом из-за снижения выработки антител. Пациенты часто страдают рецидивирующими бактериальными инфекциями дыхательных путей, аутоиммунными заболеваниями и имеют повышенный риск развития онкологических патологий. НЛГ при ОВИД обычно генерализованная, с вовлечением всей тонкой кишки.
НЛГ нередко ассоциирована с селективным дефицитом IgA, который выявляется у 1 из 300-700 лиц европеоидной расы. У таких людей отмечается снижение уровня IgA в крови ниже 0,7 г/л при нормальных или даже повышенных уровнях других иммуноглобулинов. Большинство лиц с селективным дефицитом IgA бессимптомны, однако у части из них встречаются рецидивирующие инфекции верхних дыхательных путей, аутоиммунные заболевания, аллергии и желудочно-кишечные патологии (целиакия, НЛГ).
НЛГ может быть ассоциирована с лямблиозом как у лиц с нормальным иммунным ответом, так и с иммунодефицитом. Триада НЛГ + лямблиоз + снижение уровня гамма-глобулинов известна как синдром Германа (англ. Herman’s syndrome).
Инфекция Helicobacter pylori может быть причиной развития НЛГ с вовлечением желудка и 12-перстной кишки.
НЛГ также нередко встречается у лиц с ВИЧ-инфекцией, может быть ассоциирована с семейным аденоматозом толстой кишки и синдромом Гарднера.
Существуют данные о возможной ассоциации синдрома раздраженного кишечника (СРК) с НЛГ. При этом рядом авторов НЛГ рассматривается как проявление малоактивного воспаления в слизистой оболочке толстой кишке у пациентов с СРК.
Осложнения НЛГ
НЛГ ― заболевание доброкачественное, и крайне редко приводит к развитию осложнений. Однако описаны случаи кишечной непроходимости у лиц с распространенным процессом в тонкой кишке, а также кишечных кровотечений..
Известно, что у лиц с НЛГ повышается риск лимфопролиферативных заболеваний (лимфомы), однако точный риск не установлен.
Диагностика НЛГ
Существует два основных метода диагностики НЛГ:
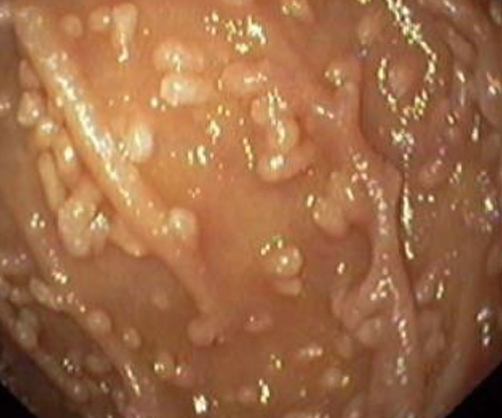
1) Эндоскопический ― выявление узелков различных размеров (2-10 мм, в среднем 5 мм) на слизистой оболочке желудка, тонкой кишки, толстой/прямой кишки. Такие узелки (чаще всего в виде выступающих папул) могут быть обнаружены при гастроскопии (ЭГДС), колоноскопии, энтероскопии или капсульной эндоскопии.
На фото ― НЛГ в 12-перстной кишке.
2) Гистологический метод ― выявление в слизистой оболочке и в поверхностной части подслизистого слоя увеличенных (гиперплазированных) лимфоидных фолликулов, которые обычно формируют группы, и могут практически сливаться между собой.
Дифференциальный диагноз
Дифференциальный диагноз ЛНГ проводится с лимфопролиферативными заболеваниями (лимфома тонкой кишки, желудка). При локализации НЛГ в толстой кишке ее элементы (узелки) могут напоминать аденоматозные полипы.
Важно помнить, что у некоторых пациентов при проведении илеоколоноскопии в подвздошной кишке могут также выявляться лимфоидные фолликулы. В этой зоне концентрация лимфоидных фолликулов максимальная по сравнению с другими отделами кишечной трубки. При этом в отличие от НЛГ узелки (те самые лимфоидные фолликулы) небольших размеров (1-3 мм, реже больше), они располагаются отдельно друг от друга, не сливаясь, между ними видны участки нормальной слизистой. Эти изменения не следует рассматривать как патологию, они ― вариант нормы.
Лечение НЛГ
Сама по себе ЛНГ не требует лечения. В случае, если имеются ассоциированные заболевания (лямблиоз, инфекция Helicobacter pylori), следует провести терапию, направленную на удалению возбудителя.
Прогноз НЛГ
Прогноз НЛГ в целом благоприятный, в большинстве случаев требуется лишь динамическое наблюдение за пациентом.
Роль микробиоты кишечника в поддержании здоровья
Микрофлора представляет собой метаболически активную и сложную экосистему, состоящую из сотен тысяч микроорганизмов — бактерий, вирусов и некоторых эукариот. Подобно невидимому чулку, биоплёнка покрывает все слизистые нашего организма и кожу. Микробиота объединяет более чем 10 14 (сто биллионов) клеток микроорганизмов, что в 10 раз превышает число клеток самого организма. Микробиота находится в содружественных отношениях с организмом человека: организм хозяина предоставляет среду обитания и питательные вещества, микроорганизмы защищают организм от патогенных возбудителей, способствуют поддержанию нормальных иммунологических, метаболических и моторных функций. Выделяют несколько важных биотопов, которые отличаются плотностью распределения микроорганизмов и составом: кожные покровы, слизистые оболочки ЖКТ, дыхательных путей, урогенитального тракта и проч. Самой многочисленной считается микробиота кишечника, на её долю приходится 60% микроорганизмов, колонизирующих организм человека.
Микрофлора кишечника состоит из группы микроорганизмов, представленных более чем 1000 видами, 99% из которых приходится на 30–40 главных видов. В научных кругах кишечную микрофлору называют также дополнительным органом.
Состояние микробиоты кишечника определяет качество и продолжительность жизни. У каждого человека есть свой индивидуальный характер распределения и состава микробиоты. Частично он определяется генотипом хозяина и первоначальной колонизацией, которая происходит сразу после рождения. Различные факторы, такие как тип родов, кормление грудью, образ жизни, диетарные предпочтения, гигиенические условия и условия окружающей среды, использование антибиотиков и вакцинация, могут определять окончательные изменения в структуре микробиоты.
При изменении состава или функции микробиоты развивается дисбиоз. Дисбиотические состояния изменяют моторику кишечника и его проницаемость, а также искажают иммунный ответ, тем самым создавая предпосылки для развития провоспалительного состояния. Такие изменения, особенно в отношении иммунных и метаболических функций хозяина, могут вызывать или способствовать возникновению ряда заболеваний, например, сахарного диабета, ожирения, неврологических и аутоиммунных заболеваний. Недавние исследования показали, что микробиота участвует в этиопатогенезе многих гастроэнтерологических заболеваний, таких как синдром раздраженного кишечника, воспалительные заболевания кишечника, целиакия, неалкогольный стеатогепатит и новообразования желудочно-кишечного тракта.
Кишечная микрофлора и иммунитет
Кишечная микробиота имеет решающее значение для развития лимфоидных тканей, а также для поддержания и регуляции кишечного иммунитета.
В кишечнике происходит сенсибилизация иммуноцитов, которые затем заселяют другие слизистые оболочки и циркулируют между различными органами. Этот механизм обеспечивает формирование клонов лимфоцитов и образование специфических антител в участках слизистой оболочки, отдалённых от очага первичной сенсибилизации.
Иммунокомпетентные ткани пищеварительного тракта объединены в лимфоидную ткань. Лимфоидная ткань представлена лимфоцитами, расположенными между эпителиальными клетками кишечника, лимфоцитами собственного слоя, пейеровыми бляшками (скопления лимфоидной ткани в тонкой кишке) и лимфоидными фолликулами.
Попавшие в просвет кишечника или на слизистые оболочки антигены распознаются иммуноглобулинами памяти (IgG), после чего информация передаётся в иммунокомпетентные клетки слизистой оболочки, где из сенсибилизированных лимфоцитов клонируются плазматические клетки, ответственные за синтез IgА и IgМ. В результате защитной деятельности этих иммуноглобулинов включаются механизмы иммунореактивности или иммунотолерантности. Благодаря индукции иммунологической толерантности в кишечнике не возникают нежелательные воспалительные реакции против кишечной микробиоты и пищевых белков.
Кишечная микробиота и обмен веществ
Кишечная микробиота вносит непосредственный вклад в метаболизм питательных веществ и витаминов, необходимых для жизнедеятельности организма хозяина, при этом извлекая энергию из пищи. Эта энергия образуется путём реакции сбраживания не усваиваемых углеводов (клетчатки), в результате реакции образуются короткоцепочечные жирные кислоты, водород и углекислый газ.
Короткоцепочные жирные кислоты обеспечивают работу колоноцитов.
Короткоцепочные жирные кислоты считаются тонкими регуляторами иммунитета, энергетического обмена и метаболизма жировой ткани. Например, короткоцепочные жирные кислоты участвуют во взаимодействии бактерий и иммунитета, подавляя сигналы, которые могут привести к развитию аутоиммунных реакций. Пропионовая и масляная жирная кислота положительно влияют на метаболизм глюкозы. Наконец, короткоцепочные жирные кислоты обеспечивают подкисление просвета толстой кишки, предотвращая рост бактериальных патогенов.
Кишечная микробиота принимает непосредственное участие в метаболизме желчных кислот, источником которых является холестерин. В печени из холестерина синтезируются первичные желчные кислоты — холевая и хенодезоксихолевая, которые поступают в кишечник. Бактероиды и лактобациллы далее превращают первичные желчные кислоты во вторичные желчные кислоты — дезоксихолевую и литохолевую. Изменение нормального баланса кишечных бактерий приводит к неадекватному синтезу желчных кислот.
Микробиота и нервная система
Ещё более удивительные данные о взаимосвязи кишечной микробиоты и нервной системы. Микробиота кишечника тесно общается с центральной нервной системой. Микробиота кишечника производит такие нейроактивные молекулы, как ацетилхолин и серотонин, дофамин, которые являются главными медиаторами сигналов в ЦНС, а также регулируют работу мозга через активацию иммунных сигнальных путей. Дополнительно, блуждающий нерв активно участвует в двунаправленных взаимодействиях между кишечной микробиотой и мозгом для поддержания гомеостаза как в головном мозге, так и в кишечнике.
Недавние исследования показали, что микробиом влияет на свойства и функцию микроглии. Микроглия защищает мозг от различных патологических состояний через активацию иммунного ответа, фагоцитоза и продукцию цитокинов. Кроме того, микроглия ответственна за формирование нейронных цепей, которые участвуют в развитии мозга. Различные дисбиотические состояния, в том числе вызванные приёмом антибиотиков приводят к угнетению созревания клеток микроглии. Незрелая микроглия приводит к нарушению иммунной активации.
Астроциты — самая многочисленная клеточная популяция в ЦНС, и они почти в пять раз превосходят численность нейронов. Подобно микроглии, астроциты выполняют несколько важных функций по поддержанию целостности ЦНС, включая контроль кровообращения в головном мозге, поддержание стабильности гематоэнцефалического барьера. Астроциты регулируют баланса ионов и оказывают влияние на передачу сигналов между нейронами. Чрезмерная активация астроцитов является пусковым механизмом в развитии дисфункции ЦНС и неврологических расстройств. Чрезмерная активация происходит под действием метаболитов микрофлоры.
Целостность гематоэнцефалического барьера регулируется также метаболитами микробиоты, которые опосредуют передачу большего количества микробных сигналов между осью кишечник-мозг.
Дисбиоз микробных видов в кишечнике может вызывать атипичные иммунные сигналы, дисбаланс в гомеостазе организме-хозяина и привести к прогрессированию заболеваний ЦНС. Например, рассматривается роль микробиоты в патогенезе рассеянного склероза-заболевания, характеризующимся демиелинизацией аксонов нервных клеток. При болезни Паркинсона, которая проявляется моторными симптомами, включая тремор, мышечную ригидность, медлительность движений и аномалию походки наблюдается накопление α-синуклеина в нейронах. Избыточное отложение α-синуклеина в нервной системе инициируется кишечной микрофлорой до того, как возникают симптомы поражения ЦНС, что связано с некоторыми специфическими пищеварительными симптомами (запоры и нарушение двигательной функции толстой кишки). Бактериальный состав кишечника влияет на болезнь Паркинсона: тяжесть симптомов, в том числе постуральная нестабильность и нарушение походки, связана с изменениями численности некоторых видов Enterobacteriaceae, уменьшение количества Lachnospiraceae приводит к более серьёзному ухудшению моторных и немоторных симптомов у пациентов с болезнью Паркинсона. Болезнь Альцгеймера — ещё одно нейродегенеративное заболевание, которое приводит к серьёзным нарушениям функции ЦНС — обучению, памяти и поведенческим реакциям. Болезнь Альцгеймера характеризуется отложением пептида амилоид-β (Aβ) снаружи и вокруг нейронов, вместе с накоплением белка тау внутри корковых нейронов. Перегрузка амилоидом и агрегация тау нарушают синаптическую передачу. Изменение состава и разнообразия микробиоты вносит определённый вклад в патогенез болезни Альцгеймера. Активированная микроглия способствует развитию заболевания, увеличивая отложение амилоида.
Ожирение и состав микробиоты
При ожирении и сахарном диабете наблюдаются изменения в составе микробиоты кишечника, в частности, снижение популяционного уровня сахаролитических бактероидов, влияющих на интенсивность метаболических процессов, а также увеличение доли бактерий класса Firmicutes (Esherichia coli, Clostridium coccoides, Clostridium leptum). Снижение содержания сахаролитических бактерий уменьшает выработку коротко-цепочных жирных кислот, обеспечивающих трофику и деление эпителия кишечника, его созревание, оказывающих антимикробное действие и регуляторное действие в отношении ионов и липидов.
Дополнительно при ожирении отмечается хроническое системное воспаление, сопровождающееся секрецией провоспалительных цитокинов (интерлейкины — ИЛ, С-реактивный белок, α-фактор некроза опухоли — α-ФНО и др.) в висцеральной жировой ткани. Нарушения в составе кишечной микрофлоры приводят к усилению эффекта системного воспаления за счёт увеличения концентрации бактериальных липополисахаридов, стимулирующих выработку провоспалительных компонентов.
Диагностика состояния кишечной микробиоты
Существует два метода определения микробиоты — стандартный анализ на дисбактериоз и оценка состава микробиоты методом масс-спектрометрии по крови (ГХ-МС). В основе методики масс-спектрометрии лежит определение присутствия микроорганизмов по их клеточным компонентам (высшие жирные кислоты, альдегиды, спирты и стерины). Методика разработана профессором Осиповым Г.А. Метод ГХ-МС позволяет одновременно измерять более сотни микробных маркёров непосредственно в образце, позволяющих сделать заключение о некультивируемых и труднокультивируемых патологических возбудителях. Метод универсален также в отношении грибов и вирусов.