Лимфопролиферативное заболевание с поражением лимфоузлов шеи что это
Аутоиммунный лимфопролиферативный синдром
Аутоиммунный лимфопролиферативный синдром – группа генетически обусловленных заболеваний, которые возникают по причине наследственных или соматических мутаций в генах, отвечающих за различные этапы FAS-обусловленного апоптоза. Симптоматика может быть вариабельной и наиболее часто включает в себя лимфаденопатию, спленомегалию и разнообразные аутоиммунные поражения системы крови, печени, щитовидной железы. Диагностика аутоиммунного лимфопролиферативного синдрома производится на основании результатов общего и биохимического анализов крови, биопсии лимфатических узлов, генетических исследований. Специфического лечения заболевания в настоящий момент нет, применяют комбинации иммунносупрессивной и цитотоксической терапии.
Общие сведения
Аутоиммунный лимфопролиферативный синдром (АЛС, ALPS, синдром Канале-Смит) – группа иммунодефицитных состояний, характеризующихся аутоиммунными цитопениями, лимфаденопатией, спленомегалией. Первые данные о заболевании стали поступать в 1968-м году, после чего вскоре началось бурное изучение патологии. Изначально АЛС был отнесен к первичным иммунодефицитам, однако со временем были обнаружены формы синдрома, обусловленные соматическими мутациями в детском и подростковом организме.
Данные о встречаемости у разных исследователей довольно сильно различаются, на сегодняшний момент описано более 500 случаев различных форм аутоиммунного лимфопролиферативного синдрома. Наследственные формы заболевания передаются по аутосомно-доминантному типу, при этом в развитии врожденных форм также довольно велика роль спонтанных мутаций. Среди больных с одинаковой частотой встречаются как мальчики, так и девочки.
Причины
Выяснено, что причиной любого типа АЛС является нарушение FAS-опосредованного апоптоза лимфоцитов. При образовании Т-лимфоцитов те линии, которые способны атаковать собственные ткани, уничтожаются за счет активизации рецепторов CD-95 (Fas-рецепторов) на поверхности их мембраны. Активация CD-95, относящегося к группе рецепторов фактора некроза опухолей, запускает многостадийную реакцию с участием каспаз, которая оканчивается апоптозом клетки.
При аутоиммунном лимфопролиферативном синдроме генетические мутации приводят к блоку этого процесса на определенном этапе, из-за чего устранения потенциально опасных клонов Т-лимфоцитов не происходит, и они начинают накапливаться в лимфатических узлах. Кроме того, создаются условия для аутоиммунного поражения органов и тканей.
Наиболее часто встречаются наследственные и спонтанные мутации в гене TNFRSF6, который кодирует собственно Fas-рецептор. При этом нарушение структуры белка (особенно домена, отвечающего за взаимодействие с FADD-молекулой) приводит к тому, что он становится неспособным выполнять свои рецепторные функции и активизировать апоптоз. Возможны и соматические мутации в гене FAS, которые в полной мере проявляют себя в позднем детском или подростковом периоде, и поэтому их относят к отдельной группе АЛС.
Второй по распространенности вариант аутоиммунного лимфопролиферативного синдрома обусловлен мутацией в гене CASP10, кодирующем цистин-аспарагин кислотную протеазу (каспаза-10). Этот белок играет ключевую роль в передаче сигнала об апоптозе с клеточной мембраны в ядро клетки. К этому же варианту относят и мутации гена CASP8.
Третьим по распространенности является аутоиммунный лимфопролиферативный синдром, который вызван мутацией в гене FASLG, кодирующем Fas-лиганд или рецептор CD-178. Он играет вспомогательную роль в распознавании факторов, стимулирующих апоптоз, и участвует в передаче сигнала в клетку.
Некоторые формы АЛС обусловлены мутацией гена NRAS, который кодирует «малый G-белок», принимающий участие в качестве вторичного мессенджера в передаче сигналов с мембраны в клетку, в том числе и ядро. Примерно в трети случаев аутоиммунного лимфопролиферативного синдрома врачам-иммунологам не удается установить непосредственную причину заболевания.
Классификация аутоиммунного лимфопролиферативного синдрома
При помощи методов современной генетики удалось выявить шесть основных форм АЛС:
ALPS 1A – вызвана мутацией гена TNFRSF6, расположенного на 10-й хромосоме, чаще всего имеет врожденный характер, наследуется по аутосомно-доминантному типу. По статистике, более 40% АЛС относятся именно к этой разновидности.
ALPS 1В – обусловлена мутацией гена FASLG, также довольно часто приводит к врожденному аутоиммунному лимфопролиферативному синдрому. К этому типу относят около 10% от всех клинических случаев АЛС.
ALPS 1m – ее причиной являются соматические мутации в гене FAS, возникающие в детском или подростковом возрасте и поэтому приводящие к поздним формам АЛС. При этом повреждение гена должно произойти в полипотентной клетке-предшественнице, которая способна дать начало многим линиям лимфоцитов. При этой форме наиболее часто возникает внезапная самопроизвольная ремиссия заболевания.
ALPS 2 – вызвана мутацией в генах CASP10 и, по некоторым данным, CASP8, которые кодируют белки-каспазы, передающие сигнал об апоптозе от рецептора к ядру клетки. Эта форма аутоиммунного лифопролиферативного синдрома составляет примерно 25% от всех случаев заболевания, может быть как врожденной, так и проявиться в более старшем возрасте.
ALPS 3 – мутация какого гена и характер ее наследования при этой форме неизвестны. Особенностью такого варианта АЛС является нарушение не только FAS-, но и IL2-опосредованного апоптоза, а также более тяжелый характер течения.
ALPS 4 – обусловлена мутацией гена NRAS, также кодирующего белки-передатчики внутриклеточного сигнала. Данный тип аутоиммунного лимфопролиферативного синдрома характеризуется более доброкачественным течением и умеренной выраженностью симптомов.
Симптомы аутоиммунного лимфопролиферативного синдрома
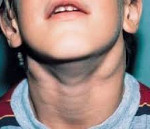
Симптомы АЛС довольно вариабельны из-за большого количества мутаций, которые могут приводить к такому состоянию. Начало заболевания можно заметить уже на 15-й день после рождения (при врожденных формах), в детском или подростковом возрасте в случае соматических мутаций в генах FAS, CASP10 или NRAS. Обычно первым проявлением заболевания является лимфаденопатия – подмышечные, паховые или шейные лимфатические узлы увеличиваются в размерах, но при этом безболезненны и не спаяны с окружающими тканями. Регистрируется спленомегалия, в некоторых случаях она сопровождается увеличением печени (гепатоспленомегалия).
Аутоиммунные проявления АЛС регистрируются обычно через некоторое время после лимфаденопатии и увеличения селезенки. В основном это поражения кровяных ростков – тромбоцитопения, гемолитическая анемия, приводящая к желтухе, изредка нейтропения. Помимо крови, аутоиммунному поражению могут подвергаться органы ЖКТ (возникают гастрит, панкреатит, колит, аутоиммунный гепатит). На коже могут проявляться признаки васкулита, делая клинику аутоиммунного лимфопролиферативного синдрома схожей с таковой при системной красной волчанке. Кроме того, могут возникать аутоиммунные формы тиреоидита, гломерулонефрита, поражаться суставы, ткани глаза (иридоциклит, увеит). Нередки поражения центральной нервной системы – эпилептические припадки, миелиты, мозжечковая атаксия.
Выраженность симптомов и их количество может значительно варьироваться у каждого конкретного больного. Кроме того, при аутоиммунном лимфопролиферативном синдроме в десятки раз возрастает риск развития злокачественных опухолей, так как опухолевые клоны лимфоцитов также устраняются посредством апоптоза.
Примерно в 20% случаев АЛС приводит к неходжкинским лимфомам (лимфома Беркитта, фолликулярная лимфома), описаны и другие онкологические заболевания. Из-за этого проявления АЛС могут быть ошибочно определены как следствие опухолевой инфильтрации лимфоидной ткани. Среди других осложнений аутоиммунного лимфопролиферативного синдрома наиболее часто встречается травматический разрыв селезенки, сепсис и другие инфекционные поражения.
Диагностика
Диагностика АЛС производится на основании осмотра, а также лабораторных, иммунологических и генетических исследований. При осмотре выявляют увеличение более чем трех групп лимфатических узлов, спленомегалию, увеличение печени. Анализ крови может показывать уменьшение количества некоторых клеток (анемию, тромбоцитопению), у части больных определяется высокая (до 30%) эозинофилия. Проба Кумбса положительная, в биохимическом анализе крови определяется выраженная гипергаммаглобулинемия.
Одним из высокочувствительных методов иммунологической диагностики аутоиммунного лимфопролиферативного синдрома является проточная иммуноцитофлюориметрия, проводимая с целью выявления количества лимфоцитов с атипичным набором рецепторов (CD3+CD4-CD8-). При АЛС количество таких клеток превышает 1% от всех лимфоцитов. В биоптате лимфатических узлов определяется фолликулярная гиперплазия, результатом гистологического исследования селезенки служит лимфоидная гиперплазия.
Врачом-генетиком может быть произведено секвенирование гена FAS с целью выявления мутаций, ставших причиной аутоиммунного лимфопролиферативного синдрома. С учетом значительной величины этого гена для ускорения и удешевления процедуры поиск может быть произведен лишь в отдельных экзонах гена FAS, в которых наиболее часто обнаруживаются нарушения – эти участки называют «горячими точками». Таким образом, при помощи генетической диагностики можно определить АЛС только 1А, 1В и 1m типов. Методики определения остальных форм АЛС генетическими методами на сегодняшний день не разработаны. Изучение наследственного анамнеза в ряде случаев будет неэффективно из-за значительной доли форм заболевания, вызванных соматическими мутациями.
Лечение аутоиммунного лимфопролиферативного синдрома
Этиотропное лечение аутоиммунного лимфопролиферативного синдрома не разработано, патогенетическая терапия сводится к применению иммуносупрессивных и цитотоксических средств. В качестве средств, подавляющих аутоиммунную активность, наиболее часто используют кортикостероиды (преднизолон, дексаметазон). К специфическим препаратам, ограничивающим скорость пролиферации лимфоцитов, относят микофенолата мофетил, сиролимус. Также при аутоиммунном лимфопролиферативном синдроме активно применяются традиционные цитотоксические средства – метотрексат, циклоспорин А и другие.
При значительном увеличении селезенки или отсутствии эффекта от консервативного лечения прибегают к спленэктомии. Пересадка костного мозга и использование стволовых клеток в долгосрочной перспективе давали только временный эффект. При значительно выраженных гематологических нарушениях применяют гемотрансфузии, введение эритроцитарной или тромбоцитарной массы. Больному следует избегать физических нагрузок, использовать высоковитаминную диету.
Прогноз
Прогноз заболевания, ввиду высокой вариабельности и выраженности симптомов, неопределенный или неблагоприятный. У большей части больных проявления заболевания постепенно нарастают, со временем приводя к летальной анемии, тромбоцитопении, билиарному циррозу печени. Также важную роль в прогнозе играют нарушения иммунитета, так как нередко причиной смерти выступают сепсис и другие инфекционные поражения. В прогнозе аутоиммунного лимфопролиферативного синдрома следует учитывать и повышенный риск онкологических заболеваний, примерно пятая часть больных умирает от различных типов лимфом. В некоторых случаях возникает спонтанная и длительная ремиссия патологии.
Поражение легких при лимфоме
Лимфома (лимфоролиферативный процесс) — это группа онкологических процессов с поражением лимфоцитов (клеток иммунной системы), которые сопровождаются изменениями в лимфатических узлах и сосудах. При этом может происходить метастазирование — миграция злокачественных клеток в соседние органы и ткани с образованием вторичных очагов рака. Увеличенные узлы при лимфоме (> 1 см в поперечнике) — плотные и абсолютно безболезненные, поэтому выявляемость заболевания на ранней стадии сравнительно низкая. В этой статье мы расскажем, какие бывают лимфомы, о симптомах, которые должны насторожить, о визуализации патологических изменений на КТ.
Лимфома легких — что это?
Лимфатическая система легких напоминает ветвистое дерево — ее сосуды пронизывают грудную клетку по всей длине и отвечают за лимфоток. Здесь расположено 13 разновидностей лимфотических узлов, классифицируемых по 5 группам:
1.Надключичные лимфатические узлы;
2.Верхние медиальные лимфатические узлы (паратрахеальные, преваскулярные, превертебральные);
3.Аортальные лимфатические узлы;
4.Нижние медиастинальные лимфатические узлы;
5.Корневые, долевые, (суб)сегментарные лимфатические узлы.
В узлах фильтруется лимфа и происходит созревание лимфоцитов. Лимфомы возникают в лимфатических узлах.
Пораженные лимфатические узлы зачастую не видны и не пальпируются. Патологические изменения — увеличенные лимфоузлы, уплотнение ткани — хорошо видны на мультисрезовом КТ-сканировании в высоком разрешении или на МРТ. Для определения специфики новообразования (нормальный или злокачественный процесс) лечащий врач может направить пациента на гистологическое исследование. В одних ситуациях увеличение узлов является относительной нормой (после перенесенных инфекционно-воспалительных заболеваний, травм, аллергических реакций), в других указывает на онкологический процесс. В последнем случае речь может идти о лимфоме.
Поскольку лимфатическая система представляет собой обширную сеть сосудов, капилляров и полостей, то злокачественные клетки могут распространиться по всему телу, образовав множественные диссеминированные метастазы.
Диагностика лимфомы легких
Обычно медицинские специалисты отдают предпочтение МРТ, поскольку отсутствует лучевая нагрузка однако в случае с обследованием воздушной ткани легочной паренхимы, которая в норме практически не содержит жидкость, наиболее подробные результаты обследования и детализированное изображение можно получить с помощью КТ легких. Если лимфома выявлена на МРТ, и у врача есть подозрение, что раковые клетки мигрировали в костную ткань, то пациенту будет рекомендовано дополнительное обследование костей. В ходе компьютерной томографии исследуют ткани разной морфологии, попадающие в зону интереса: кости, внутренние органы, сосуды. Для диагностики последних необходимо дополнительное контрастирование.
Симптомы лимфомы лёгких
Основным симптомом, по которому проще всего заподозрить лимфому легких, является увеличение лимфоузлов, локализованных в области ключиц, шеи, средостения, между ребрами. Некоторые узлы спрятаны в самой грудной клетки и не пальпируются. В таком случае лимфома дает о себе знать только тогда, когда увеличивается в размере и начинает давить на соседние органы, что вызывает дискомфорт.
Важно понимать, что увеличение лимфоузлов не является специфическим признаком злокачественной лимфомы. Оно наблюдается после антибактериальной терапии и при любом инфекционно-воспалительном заболевании — педикулезе, ОРВИ, инфекциях ротоглотки и гортани (включая заболевания стоматологического характера), при болезни кошачьих царапин (лимфоузлы увеличиваются в ответ на повреждение кожи или укус, но не сразу, а в течение последующих 3-20 дней).
Обычно лимфоузлы, увеличенные из-за воспалений, при пальпации болят и вызывают дискомфорт. При лимфоме узлы безболезненные.
Некоторые вирусы способны менять нормальную структуру ДНК лимфоцитов таким образом, что клетки превращаются в злокачественные. Так вирус Эпштейна–Барр (ВЭБ) или ВИЧ-инфекции в анамнезе существенно повышает риск развитие лимфом.
К ранним симптомам лимфомы легких относится:
В течение первых четырех недель проявляются и другие симптомы лимфомы лёгких:
У некоторых пациентов наблюдается кожный зуд. Если лимфома сдавливает органы дыхания или происходит их поражение агрессивными раковыми клетками, возможны затрудненное дыхание, кашель, одышка.
Диагностировать лимфому самостоятельно невозможно, необходимо медицинское исследование внутренних органов и тканей лимфатической системы методом КТ или МРТ.
Лимфома легких — это рак?
Не всегда. Однако к лимфомам относятся преимущественно злокачественные новообразования лимфатической системы, которые формируются из-за бесконтрольного накопления патологически измененных лимфоцитов. Исключением могут быть индолентные лимфомы. Они не требуют лечения, однако наблюдать их тоже важно. Если при этом у пациента проявляется вышеописанная симптоматика (температура, лихорадка, боль в грудной клетке), то обследование и лечение таких лимфом должно проводиться обязательно.
Злокачественные клетки-лимфоциты обладают формой, отличной от «правильных» клеток, и представляют собой фатальный «сбой» в работе организма. У таких клеток возникают совсем другие функции – они производят огромное количество белков и токсинов, при этом не уничтожаются клетками иммунной системы как враждебные.
Лимфомы не всегда являются первичным очагом онкологии. Патологически увеличенный узел или их группа (диссеминированная или локализованная в одном месте) часто бывает следствием метастатических процессов. Это происходит в связи с тем, что лимфатический узел выполняет функцию фильтра и накапливает в себе злокачественные клетки, отделившиеся от первично пораженного органа. В таком случае важно не только выявить лимфому, но и первичный очаг. Увеличение лимфоузлов легких может указывать на рак легких, молочной железы, средостения, желудка, то есть органов, расположенных в непосредственной близости.
Уточнить диагноз относительно доброкачественного или злокачественного новообразования можно по результатам биопсии (гистологического исследования образца ткани). Также пациент сдает клинический и биохимический анализы крови.На КТ легких врачи выявляют новообразование, могут оценить его размер, распространенность увеличенных лимфоузлов, однако сделать точный вывод о разновидности опухоли без анализов не представляется возможным.
Какие бывают лимфомы?
Первично лимфомы принято делить на две большие группы:
По данным НМИЦ онкологии им. Н.Н. Блохина, в России заболеваемость неходжкинскими лимфомами в 1,5-3 раза превышает заболеваемость лимфогранулематозом.
Разница между этими лимфомами становится ясна после морфологического исследования образца ткани (биопсии). При болезни Ходжкина в пораженных лимфоузлах обнаруживаются крупные мутировавшие клетки Березовского — Штернберга — Рида. Ходжкинские лимфомы отличаются более агрессивным течением с ярко выраженной симптоматикой, но они легко поддаются лечению.
Пораженные Ходжкинской болезнью лимфоузлы чаще всего расположены над ключицами, в области шеи, подмышечных впадин, средостения.
Неходжкинские лимфомы помимо B-лимфоцитов, поражают еще и T-лимфоциты. Заболевание обычно протекает без выраженной симптоматики и тяжело лечится. Но сначала необходимо правильно определить разновидность неходжкинской лимфомы — актуальная классификация состоит из 30 наименований, включая:
4 стадии лимфомы легких
Стадии течения заболевания определяют по распространенности лимфом и объему пораженной ткани:
При этом симптомы лимфомы могут быть выраженными уже на первой стадии, а могут не ощущаться пациентом практически до четвертой.
Лимфома легких на КТ
Признаки лимфомы легких особенно выражены на четвертой стадии заболевания, когда болезнь поражает дыхательный орган. На КТ при этом будут видны увеличенные лимфоузлы, формирующие цепочки, конгломераты. При этом у пациента может также наблюдаться отек легких. Однако высокая разрешающая способность КТ позволяет выявить лимфому на ранней, первой стадии.
На КТ лимфомы, как и любые уплотнения, визуализируются сравнительно более светлым цветом. В норме воздушная легочная паренхима практически однородного темного цвета. Иногда таких уплотнений несколько и они диссеминированны. Контуры лимфомы четкие и ровные. Вокруг патологических очагов обнаруживаются участки «матового стекла».
Текст подготовил
Котов Максим Анатольевич, главный врач центра КТ «Ами», кандидат медицинских наук, доцент. Стаж 19 лет
Если вы оставили ее с 8:00 до 22:00, мы перезвоним вам для уточнения деталей в течение 15 минут.
Если вы оставили заявку после 22:00, мы перезвоним вам после 8:00.
Лимфопролиферативное заболевание с поражением лимфоузлов шеи что это
● В мире ежегодно 500,000 человек заболевают неходжкинскими лимфомами
● 40% пациентов с ранним рецидивом и рефрактерным течением диффузной В-крупноклеточной лимфомы имеют крайне неблагоприятный прогноз, а их выживаемость на стандартной химиотерапии составляет около 6 месяцев
● Впервые за 15 лет в России стал коммерчески доступным препарат для терапии рецидивирующей и рефрактерной диффузной В-крупноклеточной лимфомы, который может повысить показатели выживаемости пациентов
«Несмотря на то, что лимфомы принято рассматривать отдельно от солидных опухолей из-за различного клинического течения, ответа на химиотерапию и прогноза, они являются злокачественными заболеваниями, которые ставят под угрозу здоровье и жизнь пациента – подчеркивает д.м.н, профессор, зав. отделением химиотерапии гемобластозов НМИЦ онкологии им. Н.Н. Блохина Минздрава РФ Гаяне Тумян. – В России регистрируется примерно 4-5 случаев неходжкинских лимфом на 100 тысяч населения».
В лечении лимфом 2021 год стал знаковым: с августа этого года, впервые за 15 лет в России стал коммерчески доступен препарат для терапии рецидивирующей и рефрактерной диффузной В-крупноклеточной лимфомы, который может способствовать значительному увеличению выживаемости пациентов. А это значит, что у тысяч пациентов появился шанс на полноценную продолжительную жизнь.
О фолликулярной лимфоме (ФЛ)
Фолликулярная лимфома – распространенный тип медленно растущей неходжкинской лимфомы, которая развивается из В-клеток. Этиология ФЛ не выяснена. Риск развития ФЛ связывают с длительным лечением иммунодепрессантами и хромосомной аберрации: t (14:18). ФЛ занимает 2-е место в мире по встречаемости среди лимфом, составляя в среднем 20% от всех злокачественных лимфопролиферативных заболеваний взрослых. По данным различных источников, в западных странах заболеваемость ФЛ равна 5–7 на 100 тыс. населения. В США ежегодно этот диагноз устанавливается у 14 тыс. человек. Медиана возраста пациентов составляет 60 лет, соотношение мужчин и женщин приблизительно 1/1,7.
Для ФЛ в первую очередь характерно увеличение лимфатических узлов (ЛУ) – как периферических, так и висцеральных. ЛУ при ФЛ могут быть как одиночными, небольшими, эластической консистенции, так и в виде довольно крупных конгломератов. Других клинических симптомов может долго не быть. Со временем присоединяются симптомы интоксикации – слабость, потливость, снижение массы тела. Заболевание в основном характеризуется длительным вялотекущим течением, однако в некоторых случаях возможно агрессивное течение лимфомы.
ФЛ диагностируется на ранней стадии у каждого 5-го пациента. Для терапии ранних стадий используют лучевую терапию, на поздних – химиотерапию.
О диффузной В-крупноклеточной лимфоме (ДВКЛ)
[1] Taylor, Elizabeth J. (2000). Dorland’s Illustrated medical dictionary (29th ed.). Philadelphia: Saunders. p. 1038
[2] Состояние онкологической помощи населению России в 2019 году. / Ред. А.Д. Каприн, В.В. Старинский, А.О. Шахзадова. – М., 2020. – С. 16–29.
[3] Бабичева Л.Г., Тумян Г.С., Кравченко С.К. Фолликулярная лимфома. Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний. Под ред. И.В.Поддубной, В.Г.Савченко. 2018; с. 43–52
[4] Клинические рекомендации по диагностике и лечению диффузной В-крупноклеточной лимфомы взрослых / Национальное гематологическое общество. Российское профессиональное общество онкогематологов. 2014.
[6] Sehn L and Gascoyne RD. Blood; 2015;125:22–32
[7] Cheson BD, et al. J Clin Oncol; 1999;17:1244
Лимфопролиферативное заболевание с поражением лимфоузлов шеи что это
Миелопролиферативные заболевания включают истинную полицитемию, эссенциальную тромбоцитемию, миелоидную метаплазию и хронический миелолейкоз (ХМЛ). При указанных формах патологии, наряду с интенсивной репликацией клеток-предшественников, сохраняется и их дифференцировка. В связи с этим вначале развития миелопролиферативных заболеваний не возникает цитопении (эритропении, тромбоцитопении, нейтропении).
В соответствии с местом первичного возникновения онкогенной трансформации клеток лимфопролиферативные заболевания делятся на две группы: хронические лимфоидные лейкозы и злокачественные лимфомы, имеющие первоначально внекостномозговую локализацию (лимфатические узлы, селезенка, кожа, лимфоидная ткань слизистой желудка), что отличает их от лейкозов. При лейкозах опухолевый процесс первично развивается в структурах костного мозга.
Хронический миелолейкоз – это опухоль, возникающая из клеток-предшественниц миелопоэза, дифференцирующихся до зрелых форм. Опухолевым процессом поражаются грануло-, моно-, тромбо- и эритроцитарный ростки. Однако безграничный рост в развернутой стадии, как правило, касается только одного ростка – гранулоцитарного.
В 90–97 % случаев хронического миелолейкоза отмечается появление филадельфийской хромосомы (Ph) почти во всех клетках костного мозга – гранулоцитах, моноцитах, эритрокариоцитах, мегакариоцитах. В лимфоцитах ее нет.
Рh-хромосома была найдена в 1960 году в Филадельфии. У больных с хроническим миелолейкозом обнаруживалось специфическое хромосомное нарушение – делеция части длинного плеча у одной из хромосом 21–22-й пары. В такой хромосоме отсутствует приблизительно 40 % генетического материала. Позже было обнаружено, что делетированный участок хромосомы транслоцирован на длинное плечо хромосомы 9. Транслокация может быть и на другие хромосомы.
В настоящее время стало очевидно, что транслокационный вариант мутации, приводящий к появлению филадельфийской хромосомы включает и транслокацию части генетического материала с 9-й хромосомы на 21–22-ю пары хромосом, что приводит к возникновению реципрокной (взаимной) транслокации (9;22) (q34; q11). При этом формируется химерный (слитный) ген BCR-ALB, кодирующий белок р210 с тирозинкиназной активностью.
Заболевание проходит две стадии: доброкачественную (моноклоновую) и злокачественную, терминальную (поликлоновую). Картина крови характеризуется лейкоцитозом со сдвигом до миелоцитов, промиелоцитов и единичных бластов. Кроме омоложения состава гранулоцитов, может быть увеличен процент базофилов или эозинофилов, реже тех и других одновременно (так называемая базофильно-эозинофильная ассоциация).
Красная кровь в моноклоновой стадии болезни существенно не меняется, количество тромбоцитов чаще нормальное. В 20–30 % случаев с самого начала заболевания отмечается тромбоцитоз.
Важнейшим признаком терминальной стадии хронического миелолейкоза является резкое увеличение процента бластных клеток в костном мозге и периферической крови, так называемый бластный криз. Одновременно отмечаются выраженная гранулоцитопения, тромбоцитопения и анемия.
В последние десятилетия выделена прогрессирующая (acselerated) фаза ХМЛ, когда течение заболевания преобретает злокачественный характер. Прогрессирование заболевания может наступить в любой момент, чаще после 3-х лет стабильно текущей формы заболевания. Диагностическими признаками фазы акселерации ХМЛ являются следующие:
1. Миелобласты 10–19 % в крови и/или в костном мозге от всех ядерных клеток
2. Базофилия более 20 %
3. Тромбоцитопения менее 100×109/л или тромбоцитоз более 1000×109/л, не поддающийся терапии
4. Увеличение размера селезенки и лейкоцитоз не поддающийся лечению
5. Дополнительная хромосомная аномалия
6. Возрастающее количество бластов в крови более 15 %
7. Наличие экстрамедулярных очагов кроветворения с пролиферацией бластных клеток
В классификации ВОЗ – онкологическое заболевание лимфоидной ткани, характеризующееся клональной пролиферацией и накоплением длительно-живущих неопластических лимфоцитов (преимущественно СД5+ В клеток) в периферической крови, костном мозге, лимфатических узлах, селезенке, а затем практически во всех внутренних органах и тканях (сердце, легкие, почки, ЖКТ).
Хронический лимфолейкоз – лимфома из малых лимфоцитов, характеризующийся клональной пролиферацией и накоплением предшественников CD+ В-лимфоцитов в периферической крови, костном мозге, лимфатических узлах, почке, а затем во многих других органах и тканях. ХЛЛ – или более частый вид лейкоза, составляет около 25–30 % от всех видов лейкозов.
Значительную часть клеток при хроническом лимфолейкозе составляют В-лимфоциты (80–98 %), но известны и формы болезни с Т-лимфоцитарной пролиферацией.
Этиология ХЛЛ не установлена, в патогенезе важная роль отводится нарушению апоптоза малигнизированных клеток. Факторами пролиферации малигнизированных клеток лимфоидной ткани при ХЛЛ являются такие цитокины, как TNF-α, IL-8, IL-2. Причем, повышение уровня IL-8, усиление экспрессии CD38 – плохие прогностические признаки при В-ХЛЛ.
Специфических хромосомных аномалий при ХЛЛ не выявлено, тем не менее почти у 50 % больных выявляют хромосомные мутации в виде делеции 13q14, у 20 % отмечают делеции 11q22-q23, у 15 % – трисомия 12 и др.
ХЛЛ – болезнь представителей белой расы, преимущественно западного полушария, составляет около 25–30 % всех лейкозов. В восточном полушарии ХЛЛ встречается примерно у 5 % населения.
ХЛЛ – болезнь пациентов преимущественно пожилого возраста, лишь у 10–15 % наличие заболевания диагностируется в возрасте до 50 лет, причем чаще болеют мужчины.
95 % всех случаев ХЛЛ в США и Европе приходится на В-клеточный фенотип.
Установлена определенная роль наследственного фактора в развитии патологии, в то же время очевидно, что воздействие таких факторов внешней среды, как ионизирующая радиация, канцерогенов химической природы, лекарственных препаратов не играет роли инициирующих патогенов в развитии ХЛЛ.
В основе развития ХЛЛ лежит нарушение апоптоза малигнизированных клеток и накопление их преимущественно в G0 – фазе клеточного цикла. В связи с дисбалансом соотношения основных про- и антиапоптотических белков семейства гена bcl2, таких как BAX и BAK (индуцирующих апоптоз), а также BAD, BIK, HBK (антиапоптотических ингибиторов).
Установлено, что продуцируемые модифицированными при ХЛЛ клетками цитокины (TNF-α, IL-8, IL-2) обеспечивают аутокринную и паракринную стимуляции и резистентности малигнизированных лимфоидных клеток.
В настоящее время очевидно наличие 2-х генетических вариантов ХЛЛ в зависимости от происхождения В-клеток, отличающихся по мутационному статусу генов вариабельных участков тяжелых цепей иммуноглобулинов (Vн-генов).
Выделяют: 1) первый вариант ХЛЛ – из нативных В-клеток, не прошедших этап мутации Vн-генов в герминальном центре размножения и 2) второй вариант ХЛЛ, возникающий из В-клеток памяти, подвергшихся соматической мутации Vн- генов.
Первый вариант формирования В-ХЛЛ из нативных клеток имеет плохой прогноз, особенно с экспрессией CD38 и характерными цитогенетическими аномалиями, при этом медиана выживаемости составляет 8 лет.
Медиана выживаемости при втором варианте ХЛЛ составляет около 25 лет. Плохим прогностическим признаком при ХЛЛ первого типа является экспрессия молекул ZAP-70. Около 40–60 % больных ХЛЛ диагностируется в связи с развитием лимфоаденомы и высоким лимфоцитозом. Манифестацией вовлечения костного мозга в патологию являются анемия, тромбоцитопения. Возможна инфильтрация лейкозными клетками различных органов и тканей.
Медиана выживаемости у CD5 + пациентов с ХЛЛ значительно выше, чем у CD5- больных и составляет 97,2.
В зависимости от характера клинического течения ХЛЛ выделяют три основных варианта:
● медленно-текущий ХЛЛ (индолентный)
● ХЛЛ с трансформацией в крупноклеточную лимфому (синдром Рихтера ) или пролимфоцитарный лейкоз.
Медленно-текущий вариант характеризуется стабильным течением с длительным сохранением стадии 0 (1), отсутствием инфекционных осложнений, отсутствием протеина ZAP-70. У 50–70 % больных этой группы обнаруживаются признаки соматических гипермутаций Vн-генов лейкемических В-клеток. При цитогенетическом анализе часто выявляется делеция 13q14, свидетельствующая о положительном прогнозе заболевания.
Картина периферической крови характеризуется лимфоцитозом, который на ранних этапах заболевания выражен умеренно, а на развернутой и терминальных стадиях болезни достигает высоких цифр (80–90 % лимфоцитов). Количество эритроцитов и тромбоцитов в периферической крови долгое время остается в пределах нормы или незначительно снижается. Развернутая и терминальная стадии лимфолейкоза характеризуются анемией и тромбоцитопенией, которые обусловлены аутоиммунным процессом – появлением антител к созревающим клеткам костного мозга или к зрелым элементам крови и костного мозга. Иногда в периферической крови появляется большое количество пролимфоцитов и на этом основании выделяют пролимфоцитарную форму хронического лимфолейкоза.
Прогрессирующее течение ХЛЛ характеризуется быстрой сменой стадий заболевания по К.Rai (1975), гиперлимфоцитозом и диффузной инфильтрацией костного мозга, прогрессирующей лимфоаденопатией, гепато- и спленомегалией, аутоинтоксикацией, гипогаммаглобулинемией, активацией инфекций. Характерно развитие аутоиммунной анемии и тромбоцитопении.
При этой патологии, как правило, отсутствуют мутации Vн-генов иммуноглобулинов на фоне высокой экспрессии ZAP-70.
Плохими прогностическими признаками являются мутации типа делеции 11q22-q23, трисомия 12, дисфункция р 53.
Крупные клетки при синдроме Рихтера свидетельствуют о появлении нового злокачественного клона лимфоцитов. Крупноклеточная лимфома встречается у 2–5 % пациентов, сопровождается клиническими признаками генерализации заболевания.
Развитие пролимфоцитарного ХЛЛ из зрелых клеток отмечают в 5–8 % наблюдений, характеризующиеся более агрессивным течением по сравнению с В-клеточным пролимфоцитарным ХЛЛ, формирующимся de novo.
Волосатоклеточный лейкоз – хроническое В-клеточное пролиферативное заболевание, характеризующееся появлением мононуклеаров с выростами цитоплазмы, характеризующееся прогрессирующим течением с развитием панцитопении, спленомегалии, рецидивирующей инфекции.
Волосатые клетки, экспрессируют CD19, СD26, CD22 и коэкспрессируют CD11c, СD25, CD103 как и В-клетки. при классической форме В-клеточного лейкоза. При вариантной форме отсутствуют антигены СD25, CD103.