Лимфопролиферативными заболеваниями что это
Диагностика и мониторинг лимфопролиферативных заболеваний
Лейкопения – это снижение количества лейкоцитов в единице объема крови.
Лейкопения может появиться как следствие различных заболеваний, в том числе и онкологических.
Лейкоциты – это клетки, имеющие важное значение для иммунной системы человека; белые кровяные тельца выполняют защитную функцию для организма от вирусов, бактерий и прочих агентов, способных причинить вред человеку и вызвать заболевания.
Норма содержания лейкоцитов в крови: от 4 до 9 х 109 клеток/ 1л. Если выявлено их снижение, то это может быть сигналом о подозрении на лейкопению.
ФОРМЫ ЛИМФОПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ:
Существуют различные виды лейкоцитов, обычно происходит снижение не всех, а только нескольких видов.
Причины возникновения лейкопении
ОСНОВНЫМИ ПРИЧИНАМИ ДАННОГО ЗАБОЛЕВАНИЯ ЯВЛЯЮТСЯ:
Опасность, которую несет лейкопения
Лейкоциты – это часть иммунной системы. Белые кровяные тельца атакуют чужеродные агенты, попадающие в организм, но при снижении лейкоцитов, иммунитет человека падает, защитные силы ослабевают. Организм становится более подвержен инфекционным заболеваниям.
Диагностика лимфопролиферативных заболеваний
Заболевание определяется с помощью общего анализа крови.Происходит подсчет содержания количества лейкоцитов в крови и соотношение различных видов лейкоцитов (лимфоциты, эозинофилы, базофилы, нейтрофилы, моноциты) в процентах.
Симптоматика при лейкопении может отсутствовать, особенно легкой степени заболевания. Первым симптомом может быть возникновение различных инфекций. У некоторых онкобольных наблюдается лихорадка, вызванная либо инфицированием, либо как реакция организма на прием химиопрепаратов, либо лихорадка имеет опухолевую причину.
ПОСКОЛЬКУ ЛЕЙКОПЕНИЯ ВЫЗЫВАЕТ НАРУШЕНИЕ ПРОЦЕССА КРОВЕТВОРЕНИЯ, ТО ВОЗМОЖНЫ СЛЕДУЮЩИЕ СИМПТОМЫ:
Лечение лимфопролиферативных заболеваний
Пациент, проходящий курс химиотерапии, должен находиться под постоянным наблюдением онколога, контролирующего уровень лейкоцитов в крови.
ПАЦИЕНТУ, КОТОРОМУ ДИАГНОСТИРОВАНО ДАННОЕ ЗАБОЛЕВАНИЕ СЛЕДУЕТ:
Пациент, у которого наблюдается ярко выраженная симптоматика заболевания помещается в изолированную палату, а медицинский персонал, с которым больной имеет контакт, обязательно должен соблюдать все санитарные правила антисептики. Пациент может быть направлен в гематологическую клинику, специализирующуюся только на заболеваниях крови.
Больному вводят лекарственные препараты, стимулирующие образование лейкоцитов, дополнительно могут быть назначены витаминно-минеральные комплексы для поддержания организма.
Аутоиммунный лимфопролиферативный синдром
Аутоиммунный лимфопролиферативный синдром – группа генетически обусловленных заболеваний, которые возникают по причине наследственных или соматических мутаций в генах, отвечающих за различные этапы FAS-обусловленного апоптоза. Симптоматика может быть вариабельной и наиболее часто включает в себя лимфаденопатию, спленомегалию и разнообразные аутоиммунные поражения системы крови, печени, щитовидной железы. Диагностика аутоиммунного лимфопролиферативного синдрома производится на основании результатов общего и биохимического анализов крови, биопсии лимфатических узлов, генетических исследований. Специфического лечения заболевания в настоящий момент нет, применяют комбинации иммунносупрессивной и цитотоксической терапии.
Общие сведения
Аутоиммунный лимфопролиферативный синдром (АЛС, ALPS, синдром Канале-Смит) – группа иммунодефицитных состояний, характеризующихся аутоиммунными цитопениями, лимфаденопатией, спленомегалией. Первые данные о заболевании стали поступать в 1968-м году, после чего вскоре началось бурное изучение патологии. Изначально АЛС был отнесен к первичным иммунодефицитам, однако со временем были обнаружены формы синдрома, обусловленные соматическими мутациями в детском и подростковом организме.
Данные о встречаемости у разных исследователей довольно сильно различаются, на сегодняшний момент описано более 500 случаев различных форм аутоиммунного лимфопролиферативного синдрома. Наследственные формы заболевания передаются по аутосомно-доминантному типу, при этом в развитии врожденных форм также довольно велика роль спонтанных мутаций. Среди больных с одинаковой частотой встречаются как мальчики, так и девочки.
Причины
Выяснено, что причиной любого типа АЛС является нарушение FAS-опосредованного апоптоза лимфоцитов. При образовании Т-лимфоцитов те линии, которые способны атаковать собственные ткани, уничтожаются за счет активизации рецепторов CD-95 (Fas-рецепторов) на поверхности их мембраны. Активация CD-95, относящегося к группе рецепторов фактора некроза опухолей, запускает многостадийную реакцию с участием каспаз, которая оканчивается апоптозом клетки.
При аутоиммунном лимфопролиферативном синдроме генетические мутации приводят к блоку этого процесса на определенном этапе, из-за чего устранения потенциально опасных клонов Т-лимфоцитов не происходит, и они начинают накапливаться в лимфатических узлах. Кроме того, создаются условия для аутоиммунного поражения органов и тканей.
Наиболее часто встречаются наследственные и спонтанные мутации в гене TNFRSF6, который кодирует собственно Fas-рецептор. При этом нарушение структуры белка (особенно домена, отвечающего за взаимодействие с FADD-молекулой) приводит к тому, что он становится неспособным выполнять свои рецепторные функции и активизировать апоптоз. Возможны и соматические мутации в гене FAS, которые в полной мере проявляют себя в позднем детском или подростковом периоде, и поэтому их относят к отдельной группе АЛС.
Второй по распространенности вариант аутоиммунного лимфопролиферативного синдрома обусловлен мутацией в гене CASP10, кодирующем цистин-аспарагин кислотную протеазу (каспаза-10). Этот белок играет ключевую роль в передаче сигнала об апоптозе с клеточной мембраны в ядро клетки. К этому же варианту относят и мутации гена CASP8.
Третьим по распространенности является аутоиммунный лимфопролиферативный синдром, который вызван мутацией в гене FASLG, кодирующем Fas-лиганд или рецептор CD-178. Он играет вспомогательную роль в распознавании факторов, стимулирующих апоптоз, и участвует в передаче сигнала в клетку.
Некоторые формы АЛС обусловлены мутацией гена NRAS, который кодирует «малый G-белок», принимающий участие в качестве вторичного мессенджера в передаче сигналов с мембраны в клетку, в том числе и ядро. Примерно в трети случаев аутоиммунного лимфопролиферативного синдрома врачам-иммунологам не удается установить непосредственную причину заболевания.
Классификация аутоиммунного лимфопролиферативного синдрома
При помощи методов современной генетики удалось выявить шесть основных форм АЛС:
ALPS 1A – вызвана мутацией гена TNFRSF6, расположенного на 10-й хромосоме, чаще всего имеет врожденный характер, наследуется по аутосомно-доминантному типу. По статистике, более 40% АЛС относятся именно к этой разновидности.
ALPS 1В – обусловлена мутацией гена FASLG, также довольно часто приводит к врожденному аутоиммунному лимфопролиферативному синдрому. К этому типу относят около 10% от всех клинических случаев АЛС.
ALPS 1m – ее причиной являются соматические мутации в гене FAS, возникающие в детском или подростковом возрасте и поэтому приводящие к поздним формам АЛС. При этом повреждение гена должно произойти в полипотентной клетке-предшественнице, которая способна дать начало многим линиям лимфоцитов. При этой форме наиболее часто возникает внезапная самопроизвольная ремиссия заболевания.
ALPS 2 – вызвана мутацией в генах CASP10 и, по некоторым данным, CASP8, которые кодируют белки-каспазы, передающие сигнал об апоптозе от рецептора к ядру клетки. Эта форма аутоиммунного лифопролиферативного синдрома составляет примерно 25% от всех случаев заболевания, может быть как врожденной, так и проявиться в более старшем возрасте.
ALPS 3 – мутация какого гена и характер ее наследования при этой форме неизвестны. Особенностью такого варианта АЛС является нарушение не только FAS-, но и IL2-опосредованного апоптоза, а также более тяжелый характер течения.
ALPS 4 – обусловлена мутацией гена NRAS, также кодирующего белки-передатчики внутриклеточного сигнала. Данный тип аутоиммунного лимфопролиферативного синдрома характеризуется более доброкачественным течением и умеренной выраженностью симптомов.
Симптомы аутоиммунного лимфопролиферативного синдрома
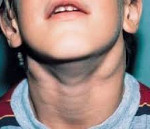
Симптомы АЛС довольно вариабельны из-за большого количества мутаций, которые могут приводить к такому состоянию. Начало заболевания можно заметить уже на 15-й день после рождения (при врожденных формах), в детском или подростковом возрасте в случае соматических мутаций в генах FAS, CASP10 или NRAS. Обычно первым проявлением заболевания является лимфаденопатия – подмышечные, паховые или шейные лимфатические узлы увеличиваются в размерах, но при этом безболезненны и не спаяны с окружающими тканями. Регистрируется спленомегалия, в некоторых случаях она сопровождается увеличением печени (гепатоспленомегалия).
Аутоиммунные проявления АЛС регистрируются обычно через некоторое время после лимфаденопатии и увеличения селезенки. В основном это поражения кровяных ростков – тромбоцитопения, гемолитическая анемия, приводящая к желтухе, изредка нейтропения. Помимо крови, аутоиммунному поражению могут подвергаться органы ЖКТ (возникают гастрит, панкреатит, колит, аутоиммунный гепатит). На коже могут проявляться признаки васкулита, делая клинику аутоиммунного лимфопролиферативного синдрома схожей с таковой при системной красной волчанке. Кроме того, могут возникать аутоиммунные формы тиреоидита, гломерулонефрита, поражаться суставы, ткани глаза (иридоциклит, увеит). Нередки поражения центральной нервной системы – эпилептические припадки, миелиты, мозжечковая атаксия.
Выраженность симптомов и их количество может значительно варьироваться у каждого конкретного больного. Кроме того, при аутоиммунном лимфопролиферативном синдроме в десятки раз возрастает риск развития злокачественных опухолей, так как опухолевые клоны лимфоцитов также устраняются посредством апоптоза.
Примерно в 20% случаев АЛС приводит к неходжкинским лимфомам (лимфома Беркитта, фолликулярная лимфома), описаны и другие онкологические заболевания. Из-за этого проявления АЛС могут быть ошибочно определены как следствие опухолевой инфильтрации лимфоидной ткани. Среди других осложнений аутоиммунного лимфопролиферативного синдрома наиболее часто встречается травматический разрыв селезенки, сепсис и другие инфекционные поражения.
Диагностика
Диагностика АЛС производится на основании осмотра, а также лабораторных, иммунологических и генетических исследований. При осмотре выявляют увеличение более чем трех групп лимфатических узлов, спленомегалию, увеличение печени. Анализ крови может показывать уменьшение количества некоторых клеток (анемию, тромбоцитопению), у части больных определяется высокая (до 30%) эозинофилия. Проба Кумбса положительная, в биохимическом анализе крови определяется выраженная гипергаммаглобулинемия.
Одним из высокочувствительных методов иммунологической диагностики аутоиммунного лимфопролиферативного синдрома является проточная иммуноцитофлюориметрия, проводимая с целью выявления количества лимфоцитов с атипичным набором рецепторов (CD3+CD4-CD8-). При АЛС количество таких клеток превышает 1% от всех лимфоцитов. В биоптате лимфатических узлов определяется фолликулярная гиперплазия, результатом гистологического исследования селезенки служит лимфоидная гиперплазия.
Врачом-генетиком может быть произведено секвенирование гена FAS с целью выявления мутаций, ставших причиной аутоиммунного лимфопролиферативного синдрома. С учетом значительной величины этого гена для ускорения и удешевления процедуры поиск может быть произведен лишь в отдельных экзонах гена FAS, в которых наиболее часто обнаруживаются нарушения – эти участки называют «горячими точками». Таким образом, при помощи генетической диагностики можно определить АЛС только 1А, 1В и 1m типов. Методики определения остальных форм АЛС генетическими методами на сегодняшний день не разработаны. Изучение наследственного анамнеза в ряде случаев будет неэффективно из-за значительной доли форм заболевания, вызванных соматическими мутациями.
Лечение аутоиммунного лимфопролиферативного синдрома
Этиотропное лечение аутоиммунного лимфопролиферативного синдрома не разработано, патогенетическая терапия сводится к применению иммуносупрессивных и цитотоксических средств. В качестве средств, подавляющих аутоиммунную активность, наиболее часто используют кортикостероиды (преднизолон, дексаметазон). К специфическим препаратам, ограничивающим скорость пролиферации лимфоцитов, относят микофенолата мофетил, сиролимус. Также при аутоиммунном лимфопролиферативном синдроме активно применяются традиционные цитотоксические средства – метотрексат, циклоспорин А и другие.
При значительном увеличении селезенки или отсутствии эффекта от консервативного лечения прибегают к спленэктомии. Пересадка костного мозга и использование стволовых клеток в долгосрочной перспективе давали только временный эффект. При значительно выраженных гематологических нарушениях применяют гемотрансфузии, введение эритроцитарной или тромбоцитарной массы. Больному следует избегать физических нагрузок, использовать высоковитаминную диету.
Прогноз
Прогноз заболевания, ввиду высокой вариабельности и выраженности симптомов, неопределенный или неблагоприятный. У большей части больных проявления заболевания постепенно нарастают, со временем приводя к летальной анемии, тромбоцитопении, билиарному циррозу печени. Также важную роль в прогнозе играют нарушения иммунитета, так как нередко причиной смерти выступают сепсис и другие инфекционные поражения. В прогнозе аутоиммунного лимфопролиферативного синдрома следует учитывать и повышенный риск онкологических заболеваний, примерно пятая часть больных умирает от различных типов лимфом. В некоторых случаях возникает спонтанная и длительная ремиссия патологии.
Лимфопролиферативные заболевания. Диагностика и определение эффективности лечения
Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний разработаны Российским профессиональным обществом онкогематологов и Национальным гематологическим обществом в 2013 г. В статье представлены основные положения по диагностике и определению эффективности лечения лимфопролиферативных заболеваний [1].
Lymphoproliferative disorders. Diagnosis and determination of treatment effectiveness
Russian clinical guidelines for the diagnosis and treatment of lymphoproliferative disorders were developed by the Russian Society of Oncohematologists and the National Hematology Society in 2013. The article presents the main provisions for diagnosis and determination of the treatment effectiveness for lymphoproliferative disorders [1].
Лимфопролиферативные заболевания — группа заболеваний, морфологическим субстратом которых являются клетки лимфоидной природы.
Среди лимфопролиферативных заболеваний выделяют лимфоидные формы лейкозов — острый лимфобластный лейкоз, хронический лимфолейкоз, парапротеинемические гемобластозы и так называемые нелейкемические лимфоидные гемобластозы, включающие неходжкинские лимфомы, при которых первичный очаг поражения развивается преимущественно вне костного мозга.
Диагноз пациента с лимфопролиферативным заболеванием (ЛПЗ) при первичном обследовании должен состоять из трех неотъемлемых частей:
1. Диагноз опухоли, сформулированный в соответствии с действующей классификацией Всемирной организации здравоохранения (ВОЗ).
2. Распространенность процесса — стадия (установленная в соответствии с принятыми классификационными системами).
3. Общее состояние больного (оцененное по международным критериям).
До биопсии лимфатического узла (ЛУ) необходимо сделать общий анализ крови с подсчетом лейкоцитарной формулы, чтобы исключить необходимость выполнения биопсии у больных хроническим лимфолейкозом (ХЛЛ), острыми лейкозами или при лимфоцитозе инфекционной этиологии (инфекционный мононуклеоз, коклюш и др.).
Диагноз опухоли устанавливают на основании морфологического исследования биопсийного или операционного материала. Морфологическое исследование проводится с помощью цитологических, гистологических и иммуногистохимических методов.
Отдельные случаи нуждаются в проведении молекулярно-биологических и генетических тестов. Цитологическое исследование пунктатов, или мазков-отпечатков ЛУ, или других опухолевых очагов не является достаточным основанием для нозологической верификации лимфом.
При первичном обследовании пациента во всех случаях проводится гистологическое и иммуногистохимическое исследование инцизионной или эксцизионной биопсии патологического очага или операционного материала.
Пунктировать ЛУ для аспирации клеточной взвеси не следует. В исключительных случаях (локализация опухоли в труднодоступных анатомических зонах) объектом исследования может быть тканевой материал, полученный с помощью пистолетной («кор»-) биопсии.
Лимфома
Что такое лимфома?
Лимфома – это поражение иммунной системы и внутренних органов, в которых скапливаются измененные клетки, нарушающие работу тканей.
Опухоль развивается в лимфатической системе, которая помогает нам бороться с инфекциями и другими заболеваниями. Циркулирующая в ней лимфа омывает все клетки организма и доставляет в них необходимые вещества, забирая отходы. В расположенных по всей ее сети лимфатических узлах опасные вещества обезвреживаются и выводятся из организма.
Лимфосистема дополняет кровеносную и помогает жидкостям перемещаться по телу. В отличие от крови, скорость движения которой задает «насос» – сердце, лимфа медленно циркулирует самостоятельно.
Как развивается лимфома?
Онкология начинается с появления в организме всего лишь одной измененной клетки иммунной системы. Всего выделяют 2 основных их типа:
Почти все ненормальные клетки выявляются и уничтожаются нашим иммунитетом, но некоторым из них удается выжить. Они постепенно размножаются, распространяются по всему телу, создают опухоли, скапливаются во внутренних органах и нарушают их работу.
Заболевание может возникать в любой области, где находится лимфатическая ткань, основными участками которой являются:
Лимфома – это рак?
Раком официальная медицина России и некоторых других стран называет злокачественные опухоли – опасные для жизни новообразования, которые развиваются в эпителиальных клетках, содержащихся в коже или слизистых оболочках, и выстилающих внутреннюю поверхность органов.
Лимфома – это не рак, а онкологическое заболевание. Она образуется из лимфоцитов, а ее клетки также умеют бесконтрольно делиться, накапливаться в тканях, нарушая их работу, и создавать дополнительные очаги заболевания в различных частях тела.
Типы лимфом
Врачи выделяют 2 их основных класса:
Лимфома Ходжкина, или лимфогранулематоз: чаще всего начинается в лимфатических узлах верхней части тела – на груди, шее или в подмышках. Как правило, она распространяется в различные лимфоузлы по лимфатическим сосудам, но в редких случаях на поздних стадиях проникает в кровоток и распространяется на другие части тела, такие как печень, легкие или костный мозг. Данный диагноз ставится при выявлении в организме особых клеток – Березовского-Рид-Штернберга, которые представляют из себя измененные В-лимфоциты.
К неходжкинским лимфомам относят все остальные типы заболевания – их насчитывается около 30. У каждого из них есть свои, особые признаки: расположение первичной опухоли, строение и скорость развития.
Причины развития лимфом
Врачам и ученым точно не известно, почему именно в организме человека начинает развиваться заболевание. Они знают лишь о факторах, которые повышают вероятность образования каждого из типов онкологии.
Для лимфом Ходжкина они выглядят следующим образом:
Список таких факторов для неходжкинских лимфом выглядит иначе:
Симптомы и признаки лимфомы
Как правило, на ранних этапах данный тип онкологии никак себя не проявляет, а ее обладатель хорошо себя чувствует и не подозревает о болезни – почти все ее симптомы появляются позже, на запущенных стадиях.
Один из наиболее частых признаков – появление припухлости на шее, в подмышках, паху или над ключицей, которая представляет из себя увеличенный лимфатический узел. Обычно такое новообразование не болит, но со временем нередко увеличивается, а рядом с ним или в других областях тела появляются новые шишки.
Лимфомы, которые начинают развиваться или разрастаются в брюшной полости, способны вызвать отек или боль в животе, тошноту и рвоту. Такие ощущения возникают из-за укрупнения лимфоузлов или внутренних органов, таких как селезенка или печень, либо скопления большого количества жидкости.
Изменившаяся в размерах селезенка может давить на желудок, вызывая потерю аппетита и чувство сытости после небольшого количества пищи.
Увеличившиеся тимус Тимус, или вилочковая железа – небольшой орган, расположенный за верхней частью грудины перед сердцем. В нем происходит созревание и развитие некоторых лимфоцитов. или лимфоузлы грудной клетки могут оказывать давление на трахею, по которой воздух проходит в легкие. Это приводит к появлению кашля, затруднению дыхания, болевым ощущениям или тяжести в груди.
Поражения головного мозга способны вызывать головную боль, слабость, изменение личности, проблемы с мышлением и судороги.
Другие типы заболевания могут распространяться на окружающие головной и спинной мозг ткани, из-за чего у пациента двоится в глазах, немеет лицо и ухудшается речь.
Лимфомы кожи часто проявляются в виде зудящих красных бугорков или шишек.
Кроме того, симптомами могут быть:
Диагностика лимфомы
Большинство пациентов обращаются к врачу из-за наличия определенных признаков заболевания или плохого самочувствия.
Специалисты начинают обследование с осмотра и опроса – о семейных диагнозах, возможных факторах риска и других проблемах со здоровьем. Затем изучают лимфатические узлы и другие части тела, в которых содержится лимфатическая ткань, включая селезенку и печень. После чего назначают целый ряд исследований:
В онкологическом центре «Лапино-2» проводится полная диагностика лимфомы – быстро, без очередей и потерь драгоценного времени, на самом современном оборудовании.
Наши специалисты ведут пациента «от» и «до» – от обследования до проведения любого лечения.
Стадии лимфомы
Сразу после обнаружения заболевания врачи определяют его стадию – выясняют, как далеко оно успело распространиться и какие ткани повредило. Данная информация крайне важна для специалистов, поскольку она позволяет не только понимать прогнозы пациента, но и подбирать для него самое подходящее лечение.
Стадии неходжкинских лимфом:
I: измененные клетки обнаруживаются только в 1 группе лимфатических узлов или одном лимфоидном органе, например, миндалинах; либо в 1 области одного органа за пределами лимфатической системы.
II: они присутствуют в 2 или более группах лимфоузлов по 1 сторону от диафрагмы; либо в лимфатических узлах и 1 области расположенного рядом одного органа, или в еще одной группе лимфоузлов на той же стороне диафрагмы.
III: клетки лимфомы есть в лимфоузлах по обе стороны от диафрагмы; либо они присутствуют и в лимфатических узлах над диафрагмой, и в селезенке.
IV: заболевание распространилось по крайней мере в один орган, не входящий в лимфатическую систему, такой как печень, костный мозг или легкие.
Лечение лимфомы
Лечение лимфомы – задача непростая. Для ее решения требуется не один доктор, а целая команда профессионалов своего дела – химиотерапевта, радиолога, хирурга, онколога, гематолога и других.
В онкологическом центре «Лапино-2» есть все необходимые специалисты – врачи мирового уровня, которые проводят полную диагностику заболевания и любую необходимую терапию.
У нас вам не придется пересдавать анализы, переделывать исследования и задаваться вопросом «что делать дальше?». Мы полностью ведем пациента и даем ему четкий план действий, следуя которому он получает лучший результат из возможных.
Для борьбы с данным типом онкологии применяется несколько методов:
Основным из них является химиотерапия – препараты, которые уничтожают измененные клетки. Они принимаются в виде таблеток или вводятся в вену, попадают в кровоток и распространяются по всему телу. Лечение проводится циклами, каждый из которых длится несколько недель, после чего следует период отдыха, за время которого организм восстанавливается.
Трансплантация костного мозга или стволовых клеток, из которых образуются клетки крови. Процедура позволяет назначать более высокие дозы химиотерапии, иногда вместе с лучевой терапией, благодаря чему лимфома уничтожается эффективнее. Пересадка возможна не только донорского, но и своего собственного, собранного за несколько недель до вмешательства материала.
Лучевая терапия – уничтожение измененных клеток с помощью радиации. Данный метод подходит для большинства пациентов, и особенно хорошо работает, если заболевание успело поразить небольшое количество тканей. Его применяют как самостоятельно, так и в сочетании с химиотерапией.
Иммунотерапия – препараты, которые помогают собственной иммунной системе человека лучше распознавать и разрушать неправильные клетки. Существует несколько их типов, применяемых при лимфомах. К ним относят:
Хирургия: часто используется для получения образцов подозрительных тканей и определения их типа, но редко – для терапии как таковой. В редких случаях операции назначаются при поражениях селезенки или других органов, которые не входят в лимфатическую систему – например, щитовидная железа или желудок.
Прогнозы и продолжительность жизни при лимфоме
Перспективы каждого человека индивидуальны – они зависят от множества различных факторов, таких как тип заболевания, его стадия, ответ на лечение, возраст и общее состояние здоровья.
Наличие некоторых из них говорит о менее благоприятных прогнозах:
Для составления примерных прогнозов врачи используют специальный термин – «пятилетняя выживаемость». Это статистический показатель, который ничего не говорит о шансах конкретного человека. Он показывает только количество людей с определенным типом заболевания на конкретной стадии, остающихся в живых спустя 5 или более лет с момента постановки диагноза.
У пациентов с лимфомой Ходжкина эта цифра выглядит следующим образом:
Для пациентов с различными видами неходжкинских лимфом – диффузной В-крупноклеточной Диффузная В-крупноклеточная лимфома – это целая группа опухолей лимфатической системы, которая развивается из В-клеток вилочковой железы, или тимуса. и фолликулярной Фолликулярная лимфома – самая распространенная из медленно растущих типов заболевания, она составляет 20-30% от всех впервые диагностированных неходжкинских лимфом. она составляет 73% и 96%, 73% и 90%, 57% и 85% соответственно.