Лимфоцитарные инфильтраты это что
Лимфоцитарные инфильтраты это что
Лимфоцитарная инфильтрация Исснера—Канофа впервые описано в 1953 г. М. Jessner и N. Kanof. Большинство исследователей полагают, что заболевание следует относить к доброкачественным лимфопролиферативным процессам, хотя некоторые авторы находят клиническое сходство его с хроническим фотодерматозом, дискоидной разновидностью красной волчанки. В настоящее время заболевание сохраняет нозологическую самостоятельность в группе доброкачественных лимфоплазий кожи.
Этиологические факторы инфильтрации Исснера-Канофа сходны с теми, которые указывают при развитии лимфоцитомы: повышенная инсоляция, инфекции (вызванные Borrelia burgdorferi), лекарственные препараты, косметические средства.
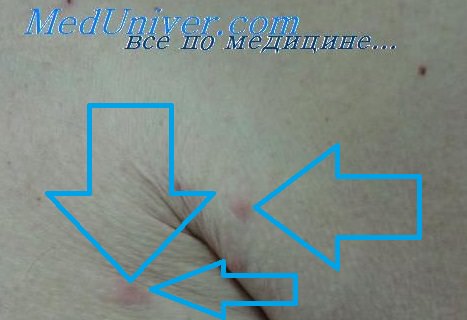
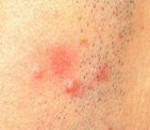
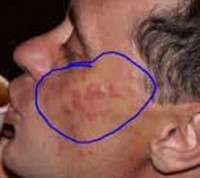
Лимфоцитарная инфильтрация Иесснера—Канофа встречается преимущественно у мужчин в возрасте от 20 до 60 лет. Наиболее типичная локализация — лицо (лоб, скулы, щеки), ушные раковины, шея, затылочная область головы, хотя очаги могут появляться на туловище и конечностях. Процесс обычно начинается с эритематозно-папулезных высыпаний, которые, увеличиваясь за счет периферического роста, постепенно сливаются, уплотняются и образуют бляшки с четкими контурами, кольцевидной или дугообразной конфигурации, с гладкой или слегка шелушащейся поверхностью, синюшно-розового или коричневато-розового цвета. Вследствие эксцентрического роста бляшки могут достигать довольно крупных размеров. В центральной части их могут появляться западения, что придает очагам кольцевидный характер. Заболевание обычно имеет длительный, затяжной характер, может не регрессировать в течение нескольких месяцев. Бывает спонтанное разрешение процесса с последующими рецидивами на тех же или других местах.
Дифференциальный диагноз инфильтрации Исснера-Канофа следует проводить в первую очередь с дискоидной разновидностью красной волчанки, особенно начальными ее проявлениями, лимфоцитомой, саркоидозом. медикаментозными токсидермиями, ЗЛК. Правильный диагноз может быть установлен на основании результатов гистологических и иммунофенотипических методов исследования.
Гистологически в очагах поражения при лимфоцитарной инфильтрации Исснера—Канофа эпидермис большей частью без особых изменений, в субпапиллярном и сетчатом слоях дермы отмечаются большие, часто четко отграниченные инфильтраты, состоящие из гистиоцитов, плазмоцитов и малыхлимфоцитов, имеющие тенденцию располагаться вокруг придатков кожи и сосудов. Образование фолликулов и зародышевых центров не отмечается. В верхних отделахдермы наблюдаются изменения тинкториальных свойств коллагена в виде базофилии, истончения пучков коллагеновых волокон, пролиферации фибробластов и других мезенхимальных элементов.
В последние годы с помощью иммуногистохимических исследований показано, что инфильтрат при инфильтрации Исснера-Канофа состоит преимущественно из Т-лимфоцитов. Однако, в отличие от ТЗЛК, клеточный инфильтрат при лимфоцитарной инфильтрации не полосовид-ный, в дерме отсутствуют утолщенные пучки коллагеновых волокон, не наблюдаются атипичные Т-клетки с церебриформными ядрами и властные формы, отсутствуют эпидермотропизм и микроабсцессы Потрие, нет утраты лимфоцитами пан-Т-клеточных маркеров (CD2, CD3, CD5, CD7). Большая часть лимфоцитов, составляющих основу пролиферата, экспрессирует на своей поверхности маркеры CD4 и CD43. Таким образом, целесообразно данное заболевание относить к группе Т-псевдолимфом кожи.
Затяжное, волнообразное течение инфильтрации Исснера-Канофа, склонность к спонтанному разрешению также подтверждают доброкачественный характер заболевания.
Лимфоцитарные инфильтраты это что
Хронический аутоиммунный тиреоидит (АИТ) – классическое органоспецифическое аутоиммунное заболевание с образованием аутоантител, основным морфологическим проявлением которого является лимфоидная инфильтрация ткани щитовидной железы [3, 10]. Прошло уже около ста лет со дня первого описания аутоиммунного тиреоидита, однако и сегодня морфологическая диагностика аутоиммунных заболеваний щитовидной железы, в частности тиреоидита Хашимото, до сих пор является сложной задачей из-за многообразия гистологических форм [5, 9]. Многие авторы выделяют очаговый тиреоидит как форму аутоиммунного тиреоидита, относя его к ранней стадии заболевания, другие авторы выделяют очаговый тиреоидит как иммунную реакцию организма на различные патологические процессы щитовидной железы, не имеющие связь с аутоиммунным тиреоидитом [6, 7]. Имеются противоречивые данные по поводу гиперплазии тиреоидного эпителия в В-клетки. По данным одних авторов при очаговом тиреоидите в области лимфоплазмоцитарной инфильтрации тиреоидный эпителий имеет характерный вид и состоит из В-клеток, а по данным других, очаговый тиреоидит характеризуется отсутствием В-клеток [1, 7, 8]. В связи с противоречивыми данными возрастает важность изучения характера клеточной инфильтрации (2). На сегодняшний день имеется большое количество научных статей, посвященных морфологическому изучению щитовидной железы при АИТ, однако сведения о клеточном составе лимфоидной инфильтрации весьма скудные [4].
Цель исследования – изучение состава клеток лимфоидного инфильтрата при аутоиммунном и очаговом тиреоидите.
Материал и методы исследования
Исследование выполнено на основе изучения историй болезни и операционного материала, полученного от 72 больных с гистологически верифицированным диагнозом АИТ и 54 больных с очаговым тиреоидитом на фоне различных патологий щитовидной железы, прооперированных в городских больницах г. Ставрополя в период с 2009 по 2011 г.
Для гистологического и гистохимического исследования материал фиксировали в 10 % нейтральном формалине, заливали парафином и готовили срезы толщиной 5–6 мкм. Гистологические срезы гематоксилином и эозином для общих обзорных целей, по Ван Гизону, по Маллори в модификации Гейденгайна. Результаты выраженности того или иного признака оценивались полуколичественным методом, предложенным О.К. Хмельницким, по следующим критериям: 0 – отсутствует, (+) – слабая степень, (++) – умеренная степень, (+++) – выраженная реакция. Также проводили иммуногистохимические окраски всех срезов с использованием антител к CD4 (Т-хелперам), CD8 (Т-супрессорам) и B-лимфоцитам CD19. Для этого приготавливали парафиновые срезы толщиной 5 мкм, наклеивали на стекла, обработанные яичным альбумином. Затем срезы высушивали не менее суток при температуре 37 °С, подвергали депарафинизации и обезвоживанию, демаскировке антигенов (нагреванием на водяной бане до 95–99 °С) и непосредственно окрашиванию антителами. Для интерпретации результатов учитывали локализацию иммунореактантов и интенсивность их окрашивания, которую оценивали полуколичественным методом по следующим критериям: 0 – отсутствует, (+) – слабая реакция, (++) – умеренная реакция, (+++) – выраженная реакция. Морфометрический анализ проводился на микроскопе Nicon Eclipse E200 с цифровой камерой Nicon DS-Fil, персональном компьютере с установленным программным обеспечением NIS-Elements F 3.2.
Результаты исследования и их обсуждение
Макроскопически щитовидная железа при аутоиммунном тиреоидите нередко кремового цвета, плотная, бугристая, неравномерно дольчатая, зачастую спаяна с окружающими тканями, режется с трудом. Поверхность разреза беловато-желтая, непрозрачная, множество белесоватых втянутых тяжей разделяет ткань на мелкие неравные дольки, выступающие над поверхностью. Масса щитовидной железы варьировала от 15 до 38 грамм.
При очаговом тиреоидите щитовидная железа имела кремовый цвет, дольчатое строение, эластическую консистенцию, не спаянную с окружающими тканями, масса щитовидной железы варьировала от 23 до 29 грамм.
При гистологическом исследовании щитовидных желез с аутоиммунным тиреоидитом было выявлена различная степень выраженности инфильтрации. В 18 случаях площадь лимфоплазмоцитарной инфильтрации занимала 20 до 40 %, при этом инфильтрат образовывал лимфоидные фолликулы без четких границ и центров размножения. От 40 до 60 % в 41 случае в инфильтрате определялись крупные фолликулы с центрами размножения в них. В тканях щитовидных желез, содержащих более 60 % лимфоплазмоцитарной инфильтрации (13 случаев), помимо крупных фолликулов с центрами размножения, наблюдался более выраженный фиброз стромы.
Лимфоплазмоцитарные инфильтраты располагались как в строме, так и в паренхиме щитовидной железы. Вблизи инфильтратов определялась деструкция тиреоидного эпителия и более выраженная гиперплазия В-клеток. В двух случах (3 %) железы среди лимфоплазмоцитарной инфильтрации наблюдались отдельные участки эпидермоидной метаплазии фолликулярного эпителия.
При иммуногистохимическом исследовании определялась слабая (+) или умерено выраженная экспрессия (++) CD4 на Т-хелперах. Количество иммунопозитивных клеток лимфоидного инфильтрата варьировало от 8 до 15 % в одном поле зрения. При окраске CD8 во всех случаях выявлялась их выраженная экспрессия на Т-хелперах (+++), а количество иммунопозитивных клеток в инфильтрате варьировало от 31 до 47 %. CD19 экспрессировалась в цитоплазме B-лимфоцитов, при этом отмечалась выраженная (+++) степень экспрессии, а количество иммунопозитивных клеток в инфильтрате варьировало от 38 до 53 %.
При гистологическом исследовании материала с наличием очагового тиреоидита участки лимфоидной инфильтрации определялись преимущественно в строме щитовидной железы. При этом ни в одном из 54 случаев скопления лимфоидной ткани не образовывали фолликулов с центрами размножения. Во всех случаях площадь, занимаемая инфильтратом, не превышала 10 %. При иммуногистохимическом исследовании выявлена в равной степени выраженная (+++) экспрессия CD4 на Т-хелперах и CD8 на Т-супрессорах. При подсчете СD4 иммунопозитивных клеток выявлено от 35 до 57 % клеток в поле зрения. Количество CD8 иммунопозитивных клеток варьировало от 44 до 56 %. Отмечалось отсутствие экспрессии либо слабая (+) экспрессия CD19 на B-лимфоцитах, соответственно количество иммунопозитивных клеток инфильтрата от 0 до 5 % в поле зрения. Среди лимфоплазмоцитарной инфильтрации при очаговом тиреоидите участки эпидермоидной метаплазии тиреоидного эпителия не наблюдались.
Выводы
Лимфоплазмоцитарная инфильтрация при аутоиммунном тиреоидите занимает значительную площадь тиреоидного эпителия, располагается как в строме, так и в паренхиме ткани щитовидной железы. Лимфоидный инфильтрат включает в себя в равной степени В и Т-лимфоциты, однако среди Т-лимфоцитов отмечается увеличение количества Т-хелперов над Т-супрессорами.
В отличие от аутоиммунного тиреоидита, очаговый тиреоидит имеет следующие особенности.
Исходя из вышеуказанных оссобенностей нет оснований рассматривать очаговый тиреоидит как раннюю стадию аутоиммунного тиреоидита.
Рецензенты:
Коробкеев А.А., д.м.н., профессор, заведующий кафедрой нормальной анатомии, ГБОУ ВПО «Ставропольский государственный медицинский университет» Министерства здравоохранения РФ, г. Ставрополь;
Чуков С.З., д.м.н., профессор кафедры патологической анатомии, ГБОУ ВПО «Ставропольский государственный медицинский университет» Министерства здравоохранения РФ, г. Ставрополь.
Лимфоцитарная инфильтрация Джесснера-Канофа
Лимфоцитарная инфильтрация Джесснера-Канофа – редкий хронический дерматоз, характеризующийся доброкачественной инфильтрацией кожи лимфоцитами. Заболевание имеет волнообразное течение, склонно к саморазрешению. Клинически проявляется высыпанием на неизменённой коже плоских гладких синюшно-розовых бляшек или папул, которые сливаются в очаги величиной с ладонь ребенка или взрослого. Первичные элементы имеют чёткие границы, шелушатся. Бляшки обычно единичные, располагаются на лице, шее, туловище, конечностях. Диагностируется клинически с гистологическим подтверждением, иногда проводят молекулярно-биологические исследования. Лечение – НПВС, гормональная терапия, препараты местного действия.
Общие сведения
Лимфоцитарная инфильтрация Джесснера-Канофа – доброкачественная псевдолимфома кожи с хроническим волнообразным рецидивирующим течением. Встречается редко. Чаще возникает у мужчин старше 20 лет. Сезонных, расовых различий не имеет, не эндемична. Иногда наблюдается улучшение в летний период. Впервые данная патология была описана в 1953 году, когда М. Джесснер и Н. Каноф рассмотрели ее как самостоятельное заболевание со сквозной инфильтрацией лимфоцитами всех слоёв дермы. Название «псевдолимфома» в 1965 году ввел К. Мач, объединивший инфильтрацию Джесснера-Канофа в одну группу с другими разновидностями лимфоцитарной инфильтрации.
В 1975 году О. Браун отдифференцировал тип заболевания, отнеся инфильтрацию лимфоцитами к В-клеточным псевдолимфомам, однако позже специалисты стали рассматривать патологию как Т-псевдолимфому. Именно Т-лимфоциты обеспечивают доброкачественное течение патологии и возможность спонтанной инволюции первичных элементов. Дальнейшие исследования показали, что в возникновении и течении лимфоцитарной инфильтрации Джесснера существенную роль играет иммунная система организма. Возможно, это связано с тем, что клетки иммунной системы располагаются в пищеварительном тракте, а он поражается в 70% случаев заболевания. Изучение лимфоцитарной инфильтрации Джесснера-Канофа продолжается и в настоящее время. Понимание причин возникновения и развития Т-лимфоидных процессов имеет большое значение в разработке патогенетического лечения псевдолимфом.
Причины лимфоцитарной инфильтрации
Наиболее вероятными причинами лимфоцитарной инфильтрации Джесснера-Канофа принято считать гиперинсоляцию, укусы клещей, инфекции, патологию желудочно-кишечного тракта, использование дерматогенной косметики и нерациональный приём лекарственных препаратов, провоцирующих системные иммунные нарушения, визуально представленные инфильтративными изменениями в коже. Механизм лимфоцитарной инфильтрации Джесснера-Канофа заключается в следующем: интактный эпидермис даёт Т-лимфоцитам возможность инфильтрировать глубокие слои дермы, располагаясь в сосочковых выростах и вокруг сосудистых сплетений по всей толще кожи. Триггеры заболевания запускают воспаление, на которое реагируют непосредственно клетки кожи и клетки иммунной системы. В процесс купирования воспаления включаются Т-лимфоциты, обеспечивающие доброкачественный ответ иммунной системы в виде пролиферации эпителиальных клеток дермы.
Одновременно в коже развивается банальное воспаление, проходящее три стадии: альтерации, экссудации и пролиферации с участием гистиоцитов – клеток ретикулярной ткани. Гистиоциты группируются и образуют островки, напоминающие лимфоидные фолликулы. На конечном этапе купирования воспаления два параллельных процесса пролиферации дополняют и усиливают друг друга. Так возникает очаг лимфоцитарной инфильтрации. Поскольку лимфоциты гетерогенны, оценка их гистохимических свойств с помощью иммунологических маркеров и моноклональных антител легла в основу иммунофенотипирования. Этот анализ имеет большое диагностическое значение в современной дерматологии.
Симптомы лимфоцитарной инфильтрации
Первичным элементом кожной сыпи при лимфоцитарной инфильтрации Джесснера-Канофа является крупная плоская розово-синюшная бляшка или папула с чёткими границами и гладкой поверхностью, имеющая тенденцию к периферическому росту. Сливаясь между собой, первичные элементы образуют кольцевидные или дугообразные «острова» с участками шелушения. Разрешение высыпавших элементов начинается с центра, поэтому сливные очаги могут иметь западание в центральной части. Типичной локализацией принято считать лицо, шею, околоушное пространство, затылок, лоб, щёки и скулы. Редко высыпания появляются на коже туловища и конечностях. Обычно первичный элемент одиночный, реже наблюдается тенденция к распространению процесса.
Лимфоцитарная инфильтрация Джесснера-Канофа характеризуется волнообразным рецидивирующим течением. Резистентна к проводимой терапии, способна спонтанно саморазрешаться. Рецидивы обычно возникают в местах прежней локализации, но могут захватывать и новые участки кожного покрова. Несмотря на длительное хроническое течение, внутренние органы в процесс не вовлекаются.
Диагностика лимфоцитарной инфильтрации
Заболевание диагностируется дерматологом на основании анамнеза, клиники, гистологии и люминесцентного микроскопирования (типичное свечение на границе дермоэпидермального соединения не определяется) с обязательной консультацией иммунолога и онколога. Гистологически при лимфоцитарной инфильтрации Джесснера-Канофа выявляется неизменённый поверхностный слой кожи. В толще дермальных слоёв обнаруживается группирование лимфоцитов и клеток соединительной ткани вокруг сосудов.
В сложных случаях проводят иммунотипирование опухоли, гистохимическое и молекулярное тестирование. К. Фан с соавторами рекомендуют основывать диагностику на результатах ДНК-цитофлюориметрии с анализом количества нормальных клеток (при лимфоцитарной инфильтрации Джесснера-Канофа более 97%). Дифференциальную диагностику проводят с саркоидозом, системной красной волчанкой, центробежной эритемой Биетта, кольцевидной гранулёмой, группой лимфоцитарных опухолей, токсикодермией и сифилисом.
Лечение лимфоцитарной инфильтрации
Лечение направлено на купирование острой фазы лимфоцитарной инфильтрации Джесснера-Канофа и увеличение продолжительности светлых промежутков. Терапия патологии неспецифическая. Отмечается хороший терапевтический эффект при назначении антималярийных препаратов (хлорохин, гидроксихлорохин) и нестероидных противовоспалительных средств (диклофенак, индометацин) после предварительного лечения сопутствующей патологии желудочно-кишечного тракта. Если состояние пищеварительной системы позволяет, применяют энтеросорбенты. Местно показаны гормональные кортикостероидные мази и кремы, а также инъекционные блокады очагов высыпаний триамцинолоном и бетаметазоном. При резистентности к проводимой терапии подключают плазмаферез (до 10 сеансов).
Клинико-лабораторная диагностика редких форм первичных лимфом кожи
Обобщен опыт клинико-лабораторной диагностики первичных лимфом кожи в клинике ГБУ СО УрНИИДВиИ за пятилетний период. Представлены описания собственных клинических наблюдений больных редкими формами первичных лимфом кожи.
The experience of the clinical and laboratory diagnostics of primary cutaneous lymphomas in the clinic of the Ural Research Institute of Dermatovenerology and Immunopathology over a five year period is summarized. The descriptions of the own clinical observations of patients with rare forms of primary cutaneous lymphomas are presented.
Своевременная диагностика и эффективное лечение первичных лимфом кожи (ПЛК), как и других новообразований, являются приоритетными задачами медицины, поскольку имеют решающее значение при выборе оптимальной тактики лечения больного и определяют долгосрочный прогноз заболевания [1, 2].
ПЛК представляют собой гетерогенную группу заболеваний, развитие которых обусловлено неопластической пролиферацией и накоплением клонов Т-лимфоцитов, NK-клеток или В-лимфоцитов в коже без обнаружения внекожных мест локализации на момент постановки диагноза [3].
Актуальность рассмотрения проблемы диагностики ПЛК в учреждениях кожно-венерологического профиля определяется тем, что врач дерматовенеролог, как правило, является специалистом «первого контакта» при обращении больного с кожными проявлениями, поскольку ПЛК на ранних стадиях заболевания могут имитировать различные хронические воспалительные дерматозы.
В настоящее время в ГБУ СО УрНИИДВиИ накоплен значительный и многолетний опыт клинической диагностики ПЛК. Институт располагает высокотехнологичной материально-технической базой и возможностями комплексной диагностики ПЛК, в том числе с проведением патоморфологического и иммуногистохимического исследования биоптатов кожи, компьютерной морфометрией результатов иммуногистохимических исследований и конфокальной лазерной сканирующей микроскопией кожи in vivo.
В клинике ГБУ СО УрНИИДВиИ за период с 2011 по 2015 г. было проведено 292 биопсии кожи с последующими патоморфологическими и иммуногистохимическими исследованиями с целью установления диагноза при подозрении на лимфопролиферативные заболевания кожи. В результате оценки клинических проявлений, данных патоморфологических и иммуногистохимических исследований биоптата кожи у 226 (77,4%) обследованных больных были установлены диагнозы хронических дерматозов, у 48 (16,4%) больных впервые был подтвержден диагноз лимфомы кожи и только у 18 (6,1%) больных диагноз не был уточнен, а пациенты взяты на диспансерный учет в целях осуществления клинического мониторинга и повторных гистологических исследований.
Из числа больных лимфомами кожи у 43 (89,5%) больных были диагностированы Т- и NK-клеточные лимфомы кожи и в 5 (10,5%) случаях — В-клеточные лимфомы кожи. Соотношение Т- и NK-клеточных и В-клеточных лейкоцитов составило 8,5:1.
В структуре Т- и NK-клеточных лимфом кожи подавляющее число составили больные грибовидным микозом — 36 случаев (87,8%), причем у всех больных диагноз был верифицирован на ранних стадиях заболевания (на IB стадии заболевания были выявлены 7 больных, на IIA стадии — 29 больных). Среди этих больных были диагностированы 4 случая фолликулотропного варианта грибовидного микоза и 2 случая пойкилодермического варианта течения заболевания. Кроме этого были диагностированы 3 случая CD30+ первичной анапластической крупноклеточной лимфомы, 2 случая лимфоматоидного папулеза, 1 случай первичной кожной CD4+ плеоморфной Т-клеточной лимфомы из клеток малого и среднего размера и 1 случай ангиоиммунобластной Т-клеточной лимфомы.
В качестве примеров клинических проявлений, результатов комплексной диагностики и лечения больных редкими вариантами первичных кожных лимфом приводим описания собственных наблюдений.
Пациент З., 72 года. Жалобы при поступлении на высыпания на коже туловища, шеи, верхних и нижних конечностей, сопровождающиеся постоянным умеренным зудом.
Anamnesis morbi: начало заболевания около 2 лет назад, постепенное, причинно ни с чем не связывает. Первые проявления в виде высыпаний на коже поясничной области и верхних конечностей, сопровождающиеся слабым периодическим зудом. Наблюдался у дерматовенеролога по месту жительства с диагнозом: распространенный токсико-аллергический дерматит, получал многократное курсовое неспецифическое лечение с кратковременным эффектом. В течение последних трех месяцев отмечает выраженное ухудшение кожного процесса: увеличение размеров и распространение высыпаний на область живота, нижних конечностей, значительное усиление интенсивности кожного зуда. С целью обследования и уточнения диагноза был направлен на стационарное лечение в ГБУ СО УрНИИДВиИ.
Общее состояние больного при поступлении удовлетворительное, положение активное, сознание ясное. Костно-мышечная система без особенностей. Подкожно-жировая клетчатка развита недостаточно, распределена равномерно. Грудная клетка правильной формы, симметричная. В легких перкуторно ясный легочный звук, при аускультации дыхание везикулярное, хрипов нет. Частота дыхания 20 в мин. Область сердца не изменена. Границы сердца в пределах нормы. Тоны сердца приглушены, ритм правильный. ЧСС 62 удара в минуту. АД 128/65 мм рт. ст. Живот при пальпации мягкий, безболезненный. Печень у края реберной дуги. Симптом Пастернацкого отрицательный с обеих сторон. Физиологические отправления в норме.
St. specialis: на коже туловища, шеи, верхних и нижних конечностей определяются множественные пятна, кирпично-красного цвета, с четкими границами, мелкопластинчатым шелушением на поверхности и единичными геморрагическими экскориациями; бляшки округлой и овальной формы, диаметром от 0,5 до 3 см, розового цвета с коричневатым оттенком, покрытые блестящими серебристо-белыми чешуйками, умеренно инфильтрированными, мягко-эластической консистенции. Дермографизм белый. Региональные лимфатические узлы интактны (рис. 1).
Общий анализ крови: Hb — 147 г/л, эр. — 4,68 × 10 12 /л, лейк. — 8,2 × 10 9 /л, нейтр. 74,7%, эоз. 2,2%, лимф. 16,3%, мон. 6%, СОЭ — 2 мм/ч. Показатели общего анализа мочи, биохимического анализа крови, иммунограммы — в пределах нормы. Антитела к ВИЧ, гепатитам В и С не обнаружены, комплекс серологических реакций к Treponema pallidum отрицательный. При рентгенологическом исследовании грудной клетки патологических изменений не выявлено.
Патоморфологическое исследование биоптата кожи: эпидермис с диффузным гиперкератозом, очаговым паракератозом, выраженным акантозом с неравномерно удлиненными и утолщенными акантотическими выростами. Фокусы лимфоидной инфильтрации клеток, преимущественно средних размеров со значительной примесью гранулоцитов, локализуются перифолликулярно, размывая дермоэпидермальную границу (рис. 2).
Иммуногистохимическое исследование биоптата кожи: опухолевые клетки экспрессируют CD3 и CD4, не экспрессируют CD8; В-лимфоциты (СD20) — в виде небольших скоплений среди опухолевых клеток; определяются единичные Т-лимфоциты, экспрессирующие CD7 и CD8.
На основании данных клинического осмотра и результатов гистологического и иммуногистохимического методов исследования биоптата кожи установлен диагноз: первичная лимфома кожи, грибовидный микоз, фолликулотропный вариант, IIА стадия (Т2, N0, M0, B0). С целью назначения профильной терапии больной направлен к гематологу.
Больная Г., 42 года, обратилась с жалобами на опухолевидное образование на коже лба, болезненность в области заушных и верхних шейных лимфоузлов справа.
Считает себя больной в течение 5 лет, на протяжении которых отмечает медленное увеличение размеров новообразования на коже лба. Наблюдалась у дерматовенеролога по месту жительства с диагнозом «гемангиома», лечение не проводилось.
При обращении в клинику общее состояние больной удовлетворительное. Со стороны внутренних органов патологических изменений не выявлено.
St. specialis: на коже височной области справа локализуется опухолевидное образование плотно-эластической консистенции, безболезненное при пальпации, неправильной формы, размером до 5 × 7 см, со слегка бугристой поверхностью, по периферии которого имеются несколько узелков от 3 до 10 мм в диаметре. Все образования имеют розово-цианотичную окраску и блестящую поверхность без шелушения (рис. 3). Регионарные лимфатические узлы увеличены, мягко-эластической консистенции, с легкой болезненностью при пальпации.
Лабораторные данные. Общий анализ крови: Hb — 126,0 г/л, эритроциты — 4,2 × 10 12 /л, лейкоциты — 4,2 × 10 9 /л, СОЭ — 10 мм/ч. В общем анализе мочи, биохимическом анализе крови и иммунограмме отклонений не выявлено. Исследование крови на вирусные гепатиты, ВИЧ и комплекс серологических реакций к Treponema pallidum отрицательные. По данным рентгенологического исследования грудной клетки патологических изменений не выявлено. УЗИ органов брюшной полости без патологии. УЗИ шейных лимфоузлов: справа увеличены лимфоузлы верхней группы, заушный лимфоузел — 25 × 19 мм, узел у бифуркации общей сонной артерии — 32 × 12 мм. МРТ головного мозга: патологии не выявлено.
В клинике ГБУ СО УрНИИДВиИ была проведена инцизионная биопсия кожи из области очага. Патоморфологическое исследование биоптата кожи: в эпидермисе гиперкератоз, акантоз, очаговый спонгиоз. Во всех отделах дермы плотный диффузно-нодулярный инфильтрат без признаков эпидермотропизма, представленный смесью клеток, среди которых преобладают лимфоидные клетки малого и среднего размера с умеренно выраженными признаками клеточной атипии, имеющие удлиненные гиперхромные ядра неправильных очертаний. В значительном количестве определяются лимфоциты обычного вида, гистиоциты, в том числе гигантские многоядерные клетки, неравномерно расположенные эозинофилы, иммунобласты и плазмоциты. Имеется пролиферация капилляров. В пограничной зоне расположено большое количество лимфатических фолликулов с крупными светлыми центрами (рис. 4).
При иммуногистохимическом исследовании биоптата кожи: иммунофенотип подавляющего большинства клеток инфильтрата CD3+, CD4+, CD8–, CD30–. Определяются рыхло расположенные немногочисленные CD8+ лимфоциты. В-лимфоциты (CD20+) расположены разрозненно в толще инфильтрата или образуют фолликулы с характерной зональностью: Bcl-6+ и Bcl-2+ — в светлых центрах и Bcl-2+ и Bcl-6+ — в зоне мантии. Экспрессия Ki67 составляет около 10% в зоне Т-клеточного инфильтрата и около 90% в светлых центрах фолликулов (рис. 5).
С учетом клинических, морфологических и иммуногистохимических данных больной был установлен окончательный нозологический диагноз: первичная кожная CD4+ плеоморфная Т-клеточная лимфома кожи из клеток малого и среднего размера. Больная была направлена на лечение к гематологу.
Больной П., 1964 г. рождения, обратился с жалобами на опухолевые образования на коже туловища и верхних конечностей, общую слабость, повышенную утомляемость, снижение массы тела на 15 кг в течение 10 лет.
Anamnesis morbi: считает себя больным в течение 20 лет, когда впервые возникли единичные высыпания на коже туловища и верхних конечностей, сопровождающиеся слабым периодическим зудом. В дальнейшем течение процесса сопровождалось регрессом имеющихся и появлением новых высыпаний на коже указанных областей, а за предыдущие 2 года — появлением бляшек и опухолей, присоединением общей слабости, повышенной утомляемости и постепенным снижением массы тела.
При объективном осмотре: положение больного активное, состояние удовлетворительное, сознание ясное. Определяются визуально увеличенные пакеты сгруппированных лимфоузлов в подмышечных и паховых областях. При пальпации лимфоузлы плотноэластической консистенции, подвижные, не спаянные с окружающими тканями, диаметром до 2 см. Размеры печени и селезенки при физикальном осмотре и по данным УЗИ органов брюшной полости увеличены.
Данные лабораторных и инструментальных методов обследования: общий анализ крови эритроциты — 3,4 × 10 12 /л, гемоглобин — 95 г/л, лейкоциты — 8,2 × 10 9 /л, форм.: эозинофилы — 1%, нейтрофилы п/я — 4%, нейтрофилы с/я — 82%, лимфоциты — 11%, моноц. — 2%, СОЭ — 50 мм/ч, анизоцитоз. В общем анализе мочи отклонений не выявлено. Биохимическое исследование крови: общий белок — 61 г/л, АЛТ — 0,17 ммоль/л, АСТ — 0,22 ммоль/л, глюкоза — 5,3 ммоль/л, мочевина — 4,6 ммоль/л, креатинин — 55,3 мкмоль/л. РПГА к Treponema pallidum — отрицат. ЭКГ: синусовый ритм, ЧСС 75 в мин.
При гистологическом исследовании биоптата кожи: во всех отделах дермы обнаружен плотный диффузный эпидермотропный полиморфный инфильтрат, представленный опухолевыми лимфоидными клетками преимущественно крупного размера с хорошо выраженной цитоплазмой, ядрами разной формы и структуры. Среди них рассеяны клетки средних размеров в большинстве с ядрами неправильной формы, а в периферических отделах инфильтрата — клетки типа лимфоцитов более мелких размеров. Также встречаются многоядерные клетки (рис. 7). Эпидермис на значительном протяжении изъязвлен. При иммунофенотипировании клетки экспрессируют CD45/LCA, CD30, CD3, единичные клетки экспрессируют Vimentin и CD68, не экспрессируют CD7, CD20, CD79 a, ALK, EMA, S100 Protein (рис. 8).
С учетом клинических и иммуноморфологических данных больному был установлен окончательный нозологический диагноз: первичная CD30+ анапластическая крупноклеточная лимфома кожи (ALK–), направлен на лечение к гематологу.
Больная З., 1949 г. рождения, обратилась с жалобами на опухолевидное образование на коже волосистой части головы, болезненное при пальпации.
.jpg)
Анамнез жизни, аллергоанамнез и профессиональный маршрут у больной без особенностей. Наследственность по кожным заболеваниям и онкопатологии не отягощена.
Объективно: больная среднего роста, правильного телосложения, удовлетворительного питания. В легких дыхание везикулярное, хрипов нет. Тоны сердца ясные, ритмичные, АД 130/86 мм рт. ст., ЧСС 70 в минуту. Живот мягкий, безболезненный при пальпации, печень и селезенка не увеличены. Пальпируются подчелюстные и заушные лимфатические узлы овальной и округлой формы, эластической консистенции, безболезненные, подвижные, до 1 см в диаметре. Физиологические отправления в норме.
St. specialis: непораженные участки кожных покровов физиологической окраски, нормальной влажности и тургора. Видимые слизистые влажные, физиологической окраски. Кожный процесс представлен опухолевидным образованием неправильной формы, плотной консистенции, розово-красного цвета, размером 4 × 4,5 см, локализованным на коже волосистой части головы, в проекции затылочной области справа. Очаг инфильтрирован, возвышается над поверхностью кожи на 0,5 см, имеет неровную и бугристую поверхность с частично сохраненными волосяными фолликулами и ростом волос. По правому краю очага, в месте изъятия биопсийного материала, определяется рубцовая деформация кожи нормотрофического характера (рис. 9). Волосы и ногтевые пластинки не изменены. Дермографизм красный, быстрый.
Лабораторные данные. Общий анализ крови: гемоглобин — 131 г/л, эритроциты — 4,21 × 10 12 /л, лейкоциты — 5,5 × 10 9 /л, нейтрофилы — 2,8 × 10 9 /л, эозинофилы — 0,3 × 10 9 /л, лимфоциты — 2,1 × 10 9 /л, моноциты — 0,3 × 10 9 /л, СОЭ — 5 мм/ч. В общем анализе мочи и иммунограмме отклонений не выявлено. В биохимической гепатограмме — повышение холестерина до 6,53 ммоль/л. Комплекс серологических реакций к Treponema pallidum отрицательный. Антитела к ВИЧ, гепатитам В и С не обнаружены.
На консилиуме дерматовенерологов в клинике ГБУ СО УрНИИДВиИ был заподозрен диагноз онкопатологии кожи, в связи с чем больная была направлена к хирургу для проведения повторной инцизионной биопсии кожи из области очага.
Результаты патоморфологического исследования биоптата кожи: эпидермис без существенных изменений. В дерме плотный диффузный инфильтрат без признаков эпидермотропности, образованный крупными лимфоидными клетками с амфофильной цитоплазмой, округлыми и овальными ядрами. Отмечается высокий уровень митоза и апоптоза (рис. 10).
Иммуногистохимическое исследование биоптата кожи: клетки опухоли диффузно экспрессируют CD20 и не экспрессируют CD3, Bcl-2, CD10, CD30. Определяется минимальное количество реактивных Т-лимфоцитов (CD3+, Bcl-2+, CD20–). Индекс Ki67 — около 90% (рис. 11).
На основании анамнеза заболевания, клинических и патоморфологических данных, результатов иммуногистохимического исследования биоптата кожи больной был установлен окончательный нозологический диагноз: первичная кожная диффузная крупноклеточная В-клеточная лимфома, тип нижних конечностей, Bcl-2 негативная, IA (Ann Arbor). Больная была направлена на лечение к гематологу, где в результате проведенных 2 курсов полихимиотерапии по протоколу R-CHOP был достигнут полный регресс опухоли (рис. 12).
Заключение
Представленные клинические случаи подтверждают сложность установления диагноза ПЛК из-за вариабельности кожных проявлений и их сходства с хроническими дерматозами, демонстрируют необходимость повышения информированности врачей дерматовенерологов амбулаторного звена о первичных лимфомах кожи, подчеркивают необходимость своевременного проведения комплексного клинико-лабораторного обследования больных с использованием гистологических и иммуногистохимических методов исследования биоптата кожи.
Литература
ГБУ СО УрНИИДВиИ, Екатеринбург

.jpg)
.jpg)
.jpg)
.jpg)
_575.jpg)