Локальная инфекция что это
Сепсис. Септический шок
Введение
Подобно тому, как местный иммунитет реагирует на занозу, – приливом крови, локальным повышением температуры, активизацией иммунных факторов, атакой макрофагов на занесенные с грязью бактерии, – общий иммунитет пытается справиться с патогенным микроорганизмом и его токсинами, если они проникают в системный кровоток и разносятся по всем тканям и органам. В этом случае острый инфекционно-воспалительный процесс вспыхивает в масштабах всего организма, и начинается, образно говоря, нечто вроде тотальной атомной войны, где противника можно уничтожить только ценой самоуничтожения.
Известно множество терминологических дефиниций понятия «сепсис». Ранее в качестве облигатного, обязательного признака указывалось присутствие болезнетворного организма в системе кровообращения, затем акцентировалась «системная воспалительная реакция» (септицемия). В последнее время, однако, в медицине отмечается стремление ко все более точным формулировкам и четкому разграничению понятий. Было установлено, например, что не каждая бактериемия (наличие бактерий в крови) приводит к сепсису, и наоборот: состояние, чрезвычайно близкое по сути и клинике к септическому шоку, может развиться и в отсутствие бактериемии (см. материал «Инфекционно-токсический шок»). На сегодняшний день многие теоретические и методологические позиции пересмотрены; в 2016 году Обществом интенсивной терапии и реаниматологии (SCCM) и Европейским обществом интенсивной терапии (ESICM) было представлено новое руководство по сепсису. В определении понятия акцентируется уже не «системная реакция на инфекцию», а жизнеугрожающая полиорганная дисфункция вследствие нарушенной регуляции иммунного отклика (такое регуляторное расстройство можно сравнить, опять же, с приказом «Бей всех подряд, своих и чужих, чем попало, как получится и с какой угодно силой»). Понятие «тяжелый сепсис» из руководства исключено как лишнее, тавтологичное. И то сказать: если это действительно сепсис, ситуация в любом случае достаточно тяжела.
В том же 2016 году в США было проведено исследование затратности медицинской помощи, оказываемой в интенсивном краткосрочном режиме. Среди состояний, требующих наиболее дорогостоящего неотложного ответа, сепсис оказался на первом месте (остеоартрит на втором, перинатальная патология на третьем, осложнения имплантации на четвертом, инфаркт миокарда на пятом).
В 2018 году было доказано, что внедрение новых протоколов интенсивной терапии сепсиса достоверно снижает летальность. Тем не менее, она остается высокой и оценивается на уровне 20-35%, а при септическом шоке (наиболее тяжелой, предельно выраженной форме сепсиса) варьирует в диапазоне 30-70%.
В Санкт-Петербурге с 2008 года действует единственный в стране Центр по лечению тяжелого сепсиса при НИИ скорой помощи им. Джанелидзе. Его руководитель, профессор С.А.Шляпников, неоднократно обращал внимание медицинской общественности на то, что отечественная статистика сепсиса далеко не полно отражает действительность; что этот диагноз, особенно если он устанавливается посмертно в качестве постоперационного, очень не любят «наверху»; что на самом деле практически все больные, умирающие после сложных хирургических вмешательств на третий-четвертый день, умирают именно от сепсиса, а не от «основного диагноза».
С 2015 года в Санкт-Петербурге активно работает мультидисциплинарное Общество специалистов по сепсису.
13 сентября отмечается Всемирный день борьбы с сепсисом.
В августе 2018 года под эгидой Глобального Альянса по борьбе с сепсисом прошел Второй всемирный конгресс по сепсису, причем проводился он полностью в онлайн-режиме, благодаря чему объединил и связал заинтересованных специалистов из самых разных стран.
Все это говорит о том, что даже сегодня, в эпоху асептики и антисептики, проблема «заражения крови» никуда не исчезла.
Причины
Причиной сепсиса теоретически может быть любой микроорганизм, – будь то бактерия, вирус, грибок, простейшее, – способный вызывать у человека инфекционно-воспалительный процесс.
На практике чаще всего выявляются гноеродные стрептококки и стафилококки, менингококки, пневмококки, клебсиелла, кишечная палочка и др. Первичным очагом примерно в половине диагностированных случаев оказывается легочная инфекция, затем следуют кишечные и урогенитальные инфекции. Однако диагностировать определенный первичный очаг не удается, по меньшей мере, в каждом третьем случае.
Главными факторами риска выступают ослабленный иммунитет (в частности, именно поэтому высока частота постоперационных, послеродовых, посттравматических сепсисов, а также сепсисов у пожилых и новорожденных, больных ВИЧ/СПИД, онкопатологией, заболеваниями печени и почек).
В основе патогенеза лежат грубые нарушения тканевой микроциркуляции крови, запускающие каскад взаимопотенцирующих патологических процессов (орган за органом, система за системой начинают дисфункционировать и угрожают полным отказом), а также общая интоксикация продуктами жизнедеятельности возбудителя инфекции (экзо- и эндотоксинами). Тем и определяется клиническая картина сепсиса.
Симптоматика
Учитывая, что возможные патогены очень многообразны (инфекция нередко носит полимикробный или комбинированный характер), что локализация и характер первичного заболевания (флегмона, пневмония, парапроктит и т.д.) также могут быть самыми разными, – причем «основная симптоматика» сепсисом отнюдь не отменяется, – словом, ждать точного повторения клинической картины в каждом конкретном случае не приходится.
Есть, однако, определенные ключевые моменты, отличающие сепсис от «простой» локальной инфекции, а септический шок, – от сепсиса в начальной или развернутой стадии.
Температура может быть очень высокой или, наоборот, низкой (менее 36°C); частота сердечных сокращений (ЧСС) и дыхательных движений (ЧДД) увеличена, дыхание поверхностное. Общее состояние лихорадочное, средней или значительной тяжести. Дальнейшее усугубление бактериемии (виремии, фунгемии), нарастание концентрации вазотропных токсинов в крови и интенсивности системной воспалительной реакции – приводят к резкому падению АД, нарушениям магистральной и капиллярной гемодинамики, гипоперфузии (ткани недостаточно пропитываются кровью) и лавинообразному нарастанию последствий ишемии. Возможны сильные боли различной локализации, похолодание конечностей, цианоз или «мраморность» кожных покровов.
Олигурия (сокращение частоты и объема мочеиспускания), спутанность и помрачение сознания с психотическими включениями (галлюцинации и псевдогаллюцинации, персекуторные идеи) служат предвестниками септического шока, при наступлении которого артериальное давление «проваливается», несмотря на назначаемую инфузионную терапию, сознание утрачивается, общее состояние прогрессивно ухудшается, развиваются множественные геморрагии и тромбоз из-за изменений в реологических свойствах крови (плотность, вязкость).
В ряде случаев при выраженной почечной, печеночной, легочной, сердечной недостаточности на фоне сепсиса изменения в тканях становятся необратимыми и спасти больного не удается.
Диагностика
Согласно новым (2016) и уже принятым в большинстве развитых стран диагностическим критериям SOFA и quickSOFA, – которые, впрочем, тоже вызывают обоснованную критику, – основными клиническими признаками сепсиса являются выраженная гипотензия (систолическое давление ниже 100 мм. рт. ст.), тахипноэ (более 22 вдохов в минуту) и угнетение сознания с появлением тех или иных психопатологических симптомов. Кроме того, в любом медучреждении, даже если оно не специализируется на оказании неотложной помощи, будут немедленно назначены лабораторные анализы крови в режиме «cito!» (срочно), результаты которых в случае сепсиса позволяют идентифицировать системную воспалительную реакцию и в первом приближении оценить степень несостоятельности жизненно важных органов. Дальнейшие диагностические исследования назначаются по мере необходимости, – в зависимости от доминирующей симптоматики и общей динамики состояния.
Лечение
Первоочередными направлениями интенсивной терапии при сепсисе и/или септическом шоке включают санацию первичного очага инфекции (в ряде случаев необходимо экстренное хирургическое вмешательство или ударные дозы мощных бактериостатиков); восстановление нормальной гемодинамики и, в частности, микроциркуляции, а также сердечной деятельности и дыхания; детоксикация; предотвращение тромбоза, геморрагий, дегидратации (обезвоживания); нормализация психического статуса, стабилизация общего состояния пациента.
Дальнейшие реабилитационные мероприятия разрабатываются в каждом случае индивидуально.
Что такое инфекция цитомегаловирусная? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 13 лет.
Определение болезни. Причины заболевания
Цитомегаловирусная болезнь (ЦМВИ, цитомегалия, вирусная болезнь слюнных желёз, болезнь с включениями) — это общее системное инфекционное заболевание, вызываемое вирусом семейства герпесов V типа — цитомегаловирусом, который специфически поражает лейкоциты и клетки различных органов (слюнных желёз, почек, лёгких, печени, головного мозга и другие).
Клинически характеризуется многообразием проявлений — от бессимптомного течения до генерализованных (распространённых) форм с поражением внутренних органов и центральной нервной системы, а также пожизненного пребывания в организме.
Этиология
Вид — Cytomegalovirus hominis (открыт в 1956 году)
Является древним человеческим вирусом (предположительно с Кембрийского периода), который в ассоциации с другими герпесвирусами оказал значительное влияние на формирование иммунитета современного человека.
Внутривидовая структура неоднородна. Известно о трёх штаммах вируса: Davis, АД 169, Kerr и Towne. Они могут иметь различия в тропизме к тканям человека, различаться по степени вирулентности и патогенности.
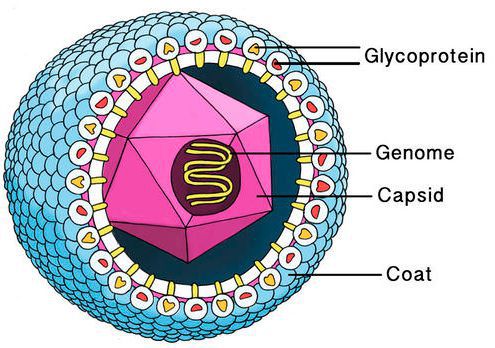
Цитомегаловирус имеет внешнюю гликопротеиновую оболочку, в составе которой есть B и H звенья — к ним формируются антитела. Представляет собой двухцепочечный ДНК-содержащий крупный вирус с диаметром нуклеокпсида до 180 нм.
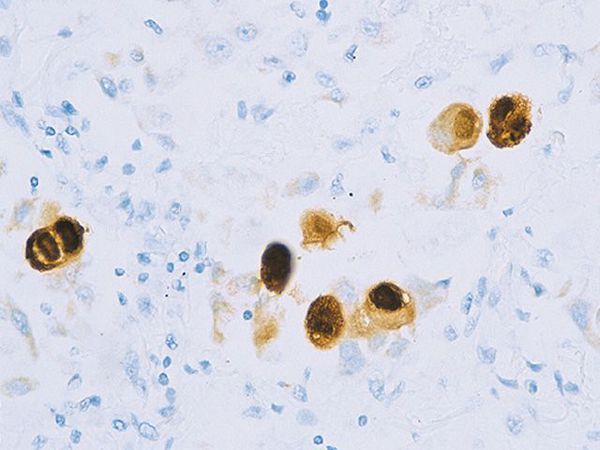
Вирус способен поражать практически любую ткань человеческого организма, т.е. обладает политропностью. При развитии в ядрах инфицированных клеток образует включения (незрелые вирионы), описываемые как «глаз совы».
Вызывает цитомегалию (увеличение) клеток, не приводя к их гибели. Способен при активном течении значительно снижать иммунитет. Возможна трансплацентарная передача вируса с развитием врождённой инфекции.
Культивируется на культуре фибробластов (клеток соединительной ткани) человека. Изменения хромосомного набора клеток не вызывает. Очень чувствительны к ЦМВ клетки плода и новорождённого.
Малоустойчив в окружающей среде, быстро погибает при повышении температуры до 56°С и действии дезинфицирующих средств, теряет заражающие свойства при замораживании. В условиях комнатной температуры способен сохраняться в течение нескольких дней. [1] [3] [4] [8]
Эпидемиология
Антропоноз. Источник инфекции — только человек (больной различными формами и носитель), причём выделение вируса возможно в течение всей жизни человека и зависит от его индивидуальных иммунологических особенностей. Возможно заражение различными штаммами ЦМВ, роль этого в изменении патологии и клинической картине пока не выяснена.
Как передаётся цитомегаловирус
Механизмы передачи вируса:
Факторами передачи вируса выступают слюна (преимущественно), моча, кровь, вагинальный секрет, слёзы, сперма, фекалии, грудное молоко.
Восприимчивость среди населения высокая, наибольшее количество заражённых выявляется в детском и подростковом возрасте, когда происходит повышение контактных взаимодействий между людьми. Во взрослом состоянии ЦМВ инфицировано до 95% населения планеты, которые являются пожизненными носителями вируса. [1] [2] [3] [8]
Симптомы цитомегаловирусной инфекции
Инкубационный период — от 15 дней до трёх месяцев (при манифестной, т. е. явно выраженной форме).
Врождённая форма цитомегаловирусной инфекции
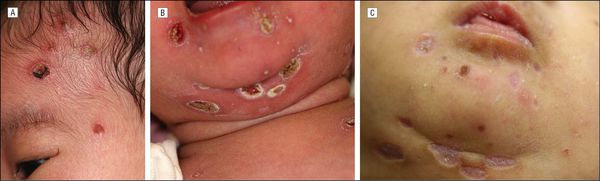
Цитомегаловирусную инфекцию выявляют примерно у одного из 200 рождённых детей, каждый пятый из них имеет или будет иметь проблемы со здоровьем. Сразу после рождения выявляются низкая масса тела, увеличение печени и селезёнки, желтуха, увеличение всех групп лимфоузлов, высыпания геморрагического характера, различные органные поражения, резкие изменения гемограммы и функциональных тестов. В крови, слюне и моче выявляется вирусная ДНК (в ряде случаев выделение вируса продолжается на протяжении нескольких лет).
Прогноз серьёзен и зависит от тяжести поражения и объёма проводимых лечебных мероприятий. В более поздние сроки инфицирования беременной вероятность тяжёлых проявлений заболевания существенно ниже, и новорождённые, как правило, не имеют симптомов врождённой ЦМВ-инфекции на начальных этапах после родов, однако это не говорит о полном клиническом благополучии в будущем — возможно поражение нервной системы различной степени выраженности и нейросенсорная тугоухость. Поэтому такие дети нуждаются в обследовании и наблюдении профильных специалистов, а при необходимости — в лечении. [1] [2] [3] [5] [8] [10]
Приобретённая форма цитомегаловирусной инфекции
При приобретённых формах заболевание чаще всего протекает в детском или подростковом возрастах. В эти периоды отмечается наибольшая лабильность иммунной системы (имеет значение при группе «детских инфекций»).
Чаще всего первичное инфицирование протекает или бессимптомно, или по типу ОРЗ нетяжёлого течения. Наблюдаются лёгкая слабость, субфебрилитет (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение лимфатических узлов шеи, увеличение и болезненность слюнных желёз.
Зачастую такие проявления не вызывают настороженности в плане ЦМВ и самостоятельно купируются в течение 1-2 недель — болезнь переходит в стадию латентного течения (носительство).
При инфицировании в более позднем возрасте (взрослые люди), а также у некоторых детей (с нарушением иммунитета) и ослабленных больных заболевание, как правило, протекает с явными морфофункциональными нарушениями и гораздо тяжелее, чем у первой группы лиц. Наблюдается:
Синдром тонзиллита не характерен. Увеличивается печень и селезёнка, значимо изменяются показатели гемограммы и функциональных печёночных проб.
В зависимости от состояния иммунной системы и возможностей её коррекции клинически значимая первичная инфекция у данной группы людей продолжается в течение 1-3 месяцев и, как правило, завершается победой организма над вирусной экспансией с последующим формированием вирусоносительства без каких-либо явных клинических проявлений.
В некоторых случаях (ВИЧ-инфекция, онкологические заболевания, длительный приём цитостатических препаратов, генетические дефекты иммунной системы) может наблюдаться длительное волнообразное течение первичной инфекции или реактивация (обострение) имеющегося носительства вируса (латентной формы). В этом случае отмечается:
Мононуклеозоподобный синдром
При выраженной форме болезни может развиться мононуклеозоподобный синдром — слабость, субфебрильная температура (37,1—38,0 °C), увеличение и чувствительность лимфоузлов, увеличение печени и селезёнки, изменения крови вирусного характера.
Симптомы цитомегаловируса у мужчин и женщин
Цитомегаловирусная инфекция поражает людей всех возрастов и полов. Принципиальных отличий в симптомах у мужчин и женщин нет, за исключением поражения половых органов.
Цитомегаловирусная инфекция у беременных
У беременных первичная инфекция может протекать бессимптомно или с ограниченными клиническими проявлениями (чаще всего). При заражении ребёнка (плода) до родов в зависимости от сроков первичного инфицирования женщины (иногда истинной реактивации ЦМВ при СПИДе) возможно развитие врождённой цитомегаловирусной инфекции.
Риск внутриутробной передачи — до 90% от всех случаев инфицирования на любом сроке беременности.
При заражении в ранние сроки беременности высок риск самопроизвольного выкидыша, мертворождения или рождения детей с явными пороками развития (патологии лёгких, головного мозга, почек, сердца, сосудов, органа слуха, психоневрологическими нарушениями).
Интересной особенностью является влияние возраста беременной, на котором произошло первичное инфицирование, на частоту передачи инфекции: у женщин до 20 лет риск передачи в три раза выше и не зависит от сроков беременности, а после 20 лет риск внутриутробного инфицирования существенно ниже
Симптомы хронической цитомегаловирусной инфекции
Болезнь становится хронической, если вирус долго находится в организме и иммунная система не может ему противостоять. Характерны длительная субфебрильная температура (37,1—38,0 °C) и слабость. Может увеличиться печень, лимфоузлы (чаще нескольких разных групп), иногда селезёнка, возникает поражение глаз и миокардит.
Цитомегаловирусная инфекция у людей с нормальным иммунитетом
Заболевание носит всеобщий характер и чаще всего не сопровождается сколько-нибудь значимыми отклонениями в жизнедеятельности человека, т.е. иммунная система среднестатистического жителя планеты способна самостоятельно найти достойный выход из ситуации.
Цитомегаловирусная инфекция при СПИДе
При СПИДе болезнь протекает крайне тяжело — может развиться генерализованная форма инфекции, т. е. поражаются различные органы:
Прогноз часто неблагоприятен. Генерализованная форма цитомегаловирусной инфекции может также развиваться у пациентов с ослабленным иммунитетом и младенцев.
Патогенез цитомегаловирусной инфекции
Входные ворота — слизистая оболочка различных органов, преимущественно ротоглотки и верхних дыхательных путей (также желудочно-кишечного тракта, мочеполовой системы и других органов).
В месте внедрения никаких структурных и воспалительных изменений не наблюдается. После проникновения вируса в организм он атакует свои главные мишени — лимфо- и моноциты, эпителиальные клетки слюнных желёз, лёгких, почек и других органов.
Поражённые клетки увеличиваются в размерах в 3-4 раза (цитомегалия), в ядре клетки формируются включения (незрелые вирионы), в результате чего клетка приобретает вид «совиного глаза». При активном течении болезни развивается депрессия большинства звеньев иммунитета, в том чичле и белка ИНФ-α.
В дальнейшем в ответ на проникновение ЦМВ развивается защитная реакция в виде образования специфических антител различных классов, активации Т-киллеров и развития реакций гиперчувствительности замедленного типа, проявляющейся в поражённых органах образованием узелковых лимфомоноцитарных инфильтратов.
Однако инфицированные клетки не погибают, а продолжают функционировать и выделяют специальный слизисто-белковый секрет, который, обволакивая вирионы, обеспечивает маскировку вируса от иммунной системы человека. Это выражается в слабом иммунном ответе и переходу острого заболевания в длительный латентный процесс (носительство).
При слабой репликации и равновесных отношениях с иммунитетом вирус может длительно (пожизненно) сохранятся в организме в состоянии относительной стабильности, не вызывать никаких органных поражений и не причинять никаких неудобств человеку. Вирусную ДНК при таком состоянии в крови выявить не удаётся, однако в эпителии слюнных желёз и моче вирус можно обнаружить (обычно в незначительном количестве).
При значительном снижении иммунитета (ВИЧ, онкологические заболевания, пересадка органов, длительный приём цитостатиков) происходит активизация вирусной репликации, вирус попадает в кровь и вновь атакует различные органы. [1] [3] [10]
Классификация и стадии развития цитомегаловирусной инфекции
Общепринятой классификации не существует, она разнится в зависимости от особенностей медицинского подхода к проблематике заболевания.
Классификация по клинической форме:
1. Приобретённая ЦМВ:
○ генерализованная (мононуклеозоподобная, лёгочная, церебральная и почечная, печёночный гепатит, с поражением ЖКТ, комбинированного вида);
Отдельно выделяют цитомегаловирусную болезнь у ВИЧ-инфицированных.
Классификация по МКБ-10:
Классификация по степени тяжести:
Осложнения цитомегаловирусной инфекции
Осложнения при цитомегалии бывают специфическими неспецифическими.
Специфические осложнения:
Неспецифические осложнения обусловлены наслоением вторичной бактериальной флоры. Это гнойные осложнения — повышение температуры тела до 41°С, соответствующие симптомы поражения определенных органов, нейтрофильный лейкоцитоз. [1] [3] [9] [10]
Диагностика цитомегаловирусной инфекции
Лабораторная диагностика:
Также проводится инструментальная диагностика:
Дифференциальная диагностика:
Лечение цитомегаловирусной инфекции
Лечение бессимптомной цитомегаловирусной инфекции
Бессимптомные носители цитомегаловирусной инфекции, как правило, не нуждаются в лечении. Исключением могут быть пациенты, которые получают сильную терапию, выраженно угнетающую иммунную систему. В таком случае может возникнуть опасное обострение инфекции, т. е. лечение проводится для профилактики.
Лечение цитомегаловирусной инфекции лёгкой степени тяжести
Лечения проводится в амбулаторных условиях. Важно отметить, что заболевание носит всеобщий характер и чаще всего не сопровождается сколько-нибудь значимыми отклонениями в жизнедеятельности человека. Это определяет основную лечебно-диагностическую тактику при выявлении активной (острой) ЦМВ-инфекции (при отсутствии тяжёлого течения и осложнений) — это здоровое питание, полноценный отдых и динамическое наблюдение. Лишь в случаях упорного течения и выраженных отклонений клинико-лабораторного характера следует подключать средства медикаментозного лечения.
Лечение средней и тяжёлой формы цитомегаловирусной инфекции
Больные средней тяжести, тяжёлые пациенты и дети неонатального возраста подлежат стационарному обследованию, наблюдению и лечению.
Принципы лечения цитомегаловируса должны отвечать следующим требованиям:
Медикаментозное лечение
С учётом индивидуальных особенностей проводится этиотропная терапия, направленная на ослабление вируса, прекращение его генерализованной циркуляции (персистенции) и патогенного потенциала.
В зависимости от условий могут применяться специфические цитомегаловирусные иммуноглобулины, специфические противовирусные препараты прямого противоцитомегаловирусного действия (в основном в условиях реанимации и интенсивной терапии).
В целях повышения сопротивляемости организма показано назначение средств иммунокоррекции и иммунотерапии, патогенетическое и симптоматическое лекарственное обеспечение.
Диета
Питание больных осуществляется согласно тяжести заболевания, проявлениям и возрастному фону. В общем показана диета №5 по Певзнеру с отказом от жирной, жареной, острой и раздражающей пищи, механически и химически щадящие питание.
Диспансерное наблюдение
После выписки за переболевшими устанавливается диспансерное наблюдение в течении 6-12 месяцев с периодическими осмотрами профильных специалистов и обследованием, объём и кратность которого определяется лечащим врачом. [1] [2] [5] [8] [10]
Прогноз. Профилактика
Прогноз, как правило, благоприятный (переход в неактивное носительство).
Специальной профилактики заражения не существует.
В очаге заболевания противоэпидемические мероприятия не проводятся, карантина нет.
После клинического выздоровления дети допускаются в коллективы без ограничительных мероприятий.
В целях выявления источников повышенной опасности ЦМВ проводятся обследования донорам крови, органов и тканей, а также беременным женщинам. Если беременная не имеет специфических антител IgG к ЦМВ, за ней следует установить более тщательное наблюдение с трёхкратным обследованием на ЦМВ за время беременности. В это время ей следует по возможности минимизировать общение с детьми, не пользоваться чужой посудой и не целоваться с новыми людьми.
Рекомендовано назначение профилактического лечения больным СПИДом и после трансплантации органов препаратами прямого противовирусного действия.
Вакцина для предотвращения врождённого ЦМВ находится в стадии разработки. [1] [2] [9]