Лунообразное лицо что это
Синдром Кушинга: как поставить диагноз
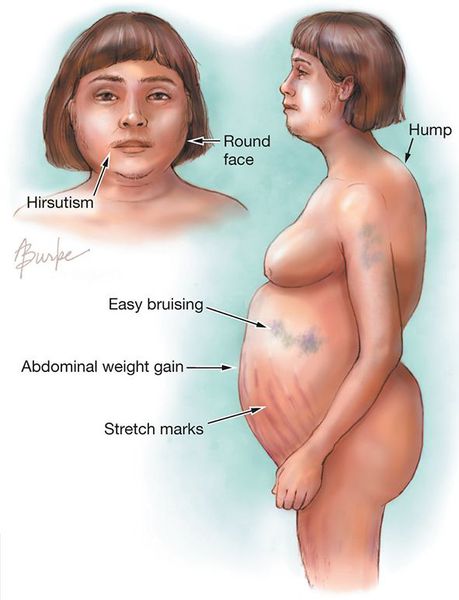
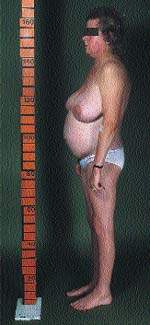
В каких случаях врач общей практики должен заподозрить синдром Кушинга? Как подтвердить диагноз? Нужно ли отменять короткие курсы экзогенных кортикостероидов постепенно? Рисунок 1. Плетора и лунообразность лица, присущие синдрому К
В каких случаях врач общей практики должен заподозрить синдром Кушинга?
Как подтвердить диагноз?
Нужно ли отменять короткие курсы экзогенных кортикостероидов постепенно?
 |
| Рисунок 1. Плетора и лунообразность лица, присущие синдрому Кушинга |
Есть прекрасное определение, позволяющее различить синдром Кушинга (СК) и болезнь Кушинга (БК). Описанный впервые Гарви Кушингом в 1912 году, синдром Кушинга объединяет симптомы, вызываемые постоянно повышенным уровнем свободного кортизола в крови. Понятие «болезнь Кушинга» оставлено за особым гипофизарным АКТГ-зависимым подтипом синдрома.
Ярко выраженный СК не представляет особых диагностических трудностей, но заболевание с умеренными проявлениями может вызвать у врача общей практики ряд проблем. Диагноз ставится клинически, а подтверждается данными лабораторных исследований.
Большинство случаев СК имеет ятрогенное происхождение и обусловлено длительным приемом преднизолона, дексаметазона или других кортикостероидов. К развитию клинических проявлений заболевания приводит ежедневное применение кортикостероидов в дозах, превышающих эквивалент 7,5 мг преднизолона.
Детям для развития кушингоидных черт достаточно меньших доз.
Хотя СК встречается относительно редко, любой врач общей практики сталкивается с его ятрогенными случаями, вызванными длительным приемом кортикостероидов по поводу таких распространенных заболеваний, как, например, ревматоидный артрит.
Таблица 1. Симптомы синдрома Кушинга (в порядке частоты встречаемости)
БК — наиболее распространенная причина неятрогенного СК (70%); оставшиеся 30% приходятся на случаи эктопической секреции АКТГ и надпочечниковое происхождение болезни (АКТГ-независимый СК).
Клиническая картина. Симптомы СК (см. табл. 1) могут, в зависимости от причины, развиваться остро или исподволь в течение нескольких лет.
Как правило, симптомы неспецифичны и включают сонливость, депрессию, увеличение веса, жажду, полиурию, слабость, легкость появления синяков и гирсутизм [1].
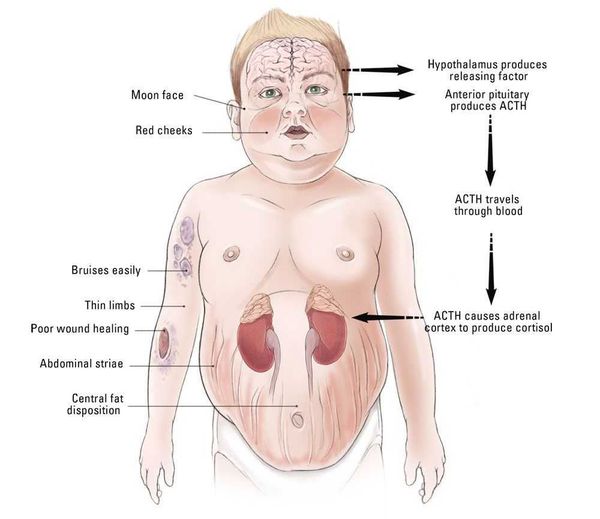
К классическим признакам СК у взрослых относятся «лунообразное» лицо (рис. 1), центральное ожирение (рис. 2), плетора лица, буйволиный горб, надключичные жировые подушечки и периферические отеки. У детей самым ранним признаком служит задержка роста; нормальная кривая роста фактически исключает СК [2].
 |
| Рисунок 2. Типичная конституция пациента с СК. Обратите внимание на центральное ожирение и относительно тонкие руки и ноги, что вызвано проксимальной миопатией |
Конечно, ожирение в общей практике встречается часто, и трудность состоит в том, чтобы отличить общее ожирение от центрального. Главным признаком является накопление жира в центральной части тела с одновременной его потерей на бедрах, ягодицах и руках. Атрофия поперечнополосатых мышц обусловливает внешний вид пациента, подобный «лимону на палочках».
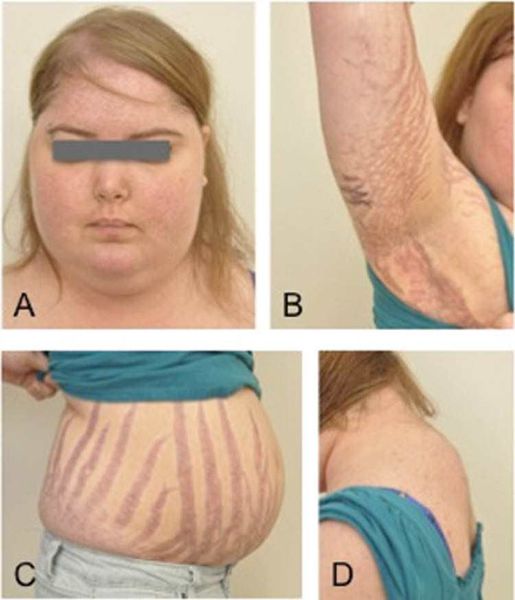
Еще одним клиническим признаком СК служат истончение кожи и ломкость капилляров, приводящие к легкому и часто спонтанному образованию синяков. Таким больным присущи кожные инфекции, например отрубевидный лишай, молочница и онихомикоз, причем кожные повреждения заживают с трудом. Почти всегда можно обнаружить абдоминальные стрии, развивающиеся вторично за счет центрального ожирения (рис. 3).
Больные могут страдать от гирсутизма вследствие избыточного образования надпочечниковых андрогенов под воздействием повышенного АКТГ.
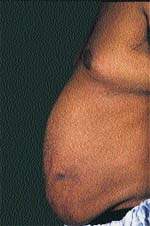 |
| Рисунок 3. Стрии живота у мужчины с СК |
Метаболические изменения, вызываемые повышенным уровнем кортизола, приводят к развитию сахарного диабета, гипертензии и дислипидемии. С длительным повышением циркулирующего в крови кортизола связано также уменьшение минеральной плотности костей и остеопороз.
Биохимическое подтверждение. Важно исключить использование кортикостероидных препаратов и злоупотребление алкоголем («алкогольный псевдо-Кушинг»).
Применение стероидных ингаляторов (например, беклометазона в дозе 200 мкг каждые 6 часов в течение более чем трех месяцев) и других местных стероидных препаратов может приводить к значительному системному всасыванию и развитию клинических проявлений СК с подавлением гипоталамо-гипофизарно-адреналовой оси.
Если пациент не принимает подобных лекарств, первым шагом будет подтверждение избытка кортизола путем определения свободного кортизола мочи (СКМ) в двух суточных пробах [3].
Следующая задача — показать, что эндогенная секреция кортизола не подавлена экзогенными глюкокортикоидами. Для этого проводится ночная дексаметазоновая проба (ДП): в 11 часов вечера пациент принимает 1 мг дексаметазона, а на следующее утро между 8 и 9 часами берется проба крови на кортизол. СК предполагается в том случае, если уровень кортизола не упал ниже 50 нмоль/л. Однако вследствие низкой специфичности теста могут быть ложноположительные результаты.
Направление к специалисту. При подозрении на СК необходимо сразу же направить пациента к эндокринологу. После направления, как правило, дважды проводится определение СКМ и выполняется более специфическое исследование — проба с дексаметазоном в низкой дозе (ДПНД) [4]. Пациент принимает по 0,5 мг дексаметазона восемь раз каждые 6 часов. Отсутствие падения кортизола ниже 50 нмоль/л в 9 часов утра по окончании ДПНД указывает на СК.
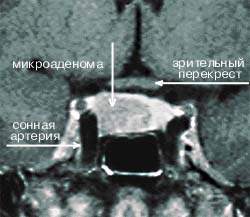 |
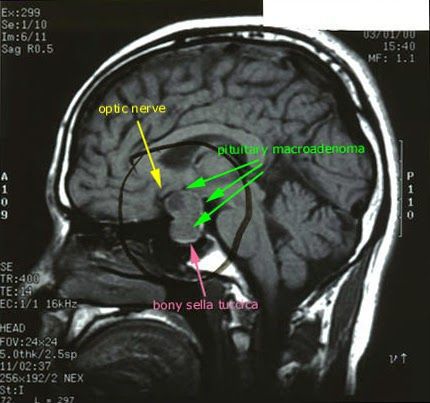
| Рисунок 4. МР-томограмма гипофиза, на которой видна правосторонняя микроаденома, секретирующая АКТГ (гипофиз-зависимая болезнь Кушинга) |
Определение СКМ дает нормальные результаты практически постоянно, если у пациента циклический СК (то есть активность заболевания нарастает и падает в течение недель или месяцев), поэтому данное исследование считается низкочувствительным. Более важная проба — ДПНД, и при обнаружении отклонений от нормы пациента следует направить на дальнейшее обследование.
Амбулаторные исследования включают изучение суточного ритма кортизола (рис. 5), дексаметазоновую пробу с высокой дозой [5] (ДПВД, рис. 6) и определение кортикотропин-рилизинг гормона (КРГ). Подтверждение гипофиз-зависимого заболевания основывается на заборе крови из нижнего каменистого синуса для определения в ней уровня АКТГ и последующего введения КРГ [6, 7]. Как правило, требуется визуализация: компьютерное сканирование надпочечников, чтобы дифференцировать надпочечниковое и АКТГ-зависимое состояние; МР-томография гипофиза (рис. 4); компьютерное сканирование грудной клетки и брюшной полости при подозрении на эктопическую секрецию АКТГ.
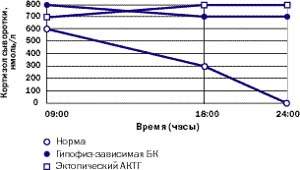 |
| Рисунок 5. Так выглядит типичный суточный ритм кортизола у здорового человека, пациента с БК и пациента с эктопическим СК |
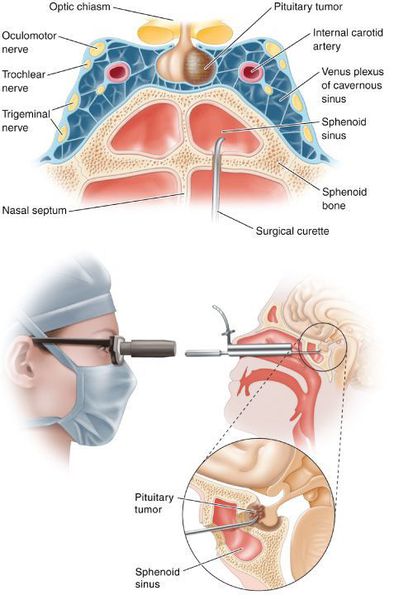
Лечение СК зависит от причины заболевания. Методом выбора при БК служит селективная транссфеноидальная микроаденомэктомия: излечения удается добиться в 80% случаев (эффективным лечение считается тогда, когда наличие кортизола через 24-48 часов после операции не обнаруживается) [8].
При успешном исходе операции по поводу БК пациенту понадобится заместительный курс гидрокортизона, пока не восстановится его собственная гипоталамо-гипофизарно-надпочечниковая (ГГН) функция. Как правило, достаточно 20 мг гидрокортизона утром и 10 мг — в 6 часов вечера.
В случае обнаружения аденомы надпочечников показана односторонняя адреналэктомия. Железа с другой стороны оказывается атрофичной (по принципу обратной связи) в результате длительного подавления секрецией АКТГ, поэтому пациенту также понадобится заместительная терапия гидрокортизоном вплоть до восстановления ГГН.
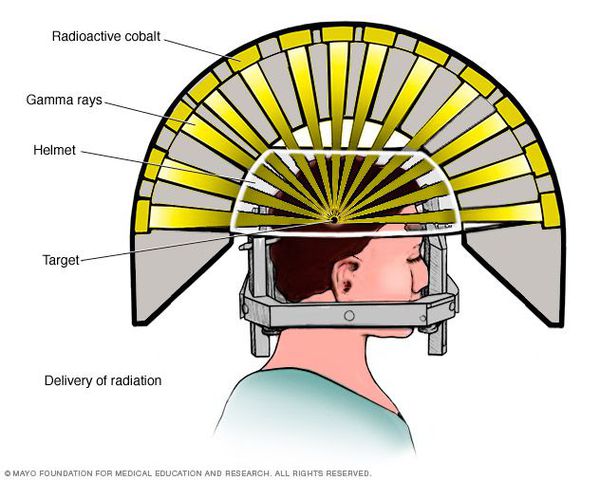
Эктопические АКТГ-секретирующие опухоли (например, карциноиды бронхов или тимуса) требуют удаления. После операции вновь проводится гидрокортизоновое прикрытие. Процесс включения ГГН может занять несколько месяцев. При отсутствии эффекта от операции проводят облучение гипофиза из внешнего источника (4500 Гр в 25 сериях).
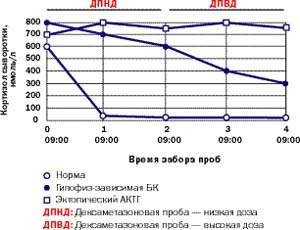 |
| Рисунок 6. Типичные реакции кортизола на дексаметазоновую супрессию низкими (0,5 мг каждые 6 часов в течение 48 часов) и высокими дозами (2 мг каждые 6 часов в течение 48 часов) у здорового человека, пациента с БК и пациента с эктопическим СК |
Если есть противопоказания к проведению оперативного вмешательства, связанные непосредственно с СК, снизить уровень кортизола можно кетоконазолом (начиная с 200 мг). Дозы препаратов подбирают индивидуально, ориентируясь на средний уровень кортизола 200-300 нмоль/л.
После медикаментозного лечения пациент может успешно перенести операцию. При отказе от операции остается возможность длительного лечения кетоконазолом, проводящимся под наблюдением госпитального эндокринолога.
Двусторонняя адреналэктомия проводится только в самых тяжелых случаях, когда безуспешно испробованы все остальные методы. Она неизбежно приводит к необходимости пожизненной заместительной терапии кортикостероидами и минералокортикоидами.
Ведение больных с СК. Самая распространенная причина СК — ятрогенная, особенно если доза принимаемых внутрь стероидов превышает эквивалент 7,5 мг преднизолона у взрослых.
Для профилактики остеопороза пациентам, принимающим стероиды более шести месяцев, назначают бисфосфонаты.
Решение о снижении дозы стероида следует принимать, проконсультировавшись с соответствующим специалистом. Экзогенные стероиды, назначаемые коротким курсом (менее 6 недель), редко вызывают клинически значимую надпочечниковую супрессию, поэтому их можно резко отменять.
При подозрении на неятрогенный СК измерение СКМ и ночная ДП могут помочь в подтверждении этого диагноза (vide supra). Но пациента, у которого обнаружены клинические признаки неятрогенного СК (см. табл.), рекомендуется обязательно направить к эндокринологу.
Случай из практики
Друзья и члены семьи 24-летней женщины заметили, что она полнеет и как бы «сама не своя». Она часто находилась в подавленном настроении и с трудом могла сосредоточиться на своей работе.
Врач общей практики, к которому она обратилась, отметил «лунообразное лицо» и умеренный гирсутизм. Артериальное давление, прежде нормальное, составляло 150/100 мм рт. ст.
Она была срочно направлена к эндокринологу по месту жительства. При обследовании выявлена повышенная суточная экскреция с мочой свободного кортизола и потеря суточного кортизольного ритма. Дексаметазоновая проба не выявила супрессии ни при низкой, ни при высокой дозе дексаметазона; реакция кортизола на экзогенный КРГ оказалась плоской.
МРТ-скан гипофиза был нормальным, а при компьютерном сканировании брюшной полости обнаружены утолщенные гиперплазированные надпочечники, характерные для АКТГ-зависимости. Пигментация ладонных складок также подтверждала повышение продукции АКТГ.
Был поставлен клинический и биохимический диагноз эктопического АКТГ-синдрома, и больную отправили в соответствующий центр. Компьютерное сканирование грудной клетки выявило опухоль размером 1 см в верхушке правого легкого, которая была удалена под прикрытием гидрокортизона.
После четырехмесячного курса преднизолона (5 мг на ночь и 2,5 мг днем) наблюдалось восстановление ее ГГН-оси, и стероиды постепенно отменили. Тело приобрело нормальные формы в течение 6 месяцев, восстановилась супрессорная активность дексаметазона.
Что такое болезнь Иценко — Кушинга? Причины возникновения, диагностику и методы лечения разберем в статье доктора Ворожцова Е. И., эндокринолога со стажем в 11 лет.
Определение болезни. Причины заболевания
Болезнь Иценко — Кушинга (БИК) — тяжёлое многосистемное заболевание гипоталомо-гипофизарного происхождения, клинические проявления которого обусловлены гиперсекрецией гормонов коры надпочечников. [1] Является АКТГ-зависимой формой гиперкортицизма (заболевания, связанного с избыточным выделением гормонов корой надпочечников).
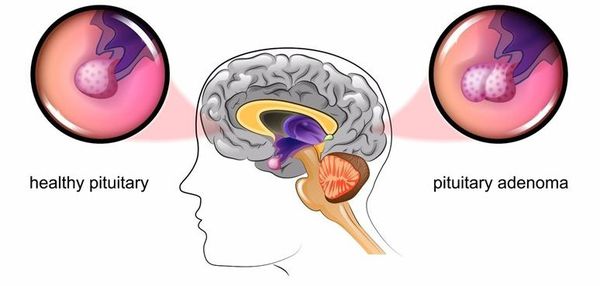
Основная причина заболевания — кортикотрофная микроаденома (доброкачественная опухоль) гипофиза. Возникновение последней может быть связано со множеством факторов. Часто заболевание развивается после травмы головного мозга, беременности, родов, нейроинфекции.
Болезнь Иценко — Кушинга является редким заболеванием, частота встречаемости которого составляет 2-3 новых случая в год на один миллион населения. [2]
Симптомы болезни Иценко — Кушинга
Клинические признаки данной болезни обусловлены гиперсекрецией кортикостероидов. В большинстве случаев первым клиническим признаком является ожирение, которое развивается на лице, шее, туловище и животе, при этом конечности становятся тонкими. Позднее проявляются кожные изменения — истончение кожи, трудно заживающие раны, яркие стрии (растяжки), гиперпигментация кожи, гирсутизм (избыточное появление волос на лице и теле).
Также важным и частым симптомом является мышечная слабость, развитие остеопороза.
Артериальная гипертензия при БИК носит постоянный и умеренный характер, в редких случаях артериальное давление остаётся в норме. Это связано с тем, что глюкокортикоиды (гормоны, вырабатываемые корой надпочечников) повышают сосудистый тонус и чувствительность адренорецепторов к катехоламинам (природным веществам, контролирующим межклеточное взаимодействие в организме).
Более чем у половины больных возникают нарушения психики. Наиболее частые из них: эмоциональная неустойчивость, депрессия, раздражительность, панические атаки, расстройство сна.
Нарушения менструального цикла (редкие, скудные менструации или их отсутствие) встречается у 70-80% пациенток, также довольно часто встречается бесплодие. У мужчин при БИК снижается половое влечение и возникает эректильная дисфункция.
Болезнь Иценко — Кушинга сопровождается иммунодефицитом, который проявляется в виде рецидивирующей инфекции (чаще всего возникает хронический пиелонефрит).
Частота клинических проявлений БИК: [3]
Патогенез болезни Иценко — Кушинга
Патогенез данного заболевания носит многоступенчатый характер.
В кортикотрофах гипофиза возникают характерные рецепторно-пострецепторные дефекты, в дальнейшем приводящие к трансформации нормальных кортикотрофов в опухолевые с гиперпродукцией адрено-кортикотропного гормона и последующим развитием гиперкортицизма. [4]
На трансформацию нормальных кортикотрофов в опухолевые влияют гормоны гипоталамуса и местные ростовые факторы:
Хронически повышенная концентрация АКТГ приводит к повышенной секреции кортизола, который и обуславливает характерную клиническую картину БИК.
Классификация и стадии развития болезни Иценко — Кушинга
Классификация БИК по степени тяжести: [5]
Классификация БИК по течению:
Осложнения болезни Иценко — Кушинга
Диагностика болезни Иценко — Кушинга
Диагноз «Болезнь Иценко — Кушинга» можно установить на основании характерных жалоб, клинических проявлений, гормонально-биохимических изменений и данных инструментальных исследований.
Исключительно важными гормональными показателями для данной патологии будут АКТГ и кортизол. Уровень АКТГ повышается и колеблется в пределах от 80 до 150 пг/мл. [7] Повышение уровня кортизола в крови не всегда является информативным, так как увеличение данного показателя может быть обусловлено рядом других причин (стрессы, алкоголизм, беременность, эндогенная депрессия, семейная резистентность (споротивляемость) к глюкокортикоидам и т. д.). В связи с этим разработаны методы исследования уровня свободного кортизола в суточной моче или слюне. Наиболее информативным является исследование свободного кортизола в слюне в 23:00. [6]
Для доказательства гиперкортицизма используется малый дексаметазоновый тест. При БИК данная проба будет отрицательной, так как подавление кортизола при приёме 1 мг дексаметазона не происходит. [7]
Биохимический анализ крови способен выявить многочиселнные измения:
После подтверждённого гиперкортицизма необходимо проведение инструментальных методов исследования (МРТ гипофиза, КТ надпочечников).
При БИК в 80-85% случаев выявляют микроаденому гипофиза (опухоль до 10 мм), у остальных 15-20% — макроаденому (доброкачественное новообразование от 10 мм). [7]
Лечение болезни Иценко — Кушинга
Медикаментозная терапия
В настоящее время эффективных лекарственных препаратов для лечения данной патологии не существует. В связи этим они используются либо при наличии противопоказаний для оперативного лечения, либо как вспомогательная терапия. Применяются следующие медикаменты:
Кроме препаратов данных групп пациентам назначается симптоматическая терапия для снижения симптомов гиперкортицизма и улучшения качества жизни пациента:
Оперативная терапия
Радиохирургия
Прогноз. Профилактика
Прогноз БИК зависит от нескольких показателей: формы и длительности заболевания, наличия осложнений, состояния иммунитета и других факторов.
Полное выздоровление и восстановление трудоспособности возможно при лёгкой форме болезни и небольшом стаже заболевания.
При средней и тяжёлой формах БИК трудоспособность крайне снижена или отсутствует. После проведённой двусторонней адреналэктомии развивается хроническая надпочечниковая недостаточность, которая диктует пожизненный приём глюко- и минералкортикоидов.
В целом любое лечение, как правило, приводит к улучшению качества жизни больного, однако она остаётся ниже, чем у лиц без данной патологии.
Болезнь Иценко — Кушинга — тяжёлое хроническое заболевание, которое при отсутствии своевременного лечения может стать причиной летального исхода. Смертность при данной патологии составляет 0,7%.
Пятилетняя выживаемость при БИК без проведения лечения составляет 50%, но заметно улучшается даже если проводить только паллиативное лечение (при двухсторонней адреналэктомии выживаемость увеличивается до 86%). [13]
Первичной профилактики БИК не существует. Вторичная профилактика заболевания направлена на предотвращение рецидива болезни.
Публикации в СМИ
Синдром Иценко–Кушинга
По поводу лечения данного заболевания Вы можете обратиться в Хирургическое отделение №2 Клиники факультетской хирургии им. Н.Н. Бурденко
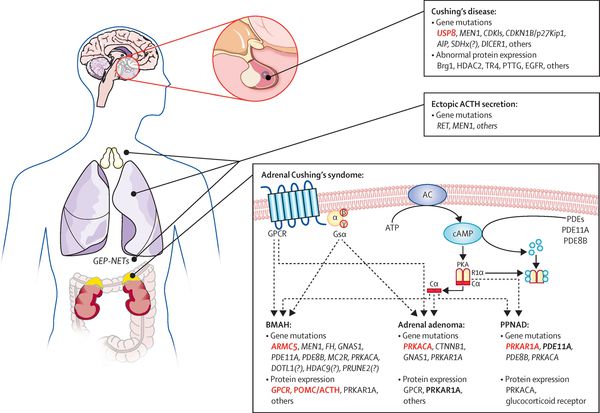
Синдром Иценко–Кушинга (синдром Кушинга) — гиперкортицизм, обусловленный повышением содержания в крови эндогенных или экзогенных ГК. Эндогенные ГК появляются вследствие их гиперпродукции корой надпочечников при наличии: • глюкостеромы; • гиперпродукции АКТГ передней долей гипофиза (наличие аденомы; в этом случае говорят о болезни Иценко–Кушинга); • секретирующей АКТГ опухоли различных органов (в первую очередь лёгких; в этом случае говорят о синдроме эктопической продукции АКТГ). Экзогенные ГК обусловливают лекарственный синдром Иценко–Кушинга, встречающийся значительно чаще, чем спонтанный; обычно развивается у больных, длительное время получающих ГК по поводу различных заболеваний (например, аутоиммунных).
Статистические данные. Наиболее часто синдром Иценко–Кушинга имеет ятрогенную природу. В США частота развития синдрома Иценко–Кушинга, обусловленного эндогенной гиперпродукцией ГК, составляет 13 случаев на 1 млн населения. Из них 70% обусловлено болезнью Иценко–Кушинга с наличием АКТГ-продуцирующей аденомы, 15% — эктопической продукцией АКТГ и 15% — первичной опухолью надпочечников (глюкостеромы). Преобладающий пол — женский (5:1). Преобладающий возраст: для синдрома Кушинга, обусловленного аденомой гипофиза или надпочечников, — 25–40 лет, для эктопической продукции АКТГ вследствие рака лёгких — пожилой возраст.
Этиология
• Лечение ГК: обычно синдром Иценко–Кушинга возникает при системном применении ГК, однако возможно его развитие при внутрисуставном введении ГК и даже ингаляционном использовании. Спектр заболеваний, при которых назначают ГК, очень широк и включает разнообразную ревматологическую, нефрологическую, лёгочную и неврологическую патологию; кроме того, назначение ГК возможно при наличии трансплантированных тканей и органов.
• Эндогенная гиперпродукция ГК вследствие: •• наличия АКТГ-продуцирующей аденомы гипофиза (в рамках болезни Иценко–Кушинга), при больших размерах сдавливающей ткань гипофиза и подавляющей выработку большинства гипофизарных гормонов, а также приводящей к офтальмологическим нарушениям; •• поражения надпочечников: глюкостерома (аденома или карцинома), макро- или микронодулярная гиперплазия (возможно одновременное увеличение гиперпродукции как ГК, так и андрогенов клетками ретикулярной или пучковой зон коры надпочечников) •• эктопической продукцией АКТГ раковыми клетками при овсяно-клеточном или мелкоклеточном раке лёгкого.
Патогенез
• Усиление синтеза АКТГ приводит к надпочечниковым и вненадпочечниковым эффектам •• Надпочечниковые — повышение содержания ГК и андрогенов сетчатого слоя коры надпочечников. В меньшей степени АКТГ влияет на повышение концентрации минералокортикоидов •• Вненадпочечниковые — гиперпигментация кожи и слизистых оболочек (в 10% случаев) и психические расстройства
• Повышение продукции ГК — ключевой момент патогенеза синдрома/болезни Иценко–Кушинга. Эффекты: •• Катаболическое действие на белковый и углеводный обмен приводит к атрофии мышечной (в т.ч. сердечной) ткани и кожи, а также гипергликемии с развитием стероидного диабета (в 20% случаев). В патогенезе стероидного диабета также играют роль относительная недостаточность инсулина (с усилением глюконеогенеза в печени) и инсулинорезистентность •• Анаболическое действие на жировой обмен приводит к ожирению (более 90% случаев) •• Минералокортикоидная активность способствует активации системы ренин-ангиотензин-альдостерон с развитием артериальной гипертензии и гипокалиемии. Определённое значение в патогенезе артериальной гипертензии имеет потенцирование ГК эффекта катехоламинов и биогенных аминов (в частности, серотонина) •• Катаболическое действие на костную ткань приводит к снижению способности костной ткани фиксировать кальций и развитию остеопороза (более 80% случаев). Определённую роль в патогенезе остеопороза играет уменьшение ГК реабсорбции кальция в ЖКТ, что связано с торможением процессов гидроксилирования кальциферола •• Подавление специфического иммунитета приводит к развитию вторичного иммунодефицита •• Повышение секреции андрогенов (тестостерона) надпочечниками приводит к снижению гонадотропной функции гипофиза и развитию половых расстройств •• Изменение секреции других тропных гормонов — снижение уровня СТГ и ТТГ, увеличение содержания пролактина.
Клинические проявления
• Симптомы нарушения жирового обмена определяют кушингоидную внешность: •• Лунообразное лицо (отложение жира на лице) •• Отложение жировой ткани на шее («бизоний горб») и верхней части туловища (особенно заметное над ключицами), но не на конечностях («колосс на глиняных ногах»).
• Симптомы нарушения углеводного обмена — стероидный диабет или снижение толерантности к глюкозе с быстро нарастающей гипергликемией и/или глюкозурией.
• Симптомы нарушения белкового обмена: •• Мышечная слабость — стероидная миопатия: у больных возникают затруденения при подъёме по лестнице, вставании с низкого стула, поднятии рук •• Полосы растяжения (стрии) красно-фиолетового цвета на коже живота, груди и бёдер •• Предрасположенность к возникновению экхимозов (в связи с повышенной ломкостью капилляров) •• Замедленное заживление ран •• Предрасположенность к инфекциям вследствие иммунодефицита.
• Симптомы нарушения водно-электролитного обмена: увелчиние ОЦК вследствие задержки воды и натрия.
• Наличие АКТГ-продуцирующей аденомы гипофиза (в рамках болени Иценко–Кушинга) проводит к появлению офтальмологических расстройств, головных болей, галактореи и других нарушений (см. Аденома гипофиза).
• Другие нарушения: •• Артериальная гипертензия (выявленная впервые или прогрессирующая) •• Нарушения липидного обмена (увеличение синтеза как ЛПВП, так и ЛПНП, триглицеридов) способствуют быстрому прогрессированию атеросклероза коронарных артерий и развитию ИБС •• Петические язвы, иногда бессимптомные, особенно у пациентов, получающих высокие дозы ГК •• Остеопения и остеопороз (вплоть до остеопоретических переломов); также возможен аваскулярный некроз бедренной кости •• Расстройства гормональной регуляции половой сферы (дисменорея, аменорея, бесплодие) •• Акне, гирсутизм •• Образование трофических язв и гнойничковых поражений кожи (вследствие развития вторичного иммунодефицита) •• Гиперпигментация кожи и слизистых оболочек (эффект АКТГ), обычно в местах трения кожи — важный дифференциально-диагностический признак для выявления избыточной продукции АКТГ •• Эмоциональная лабильность, депрессия, когнитивные расстройства •• У детей — задержка роста.
Надпочечниковый (адреналовый) криз. Неотложное состояние; может возникнуть у больных с синдромом Иценко–Кушинга вследствие резкого прекращения приёма ГК, а также в том случае, если при развитии у пациента какого-либо острого заболевания не увеличить дозу ГК. Кроме того, возникает в послеоперационном периоде после удаления АКТГ- или ГК-продуцирующей опухоли.
Клинически проявляется артериальной гипотензией, болями в животе, рвотой и нарушениями сознания. Лабораторные изменения включают гипогликемию, гипонатриемию, гиперкалиемию и метаболический ацидоз.
Лабораторные данные. Основная цель — определение гиперпродукции ГК в организме больного с одновременным определением содержания АКТГ (условие достоверных результатов — отсутствие у больного острого заболевания). Первый шаг — оценка зависимости/независимости проявлений от АКТГ • Для выявления гиперпродукции ГК необходимо обнаружение повышенного содержания в крови самого кортизола или в моче его самого либо его метаболитов (повышение суточной экскреции с мочой свободного кортизола или 17-оксикортикостероидов [17-ОКС]) •• Повышение концентрации кортизола в крови в ночное время (предпочтительно ближе к полуночи) более 7,5 мкг% — достоверный признак синдрома Иценко–Кушинга. Ещё более достоверным считают выявление повышенного содержания в крови кортизола в течение нескольких дней подряд. В настоящее время разработы методики определения содержания кортизола в слюне (сбор слюны в домашних условиях), одноко их применение ограничено вследствие дороговизны • Повышение уровня АКТГ в плазме до 20 пг/мл (наиболее достоверно ночное повышение) — важный дифференциально-диагностический признак •• При глюкостероме вследствие чрезмерной продукции кортизола секреция АКТГ гипофизом подавляется, что приводит к снижению его уровня в плазме (менее 5 пг/мл) •• При синдроме эктопической продукции АКТГ или АКТГ-серетирующей аденомы гипофиза его концентрация составляет 10–20 пг/мл и выше.
Тем не менее для выявления синдрома Иценко–Кушинга обычно применяеют два скрининговых теста (более удобны).
• Тест суточной экскреции кортизола. Это наиболее достоверный тест для выявления суточной гиперпродукции ГК. Повышение более чем в 3–4 раза (относительно верхней границы нормы) свидетельствует о несомненном диагнозе синдрома/болезни Иценко–Кушига, тогда как при повышении в 2–3 раза необходимо проводить дифференциальную диагностику с псевдосиндромом Иценко–Кушинга. При проведении теста следует убедиться, что больной правильно собирал суточную мочу — для этого нужно определить в той же суточной моче количество креатинина.
• Ночной тест подавления дексаметазоном — тест первичной диагностики при подозрении на болезнь или синдром Иценко–Кушинга (введение экзогенного ГК в норме приводит к снижению выработки АКТГ и, следовательно, котризола). Больной принимает 1 мг дексаметазона внутрь в 11 ч вечера, а на следующее утро в 8 ч определяют содержание кортизола сыворотки •• Концентрация кортизола сыворотки крови менее 1,8 мкг% указывает на нормальное подавление АКТГ и кортизола дексаметазоном и позволяет исключить диагноз синдрома Иценко–Кушинга. В этом случае тест считают чувствительным, необходимости в дальнейшем уточнении диагноза нет •• У больных с болезнью или синдромом Иценко–Кушинга концентрация кортизола при проведении данного теста превышает 1,8 мкг% (обычно 5–10 мкг%). При получении подобных результатов тест не считают достаточно специфичным, поскольку возможны ложноположительные результаты (ожирение, алкоголизм, стресс, ХПН, анорексия, булимия; приём фенобарбитала, содержащегося, например, в препаратах типа «Корвалол», «Валокордин», тамоксифена, рифампицина).
При необходимости дальнейшего обследования применяют следующие тесты.
• Стандартный тест подавления дексаметазоном — надёжный тест диагностики синдрома/болезни Иценко–Кушинга, хотя чувствительность и специфичность данного теста составляют примерно 70%. Подавление гипоталамо-гипофизарно-надпочечниковой системы исследуют при введении дексаметазона в низких дозах (0,5 мг дексамтезона, разделённого на 8 доз, каждые 6 ч внутрь в течение 2 дней) с измерением концентрации кортизола в сыворотке и уровня 17-ОКС в моче на второй день (ожидается снижение). В настоящее время перспективным считают сочетание стандартного теста подавления дексаметазоном с дополнительным введением кортиколиберина (1 мкг/кг в/в через 2 ч после приёма восьмого приёма дексаметазона). При проведении теста также возможно определение снижения экскреции 17-ОКС более чем на 50%.
• Ночной тест подавления большой дозой дексаметазона удобнее в исполнении, чем стандартный тест. Его применяют, когда содержание АКТГ промежуточное между 5 и 10 пг/мл. Концентрацию кортизола сыворотки крови определяют в 8 ч утра в течение двух дней подряд, в 11 ч вечера первого дня принимают 8 мг дексаметазона. Падение уровня кортизола сыворотки более чем на 50% на второй день указывает гипофизарное происхождение избыточного АКТГ в большей степени, чем на эктопическую продукцию АКТГ или первичную надпочечниковую патологию.
• Тест стимуляции кортиколиберином. Парентерально вводят кортиколиберин и через 15 мин измеряют уровень АКТГ и кортизола. При болезни Иценко–Кушинга показатели обычно повышены (для кортизола — более 1,4 мкг%), отсутствие ответа свидетельствует об эктопическом или надпочечниковом генезе гиперкортицизма.
Другие критерии • Нейтрофильный лейкоцитоз (иногда более 11 ´ 10 9 /л) • Гипергликемия и глюкозурия • Гиперлипидемия • Гипокалиемия • Лимфопения • Эозинопения.
Инструментальные данные. Применение специальных методов исследования необходимо предварять тщательным лабораторным обследованием.
• Рентгенография черепа позволяет выявить макроаденомы гипофиза (10% случаев), рентгенография поясничного отдела позвоночника — остеопороз. Тем не менее для диагностики синдрома и болезни Иценко–Кушинга данный метод в настоящее время считают малоинформативным.
• При подозрении на болезнь Иценко–Кушинга (гипофизарное происхождение избыточной продукции АКТГ) необходимо проведение визуализирующих исследований головы •• КТ головы с введением контраста позволяет выявить около 50% аденом гипофиза •• МРТ с гадолиновым контрастом — метод выбора — повзоляет выявить около 75% таких опухолей •• Зачастую даже при МРТ не обнаруживают никаких изменений вследствие микроаденом очень небольшого размера или диффузной гиперплазии соотвествующих гипофизарных клеток. В этом случае полезно раздельное определение содержания АКТГ в крови из нижнего каменистого синуса и периферических вен. Забирают пробы крови из периферических вен и (путём катетеризации) из нижнего каменистого синуса твёрдой мозговой оболочки. Соотношение уровня АКТГ в крови синуса к уровню АКТГ в периферических венах больше 2,0 наблюдают при болезни Иценко–Кушинга, тогда как соотношение менее 1,5 характерно для синдрома эктопической продукции АКТГ.
• При подозрении на потологию надпочечников проводят следующие диагностические процедуры •• КТ брюшной полости, позволяющую выявить увеличение надпочечников (при их размерах более 4–6 см в первую очередь следует исключить карциному, для чего возможно проведение прицельной аспирационной биопсии под контролем КТ). Равномерное увеличение обоих надпочечников предполагает болезнь Иценко–Кушинга или синдром эктопической продукции АКТГ. Увеличение одного надпочечника при наличии соответствующей клиники предполагает глюкостерому • Радиоизотопное исследование с использованием 19-йодхолестерина, меченного радиоактивным йодом, выявляет двустороннюю гиперплазию в случае болезни Иценко–Кушинга или синдрома эктопической продукции АКТГ, при глюкостероме — несимметричное поглощение препарата.
• При подозрении на синдром эктопической продукции АКТГ: •• КТ грудной и брюшной полостей •• Сцинтиграфию с меченным октреотидом (клетки нейроэндокринных опухолей имеют рецепторы к соматостатину).
Диагностическая тактика. Заподозренный на основании анамнестических и клинических данных синдром Иценко–Кушинга после исключения экзогенного поступления ГК (даже ингаляционного или внутрисуставного) нуждается в верификации с помощью тщательного лабораторного обследования, преследующего цель выявления источника гиперпродукции ГК и зависимости состояния от АКТГ. Специальные инструментальные методы исследования (головы, надопочечников или грудной полости) назначают для окончательной верификации диагноза после того, как сформулировано обоснованное лабораторными находками предположение о причине синдрома Иценко–Кушинга.
Дифференциальная диагностика • Функциональный гиперкортицизм при алкоголизме (в настоящее время его обзначают термином «алкоголь-индуцированный псевдосиндром Иценко–Кушинга») и при беременности • Депрессивные расстройства — зачастую они проявляются в том числе изменениями функций гипоталамо-гипофизарно-надпочечниковой системы с гиперпродукцией ГК и вторичным развитием умеренно выраженного синдрома Иценко–Кушинга. С другой стороны, синдром Иценко–Кушинга может проявляться эмоциональной лабильностью и депрессией, поэтому сочетание обоих состояний требует тащателного поиска первопричины • Ожирение, протекающее с артериальной гипертензией и нарушениями углеводного обмена • Адреногенитальный синдром.
ЛЕЧЕНИЕ
Общая тактика. Лечение синдрома/болезни Иценко–Кушинга зависит от причины. Ятрогенный синдром (лечение обязательно и в этом случае) предполагает постепенную отмену ГК (с заменой их при необходимости на другие иммунодепрессанты).
При синдроме Иценко–Кушинга с гиперпродукций ГК метод выбора — хирургическое удаление причинно-значимой опухоли (гипофиза, надпочечников, лёгких). При неффективности или невозможности хирургического лечения (что чаще бывает при синдроме эктопической секреции АКТГ или метастатической карциноме) предпринимают попытку медикаментозного лечения. К сожалению, последнее часто оказывается неэффективным, и тогда прибегают к двусторонней адреналэктомии. При АКТГ-продуцирующей аденоме гипофиза часто прибегают в т.ч. к лучевой терапии.
Лекарственная терапия. Для обеспечения «лекарственной адреналэктомии» применяют такие препараты, как митотан, кетоконазол, аминоглутетимид. Однако в дозах, вызывающих снижение синтеза кортизола, эти препараты зачастую токсичны. Поэтому при их назначении необходимо тщательно наблюдать за пациентом, оценивая эффективность проводимой терапии по уровню суточной экскреции кортизола • Препарат выбора для длительного приёма — кетоконазол. Он ингибирует как синтез кортизола, так и скорее всего АКТГ • В настоящее время проводят исследования эффективности препаратов, уменьшающих векрецию АКТГ и кортиколиберина — бромокриптин, октреотид, вальпроевая кислота, ципрогептадин.
Лучевая терапия. Её применяют при неэффективности проводимого лечения — хирургического или медикаментозного, обычно в комбинации с ними. Лучевая терапия увеличивает эффект медикаментозного лечения.
Хирургическое лечение
• Метод выбора при болезни Кушинга — транссфеноидальная резекция аденомы гипофиза при максимально возможном сохранении его функций. В настоящее время становится доступной эндоскопическая методика. Операция успешна в 60–80% случаев и сопровождается установлением в последующем нормальной функции гипофиза и надпочечников и излечением синдрома Иценко–Кушинга. При неээфективности обычного хирургического лечения необходимо иметь ввиду возможность проведения операции на гипофизе по контролем МРТ.
• При эктопической продукции АКТГ проводят хирургическое лечение выявленной опухоли; при его невозможности показаны лекарственное лечение или двусторонняя адреналэктомия.
• При опухоли надпочечников обычно проводят одностороннюю адреналэктомию.
• Двусторонняя адреналэктомия показана в двух случаях: •• неэффективность проводимой ранее терапии (хриругической, лучевой, лекарственной); •• необходимость быстрой нормализации концентрации в крови кортизола. Процедура излечивает болезнь Иценко–Кушинга, но у больного развивается болезнь Аддисона и возникает необходимость пожизненного возмещения стероидов (ГК и минералокортикоидов). Кроме того, в некоторых случаях вслед за адреналэктомией развивается синдром Нельсона, при котором аденома гипофиза начинает быстро расти, т.к. она больше не ингибируется повышенным уровнем кортизола.
Осложнения • Остеопороз • Предрасположенность к гнойно-воспалительным заболеваниям • Гирстутизм • СД • Артериальная гипертензия • Адреналовый криз • Пангипопитуитаризм • Несахарный диабет • Следует иметь ввиду, что при повышенном содержании в крови ГК клиническая картина острой патологии брюшной полости может быть крайне скудной.
Прогноз. Зависит от причины состояния, а также возможности и эффективности проведения оперативного лечения.
Сокращение. 17-ОКС — 17-оксикортикостероиды.
МКБ-10 • E24 Синдром Иценко-Кушинга